条斑紫菜类囊体膜蛋白质组双向电泳研究方法
2014-06-26何林文陆勤勤朱建一杨睿灵王广策
周 伟 ,何林文陆勤勤,朱建一,高 山 杨睿灵,杨 芳,王广策
(1.中国科学院 海洋研究所 实验海洋生物学重点实验室,山东 青岛 266071;2.中国科学院大学,北京,100049;3.江苏省海洋水产研究所,江苏 南通,226007;4.常熟理工学院 生物与食品工程学院,江苏 常熟 215500;5.天津科技大学 海洋科学与工程学院 天津 300457)
紫菜(Porphyra)是一类原始红藻,属于红藻门(Rhodophyta)红藻纲(Rhodophyceae)红毛菜亚纲(Bangiophycidae)红毛菜目(Bangiales)红毛菜科(Bangiaceae)紫菜属(Porphyra)[1]。紫菜是世界上最重要的栽培海藻之一,目前我国的栽培物种包括长江以南的坛紫菜和长江以北的条斑紫菜,其中条斑紫菜的产值最高。
长期以来,对于光合作用研究主要集中在陆地高等植物,对于藻类方面的研究也大多集中在遗传背景较清晰的海洋绿藻类等少数物种上,关于红藻的光合作用研究报道较少。红藻的光合系统结构与高等植物大不相同,例如,红藻光系统Ⅱ的捕光色素系统主要由附着在类囊体膜上的藻胆体构成[2-3],光合碳同化作用的关键酶 Rubsico大小亚基编码基因均存在于叶绿体基因组中等[4]。另外,对于红藻的光合作用研究也一直缺少较好的模式材料。紫菜生活史周期短、便于室内培养、基因组小且减数分裂阶段形成四分子等特点使其成为藻类尤其是红藻光合作用研究的理想模式生物。
光合作用的基本反应都是在类囊体膜上进行,这些反应是由存在于PSⅠ、PSⅡ、Cytb6/f、ATPase这 4个复合物上几百个蛋白完成的。这些蛋白除了负责把光能转化为电能外,还有个别蛋白负责 4个复合物的组装、固定与调节[5]。处于不同进化层次上的光合生物,其光合膜上的色素蛋白质复合物结构、组成和功能并不完全相同。红藻属于最原始的真核藻类,其光合作用进化地位处于蓝藻与高等植物之间的过渡类型,类囊体膜并不形成垛叠的基粒结构[6]。研究探寻条斑紫菜类囊体膜上的蛋白组成与功能将对了解掌握红藻的光合作用机制提供基础依据。
1991年,Schägger等[7]为了研究哺乳动物和真菌线粒体中的蛋白质复合物,建立了一种温和胶电泳系统,并称之为 blue-native polyacrylamidegel electrophoresis(BN-PAGE).它可以真实地反映叶绿体蛋白质复合物的情况,具有直观、高效、方便的优点和被广泛应用于同类蛋白质组研究中的潜质。该温和胶电泳系统与其他温和胶系统最明显的区别就在于,电泳之前,考马斯亮蓝染液代替了阴极电极液,从而使电泳和染色得以同时进行,直观而快速地反映了电泳的结果。在电泳时,结合叶绿素的蛋白质复合物呈绿色,而不含叶绿素的呈蓝色, 因此称之为蓝绿温和胶电泳。作者以蓝绿温和胶电泳为工具,首次在国内用于条斑紫菜类囊体膜色素蛋白质复合物的研究。
1 材料与方法
1.1 材料来源
条斑紫菜叶状体采自江苏南通栽培海区,取回实验室后用消毒海水洗净,阴干,冻存于−80℃待用。
1.2 材料组织破碎
将叶状体放入高速组织捣碎机(上海标本模型厂)中,加入预冷的类囊体膜提取缓冲液(50 mmol/L Tris,5 mmol/L EDTA,1 mmol/L MnCl2,1 mmol/L MgCl2,2 mmol/L NaNO3,100 mmol/L Sucrose,0.5 mmol/L K2HPO4,pH7.8)[8]。整个破碎过程在冰浴低光条件下进行。将叶状体尽量搅碎,在显微镜下检查碎片大小小于1 mm2。破碎后溶液经筛绢过滤,去除细胞碎片,滤液于4℃避光保存。
1.3 超声波破碎细胞
将滤液保持在低温避光条件下进行超声处理(JY92-II超声波细胞粉碎机,宁波新芝),超声条件输出功率100 W,工作时间5 s,间隙时间15 s,工作次数300次。
1.4 类囊体膜制备
将超声后样品进行超速离心30000 rpm,30 min,4℃(Beckman Coulter,SW 32 Ti rotor),所得沉淀即为类囊体膜粗制品。将沉淀保持在低温避光条件下,加入不含蔗糖的类囊体膜提取缓冲液,充分研磨后重新悬浮。再进行蔗糖密度梯度离心,30000 r/min,4 h,4℃(Beckman Coulter,SW 32 Ti rotor),不连续蔗糖密度梯度从下至上为 70%,60%,50%,40%,30%蔗糖浓度,每个梯度加入蔗糖溶液体积分别为2,2,2,1,1mL。超离后吸出各条带,加入 10倍无蔗糖缓冲液超离30 000r/min,30 min,4℃,去除样品中的蔗糖。所得沉淀用无蔗糖缓冲液重悬,分装后,一部分用Shimadzu UV-1800分光光度计测定其吸收光谱,其余冻存于–80℃待用。
1.5 Blue-native PAGE
BN-PAGE参照 Nijtmans[9]进行: 取冻存样品,解冻后离心 8 000g,15 min,去上清。沉淀用增溶buffer(1.5 mol/L aminicaproic acid,50 mmol/L Bis-Tris/HCl pH=7.0)溶解后再加入 5% 十二烷基麦芽糖苷(dodecyl-β-maltoside,DM)或 1% Triton X-100进行增溶。去污剂/Chla(w/w)为5︰1,10︰1,15︰1,20︰1,冰浴30 min~1h后离心8 000g,10 min去除未溶解的沉淀。上清加入1︰10(v/v)上样buffer(750 mmol/L aminocaproic acid,50 mmol/L Bis-Tris/HCl, pH 7.0(4℃),0.5 mmol/L EDTA,5% Coomassie-blue G250)后即可上样。电泳缓冲液阴极 A: 50 mmol/L Tricine/15 mmol/L Bis-Tris/HCl,pH 7.0 (4℃)/0.02%(w/v)Coomassie-blue,阴极 B: 50mmol/L Tricine/15 mmol/L Bis-Tris/HCl,pH 7.0 (4℃);阳极: 50 mmol/L Bis-Tris/HCl,pH 7.0 (4℃)。电泳在 Bio-Rad 的Mini-Protean III cell 装置中进行,分离胶为5%~13%梯度,浓缩胶为4%。凝胶大小为10 cm×8 cm×0.075cm。电泳在4℃进行,初始条件为50 V,30min,进入分离胶后为 120V,当电泳前沿到达分离胶的一半时,用阴极缓冲液B代替阴极缓冲液A。当蓝色前沿到达凝胶底部时电泳结束。
1.6 SDS-Urea-PAGE第二向电泳
将第一向电泳凝胶用处理液(6 mmol/LUrea,5%SDS,10% 2-mercaptoethanol,50 mmol/LTris/HCl,pH 7.0,20% glycerin)室温下平衡 1h,去离子水清洗 3次。将各复合物条带分别切下,插入上样孔后进行第二向电泳。电泳方法与常规SDS电泳基本相同。12%分离胶和5%浓缩胶中均含有6 mol/L尿素。电泳在Bio-Rad 的Protean II xi装置中进行,凝胶大小为20 cm×20 cm×0.1cm。电泳后凝胶用考马斯亮蓝 R250进行染色。
1.7 质谱检测
将第二向电泳凝胶上的点切下后,送至天津生物芯片技术有限责任公司进行质谱检测。具体步骤为将电泳染色后凝胶中的蛋白质点切成1~2 mm2大小,清洗几次后用含50%乙腈,25 mmol/L NH4HCO3(100 µL ,pH8.0)溶液浸泡胶块,振荡20 min后弃去溶液,重复3次至胶块中蓝色褪尽。蒸馏水洗涤1次。加入乙腈脱水,胶块变白,然后室温抽干。脱水胶块加入胰蛋白酶溶液(10 mg/L Trypsin,50 mmol NH4HCO3,pH8.0)再水化,37℃保温过夜。酶解胶块加40 µL 5%TFA于40℃保温1 h,吸出上清,加入40 µL 5% TFA,50% 乙腈于37℃保温l h,小心吸出上清,抽真空干燥,4℃保存待用。用ABI 4700质谱仪分析,数据在NCBI非冗余(nr)、Swissprot数据库进行了检索。
2 结果
2.1 类囊体膜的分离
样品经蔗糖密度梯度离心,分成 3条明显的绿色条带,分别位于40%,50%,60%蔗糖密度层(图1)。位于离心管上端 30%蔗糖密度层的色素带为游离色素和藻红蛋白,其他较大的细胞碎片均沉于离心管底部。对所得 3条绿色条带进行可见光吸收光谱测定,得到类囊体膜上蛋白的特征吸收峰(图 2)。434~438 nm和680 nm左右为叶绿素a的特征吸收峰,488 nm左右和627 nm左右处为辅助色素吸收峰,其中488 nm为类胡萝卜素,627 nm处可能是藻蓝蛋白,418 nm为脱镁叶绿素a吸收峰。所得3条类囊体膜条带的吸收光谱基本一致。

图1 蔗糖密度梯度离心分离类囊体膜Fig.1 Thylakoid membranes isolated by sucrose density gradients
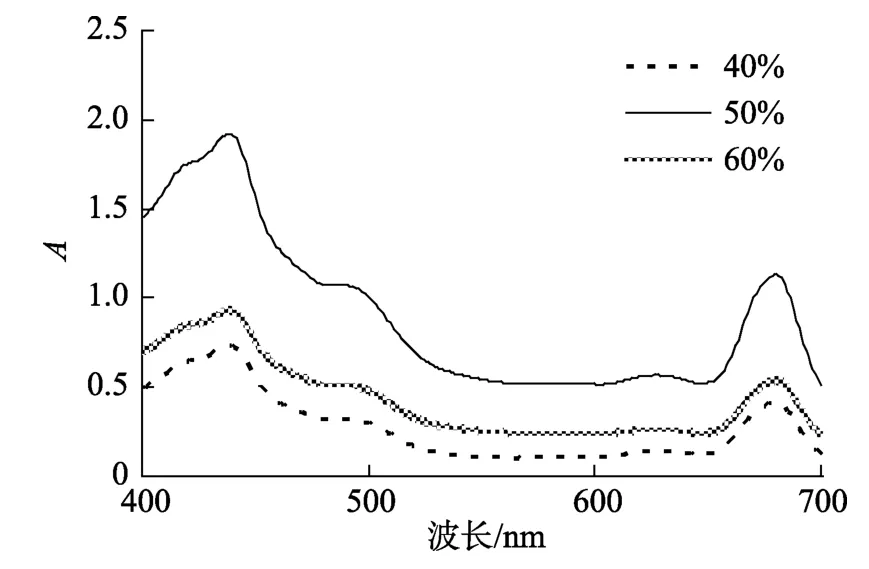
图2 40%、50%和 60%蔗糖密度层类囊体膜可见光吸收光谱Fig.2 Visible absorption spectra of thylakoid membranes located at 40%,50% and 60% sucrose layers
2.2 去污剂的选择
实验选用 40%蔗糖层分离到的类囊体膜进行去污剂的筛选。尝试选用了两种不同的去污剂 Triton X-100和DM对类囊体膜增溶,以比较蓝绿温和胶电泳分离的效果,结果显示,确定DM/Chla(w/w)15︰1产生的效果较好,在BN-PAGE胶中可以分离到较多较清晰的条带。相比较而言,用Triton X-100增溶类囊体膜时,只有少数膜蛋白复合物被分离,条带较少,显示增溶效果不充分(图3,图4)。

图3 Triton X-100和DM增溶类囊体膜BN-PAGE电泳图Fig.3 BN-PAGE analysis of thylakoid membranes solubilized by Triton X-100 and DM
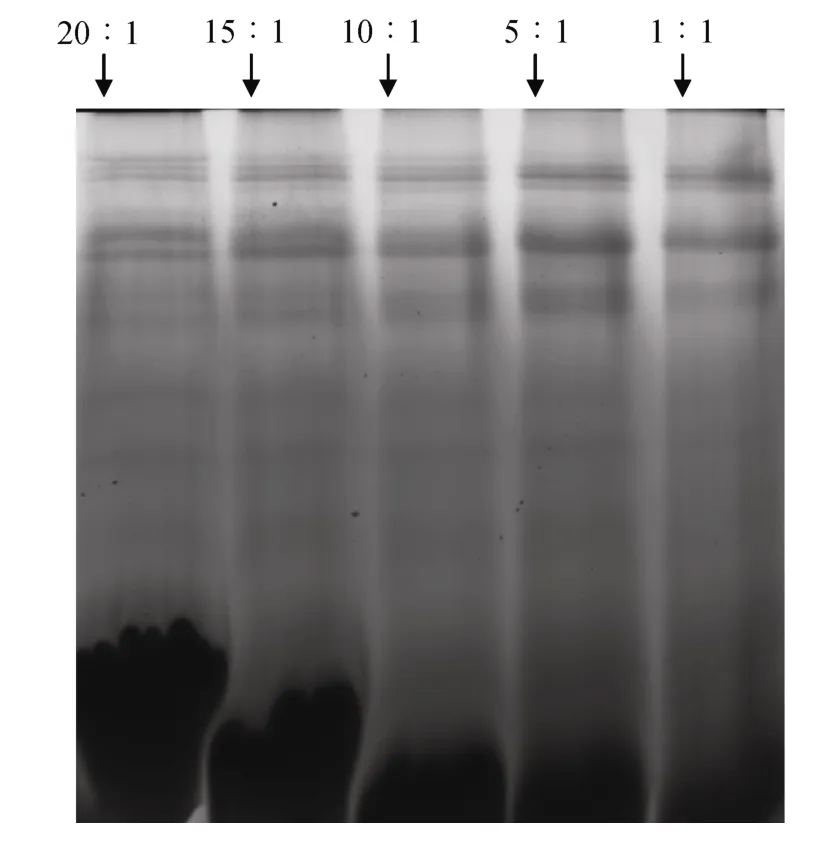
图4 不同浓度DM增溶类囊体膜BN-PAGE电泳Fig.4 BN-PAGE analysis of thylakoid membranes solubilized by different concentrations of DM
2.3 双向电泳
选取蔗糖密度层 50%条带制备得到的类囊体膜样品进行第一向 BN-PAGE和第二向 SDS-Urea-PAGE电泳实验。如图5,第一向电泳得到4条清晰的条带,既分离出4个蛋白复合物。为了进一步分析类囊体膜蛋白复合物的组成,将这 4条带切下再做第二向电泳,在此条件下,复合物各蛋白质亚基解离,依据各自分子质量不同而分离。如图 6,在第二向电泳中,各蛋白质复合物的各个亚基可以被清晰地分开。为了确定各个亚基的性质,我们将第二向电泳胶上的15个蛋白点切取做质谱鉴定。其中7个点有结果,其余8个点未与数据库中蛋白序列比对上。质谱结果 5: PSⅡ 47ku ,6: PSⅡ 44ku,7: cytochrome f ,8: PSⅡ D2, 9: PSⅡ D1,13: PSⅡ D2 ,14: PSⅡ D1 另外,1、2、3、4、10、11、12、15 号点未检出。
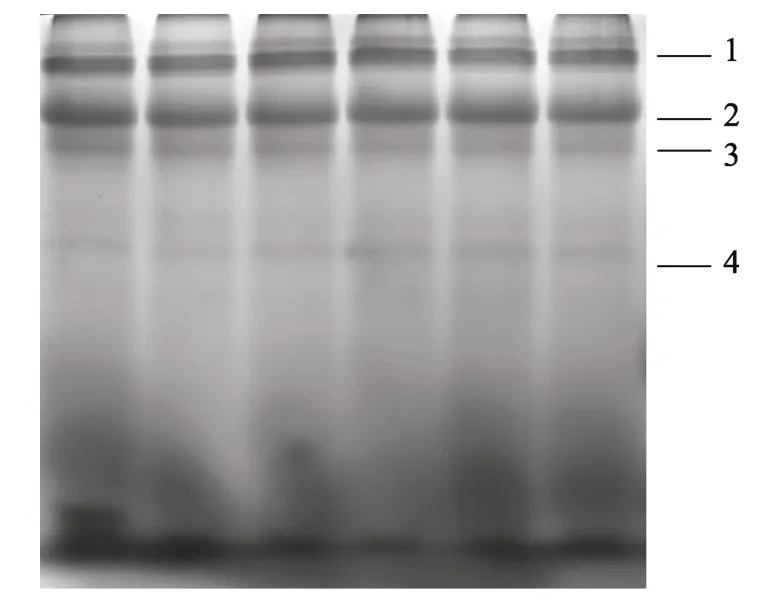
图5 BN-PAGE分离类囊体膜蛋白复合物Fig.5 BN-PAGE analysis of protein complexes in thylakoid menmbrane
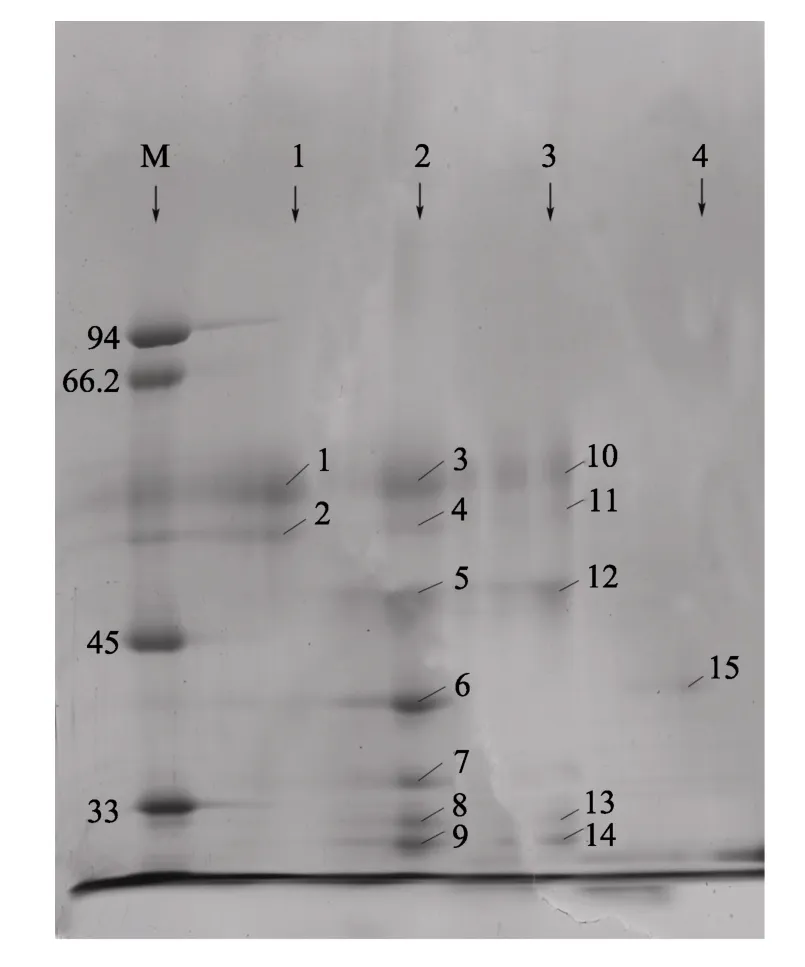
图6 双向电泳分析类囊体膜蛋白组成Fig.6 Two-dimensional analysis of protein composition of thylakoid membrane
3 讨论
以等电聚焦(isoelectric focusing,IEF)为第一向的双向聚丙烯酰胺凝胶电泳(2D-PAGE),是目前最常用来分离蛋白质的技术。但一些分子质量较大的蛋白质(大于200 ku),偏酸偏碱的蛋白质以及疏水性较强的膜蛋白的分离,采用2D-PAGE往往不能得到理想的结果[10]。BN-PAGE改进了第一向电泳,使样品保持复合物的活性在非变性条件下分离开。这一技术的难点首先在于去污剂的选择与用量。去污剂太少复合物不容易从膜上分离出来,去污剂太强则会导致复合物的降解。本实验采用了非离子型去污剂十二烷基麦芽糖苷 dodecylmaltosi- de(DM),这是一种温和去污剂,能打断脂质间连接,而不破坏蛋白质复合物的完整性。其次在电泳过程中以考马斯亮蓝G250代替SDS使蛋白质复合物带负电荷。因为 SDS作为离子载体同时也会是很强的去污剂,不仅会解离蛋白质复合物,还会使蛋白彻底变性。考马斯亮蓝G250则不会使蛋白变性,而且在电泳的同时进行染色,含叶绿素的蛋白质复合物如 PSⅠ,PSⅡ条带呈绿色,不含叶绿素的蛋白质复合物条带呈蓝色。另外第二向 SDS-PAGE中加入了尿素,提高了蛋白的溶解效率。然而最终分离到的蛋白点还是不多,原因可能与第二向电泳前的胶处理不充分有关,这方面技术还有待改进。
陈熙等[11]研究水稻类囊体膜蛋白分离出 8个叶绿素蛋白复合物。Kantzilakis[12]研究单细胞绿藻Scenedesmus obliquus也分离出8个叶绿素蛋白复合物。Kügler[13]用BN-PAGE从菠菜的叶绿体中分离到6个叶绿素蛋白复合物。本实验结果只有4个叶绿素蛋白复合物。高等植物的 PSⅡ捕光色素复合物是Lhc1至Lhc6其中由Lhcb1和Lhcb2组成的三聚体是PSⅡ主要的外周天线复合物[14]。而红藻的主要捕光天线复合物是藻胆体,其附着在类囊体膜的外表面上,通过锚定蛋白与类囊体的光合膜相联。本实验中,制备类囊体膜样品采用的研磨,超声方法使得藻胆体从类囊体膜上脱落下来,并发生解离,因此电泳条带结果不呈现捕光天线复合物的蛋白成分,与高等植物相比条带较少。
此外,第二向电泳结果的质谱分析,也只检测到 PSⅡ有关的蛋白和细胞色素b6f连接蛋白等,而关于PSⅠ的蛋白均没有检测出来。原因是分离到的PSⅠ蛋白浓度较低,损失也较多,其蛋白量低于质谱检测要求,导致没有成功检出。
温和胶电泳在研究叶绿体类囊体膜复合物的组成、生物发生中具有十分重要的作用,可使叶绿体蛋白质复合物以近似天然的状态分离。高等植物的叶绿体类囊体膜的研究已广泛应用这一技术,并成功分离出多个蛋白复合物。对于条斑紫菜这种原始红藻的类囊体膜研究,尚属于起步阶段,本实验证实了温和胶电泳与 SDS电泳结合在这方面应用的可行性。
[1]郑宝福.中国海藻志 第二卷 红藻门 第一册 [M].北京: 科学出版社,2009.
[2]王广策,邓田,曾呈奎.藻胆蛋白的研究(I)[J].海洋科学,2000,24(2): 22-25.
[3]王广策,邓田,曾呈奎.藻胆蛋白的研究(II)[J].海洋科学,2000,24(3): 19- 22.
[4]Ga H S Y,Han G C,Kazuhiro K,et al.Phylogeny of family Sctyosiphonaceae (Phaeophyta)from Korea based on sequences of plastid-encoded Rubisco spacer region[J].Algae,2001 (16): 145-150.
[5]Hippler M,Klein J,Fink A,et al.Towards functional proteomics of membrane protein complexes: analysis of thylakoid membranes from Chlamydomonas reinhardtii[J].The Plant Journal ,2001,28(5): 595-606.
[6]Gardian Z,Bumba L,Schrofel A,et al.Organisation of photosystem I and photosystem II in red alga Cyanidium caldarium: encounter of cyanobacterial and higher plant concepts[J].Biochim Biophys Acta,2007,1767(6): 725-731.
[7]Schägger H,von Jagow G.Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active forrn[J].Anal Biochem,1991,199 (2): 223- 231.
[8]Strbac D,Rodrigues M A,Pdos S C,et al.Chloroplast isolation from Laminaria digitata (Phaeophyceae): A reproducible methodology yielding photosynthetically active chloroplasts[J].Planta,1994,195:138-141.
[9]Nijimans L G J,Henderson N S,Holt I J.Blue Native electrophoresis to study mitochondrial and other protein complexes[J].Methods,2006,26: 327-334.
[10]Eubel H,Braun H P,Millar A H.Blue-native PAGE in plants: a tool in analysis of protein-protein interactions[J].Plant Methods,2005,1:11.
[11]陈熙,崔香菊,Zhao Y X,等.低叶绿素b水稻突变体类囊体膜的比较蛋白质组学[J].生物化学与生物物理进展,2006,33(7): 653-659.
[12]Kantzilakis K,Aivaliotis M,Kotakis C,et al.A comparative approach towards thylakoid membrane proteome analysis of unicellular green alga Scenedesmus obliquus[J].Biochimica et Biophysica Acta,2007,1768: 2271-2279.
[13]Kügler M,Jänsch L,Kruft V,et al.Analysis of the chloroplast protein complexes by blue-native polyacrylamide gel electrophoresis (BN-PAGE)[J].Photosynthesis Research,1997,53:35-44.
[14]Janson S.The light-harvesting chlorophyll a/b- binding proteins[J].Biochim Biophy Acta,1994,l184: l- 19.
