圆红冬孢酵母新颖脂肪酸合酶的重组表达、纯化与活性检测
2014-06-24朱志伟张素芳林心萍刘武军赵宗保
朱志伟,张素芳,林心萍,刘武军,赵宗保
1中国科学院大连化学物理研究所生物技术部,辽宁大连116023
2中国科学院大连化学物理研究所大连洁净能源国家实验室(筹),辽宁大连116023
3中国科学院大学,北京100049
圆红冬孢酵母新颖脂肪酸合酶的重组表达、纯化与活性检测
朱志伟1,3,张素芳1,2,林心萍1,3,刘武军1,2,赵宗保1,2
1中国科学院大连化学物理研究所生物技术部,辽宁大连116023
2中国科学院大连化学物理研究所大连洁净能源国家实验室(筹),辽宁大连116023
3中国科学院大学,北京100049
朱志伟,张素芳,林心萍,等.圆红冬孢酵母新颖脂肪酸合酶的重组表达、纯化与活性检测.生物工程学报,2014,30(9): 1414−1423.
Zhu ZW,Zhang SF,Lin XP,et al.Expression,purification and characterization of a novel fatty acid synthase from Rhodosporidium toruloides.Chin J Biotech,2014,30(9):1414−1423.
脂肪酸合酶(Fatty acid synthase,FAS)催化乙酰辅酶A和丙二酸单酰辅酶A反应生成脂肪酸,是油脂合成代谢途径中最重要的酶之一。在高产油脂的圆红冬孢酵母Rhodosporidium toruloides中发现了一种新颖的FAS,它含两个亚基,与其他物种的FAS相比,具有独特的结构域组成,尤其是含两个酰基载体蛋白(ACP)结构域。由于ACP在脂肪酸合成反应中起辅因子作用,推测多个ACP有利于提高FAS的催化活性,为研究该FAS的生物化学和结构特征,构建了表达FAS两个亚基的载体,并转化大肠杆菌Escherichia coli BL21(DE3),含pET22b-FAS1和pET24-FAS2质粒的重组菌株ZWE06可同时高表达两个亚基,经硫酸铵沉淀、蔗糖密度梯度离心和阴离子交换层析纯化,得到的重组FAS比活力达到548 mU/mg。纯化的FAS复合物可用于后续酶动力学和蛋白结构研究,且表达与纯化方法的建立对研究其他ACP的功能具有参考价值。
圆红冬孢酵母,脂肪酸合酶,过表达,纯化,酶活性
近些年,随着能源、环境与气候问题日益严峻,迫切需要开发绿色的可再生能源,其中生物柴油是甘油三酯转酯化得到的脂肪酸甲酯(或乙酯)[1],与现有石化柴油非常相似,因此受到广泛关注。目前,生产生物柴油的原料主要为植物油或废弃食用油,其生产依赖植物油脂资源。尽管油脂是可再生资源,但主要用于食品。全世界年产油脂约1.67亿t(2009年),其中植物油1.42亿t,但80%的油脂用于食品,少量用作动物饲料,只有14%可作为油脂化工原料[2]。而越来越多的油脂被加工成生物柴油,导致油脂原料供应不足,必须开发新的油脂资源。
将廉价的生物质资源转化为油脂是其中一种可能的选择[3]。微生物可将碳源转化为油脂,作为能源物质储存在细胞内,其中部分微生物可积累超过自身干重20%的油脂,这些微生物被称为产油微生物(Oleaginous microbes)[4]。圆红冬孢酵母Rhodosporidium toruloides可积累超过自身干重70%的油脂[5],高密度发酵最高油脂产量达到78.7 g/L[6],它可利用多种生物质水解液,并对其中的抑制成分有较好的耐受性[7],因此是一株具有良好工业应用潜能的菌株。
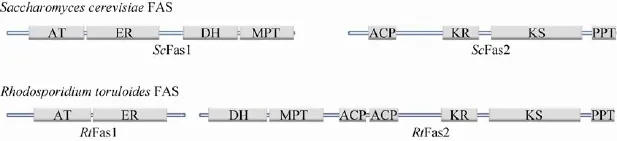
图1 比较圆红冬孢酵母与酿酒酵母脂肪酸合酶Fig.1Comparison of the fatty acid synthases from R.toruloides and S.cerevisiae.The FASs are composed of the following domains,acetyl transferase,AT;enoyl reductase,ER;dehydratase,DH;malonyl/palmitoyl transferase,MPT; acyl carrier protein,ACP;ketoacyl reductase,KR;ketoacyl synthase,KS and phosphopantetheinyl transferase,PPT.
对圆红冬孢酵母进行了基因组测序和注释,发现它含新颖的脂肪酸合酶(FAS)基因[8],该酶由两个亚基组成,且与其他物种(如酿酒酵母Saccharomyces cerevisiae)的FAS明显不同(图1)。其β亚基(Fas1)由乙酰转移酶(Acetyl transferase)和烯酰还原酶(Enoyl reductase)结构域组成,而α亚基(Fas2)由脱水酶(Dehydratase)、丙二酰/棕榈酰转移酶(Malonyl/palmitoyl transferase)、酰基载体蛋白(Acyl carrier protein,ACP)、酮酰还原酶(Ketoacyl reductase)、酮酰合酶(Ketoacyl synthase)和磷酸泛酰巯基乙胺转移酶(Phosphopantetheinyl transferase,PPT)结构域组成。且Fas2含两个ACP结构域,它们的序列一致性达到76%。到目前为止,首次发现FAS含两个ACP结构域[8]。ACP在脂肪酸合成过程中,起辅因子作用。被PPT活化后,在保守的丝氨酸残基上修饰磷酸泛酰巯基乙胺,而磷酸泛酰巯基乙胺含巯基,可共价结合酰基基团[9],而酰基-ACP在FAS的不同活性位点处完成各步反应,每个周期增加一个二碳单元(-CH2CH2-)[10-11]。酿酒酵母FAS为α6β6异十二聚体,分子量约为2 600 kDa,该巨型复合物形成6个反应活性空腔[10-12],每个空腔包含所有酶活性位点和一个辅因子ACP。若圆红冬孢酵母FAS也形成类似复合物结构,其活性空腔将含两个ACP,故可能提高空腔中反应中间物浓度,有利于脂肪酸合成[13]。为研究圆红冬孢酵母FAS的生物化学与结构特性,构建了表达FAS两个亚基的载体,在大肠杆菌中过表达了该复合物,经硫酸铵沉淀、蔗糖密度梯度离心和阴离子交换层析纯化,所得重组FAS的比活力超过500 mU/mg。
1 材料与方法
1.1 材料
pYX212-FAS1-FAS2-WT质粒由本实验室构建和保存[14];抗生素、β-巯基乙醇(β-ME)、苯甲基磺酰氟(PMSF)、异丙基-β-D-硫代半乳糖苷(IPTG)、溶菌酶、HEPES、EDTA、E.coli DH5α和BL21(DE3)购自北京鼎国生物技术有限公司;pET22b(+)、pET24b(+)和pACYCDuet-1载体购自Novagen公司;PrimeSTAR DNA聚合酶、限制性内切酶和DNA连接酶购自大连TaKaRa公司;所用引物如表1所列,引物由鼎国生物技术有限公司合成;DNA测序由北京Invitrogen公司完成;NADPH、乙酰辅酶A和丙二酸单酰辅酶A购自Sigma公司;DEAE Sepharose Fast Flow树脂购自GE Healthcare公司;cOmplete蛋白酶抑制剂购自Roche公司;其他化学试剂均为分析纯。LB培养基组成为10 g/L蛋白胨,5 g/L酵母粉,10 g/L NaCl,pH 7.0;TB培养基组成为12 g/L蛋白胨,24 g/L酵母粉,4 mL/L甘油,0.017 mol/L KH2PO4和0.072 mol/L K2HPO4。

表1 质粒构建所用的引物序列Table 1Primers used in this study
1.2 方法
1.2.1 FAS表达载体的构建
以pYX212-FAS1-FAS2-WT为模板,使用FAS1-5-NdeI/FAS1-3-EcoRI引物扩增FAS1基因,该片段在5′端引入StrepⅡ-标签序列,获得的片段经NdeⅠ/EcoRⅠ双酶切,连入同样酶切的pET24b(+)载体,得到质粒pET24b-FAS1。使用FAS1-5-NdeⅠ-His/FAS1-3-EcoRⅠ引物扩增FAS1基因,该片段在5′端引入His-标签序列,并连入pET22b(+)载体的NdeⅠ/EcoRⅠ位点,得到质粒pET22b-His-FAS1。也将pET24b-FAS1上的NdeⅠ/EcoRⅠ插入片段连入pET22b(+)载体得到pET22b-FAS1。以pET24b-FAS1为模板,使用FAS1-5-NcoⅠ/FAS1-3-HindⅢ引物扩增带StrepII-标签的FAS1基因,经NcoⅠ/HindⅢ双酶切后连入表达载体pACYCDuet-1,得到质粒pACYC-FAS1。
以pYX212-FAS1-FAS2-WT为模板,用FAS2-5-HindⅢ/FAS2-3-NotⅠ引物扩增FAS2基因,得到的片段经HindⅢ/NotⅠ双酶切,连入同样酶切的pET24b(+)载体,得到质粒pET24b-FAS2,用于表达C端带His-标签的融合蛋白。用FAS2-5-NdeⅠ/FAS2-3-His-AvrⅡ引物扩增FAS2基因,该片段在3′端引入His-标签序列,经NdeⅠ/AvrⅡ双酶切后连入前面获得的pACYC-FAS1质粒,得到pACYC-FAS1-FAS2质粒。前面所得正确质粒,均经测序验证无碱基突变。上述质粒转化E.coli BL21(DE3),得到重组菌株。构建的质粒和重组菌株如表2所示。
1.2.2 重组蛋白的表达纯化
接种重组菌株ZWE06的单菌落于5 mL LB液体培养基(含100 μg/mL氨苄青霉素和50 μg/mL卡那霉素),37℃振荡培养过夜。取1 mL接种于400 mL TB培养基(含100 μg/mL氨苄青霉素和50 μg/mL卡那霉素),37℃、200 r/min培养至OD600约为0.8,加入终浓度为0.5 mmol/L的IPTG,16℃诱导培养36 h,离心收集菌体,–20℃保存。
以下纯化步骤在冰上或4℃进行。
细胞裂解:湿菌体约12 g,以1∶3比例加入裂解缓冲液(100 mmol/L K3PO4,5 mmol/L EDTA,5 mmol/L β-ME,1 mmol/L PMSF,3 mmol/L MgCl2,0.5 mg/mL溶菌酶,蛋白酶抑制剂2片,pH 7.0),超声裂解细胞,18 000×g离心30 min,去细胞碎片,上清液转移至锥形瓶,并加入磁转子。

表2 构建的质粒和重组菌株Table 2Plasmids and strains used in this study
硫酸铵沉淀:上述细胞裂解上清液中,加入1/4体积的饱和硫酸铵溶液(pH 7.0),使硫酸铵终浓度为20%,搅拌30 min,18 000×g离心30 min。上清液中加入1/3体积的饱和硫酸铵溶液,使硫酸铵终浓度增加到40%,搅拌30 min,18 000×g离心30 min。沉淀溶于16 mL缓冲液A(20 mmol/L HEPES,100 mmol/L KCl,5 mmol/L EDTA,5 mmol/L β-ME,pH 8.0)。
蔗糖密度梯度离心:用缓冲液A配制10%、 15%、20%、25%、30%、35%和40%(W/V)蔗糖溶液,使用38.5 mL的Ultra Clear Open-top离心管,依次加入5 mL上述蔗糖溶液,制成分阶蔗糖梯度溶液,室温放置7 h,让其形成线性密度梯度。然后加入2.8 mL蛋白溶液,使用Beckman SW32转头,90 000×g、4℃离心15 h。从上往下依次用针头抽取3 mL样品,进行SDS-PAGE分析,含FAS两个亚基的组分被混合,超滤浓缩。
弱阴离子交换层析:层析填料DEAE Sepharose Fast Flow,层析柱直径25 mm,装填量约15 cm(约80 mL)。先使用400 mL缓冲液A平衡层析柱,超滤浓缩的蛋白样品上样,然后用100 mL缓冲液A洗涤,再用250 mL缓冲液A和250 mL缓冲液B(20 mmol/L HEPES,800 mmol/L KCl,5 mmol/L EDTA,5 mmol/L β-ME,pH 8.0)组成的梯度混合液洗脱,自动收集洗脱蛋白,洗脱组分用Bradford法测量蛋白浓度,SDS-PAGE分析,含目的蛋白的组分被合并,并超滤浓缩。
1.2.3 活性检测
酶活测定反应体系含100 mmol/L K3PO4(pH 7.0),5 mmol/L EDTA,5 mmol/L DTT,12.5 μmol/L乙酰辅酶A,50 μmol/L丙二酸单酰辅酶A,75 μmol/L NADPH,加入适量酶,在200 μL的微型石英比色皿中,室温(约25℃)反应,检测340 nm吸光值的变化,以不加丙二酸单酰辅酶A为对照。酶活单位定义,每分钟消耗1 nmol NADPH(1 mL反应体系中,吸光度减少0.006 2)所需酶量为1 mU。
2 结果与分析
2.1 FAS表达菌株构建与优化
圆红冬孢酵母FAS含有两个亚基,分别由FAS1和FAS2基因编码,Fas1含1 266个氨基酸,Fas2含2 928个氨基酸(GenBank Accession No.分别为EMS21161和EMS21268),故这两个亚基均为大蛋白。将FAS1和FAS2基因分别克隆到表达载体pET24b(+),并转化E.coli BL21(DE3)得到重组菌株ZWE01和ZWE02,IPTG可诱导表达目的蛋白,且均为可溶性蛋白(图2)。
为纯化FAS复合物,需在同一菌株中表达两个亚基,使表达产物形成复合物[15]。为此,将FAS1和FAS2克隆到可表达两个蛋白的pACYCDuet-1载体,该载体含有两个多克隆位点,且都置于表达元件(T7启动子/lac操纵子和核糖体结合位点)下游。然而,含pACYCFAS1-FAS2质粒的重组菌株ZWE04只大量表达

图2SDS-PAGE分析重组菌株表达目的蛋白Fig.2SDS-PAGE analysis of the cell lysates from recombinant strains with the indicated plasmids.White and black arrows indicated expressed Fas1 and Fas2 subunits,respectively.The cells were precultured in LB broth with appropriate amount of antibiotics at 37℃to OD600~0.8,then 0.5 mmol/L IPTG was added and the temperature was reducedto 16℃to induce the expressionofrecombinantproteins,exceptingthe control culture without IPTG.Cell pellets harvested fromovernightculturewereusedforSDS-PAGE analysis.
Fas1蛋白,而更大的Fas2蛋白基本不表达(图2)。
然后,在E.coli BL21(DE3)中同时转化pACYC-FAS1和pET24b-FAS2质粒,得到重组菌株ZWE05。这两个质粒含不同复制区和抗性标记基因,具有很好的兼容性。虽然重组菌株ZWE05可同时表达两个蛋白,但Fas1表达量明显低于Fas2(图2),可能是由于pACYCDuet-1质粒使用P15A复制子,而pET24b(+)使用pBR322复制区,前者质粒拷贝数只有后者的1/4[16],故导致Fas1表达水平偏低。
由于FAS两个亚基的计量关系为1∶1,但重组菌株ZWE05,两个亚基的表达水平不协调。pET22b(+)与pET24b(+)载体都使用pBR322复制区,但含不同抗性标记基因,因此用两种抗生素可维持这两个并不兼容的质粒复制,且质粒拷贝数相近。用不兼容质粒共表达目的蛋白已有文献报道[17],因此,将pET22b-FAS1和pET24b-FAS2质粒同时转化E.coli BL21(DE3),得到的重组菌株ZWE06,可表达FAS的两个亚基。SDS-PAGE分析表明,含pET22b-FAS1和pET24b-FAS2质粒的重组菌株ZWE06,两个蛋白的表达量相当(图3)。
2.2 纯化重组的FAS
重组菌株ZWE06,表达N端带StrepII-标签的Fas1和C端带His-标签的Fas2,尝试了Ni-NTA树脂亲和层析纯化FAS复合物,但没有成功。为此,又构建了pET22b-His-FAS1质粒用于表达N端带His-标签的Fas1。含pET22b-His-FAS1和pET24b-FAS2质粒的重组菌株ZWE07也可较好地表达两个蛋白(结果未列出),但使用Ni-NTA树脂亲和层析纯化FAS,仍然没有成功。
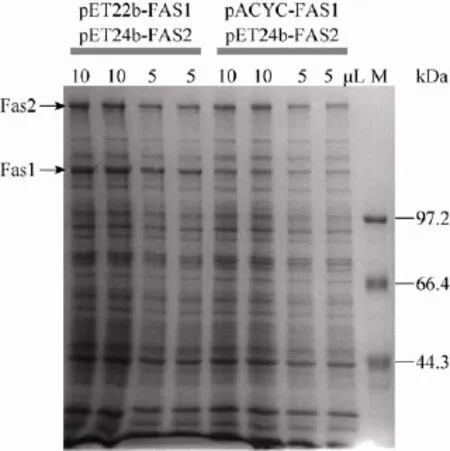
图3 比较两重组菌株目的蛋白表达水平Fig.3Comparison of the expression of FAS subunits in the strains with plasmids as indicated.The arrows indicated expressed Fas1 and Fas2 subunits.The culture conditions were the same as Fig.2,and 5 or 10 μL cell lysates(as indicated)from the same volume of culture broth were loaded into the gel.M:protein molecular weight standard.
最后,使用重组菌株ZWE06表达FAS两个亚基,经硫酸铵沉淀富集目的蛋白,预实验表明30%–40%饱和硫酸铵分级沉淀,回收目的蛋白最多,回收率达70%,最终选择20%–40%饱和硫酸铵沉淀,目的蛋白回收率为92%。
由于酿酒酵母FAS为α6β6复合物,其分子量达2 600 kDa,推测圆红冬孢酵母FAS也可能组装成类似的复合物结构,而具有相当的分子量。对于该巨型复合物,可采用蔗糖密度梯度离心进行分离。使用10%–40%线性蔗糖密度梯度,Beckman SW32转头,90 000×g离心15 h,两个亚基蛋白同时出现在蔗糖密度超过25%的梯度层(图4,泳道8),该结果与酿酒酵母FAS的蔗糖密度梯度离心结果类似[10],表明圆红冬孢酵母FAS可能具有与酿酒酵母FAS类似的复合物结构。同时大量游离的Fas1亚基蛋白存在于低蔗糖密度层(图4,泳道4,白色箭头),且许多FAS蛋白凝集体存在于离心沉淀中(图4,泳道p,白色和黑色箭头),说明蔗糖密度梯度离心不仅能分离杂蛋白,而且可以去除游离的亚基和蛋白凝集体。

图4 SDS-PAGE分析蔗糖密度梯度离心分离组分Fig.4SDS-PAGE analysis of the protein fractions from sucrose density gradient centrifugation.From lane 1 to 12,the sucrose density increased from 10%to 40%. Lane p was loaded with proteins from the centrifugation pellets.White and black arrows indicated the Fas1 and Fas2 subunits,respectively.
收集含FAS复合物的蔗糖层,超滤浓缩后,经阴离子交换层析进一步纯化,使用的填料为DEAE Sepharose弱阴离子交换树脂,KCl浓度梯度洗脱,目的蛋白被100–200 mmol/L的KCl洗脱。经过上述三步纯化,FAS的纯度达到90%以上(图5)。再次用蔗糖密度梯度离心分析表明只有一条单一的蛋白区带。
2.3 FAS的酶活性测定
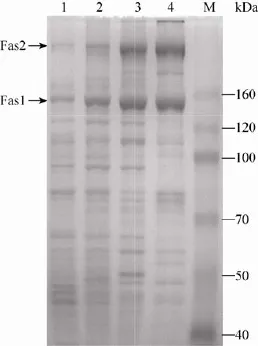
图5 SDS-PAGE分析纯化过程的蛋白样品Fig.5SDS-PAGE analysis of proteins obtained from the purification procedures.The arrows indicated Fas1 and Fas2 subunits.Equal amount of proteins(3 μg)were loaded in each lane.lane 1:lysate supernatant;lane 2: 20%–40%(NH4)2SO4precipitation;lane 3:sucrose density gradient centrifugation;lane 4:DEAE sepharose anion exchange chromatography;M:protein molecular weight standard.
由于FAS的底物NADPH在340 nm有特征吸收峰,比摩尔消光系数为6.2×103L/(mol·cm),故可直接检测底物NADPH消耗速率[18]。采用分光光度法进行酶活性测定,发现重组圆红冬孢酵母FAS的比活力为(548±16)mU/mg。
3 讨论
圆红冬孢酵母是一株性状突出的产油酵母,为了解其油脂积累机制,进行了基因组、转录组和蛋白质组学分析,发现了一些可能与油脂过量积累相关的基因,其中包括FAS基因,编码FAS两个亚基的基因FAS1和FAS2,在油脂积累过程中表达上调[8]。而检查了两个亚基的氨基酸序列,发现它们具有独特的结构域组成,并含有两个ACP结构域(图1)。到目前为止,只在红酵母中发现了这种含多个ACP结构域的FAS。然而与FAS类似的由多结构域组成的聚酮合酶(Polyketide synthases,PKS),经常含有多个ACP[19]。有研究证明,含5个串联ACP的多不饱和脂肪酸合酶(属于PKS,而非FAS),活性ACP数量越多,其合成多不饱和脂肪酸的能力越强[20]。Curacin A合成途径的CurA蛋白含有3个ACP结构域,类似研究也证明ACP数量越多,Curacin A得率越高[21]。
脂肪酸合成是生物界通用的代谢反应,然而不同物种的FAS却有很大差别。在原核生物或植物质体中,FAS由多个分开的蛋白组成;而在真菌或动物中,FAS是由不同结构域组成的多酶体系[22]。圆红冬孢酵母FAS为真菌型多结构域蛋白,且该酵母只含一套FAS系统。ACP是脂肪酸合成必需的蛋白辅因子[23],在E.coli中,ACP是高丰度蛋白(胞内浓度约为100 mol/L),而在真菌中,由于FAS复合物形成6个反应空腔,有学者认为在每个反应空腔中,ACP的浓度比E.coli中高一个数量级,从而有效地提高了反应中间物浓度,使催化效率更高[13]。圆红冬孢酵母FAS含有两个ACP,且蔗糖密度梯度离心结果表明它可能形成与酿酒酵母FAS类似的巨型复合物,按照前面的假设,则活性中心ACP浓度更高,将可能具有更好的催化活性。本文建立了圆红冬孢酵母FAS表达纯化条件,为研究其酶动力学和蛋白结构奠定了基础,同时该新颖的FAS可用于脂肪酸类生物燃料的代谢工程和合成生物学研究[24-26]。 REFERENCES
[1]Ma F,Hanna MA.Biodiesel production:a review. Bioresour Technol,1999,70(1):1−15.
[2]Biermann U,Bornscheuer U,Meier MAR,et al. Oilsandfatsasrenewablerawmaterialsin chemistry.Angew Chem Int Ed,2011,50(17): 3854−3871.
[3]ZhaoZB,HuaYY,LiuB.Howtosecure triacylglycerolsupplyforChinesebiodiesel industry.China Biotechnol,2005,25(11):1−6(in Chinese).赵宗保,华艳艳,刘波.中国如何突破生物柴油产业的原料瓶颈.中国生物工程杂志,2005, 25(11):1−6.
[4]RatledgeC,WynnJP.Thebiochemistryand molecularbiologyoflipidaccumulationin oleaginous microorganisms.Adv Appl Microbiol, 2002,51:1−51.
[5]Li Y,Zhao Z,Bai F.High-density cultivation of oleaginous yeast Rhodosporidium toruloides Y4 in fed-batch culture.Enzyme Microb Technol,2007, 41(3):312−317.
[6]Zhao X,Hu C,Wu S,et al.Lipid production by RhodosporidiumtoruloidesY4usingdifferent substratefeedingstrategies.JIndMicrobiol Biotechnol,2011,38(5):627−632.
[7]Hu C,Zhao X,Zhao J,et al.Effects of biomass hydrolysisby-productsonoleaginousyeast Rhodosporidiumtoruloides.BioresourTechnol, 2009,100(20):4843−4847.
[8]Zhu Z,Zhang S,Liu H,et al.A multi-omic map of thelipid-producingyeastRhodosporidium toruloides.Nat Commun,2012,3:1112.
[9]Johansson P,Mulinacci B,Koestler C,et al. Multimeric options for the auto-activation of the SaccharomycescerevisiaeFAStypeI megasynthase.Structure,2009,17(8):1063−1074.
[10]Lomakin IB,Xiong Y,Steitz TA.The crystal structure of yeast fatty acid synthase,a cellular machine with eight active sites working together. Cell,2007,129(2):319−332.
[11]Leibundgut M,Jenni S,Frick C,et al.Structuralbasis for substrate delivery by acyl carrier protein in the yeast fatty acid synthase.Science,2007,316: 288−290.
[12]Jenni S,Leibundgut M,Boehringer D,et al. Structureoffungalfattyacidsynthaseand implicationsforiterativesubstrateshuttling. Science,2007,316:254−261.
[13]Johansson P,Wiltschi B,Kumari P,et al.Inhibition ofthefungalfattyacidsynthasetypeI multienzyme complex.Proc Natl Acad Sci USA, 2008,105(35):12803−12808.
[14]Zhao ZB,Zhu ZW,Zhang SF.A fatty acid synthase from the oleaginous yeast,the coding genes and application:CN,201310067825.2013-03-05(in Chinese).赵宗保,朱志伟,张素芳.一种产油酵母脂肪酸合酶及其编码基因与应用:中国专利,申请号201310067825.2013-03-05.
[15]Selleck W,Tan S.Recombinant Protein Complex Expression in E.coli.In Current Protocols in Protein Science.Hoboken,New Jersey:John Wiley &Sons,Inc.,2008:Chapter 5,Unit 5 21.
[16]Tolia NH,Joshua-Tor L.Strategies for protein coexpression in Escherichia coli.Nat Methods, 2006,3(1):55−64.
[17]Pang YQ,Jia HG,Fang RX,et al.A simple and visibleassayforcrerecombinaseactivityin Escherichiacolibyusingtwoincompatible plasmids.ActaMicrobiolSin,2005,45(1): 125−128(in Chinese).庞永奇,贾红革,方荣祥,等.利用不相容质粒共转化大肠杆菌对Cre重组酶体内重组活性的可视检测.微生物学报,2005,45(1):125−128.
[18]LynenF.Yeastfattyacidsynthase.Methods Enzymol,1969,14:17−33.
[19]Zheng P,Xia Y,Xiao G,et al.Genome sequence of the insect pathogenic fungus Cordyceps militaris,a valued traditional Chinese medicine.Genome Biol, 2011,12(11):R116.
[20]Jiang H,Zirkle R,Metz JG,et al.The role of tandemacylcarrierproteindomainsin polyunsaturatedfattyacidbiosynthesis.JAm Chem Soc,2008,130(20):6336−6337.
[21]Gu L,Eisman EB,Dutta S,et al.Tandem acyl carrier proteins in the curacin biosynthetic pathway promote consecutive multienzyme reactions with a synergistic effect.Angew Chem Int Ed,2011, 50(12):2795−2798.
[22]Schweizer E,Hofmann J.Microbial type I fatty acid synthases(FAS):major players in a network of cellular FAS systems.Microbiol Mol Biol Rev, 2004,68(3):501−517.
[23]Chan DI,Vogel HJ.Current understanding of fatty acid biosynthesis and the acyl carrier protein. Biochem J,2010,430(1):1−19.
[24]Steen EJ,Kang Y,Bokinsky G,et al.Microbial productionoffatty-acid-derivedfuelsand chemicals from plant biomass.Nature,2010,463: 559−562.
[25]LeberC,DaSilvaNA.Engineeringof Saccharomyces cerevisiae for the synthesis of short chain fatty acids.Biotechnol Bioeng,2014,111(2): 347−358.
[26]Runguphan W,Keasling JD.Metabolic engineering of Saccharomyces cerevisiae for production of fatty acid-derived biofuels and chemicals.Metab Eng, 2014,21:103−113.
(本文责编郝丽芳)
Expression,purification and characterization of a novel fatty acid synthase from Rhodosporidium toruloides
Zhiwei Zhu1,3,Sufang Zhang1,2,Xinping Lin1,3,Wujun Liu1,2,and Zongbao K.Zhao1,2
1 Division of Biotechnology,Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,Liaoning,China
2 Dalian National Laboratory for Clean Energy,Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023, Liaoning,China
3 University of Chinese Academy of Sciences,Beijing 100049,China
Fatty acid synthase(FAS)catalyses the reaction between acetyl-CoA and malonyl-CoA to produce fatty acids. It is one of the most important enzyme in lipid biosynthesis.FAS of the oleaginous yeast Rhodosporidium toruloides has two acyl carrier protein(ACP)domains and a distinct subunit composition compared with FASs of other species.As ACP is a protein cofactor crucial for fatty acid chain elongation,more ACPs in the FAS may facilitate the reaction.To study the biochemical and structural properties of this novel FAS from R.toruloides,plasmids were constructed and transformed into Escherichia coli BL21(DE3).The strain ZWE06 harboring plasmids pET22b-FAS1 and pET24b-FAS2 could co-overexpress the two subunits.The recombinant FAS was purified by sequentially using ammonium sulphate precipitation,sucrose density gradient centrifugation and anion exchange chromatography.The specific activity of the recombinant FAS was 548 mU/mg.The purified complex would be used to study enzyme kinetics and protein structure of FAS,and heterogeneous expression and purification will facilitate revealing the mechanism of this novel FAS with double ACPs.
Rhodosporidium toruloides,fatty acid synthase,overexpression,purification,enzyme activity
December 11,2013;Accepted:January 24,2014
Zongbao K.Zhao.Tel/Fax:+86-411-84379211;E-mail:zhaozb@dicp.ac.cn
Supported by:National Natural Science Foundation of China(Nos.31000052,31170060).
国家自然科学基金(Nos.31000052,31170060)资助。
时间:2014-03-10网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.130626.html
