反硝化脱硫工艺中生物硫分布特征及分离方法
2014-06-24王爱杰马素丽赵友康谭文勃徐熙俊孙德智
远 野,王爱杰,马素丽,陈 川,赵友康,谭文勃,黄 聪,徐熙俊,孙德智
反硝化脱硫工艺中生物硫分布特征及分离方法
远 野1,2,王爱杰1,2,马素丽1,2,陈 川1,2,赵友康1,2,谭文勃1,2,黄 聪1,2,徐熙俊1,2,孙德智1,2
(1.哈尔滨工业大学市政环境工程学院,150090哈尔滨;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨)
为探寻反硝化脱硫工艺生物硫分离方法,运行反硝化脱硫系统获得生物硫在系统中分布特征,并对生物硫进行粒径分布、Zeta电位、能谱及电镜扫描分析,确定了一种分离生物硫的新方法.结果表明,生物硫在反硝化脱硫系统中水相占65%,污泥相占35%.能谱分析表明,生物硫硫元素占60%以上,电镜分析显示生物硫表面具有多聚糖、蛋白质等官能团,生物硫Zeta电位平均为-20 mV带负电(在±30 mV之间),得出生物硫具有胶体特性.进一步用阳离子絮凝剂实验分离生物硫获得99%分离率.混凝沉淀方法能有效地分离回收生物硫.
生物硫;分布特征;胶体特性;混凝沉淀
含硫含氮废水毒性高、腐蚀性强、污染性大,对环境造成严重破坏[1-4].王爱杰等[5-8]成功将反硝化脱硫工艺应用于含硫、氮、碳废水的处理,通过在生态位上调节反硝化自养和异养的协同作用,实现了反硝化脱硫工艺中硫化物向单质硫(简称“生物硫”)的定向转化,在同步去除硫、氮、碳污染物的同时获得了较高单质硫转化率.然而,单质硫易被空气氧化,如果在反硝化脱硫工艺后续处理中,单质硫不能被有效分离出来,将被继续氧化为硫酸盐等硫系污染物,对水体造成二次污染[9-14].陈川等[15-16]对反硝化脱硫工艺中碳氮比、硫氮比和进水负荷等工艺参数进行了研究,讨论了影响单质硫转化率的因素.但是,目前关于单质硫在反硝化脱硫工艺系统中分布情况的研究未见报道.反硝化脱硫微生物产生的生物硫分散在水相和污泥相中,研究其分布情况有助于生物硫的分离回收,可作为再生资源应用于农业和工业生产中.
本文成功运行反硝化脱硫反应器实现了单质硫最大产率,通过单质硫的实测和物料平衡分析得出生物硫在反硝化脱硫工艺水相和污泥相的分布情况,并对生物硫进行了粒径分布、Zeta电位、能谱元素分析以及电镜扫描等物化特性的分析,得出生物硫具有胶体特性的重要结论.进而提出可利用混凝沉淀的方法进行生物硫的分离回收,为下一步生物硫的分离优化提供理论基础.
1 实 验
1.1实验装置
反硝化脱硫反应器采用颗粒污泥膨胀污泥床反应器EGSB,装置如图1所示.内径50 mm,总高度120 cm,反应区高度140 cm,总容积5.0 L,主反应区1.0 L,高径比为18.反应器外侧缠绕电热丝通过温控仪控制温度在(35±1)℃.进水采用蠕动泵从反应器底部连续打入,并在反应器沉淀区设有回流口,通过蠕动泵回流实现内循环,回流比控制在10∶1,上升流速vup为1.5 m/h.产生的气体经2 mol/L的碱液吸收后进入湿式气体流量计测量体积.
1.2接种污泥
反硝化脱硫反应器接种污泥取自哈尔滨太平污水处理厂二沉池,污泥的生物量指标分别为:悬浮物质量浓度(SS)27.48 g/L,挥发性悬浮物(VSS)1.75 g/L,VSS与SS比0.75.在接入反应器之前,采用不同孔径的泰勒式标准筛对接种污泥进行淘洗和筛选,以去除污泥中较大的无机颗粒和金属沉淀物质.将经过淘洗粒径均匀且小于0.2 mm的污泥接入反应器中.
1.3反应器的启动
反硝化脱硫反应器进水组成为硫化物200 mg/L、硝酸盐90 mg/L、乙酸盐78 mg/L.根据微生物生长代谢的需要,每升进水加入1 mL微量元素溶液,组成为:EDTA,50 g/L;NaOH,11 g/L;CaCl2·2H2O,7.34 g/L;CuCl2·2H2O,0.14 g/L;(NH4)6Mo7O24·4H2O,0.5 g/L;MnCl2·2H2O,2.5 g/L;ZnCl2,1.06 g/L;FeCl2·4H2O,3.58 g/L;CoCl2·6H2O,0.5 g/L.进水调节pH至7.5~8.5,温度保持在25℃.水力停留时间(HRT)从12 h逐渐缩短到8、6、4 h以提高反应器进水负荷,以硫化物、硝酸盐和乙酸盐的去除率及单质硫生成率作为考察反应器处理效果的依据.

图1 反硝化脱硫EGSB反应器
1.4分析方法
一出门,丁香就给权筝打电话避开一切与自杀相关的敏感话题,直接切入“结婚”。她要求权筝别人说什么都别想,就问问自己对何东的感觉,他是不是比较接近你条件的男人?权筝想了一下说是,我长的不美,傻博一个,还不会持家,能找到他这样的,很满意。丁香就说,那还等什么?女人是性别上的弱势群体,八十岁的男人还能传种接代呢,八十岁的女人你试试?
硝酸盐和乙酸盐采用离子色谱法测定[17];硫化物采用亚甲基蓝分光光度法测定[18];单质硫的测定采用亚硫酸盐法[8,19],单质硫与亚硫酸盐在高pH下转化为硫代硫酸盐,利用离子色谱法测定硫代硫酸盐含量间接得到生物硫含量.生物硫特性测定方法:粒径分布采用激光粒度分布仪测定,Zeta电位采用Zeta电位分析仪测定.SEM图片采用Quanta 200环境扫描电镜.
2 结果与讨论
2.1反硝化脱硫反应器运行效能
反硝化脱硫反应器运行效能见图2.第Ⅰ阶段(0~30 d),反应器启动期的水力停留时间(HRT)为12 h,在进水硫化物、硝酸盐和乙酸盐负荷为0.40,0.18和0.15 kg·m-3·d-1条件下,硫化物的去除率逐渐达97%,单质硫的转化率达93%.硝酸盐和乙酸盐的去除率分别达97%和96%.在反应器底部发现直径在0.5~2.0 mm的颗粒污泥,颗粒污泥外面包裹着一层白色的单质硫.反应器启动期驯化出具有高效反硝化脱硫功能的颗粒污泥.

图2 反硝化脱硫反应器运行效能
第Ⅱ阶段(30~50 d),HRT缩短到8 h,进水硫化物、硝酸盐和乙酸盐负荷提高到0.61,0.29和0.22 kg·m-3·d-1,硫化物、硝酸盐和乙酸盐的去除率依然可达94%以上,并在气相中检测到N2和CO2,未检出H2S和N2O.为继续提升反硝化脱硫反应器的效率,在第Ⅲ阶段(50~70 d)缩短HRT到6 h,进水硫化物、硝酸盐和乙酸盐负荷提高到0.80,0.37和0.31 kg·m-3·d-1,单质硫转化率仍然达95%,同时硫化物、硝酸盐和乙酸盐的去除率保持在95%以上.在第Ⅳ阶段(70~80 d),HRT进一步缩短到4 h,进水硫化物、硝酸盐和乙酸盐负荷进一步提高到1.23,0.52和0.45 kg·m-3·d-1,硫化物、硝酸盐和乙酸盐去除率下降到81%,69%和57%,单质硫转化率下降到80%以下.式(1)~(3)是由Reyes⁃Avila和陈川等[4,16,20]提出的自养反硝化微生物和异养反硝化微生物生化反应式:

第Ⅳ阶段(70~80 d),负荷进一步提高,反应器出水检测到0.11 kg·m-3·d-1亚硝酸盐,同时乙酸盐去除率下降,说明异养反硝化细菌活性受到抑制,这与陈川等[21]得到的结果一致.过量的亚硝酸盐具有生物毒性,亚硝酸盐的不断积累也逐渐影响自养反硝化细菌的活性,破坏了自养微生物和异养微生物的协同作用,从而导致硫化物的去除率和单质硫的转化率逐渐下降[21].所以,当HRT为4 h,反应器体系超出所能承受的最大负荷.因此,该反应器体系最适宜的运行参数为HRT=6 h,进水硫化物负荷0.80 kg·m-3·d-1、硝酸盐负荷0.37 kg·m-3·d-1和乙酸盐负荷0.31 kg·m-3·d-1.
2.2系统碳、氮、硫平衡及单质硫分布
系统碳、氮、硫平衡及单质硫分布情况在反应器最适宜的运行参数下进行(HRT=6 h,硫化物负荷0.80 kg·m-3·d-1、硝酸盐负荷0.37 kg·m-3·d-1和乙酸盐负荷0.31 kg·m-3·d-1).反应器系统运行稳定下的单质硫产率见图3,系统硫平衡见表1,平均94%的硫化物(S2--S)转化为单质硫S0.然而,在反硝化脱硫反应器出水中只检测到0.49 kg·m-3·d-1的单质硫S0,约占单质硫总量的65%.这是由于35%的单质硫附着在颗粒污泥上沉淀在反应器的底部.陈川等[4]利用一个EGSB反应器同时去除硝酸盐1.45 kg·m-3·d-1,硫化物3.1 kg·m-3·d-1和有机碳2.77 kg·m-3·d-1,并获得了90%的单质硫产率2.79 kg·m-3·d-1,高于本系统获得的单质硫产率.Reyes⁃Avila等[16]利用CSTR反应器处理负荷0.29 kg·m-3·d-1Acetate⁃C,0.2 kg·m-3·d-1N3-⁃N和0.294 kg·m-3·d-1S2-⁃S,获得了99%的单质硫产率0.291 kg·m-3·d-1,低于本系统获得的单质硫产率.这些脱硫反硝化工艺只针对单质硫的转化率进行讨论,并未给出单质硫在工艺系统中水相和污泥相的分布.本研究对反硝化脱硫系统单质硫的分布进行研究,得出单质硫在水相约占65%,污泥相约占35%.这些研究为分别从水相和污泥相分离单质硫提供基础数据.由表2可见,每消耗1 g NO3--N产生0.797 g N2.在气相中检测出CO2和N2,未检测出N2O和H2S.出水中没有积累过量的有机碳和硝酸盐,去除率均达94%以上.
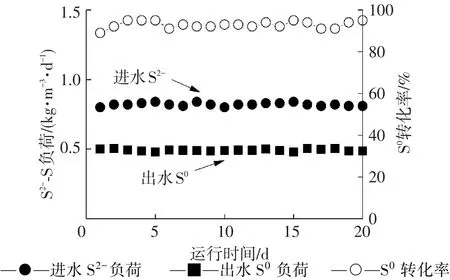
图3 反硝化脱硫反应器单质硫产率
2.3生物硫特性及其分离方法的确定
2.3.1 生物硫的粒径分布
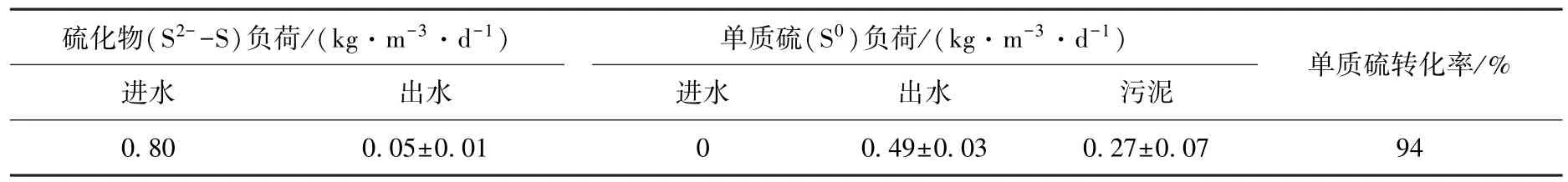
表1 反硝化脱硫反应体系中硫平衡

表2 反硝化脱硫反应体系中碳、氮平衡

图4 反硝化脱硫系统含生物硫出水

图5 生物硫粒径体积分布
2.3.2 生物硫扫描电镜分析
通过电镜扫描(SEM)对出水中生物硫颗粒的形貌特征进行分析.由图6可以看出,出水中线条、颗粒状等多种形状的物质相互交错形成立体网状结构,利于出水中生物硫的网捕凝聚和絮凝沉淀作用[23].图7为生物硫颗粒的放大形貌,呈表面粗糙的球状,携带大分子的聚糖、蛋白质等多种官能团,官能团带电可使不同带电物质凝集形成絮体[24],生物硫的这些特点为其分离奠定了基础.

图6 反应器出水中生物硫形貌图

图7 生物硫颗粒的放大形貌图
2.3.3 生物硫能谱分析
通过能谱分析得出生物硫颗粒的元素分布为:硫元素(S)质量分数约60.07%,同时含有碳(C)14.51%、氧(O)18.95%和镁(Mg)6.47%等元素,这是因为生物硫颗粒外表面具有大分子有机物质[24].
2.3.4 生物硫Zeta电位
Zeta电位是对颗粒之间相互排斥或吸引力强度的度量,是表征胶体体系稳定性的重要指标[25-26].分子或分散粒子越小带有较多正或负同性电荷,Zeta电位(正或负)越高,体系越稳定,即溶解或分散可以抵抗聚集.反之,Zeta电位(正或负)越低,越倾向于凝结或凝聚,即吸引力超过了排斥力,分散被破坏而发生凝结或凝聚[27].Moiler等[28]得出,胶体体系的Zeta电位绝对值大于30 mV可以获得较好的稳定体性,随着Zeta绝对值增大,稳定性越高.
本反硝化脱硫反应器含生物硫出水的Zeta电位在±30 mV之间,平均为-20 mV,见图8.表明生物硫的胶体分散体系不稳定,同时由测定值得出生物硫颗粒带负电荷.进一步推断,生物硫胶体颗粒可与正电荷物质如阳离子絮凝剂作用发生絮凝沉淀.生物硫颗粒的胶体特性进一步为生物硫的絮凝分析提供了条件.
2.3.5 生物硫分离方法初探
取反硝化脱硫反应器含生物硫出水放入烧杯中(如图9(a)),将一束汇光线垂直照射含有生物硫烧杯,出现一条贯穿烧杯的乳红色光柱,产生了丁达尔效应现象,表明含生物硫出水具有悬浊液性质.通过投加1.67 mg/L的聚合氯化铝,生物硫获得了很好的分离,乳白色生物硫沉淀到烧杯底部(见图9(b)).通过检测上浮水单质硫含量,获得了99%的絮凝率和浊度去除率.证明利用混凝方法进行生物硫的分离是可行的.

图8 生物硫出水Zeta电位

图9 混凝方法分离生物硫的效果
3 结 论
1)反硝化脱硫反应器实现了94%的单质硫最大产率,生物硫在反硝化脱硫工艺系统的分布为水相65%和污泥相35%.
2)通过对生物硫进行粒径分布、Zeta电位、能谱元素分析以及电镜扫描等物化特性分析,得出生物硫具有胶体特性.初步利用阳离子絮凝剂进行生物硫的分离回收,获得99%的分离率.为下一步生物硫的分离优化工作提供了理论基础.
[1]DORMAN D C,STRUVE M F,GROSS E A,et al.Respiratory tract toxicity of inhaled hydrogen sulfide in Fischer⁃344 rats,Sprague⁃Dawley rats,and B6C3F1mice following subchronic(90⁃day)exposure[J].Toxicology and Applied Pharmacology,2004,198(1):29-39.
[2]JICKELLS T.External inputs as a contributor to eutrophication problems[J].Journal of Sea Research,2005,54(1):58-69.
[3]LIU Y,YANG S F,XU H,et al.Biosorption kinetics of cadmium(Ⅱ)on aerobic granular sludge[J].Process Biochemistry,2003(38):997-1001.
[4]CHEN C,REN N Q,WANG A J,et al.Simultaneous biological removal of sulfur,nitrogen and carbon using EGSB reactor[J].Applied Microbiology and Biotechnology,2008,78(6):1057-1063.
[5]REYES J,RAZO E,GOMEZ J.Simultaneous biological removal of nitrogen,carbon and sulfur by denitrification[J].Water Research,2004,38(14/15):3313-3321.
[6]王爱杰,杜大仲,任南琪,等.脱氮硫杆菌在废水脱硫、脱氮处理工艺中的应用[J].哈尔滨工业大学学报,2004,36(4):423-425.
[7]CHEN C,REN N Q,WANG A J,et al.Enhanced performance of denitrifying sulfide removal process under micro⁃aerobic condition[J].Journal of Hazardous Materials,2010,179:1147-1151.
[8]JIANG GM,KELLER J.Sulfur transformation in rising main sewers receiving nitrate dosage[J].Water Research,2009,43(17):4430-6574.
[9]胡亮,何艳明,陈加希.硫酸盐水污染状况与控制技术[C]//中国环境科学学会学术年会优秀论文集,2008:810-815.
[10]胡亮,陈加希,何艳明.硫酸盐污水的污染状况分析[J].云南冶金,2010,39(2):102-105.
[11]缪应祺.废水生物脱硫机理及技术[M].北京:化学工业出版社,2004.
[12]郝晓地,戴吉,魏丽.生物除硫理论与技术研究进展[J].生态环境,2006,15(4):844-853.
[13]于文波,胡明成.硫酸盐的环境危害及含硫酸盐废水处理方法[J].科技信息,2011(11):10401-10402.
[14]胡明成.硫酸盐的环境危害及含硫酸盐废水处理技术[J].成都大学学报:自然科学版,2012,31(2):181-184.
[15]CHEN C,WANG A J,REN N Q,et al.High⁃rate denitrifying sulfide removal process in expanded granular sludge bed reactor[J].Bioresource Technology,2009,100(7):2316-2319.
[16]REYES⁃AVILA J,RAZO⁃FLORES E,GOMEA J.Simultaneous biological removalofnitrogen,carbon and sulfur by denitrification[J].Water Research,2004,38(14):3313-3321.
[17]GOMMERS P J F,BULEVELD W,ZUIJDERWIJK F J M,et al.Simultaneous sulfide and acetate oxidation in a denitrifying fluidized bed reactor⁃II.measurements of activities and conversion[J].Water Research,1988,22(9):1085-1092.
[18]KRISHNAKUMAR B,MAJUMDAR S,MANILAL V B,et al.Treatment of sulphide containing wastewater with sulphur recovery in a novel reverse fluidized loop reactor(RFLR)[J].Water Research,2005,39(4):639-647.
[19]ZHOU X,LIU L,CHEN C,et al.Reduction of produced elementary sulfur in denitrifying sulfide removal process[J].Applied Microbiology and Biotechnology,2011,90(3):1129-1136.
[20]MANCONI I,CARUCCI A,LENS P,et al.Simultaneous biological removal of sulphide and nitrate by autotrophic denitrification in an activated sludge system[J].Water Science&Technology,2006,53(12):91-99.
[21]CHEN C,WANG A J,REN N Q,et al.Biological breakdown of denitrifying sulfide removal process in high⁃rate expanded granular bed reactor[J].Applied Microbiology and Biotechnology,2008,81(4):765-770.
[22]陶丽霞,王成端,向迎洪,等.絮凝沉淀处理含241Am废水时絮凝体粒径分布的影响因素初探[J].辐射防护,2006,26(3):177-180.
[23]郑怀礼,张会琴,蒋绍阶,等.聚磷硫酸铁的形貌结构与絮凝机理[J].光谱学与光谱分析,2011,31(5):1409-1413.
[24]JANSSEN A J H.Sufrace characteristics and aggregation of microbiologically produced sulfur particles in relation to the process conditions[J].Colloids and Surfaces B:Biointefaces,1996,6:115-129.
[25]HUNTER,R J.Zeta potential in colloid science:principles and applications[M].San Diego:Academic Press Inc,1981:386.
[26]RUNKANA V,SOMASUNDARAN P,KAPUR P C.Mathematical modeling of polymer⁃induced flocculation by charge neutralization[J].Journal of Colloid and Interface Science,2004,270:347-358.
[27]杨锦,黄志杰,侯善华,等.磷酸铵镁结石患者尿微晶组分分析及其与结石形成的关系[J].光谱学与光谱分析,2011,31(1):168-172.
[28]MOILER R H,JACOBS C.Buparvaquone mucoadhesive nanosuspension:preparation,optimisation and long⁃term stability[J].International Journal of Pharmaceutics,2002,237(1/2):151-161.
(编辑刘 彤)
Distribution characteristics and separation of biological sulfur in denitrifying sulfide removal process
YUAN Ye1,2,WANG Aijie1,2,MA Suli1,2,CHEN Chuan1,2,ZHAO Youkang1,2,TAN Wenbo1,2,HUANG Cong1,2,XU Xijun1,2,SUN Dezhi1,2
(1.School of Municipal and Environmental Engineering,Harbin Institute of Technology,150090 Harbin,China;2.State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,150090 Harbin,China)
To better separate biologicalsulfur from denitrifying sulfide removal(DSR)process,we determined a new method by researching on the distribution characteristics of biological sulfur in this process system,Zeta potential,particle size distribution,scanning electron microscope and energy spectrum analysis.The results showed that the biological sulfur in the effluent and sludge accounted for 65%and 35%of the total sulfur production,respectively.S content of biological sulfur particles is no less than 60%.Zeta potential value is approximately-20 mV(between±30 mV);Biological sulfur particles are spherical with rough surfaces,with many functional groups on the surface such as polysaccharide and proteins.The above biological properties indicate that it has characteristics of colloid.The biological sulfur flocculation rate is approximately 99%when using cationic coagulant to separate biological sulfur.Coagulation is an effective method ofseparating biological sulfur form(DSR)process.
biological sulfur;distribution characteristics;characteristics of colloid;coagulation
X703.1
A
0367-6234(2014)08-0034-06
2013-03-15.
国家高技术研究发展计划(863计划)主题项目(2011AA060904).
远 野(1984—),男,博士研究生;
王爱杰(1972—),女,教授,博士生导师.
远 野,yuanye-19840915@163.com.
