太平洋鳕鱼脑中硫苷脂的分离纯化和分析❋
2014-06-24薛长湖贾子才丛培旭
薛长湖,宋 雨,徐 杰,贾子才,丛培旭
(中国海洋大学食品科学与工程学院,山东青岛266003)
太平洋鳕鱼脑中硫苷脂的分离纯化和分析❋
薛长湖,宋 雨,徐 杰,贾子才,丛培旭
(中国海洋大学食品科学与工程学院,山东青岛266003)
以太平洋鳕鱼为原料,从鳕鱼脑中分离硫苷脂,确立了提取及纯化的条件,并对硫苷脂的纯度和分子种进行分析。首先,采用氯仿/甲醇(2∶1,v/v)提取总脂。然后,依次采用氯仿/甲醇/水(7∶3∶0.3,v/v/v)洗脱硅胶柱层析,含0.2 mol/L乙酸铵的氯仿/甲醇/水(30∶60∶8,v/v/v)洗脱DEAE Sephadex-A25离子交换柱层析,40%甲醇脱盐和100%甲醇洗脱反相C8柱层析,获得硫苷脂纯品。最后,利用500YMC Diol液相色谱柱(3.0 mm×250 mm,5μm)分离,以正己烷/异丙醇(70∶30,v/v),异丙醇/水/甲酸/氨水(100∶13∶1∶0.14,v/v/v/v)为流动相梯度洗脱,采用负电喷雾电离(ESI)和母离子扫描模式,用液相色谱-串联质谱(LC-MS/MS)法分析了鳕鱼脑硫苷脂的纯度和分子种组成,并比较了其与哺乳动物脑中硫苷脂分子种组成的异同。结果表明,本实验制得的鳕鱼脑硫苷脂纯度为90.74%,与哺乳动物类似,鳕鱼脑硫苷脂的长链碱基以鞘氨醇为主,主要分子种为d18∶1-C24∶1,但脂肪酸的羟基化程度略低,且含少量独特的分子种,如d18∶1-22∶1和d18∶2-25∶2。
鳕鱼脑;硫苷脂;分离纯化;液相色谱-串联质谱;分子种
鳕形目鱼类是海洋世界的大家族,已知约500余种,广泛分布于世界各海域,是海洋渔业的主要捕捞对象。纯正鳕鱼指鳕属(Gadus)鱼类,包括太平洋鳕鱼(Gadus macrocephalus)、大西洋鳕鱼(Gadus morhua)和格陵兰鳕鱼(Gadus ogac)三大类[1]。太平洋鳕鱼别称大头鳕(Pacific cod),广泛分布于中国的黄、渤海地区,太平洋鳕鱼除可以鲜食外还可加工成多种水产制品,鳕鱼肝可用于提取鱼肝油,鳕鱼皮可用于制取明胶和胶原蛋白[2],鳕鱼骨可制备鳕鱼骨钙粉[3],太平洋鳕鱼具有潜在的巨大的经济价值。
硫酸脑苷脂(简称硫苷脂)是脑苷脂糖基的某一碳位的羟基被硫酸酯化所得的产物,是一种弱极性的鞘糖脂[4]。硫苷脂在生物界分布广泛,主要存在于动物体内,特别在动物脑中含量极为丰富,天然存在的硫苷脂最先发现于藻类,后来在软体动物[5-6]、软骨鱼和硬骨鱼等无脊椎动物[7-9]和哺乳动物脑中也发现了硫苷脂。此外,硫苷脂也可通过化学法和酶法人工合成。硫苷脂生物活性独特,其在体内含量出现异常可能与Krabbe’s症[10]、多发性硬化症[11]、阿尔兹海默病[12]以及Ⅰ型和Ⅱ型糖尿病有关[13-14],硫苷脂还会对表面介质活性产生影响,具有促进凝血、消炎的作用,并且对多种疾病如动脉硬化、艾滋病、肿瘤等有一定的疗效[15],除此之外,硫苷脂还可增强生物体的机体免疫能力[16-17]。
海洋生物在复杂的生存环境与长期的进化过程中产生许多陆地生物所不具有的独特结构和活性物质。目前,由于我国水产品加工业中废弃物的利用水平较低,导致大量的水产品下脚料无法得到有效地加工利用,这成为影响水产业经济效益的关键。以鳕鱼加工为例,加工中产生的大量鱼头废弃物未得到有效的利用。本文对太平洋鳕鱼脑中硫苷脂的分离纯化和结构进行了较为系统的研究,这对于鳕鱼加工中副产物的充分利用、鳕鱼的高值化开发和海洋新原料来源的发现具有重要意义。
1 材料与方法
1.1材料与仪器
原料 新鲜太平洋鳕鱼(Gadus macrocephalus)鱼头(购于青岛浩大实业有限公司)。
试剂 甲醇、氯仿(色谱纯,德国Merck公司)、甲酸、氨水、正己烷、异丙醇(色谱纯,美国Sigma公司);Sulfatides标准品(Brain,Porcine,美国Avanti Polar Lipids公司);HSGF254薄层硅胶板(烟台市化学工业研究所);硅胶(300~400目,青岛海洋化工厂);反相C8硅胶填料(日本Fuji公司);离子交换凝胶DEAE Sephadex-A25(GE Healthcare Bio-Sciences公司);Supelclean ENVI-18 SPE(Tubes 3cc 500 mg,美国Supelco公司);500YMC Diol分析柱(3.0 mm×250 mm,5μm);0.22μm微孔滤膜(天津津腾实验设备有限公司);甲醇、氯仿、超纯水、乙酸铵、浓硫酸、无水乙醇(分析纯,国药集团化学试剂有限公司)。
仪器 AL-204分析天平(瑞士梅特勒-托利多公司);RCT basic磁力搅拌器(德国IKA公司);冷冻干燥机ALPHA1-4LD(德国CHRIST公司);Elix5+Milli-QA超纯水系统(美国Millipore公司);1260型高效液相色谱(美国Agilent公司);G6410B三重四极杆质谱仪(美国Agilent公司)。
1.2实验方法
1.2.1 总脂的提取 从新鲜太平洋鳕鱼头中分离出鳕鱼脑,冻干,再采用氯仿/甲醇法进行总脂提取,具体过程如图1所示。取120 g冻干鳕鱼脑,加入9倍体积的氯仿/甲醇(2∶1,v/v),在室温下磁力搅拌1 h,过滤,滤渣再加入3倍体积氯仿/甲醇(2∶1,v/v)重复提取2遍,合并滤液。将合并溶液移入分液漏斗中再加入1/3体积10 g/L的Na2SO4溶液,充分萃取,静置分层,收集下层有机相;上层再加入一定体积的氯仿,重复萃取2遍,最后将上下层合并,30℃旋蒸得到鳕鱼脑总脂[18]。

图1 从太平洋鳕鱼脑中提取总脂的流程Fig.1 The extraction process of total lipid from the codfish brain
1.2.2 薄层色谱分析 样品以氯仿溶解后,点样于活化后的薄层色谱(TLC)板上,再以氯仿/甲醇/水(7∶3∶0.3,v/v/v)为展开剂展开。展开后吹干,5%硫酸乙醇溶液110℃下显色10 min。
1.2.3 硫苷脂分离纯化
1.2.3.1硅胶柱层析 用50 mL氯仿溶解31 g鳕鱼脑总脂,上样于硅胶柱(80 mm×600 mm)中,依次用3倍柱体积的氯仿、氯仿/甲醇/水(80∶15∶1,v/v/v)、氯仿/甲醇/水(7∶3∶0.3,v/v/v)梯度洗脱,50 mL/瓶收集洗脱液,进行TLC分析。将含硫苷脂的洗脱液合并,30℃下旋蒸至干,得到硫苷脂粗品。
1.2.3.2离子交换柱层析 将硫苷脂粗溶于氯仿/甲醇/水(30∶60∶8,v/v/v)后,上样于DEAE Sephadex-A25离子交换柱(35 mm×600 mm)中,依次采用3倍体积的氯仿/甲醇/水(30∶60∶8,v/v/v)、含0.2 mol/mL乙酸铵的氯仿/甲醇/水(30∶60∶8,v/v/v)溶剂洗脱,控制流速2 mL/min,10 m L/管收集洗脱液,经TLC分析,合并含硫苷脂的洗脱液,30℃下旋蒸至干,获得较纯的硫苷脂[19]。
1.2.3.3反相柱脱盐 采用反相C8硅胶柱(25 mm× 560 mm)层析,先用500 mL 40%甲醇溶液平衡层析柱,样品用40%甲醇溶解后上样,500 mL 100%甲醇洗脱除去乙酸铵,再用500 mL 100%甲醇洗脱出硫苷脂,收集脱盐后的硫苷脂溶液,30℃下旋蒸至干后,再加水超声并冻干,得到鳕鱼脑硫苷脂纯品,称量。
1.2.4 测定硫苷脂的纯度和分子种 样品处理:精确称取1 mg鳕鱼脑硫苷脂纯品,溶于2 m L正己烷/异丙醇(7∶3,v/v)中,配制成500μg/mL的样品溶液,4℃冷藏保存,待分析。
液相色谱-质谱条件:500YMC Diol色谱柱(3.0 mm×250 mm,5μm),流速:0.5 mL/min,进样体积5μL;流动相:A-正己烷/异丙醇(70∶30,v/v),B-异丙醇/水/甲酸/氨水(100∶13∶1∶0.14,v/v/v/v),梯度洗脱程序见表1。负电喷雾离子化(ESI);一级质谱扫描范围m/z 600~1 000;二级质谱扫描范围m/z 50~1 000;毛细管电压4000V;喷雾气压40 psi;干燥气流速9.0 L/min;气体温度350℃。

表1 梯度洗脱程序Table 1 Adjustable gradient elution program
纯度分析。硫苷脂标准溶液的配制过程如下:精确称取1 mg硫苷脂标准品溶于1 mL正己烷/异丙醇(7∶3,v/v)中,梯度稀释至500、250、50和10μg,另取1 mg纯化后的硫苷脂样品溶于1 mL正己烷/异丙醇(7∶3,v/v),每次进样5μL。根据硫苷脂标准品的提取离子色谱峰面积对含量做标准曲线,得到相应的回归方程和相关系数,再将硫苷脂样品的提取离子色谱峰面积代入回归方程,计算样品纯度。
分子种分析。采用正负离子模式分别分析硫苷脂标准品的质谱裂解规律。据此,在负离子模式下通过母离子扫描,找到样品中不同硫苷脂分子种对应的m/z,确定提取离子色谱峰面积。在正负离子模式下分别进行二级质谱分析,进一步确定长链碱和脂肪酸的组成,从而确定其结构和含量比例。
2 结果与讨论
2.1鳕鱼脑硫苷脂的分离纯化结果
本文尝试采用低毒高效的正己烷-异丙醇溶剂体系(3∶2,v/v)提取鳕鱼脑中的总脂[20]。与传统的氯仿/甲醇法作对照,分别取10 g冻干后的鳕鱼脑进行预实验,通过比较总脂提取率来评价2种提取方法的优劣,以确定最终的提取体系。结果表明,以标准方法(氯仿-甲醇法)的提取率为100%计,正己烷/异丙醇法的相对提取率只有85.3%,故本文仍采用传统的氯仿-甲醇法提取鳕鱼脑总脂。
鳕鱼脑总脂中含有游离脂肪酸、甘油酯、脑苷脂、磷脂等其他脂类,硅胶柱层析时,氯仿/甲醇/水(80∶15∶1,v/v/v)溶剂可将上述脂肪酸、甘油酯、脑苷脂等低极性脂类洗脱下来,再经氯仿/甲醇/水(7∶3∶0.3,v/v/v)溶剂将硫苷脂成分洗脱出来,磷脂等其它极性脂类仍然保留在硅胶柱中。洗脱出的硫苷脂组分经TLC检测,发现仍含有少量其他脂类。DEAE Sephadex-A25离子交换柱层析时,先采用氯仿/甲醇/水(30∶60∶8,v/v/v)洗脱,将不带电荷的脂类去除,再采用含0.2 mol/mL乙酸铵的氯仿/甲醇/水(30∶60∶8,v/v/v)溶剂将带有负电荷的硫苷脂洗脱出来。经离子交换柱层析得到的硫苷脂中含有乙酸铵,为进一步提高硫苷脂的纯度,需要将乙酸铵脱除。
反相柱洗脱条件的确定。先将Supelclean ENVI-18 SPE柱活化,称取含乙酸铵的硫苷脂5 mg,分别溶于3 mL不同浓度甲醇(100%,60%,40%),过膜,取1 mL上样,再分别用3倍柱体积不同浓度的甲醇(100%,60%,40%)脱盐,再用100%甲醇洗脱硫苷脂。将上述洗脱液分别进行质谱分析,采用负离子模式检测硫苷脂特征碎片离子m/z 97,发现40%甲醇脱盐效果较好且不会将硫苷脂组分洗脱下来,而100%甲醇可以将硫苷脂组分洗脱完全。最后,确定出硫苷脂的脱盐和洗脱体系,并采用反相C8填料进行大量样品的脱盐。
2.2鳕鱼脑硫苷脂的纯度分析
进样浓度在10~500μg范围内时,硫苷脂标准品都呈现良好的线性关系,y=5 600.8x+190 077(R= 0.995 5)。根据此标准曲线,求得制备出的鳕鱼脑硫苷脂纯度为90.74%。
2.3鳕鱼脑硫苷脂的分子种分析
2.3.1 一级质谱分析 在负离子模式下,从母离子扫描图谱(见图2)看,硫苷脂的出峰时间在11~14 min,提取硫苷脂峰进行分析,可以看到不同质荷比的硫苷脂分子种(见图3)。参考文献[21-24],对生物体内硫苷脂分子脂肪酸和鞘氨醇部分的归纳以及个别硫苷脂分子的二级质谱分析,推断出8种鳕鱼脑硫苷脂的主要分子种(见表2)。其中,m/z 888.9的硫苷脂分子种占鳕鱼脑总硫苷脂的一半以上,为最主要的分子种形式。
2.3.2 二级质谱分析 以[M-H]-m/z 888.9为例,在负离子模式下,硫苷脂分子碎裂产生硫酸半乳糖(m/z 241)、N-酰基脂肪酸(m/z 390)和硫酸根(m/z 97)碎片(见图4)。为了进一步确定[M-H]-m/z 888.9硫苷脂分子种的脂肪酸和长链碱结构,通过正离子模式下的二级质谱(见图5),检测到m/z 264碎片离子,该离子为d18∶1长链碱的特征碎片。结合正负离子模式的二级质谱,推断出[M-H]-m/z 888.9对应的硫苷脂分子种为d18∶1-24∶1。以此类推,得出其他不同m/z对应的硫苷脂分子种。
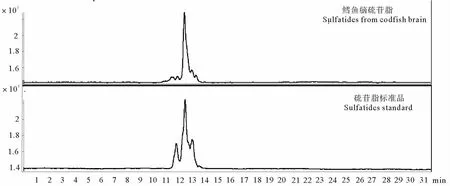
图2 负离子模式下鳕鱼脑硫苷脂和硫苷脂标准品的总离子流图Fig.2 Total ion chromatograms of sulfatides from codfish brain and sulfatides standard in negative ion mode

图3 鳕鱼脑硫苷脂母离子扫描质谱图Fig.3 Precursor ion scan mass spectrogram of sulfatides from the codfish brain

图4 负离子模式下硫苷脂分子d18∶1-24∶1的二级质谱图Fig.4 Negative MS2mass spectrum of d18∶1-24∶1 sulfatide

图5 正离子模式下硫苷脂分子d18∶1-24∶1的二级质谱图Fig.5 Positive MS2mass spectrum of d18∶1-24∶1 sulfatide
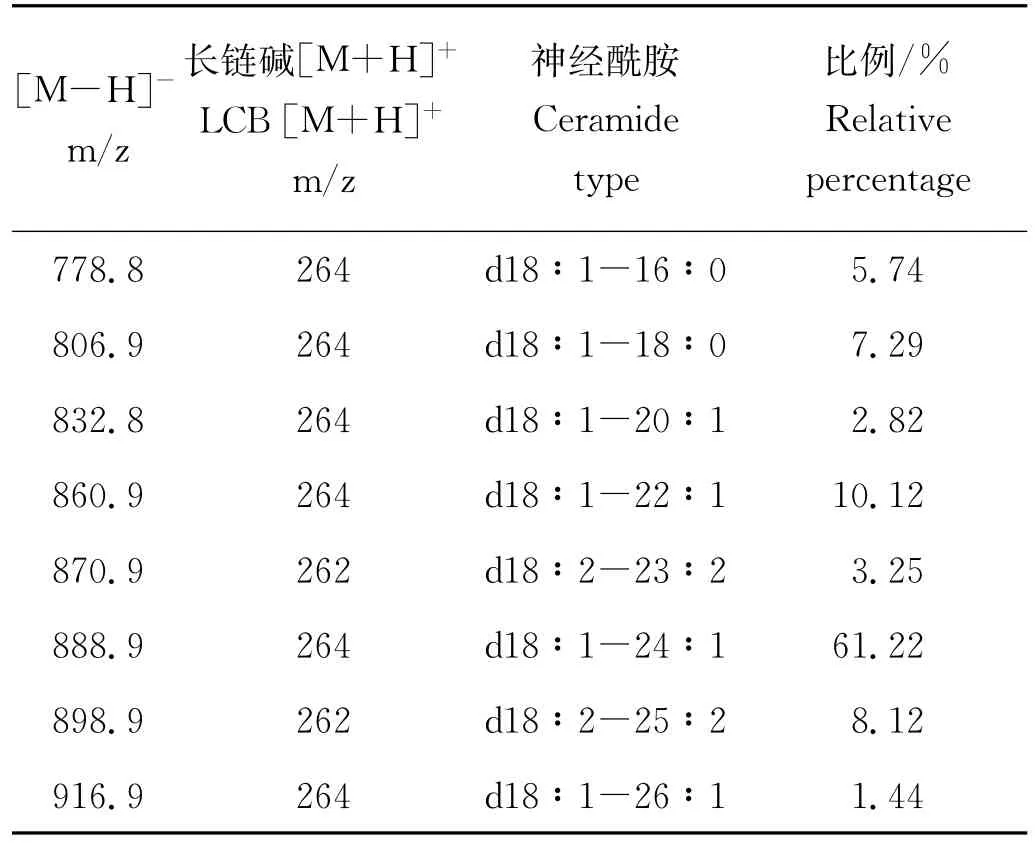
表2 鳕鱼脑的硫苷脂分子种Table 2 Sulfatide molecular species from the codfish brain
2.3.3 鳕鱼脑硫苷脂和哺乳动物脑硫苷脂的分子种比较 将鳕鱼脑硫苷脂分子种与文献[24]报道的猪脑、牛脑和兔脑等哺乳动物硫苷脂分子种进行对比,发现脑中硫苷脂分子的长链碱部分基本一致,大多为d18∶1,只有少数为d18∶2;在所有动物脑中,d18∶1-24∶1都是最主要的分子种,比例都在30%以上。牛脑和兔脑中含24C脂肪酸的硫苷脂占70%以上,且脂肪酸的羟基化程度很高,而鳕鱼脑中硫苷脂脂肪酸基本没有羟基化。猪脑中含17种硫苷脂分子种;牛脑中含14种硫苷脂分子种;兔脑硫苷脂分子种与牛脑相似,有13种硫苷脂分子种,但[M-H]-m/z 906的硫苷脂分子含量明显高于其他3种脑组织。通过比较来看,鳕鱼脑硫苷脂有其它哺乳动物不含的[M-H]-m/z 860.9(d18∶1-22∶1)、[M-H]-m/z 870.9(d18∶2-23∶2)和[M-H]-m/z 898.9(d18∶2-25∶2)3种硫苷脂分子,[M-H]-m/z 778.8(d18∶1-16∶0)和[M-H]-m/z 832.8(d18∶1-20∶1)所占比例远高于哺乳动物。
3 结论
本文以太平洋鳕鱼加工副产物鳕鱼脑为研究对象,优化了提取、纯化硫苷脂的方法。通过3种柱层析的结合使用并尝试不同的洗脱体系,确立了一套从动物组织中有效提取、制备高纯度硫苷脂的工艺路线。同时,采用灵敏、准确的LC-MS/MS方法,分析了鳕鱼脑硫苷脂的纯度和分子种,并与哺乳动物脑硫苷脂进行比较,归纳出鳕鱼脑硫苷脂的分子组成特点。本研究为鳕鱼加工废弃物的综合利用和硫苷脂的活性研究提供了方法基础。
[1] 高天翔,李朝秀.四种鳕鱼的形态学研究[J].青岛海洋大学学报:自然科学版,2002,32(6):884-890.
[2] 俞秋文.用鳕鱼皮制明胶的生产工艺介绍[J].中国水产,1994,2:49.
[3] 霍健聪,邓尚贵,童国忠.鳕鱼骨钙片的制备及其生物利用[J].水产学报,2010(3):382-388.
[4] 佘蕾.海洋生物中硫酸脑苷脂的分离纯化和结构分析[D].青岛:青岛海洋大学,2000.
[5] Bolognani L,Masserini M,Bodini P A,et al.Lipid composition in ganglia of Mollusca[J].Journal of Neurochemistry,1981,36(3):821-825.
[6] Levitina M V,Abramova L N.Fatty acids of the cerebrosides(1-β-glycosylceramides)and sulfatides(sulfoglycosylceramides)from the brain of the lamprey Lampetra fluυiatilis[J].Zh Evol Biokhim Fiziol,1979,15(3):307-311.
[7] Hansson G C,Heilbronn E,Karlsson K A,et al.The lipid composition of the electric organ of the ray,Torpedomarmorata,with specific reference to sulfatides and Na+-K+-ATPase[J].Journal of Lipid Research,1979,20(4):509-518.
[8] Levitina M V.Pealiarities of fatty acid composition of cerebrosides and sulfo cerebrosides from the brain of deep water fishes[J].Zh Evol Biokhim Fiziol,1987,23(4):441-450.
[9] Tamai Y,Kojima H,Saito S,et al.Characteristic distribution of glycolipids in gadoid fish nerve tissues and its bearing on phylogeny[J].Journal of Lipid Research,1992,33(9):1351-1359.
[10] Kohlschütter A.Lysosomal leukodystrophies:Krabbe disease and metachromatic leukodystrophy[J].Handbook of Clinical Neurology,2012,113:1611-1618.
[11] Jana A,Pahan K.Sphingolipids in multiple sclerosis[J].Neuromolecular Medicine,2010,12(4):351-361.
[12] Yuyama K,Mitsutake S,Igarashi Y.Pathological roles of ceramide and its metabolites in metabolic syndrome and Alzheimer's disease[J].Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,2014,1841(5):793-798.
[13] Subramanian L,Blumenfeld H,Tohn R,et al.NKT cells stimulated by long fatty acyl chain sulfatides significantly reduce the incidence of type 1 diabetes in nonobese diabetic mice[J].PloS One,2012,7(5):352-358.
[14] Roeske Nielsen A,Dalgaard L,Mansson JE,et al.The glycolipid sulfatide protects insulin-producing cells against cytokine-induced apoptosis,a possible role in diabetes[J].Diabetes/Metabolism Research and Reviews,2010,26(8):631-638.
[15] Ambrosino E,Terabe M,Halder R C,et al.Cross-regulation between type Iand type II NKT cells in regulating tumor immunity:a new immunoregulatory axis[J].The Journal of Immunology,2007,179(8):5126-5136.
[16] Mulligan M S,Miyasaka M,Suzuki M,et al.Anti-inflammatory effects of sulfatides in selectin-dependent acute lung injury[J]. International Immunology,1995,7(7):1107-1113.
[17] 严小军,秦松.藻类分子生物技术两年评—与藻类活性物质研究有关的生物技术[J].海洋与湖沼,1997,28(4):440-446.
[18] Folch J,Lees M.A simple method for the isolation and purification of total lipids from animal tissues[J].Isolation of Total Lipids,1957:6(15):497-519.
[19] 刘洋.猪脑中总神经节苷脂的分离及GTlb的纯化[D].长春:东北师范大学,2012.
[20] 韩菊,魏福祥,云自厚.采用低毒溶剂提取脂质[J].分析化学,2002,4(30):450-453.
[21] Ikeda K,Shimizu T,Taguchi R.Targeted analysis of ganglioside and sulfatide molecular species by LC/ESI-MS/MS with theoretically expanded multiple reaction monitoring[J].Journal of Lipid Research,2008,49(12):2678-2689.
[22] Hsu F F,Bohrer A,Turk J.Electrospray ionization tandem mass spectrometric analysis of sulfatide:Determination of fragmentation patterns and characterization of molecular species expressed in brain and in pancreaticislets[J].Biochimicaet Biophysica Acta(BBA)-Lipids and Lipid Metabolism,1998,1392(2):202-216.
[23] Hsu F F,Turk J.Studies on sulfatides by quadrupoleion-trap mass spectrometry with electrospray ionization:structural characterization and the fragmentation processes that includean unusual internal galactose residue loss and the classical charge-remote fragmentation[J].Journal of the American Society for Mass Spectrometry,2004,15(4):536-546.
[24] Allegood J C.Application of liquid chromatography tandem mass spectrometry for the separation and quantitative analysis of sphingolipids[D].Georgia:Georgia Institute of Technology,2011.
The lsolation and Molecular Species Analysis of Sulfatides from Codfish Brain
XUE Chang-Hu,SONG Yu,XU Jie,JIA Zi-Cai,CONG Pei-Xu
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
The objective of the research is to establish an efficient extraction and isolation workflow for purification of codfish sulfatides as well as procedures to determine the purity and molecular species of the purified sulfatides.The crude lipids extracted with chloroform/methanol(2∶1,v/v)were firstly applied to a normal phase silica column and fractions containing sulfatides were eluted with chloroform/methanol/water(7∶3∶0.3,v/v/v).The fractions were combined and further applied to a DEAE-Sephadex A25 anion exchange column.Negative charged sulfatides were eluted with solvent chloroform/methanol/water(30∶60∶8,v/v/v)containing 0.2 mol/L ammonium acetate.Subsequent desalting procedure was achieved on a reversed chromatography by cleaning column with 40%methanol in water and recover sulfatides with methanol.The purity and molecular composition of purified sulfatides were determined by a normal phase liquid chromatography coupled to tandem mass spectrometry method.Gradient elution on a 500YMC Diol column(3.0 mm×250 mm,5μm)with solvent hexane/isopropanol(70∶30,v/v)and solvent isopropanol/water(100∶13,v/v)containing 0.8%formic acid and 0.1%aqueous ammonia can separate sulfatides successfully.Mass spectrometer was operated on negative ionization mode and the sulfatide molecules were detected by precursor ion scan.The purity of isolated codfish sulfatides is 90.74%. The most abundant molecule is d18∶1-C24∶1 and the major long chain base is sphingosine,both the characteristics are similar to mammalian sulfatides.However,the hydroxylation degree of fatty acids was lower than that of mammalian sulfatides,and unique molecules with structure d18∶1-C22∶1 and d18∶2-C25∶2 in lower content were also identified.
codfish brain;sulfatides;isolation and purification;liquid chromatography coupled to tandem mass spectrometry;molecular species
TS254.9
A
1672-5174(2014)10-051-06
责任编辑 朱宝象
长江学者和创新团队发展计划项目(IRT1188);“泰山学者”建设工程专项经费项目资助
2014-08-03;
2014-09-24
薛长湖(1964-),男,教授,博导。研究方向:水产品加工。E-mail:xuech@ouc.edu.cn
