天然斜发沸石对氨氮的快速吸附特性研究
2014-06-23李元志沈志强周岳溪周继红刘佳
李元志,沈志强,周岳溪*,周继红,刘佳
1.河北工程大学城市建设学院,河北邯郸 056038
2.中国环境科学研究院水污染控制技术研究中心,北京 100012
3.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012
天然斜发沸石对氨氮的快速吸附特性研究
李元志1,2,3,沈志强2,3,周岳溪2,3*,周继红1,刘佳1,2,3
1.河北工程大学城市建设学院,河北邯郸 056038
2.中国环境科学研究院水污染控制技术研究中心,北京 100012
3.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012
通过静态摇床试验研究了天然斜发沸石对氨氮的吸附特性,以及沸石投加量和外加金属阳离子对其快速吸附氨氮特性的影响。结果表明,沸石对氨氮的等温吸附过程更符合Langmuir吸附模型,其最大吸附量为12.903 mg/g;沸石粒径减小,有利于沸石对氨氮的交换吸附,不同粒径沸石对氨氮的吸附均符合准二级动力学过程;斜发沸石中与氨氮进行离子交换的阳离子主要为Na+,其次为Ca2+,随着吸附氨氮浓度的升高或吸附时间的延长,Na+与NH4
+吸附去除量的比值呈下降趋势,而Ca2+的比值呈上升趋势。沸石投加量与氨氮去除率和沸石释放至水中的总金属阳离子浓度成正比,随着投加量增加Na+与NH4+吸附去除量的比值由1.222增至1.383;溶液中分别加入40 mg/L的K+,Na+,Ca2+,Mg2+4种离子,对沸石吸附氨氮产生抑制作用的强弱顺序为K+>Ca2+>Na+>Mg2+。
斜发沸石;氨氮;快速吸附;金属阳离子
随着人类对自然资源的不断开发利用,人们所面对的环境问题也日渐严峻,大量的含氮污染物的生活污水、工业废水排入江河湖泊中,给安全饮水带来威胁,对鱼类等水体动物带来危害,造成富营养化,使湖泊生态系统恶性循环。但单纯控制点源仍不能有效地控制氨氮污染,因为除点源之外,大量面源污染物分散地不间断地进入水体[1]。面源污染中污染运输转移的主要途径为暴雨径流,在暴雨的淋洗冲刷作用下,大气、地面和地下的污染物进入江河、湖泊、水库和海洋等而造成水体污染[2]。我国自20世纪80年代开始认识到研究暴雨径流问题的重要性,并展开了相关研究。其中利用沸石吸附特性处理污水的研究非常活跃。
沸石是瑞典矿物学家克朗斯提(Cronstedt)发现的一类硅铝酸盐矿石,因其在灼烧时会产生沸腾现象而命名为“沸石”。沸石是种呈结晶阴离子型架状结构的多孔硅铝酸盐矿物质,其分子通式为Mn/2·Al2O3·xSiO2·yH2O(M为碱金属和碱土金属阳离子)。沸石中的阳离子在溶液中非常容易和外界阳离子进行离子交换,具有优良的离子交换性能[3],特别是对氨氮具有很好的选择吸附性,具有快速吸附缓慢平衡的特点。同时,暴雨径流中的污染物如氨氮、总磷、COD等的浓度变化特点为径流初期随着流量的增长而迅速增加,且大都在流量峰之前出现浓度峰,之后,污染物浓度随时间呈负指数规律衰减[4]。因此利用沸石快速吸附的特点可以有效地控制暴雨径流氨氮污染。笔者利用静态摇床试验研究了天然沸石对氨氮的快速吸附特性,以期为利用沸石控制暴雨径流污染提供理论依据。
1 材料与方法
1.1 材料
试验选用的天然斜发沸石产自浙江省缙云县。其元素组成为:SiO2,69.58%;Al2O3,12.20%;Na2O,2.59%;CaO,2.59%;K2O,1.13%;Fe2O3,0.87%;MgO,0.13%;其他,10.91%。
试验所用的氯化铵、酒石酸钾钠、氢氧化钠、碘化汞、碘化钾试剂均为分析纯,用去离子水配置成所需浓度的溶液。
1.2 分析方法
水样经0.45 μm膜过滤后进行测定。氨氮采用纳氏试剂分光光度法(UNIC UV-2100分光光度计)测定;金属阳离子采用火焰原子吸收法(岛津AA-6300原子吸收光谱仪)测定[5]。
1.3 试验方法
1.3.1 等温吸附
取以去离子水清洗并烘干后的沸石(粒径为3~5 mm)10 g,及氨氮浓度分别为50、100、200、500、1 000、2 000、4 000和6 000 mg/L的氯化铵溶液各100 mL分别加入250 mL的磨口锥形瓶中,在恒温振荡培养箱中进行振荡吸附试验,试验温度为25℃,转速为150 r/min,反应时间为4 d。
1.3.2 沸石粒径的影响
于250 mL的磨口锥形瓶中分别放入粒径为0.25~0.45、0.45~1、3~5和7~10 mm经去离子水清洗烘干后的沸石各10 g,各加入氨氮浓度为250 mg/L的氯化铵溶液100 mL。在温度为25℃,转速为100 r/min的恒温振荡培养箱中进行吸附动力学试验,反应时间分别为5、10、20、30 min,1、2、3、4、8和24 h。
1.3.3 沸石投加量的影响
于250 mL的磨口锥形瓶中分别放入5、10、20、30、40、50、60 g经去离子水清洗并烘干后的沸石(粒径为3~5 mm),各加入氨氮浓度为250 mg/L的氯化铵溶液100 mL。在温度为25℃,转速为150 r/ min的恒温振荡培养箱中进行吸附动力学试验,反应时间为30 min。
1.3.4 金属阳离子的影响
研究Na+、Ca2+、Mg2+和K+的浓度分别为40 mg/L及同时含有这4种金属阳离子时(综合样)对沸石快速吸附氨氮的影响。取20 g沸石(粒径为3~5 mm)放入250 mL磨口锥形瓶中,加入100 mL含有金属阳离子的氨氮浓度为250 mg/L的氯化铵溶液。在温度为25℃,转速为100 r/min恒温振荡培养箱中进行吸附试验,反应时间为30 min。
2 结果与讨论
2.1 沸石对氨氮等温吸附模型
温度恒定,改变初始氨氮浓度,进行静态吸附试验,可测得1组液相平衡的氨氮浓度(Ce)和沸石吸附量(qe)的数据,所绘的曲线即吸附等温线。水处理中常用的等温线公式有 Langmuir公式和Freundlich公式[6-7]。
2.1.1 Langmuir等温吸附模型
Langmuir等温吸附方程式假定吸附剂表面均一,吸附质间无相互作用,吸附限于单层吸附[8]。
Langmuir等温吸附方程式为:
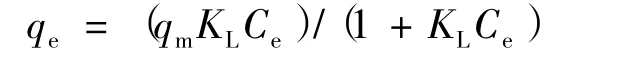
转化得:

式中,qe为平衡时的吸附质量比,mg/g;Ce为吸附平衡时溶液浓度,mg/L;qm为最大吸附质量比,mg/g;KL为Langmuir等温吸附方程式常数。以Ce为横坐标,Ce/qe为纵坐标得到Langmuir等温吸附模型曲线(图1)。

图1 Langmuir等温吸附模型曲线Fig.1 Langmuir adsorption isotherm
根据图1计算出沸石对氨氮的最大吸附量(qm)为12.903 mg/g,常数(KL)为0.007 9。线性相关系数(R2)为0.997 9,说明沸石对氨氮的吸附特征非常适于用Langmuir等温吸附模型进行描述。
2.1.2 Freundlich等温吸附模型
Freundlich等温吸附方程式是经验公式,其公式为:
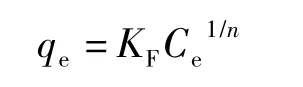
简化得:
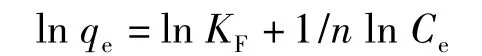
式中,KF和n为Freundlich等温吸附常数。以ln Ce为横坐标,ln qe为纵坐标得到Freundlich等温吸附模型曲线(图2)。
使用Freundlich等温吸附方程进行拟合的相关线性系数仅为0.949 5,小于Langmuir等温吸附方程的相关线性系数。从图2可以看出,在较低的ln Ce时,ln qe随ln Ce线性增加;ln Ce较高时,ln qe增速逐渐变缓。其可能是因为较高的NH4+浓度影响到吸附剂-吸附质间的相互作用力,或者吸附剂上的吸附质分子间存在相互作用力而引起吸附过程与理想状态的偏离。由于 Langmuir方程或Freundlich方程成立的条件不同,从而导致高浓度下Freundlich拟合效果与相应的理想条件偏离较大[9]。因此沸石对氨氮的吸附过程更适合用Langmuir等温吸附模型进行描述。
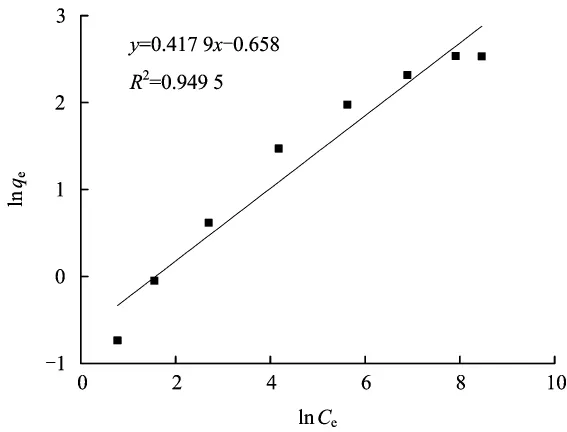
图2 Freundlich等温吸附模型曲线Fig.2 Freundlich adsorption isotherm
2.1.3 金属阳离子的变化趋势
研究表明[10-11],沸石对溶液中氨氮既有交换作用,也有吸附作用,沸石主要是通过离子交换作用去除水中氨氮,吸附作用很小。等温吸附过程中去除氨氮与释放出的金属阳离子浓度变化如图3所示(因Mg2+浓度太低,图中未列出)。
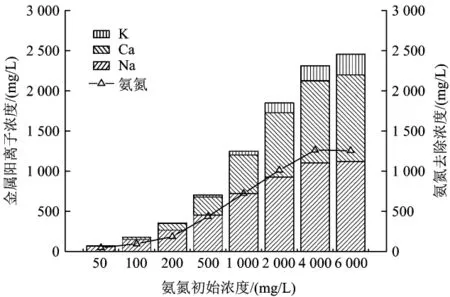
图3 初始氨氮浓度与金属阳离子的变化趋势Fig.3 Metal cation equivalent of different ammonia nitrogen concentration
由图3可以看出,随着氨氮初始浓度的增加,释放的金属阳离子总和也随之增加;与进行交换的阳离子是Na+、Ca2+和K+,其中主要是Na+和Ca2+。在氨氮初始浓度从50 mg/L提高到6 000mg/L时,Na+与吸附去除量的比值从1.410下降至0.893,而Ca2+的比值从0.005上升到0.856。这一规律是由沸石的离子交换选择性顺序(K+>>Na+>Ca2+>Mg2+)决定的[12]。沸石中的Na+浓度最高,离子半径小且活泼性大,因此Na+优先与进行交换;Ca2+浓度较高,离子半径远大于Na+且活泼性较Na+低,也容易与交换;虽然沸石中K+的浓度不低,且活泼性大,但是斜发沸石离子交换中K+的选择性优先于,所以不易与进行交换;Mg2+浓度低,且活泼性不高,因此不易和交换。在氨氮浓度低时优先与Na+交换,当氨氮浓度升高且反应时间足够长时,与Ca2+的交换量增加并超过Na+[4]。
从图3还可看出,随着初始氨氮浓度的增加,氨氮去除量也随之增加,并且与金属阳离子总浓度的变化趋势相同。此外,还可以发现氨氮去除量要小于溶液中金属阳离子的浓度之和。这是由于的半径大于Na+、Ca2+等金属阳离子,当进行离子交换时,沸石表面的向内部扩散的阻力大于沸石内部阳离子向外扩散的阻力,从而向内部扩散较慢,直接影响了固液两相间交换速率,这就造成了在吸附过程中交换的不等性[12]。
2.2 沸石粒径的影响及其动力学过程
2.2.1 沸石粒径对氨氮去除效果的影响
沸石粒径对氨氮吸附的影响如图4所示。

图4 沸石粒径对氨氮吸附的影响Fig.4 The effects of different particle size of zeolite to ammonium adsorption
不同粒径的沸石对氨氮的吸附量都随着时间的增加而增加,随着粒径的增大而减小。在吸附反应的初始阶段(0~180 min)反应速率非常快,吸附量急剧增加;但随着反应的进行,吸附速率逐渐减小,大约8 h后反应基本达到平衡。粒径为0.25~0.45、0.45~1、3~5和7~10 mm的沸石的吸附量分别为2.327、2.322、2.284和1.985 mg/g。
2.2.2 沸石粒径对氨氮吸附的动力学过程
固体吸附剂对水溶液中的氨氮的吸附动力学过程可以用准二级动力学进行描述。
准二级动力学公式为:
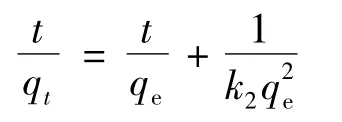
式中,qt为t时间的吸附量,mg/g;k2为二级吸附速率常数,mg/(g·h)[13-14]。
以准二级动力学模型对不同粒径沸石对氨氮的吸附动力学过程进行拟合,结果如图5所示。由图5可知,粒径为0.25~0.45、0.45~1、3~5和7~10 mm沸石的准二级动力学方程拟合的线性相关系数分别为0.999 8、0.999 9、0.999 5和0.993 2,线性相关性非常好。通过拟合方程计算得出的qe分别为2.352、2.339、2.317和2.006 mg/g,这与试验测得的不同粒径沸石的 qe(2.327、2.322、2.284和1.985 mg/g)非常相近。说明不同粒径沸石吸附氨氮的过程符合准二级动力学。

图5 不同粒径沸石准二级动力学模型Fig.5 The second quasi-dynamicmodel of zeolite with different grain size
2.2.3 金属阳离子的变化
图6为不同粒径沸石交换的金属阳离子浓度随吸附时间的变化(因Mg2+浓度太低,图中未列出)。由图6可知,不同粒径的沸石随着反应时间的增加交换出来的总金属阳离子量也在增加。同时,在相同的时间点随着沸石粒径的减小交换出的总金属阳离子量也随之增加,特别是粒径为0.25~0.45 mm时增加尤为明显。这是由于沸石对氨氮的吸附速率表现为细沸石>中沸石>粗沸石,沸石中离子交换吸附的控制步骤是离子的粒内扩散[15-16],因此对于小粒径沸石,沸石内部的金属阳离子扩散阻力小,其更易于释放至溶液中,导致其在溶液中浓度更大。以3~5 mm粒径的沸石为例,在24 h的反应过程中Na+与吸附去除量的比值从1.615降至1.223,而Ca2+的比值从0.280升至0.429。这一结果证实了2.1.3节中所描述的随着反应时间的增加,Ca2+所占总金属阳离子的比例会增加,而Na+的会减小。
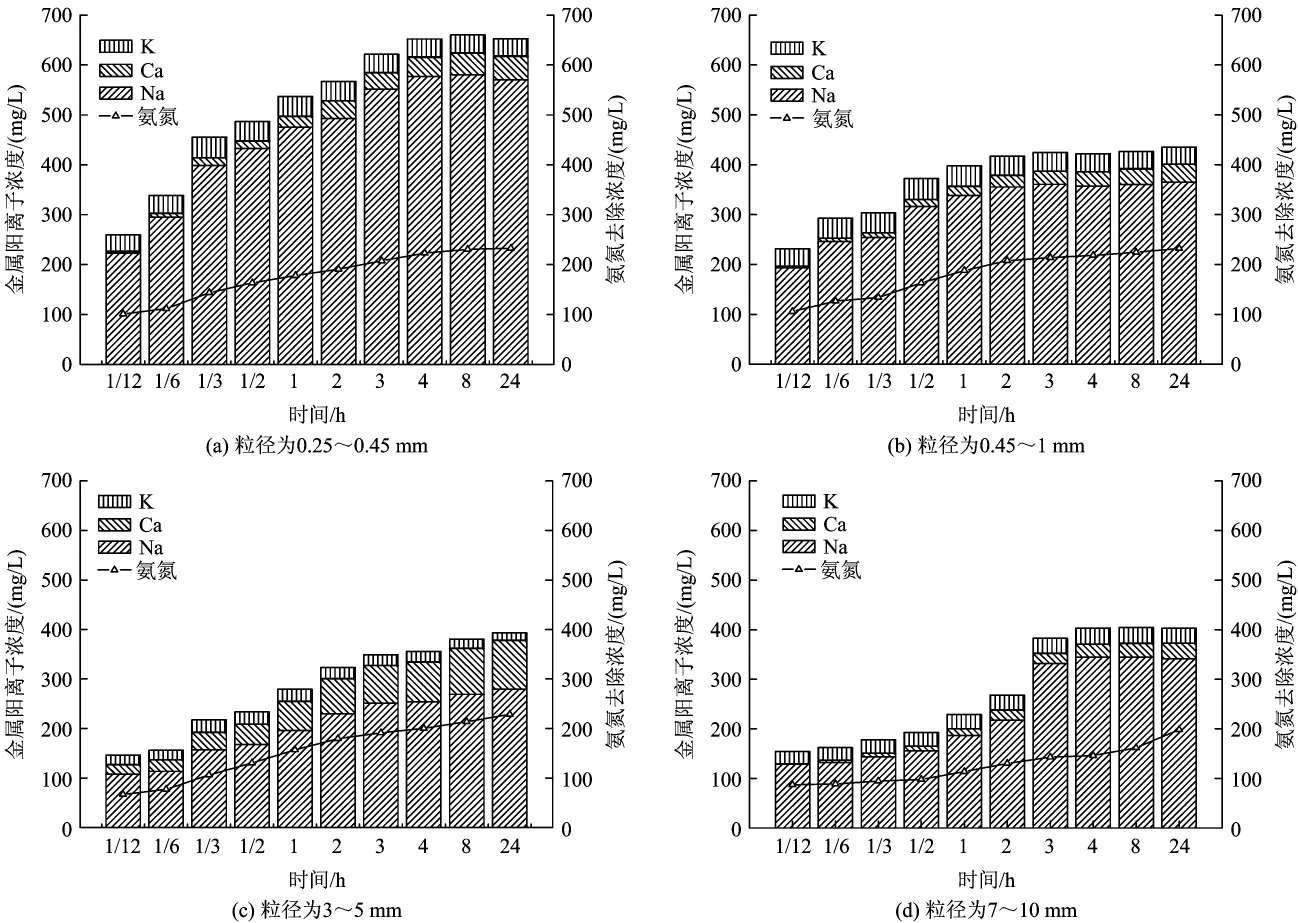
图6 不同粒径沸石的金属阳离子浓度Fig.6 Metal cation equivalent of zeolite with different grain size
2.3 沸石投加量的影响
图7为沸石投加量对氨氮去除效果的影响。从图7可以看出,随着沸石投加量的增加,氨氮的去除率随之增加,沸石吸附量从 1.475 mg/g锐减到0.389 mg/g。此外,当沸石投加量低于20 g时,随投加量的增加氨氮去除率迅速增加,随后增长缓慢。
随着沸石投加量的增加金属阳离子的浓度也随之增加(图8,因Mg2+浓度太低,图中未列出),并且与去除氨氮浓度先迅速增加后逐渐平缓的变化趋势相同。随着沸石投加量增加Ca2+和K+浓度增加不明显,而Na+浓度增加十分明显。这是由于沸石投加量增加,可交换的总金属阳离子量增加,但是反应时间短,仅为30 min,这使得优先与活泼性较高且离子半径小交换阻力小的Na+进行交换,使其浓度增加明显。而同样活泼的Ca2+半径远大于Na+,致其阻力也较大,需要较长的时间才能从沸石内部扩散到液体中。

图7 沸石投加量对吸附的影响Fig.7 The effects of zeolite additive amount to adsorption

图8 金属阳离子浓度随沸石投加量的变化Fig.8 Metal cation equivalent of different zeolite additive amount
2.4 金属阳离子的影响
图9为金属阳离子对沸石快速吸附氨氮的影响。由图9可知,Na+对沸石吸附氨氮几乎没有抑制作用,其次是Mg2+;而K+对吸附过程的影响最大,使氨氮的交换容量下降了5%,Ca2+对沸石吸附氨氮的抑制作用比K+稍弱,主要是由于沸石对阳离子的选择性顺序(K+>> Na+> Ca2+>Mg2+)所决定的。K+的选择性高于,同时存在于溶液中时沸石会优先吸附K+从而降低氨氮的交换容量;对选择性弱于的Na+和Mg2+则不会产生较大的影响;与此同时,Ca2+的抑制作用仅次于K+,虽然Ca2+的选择性低于,但是Ca2+会和竞争沸石晶格结构中的空穴,从而降低氨氮的交换容量[17]。
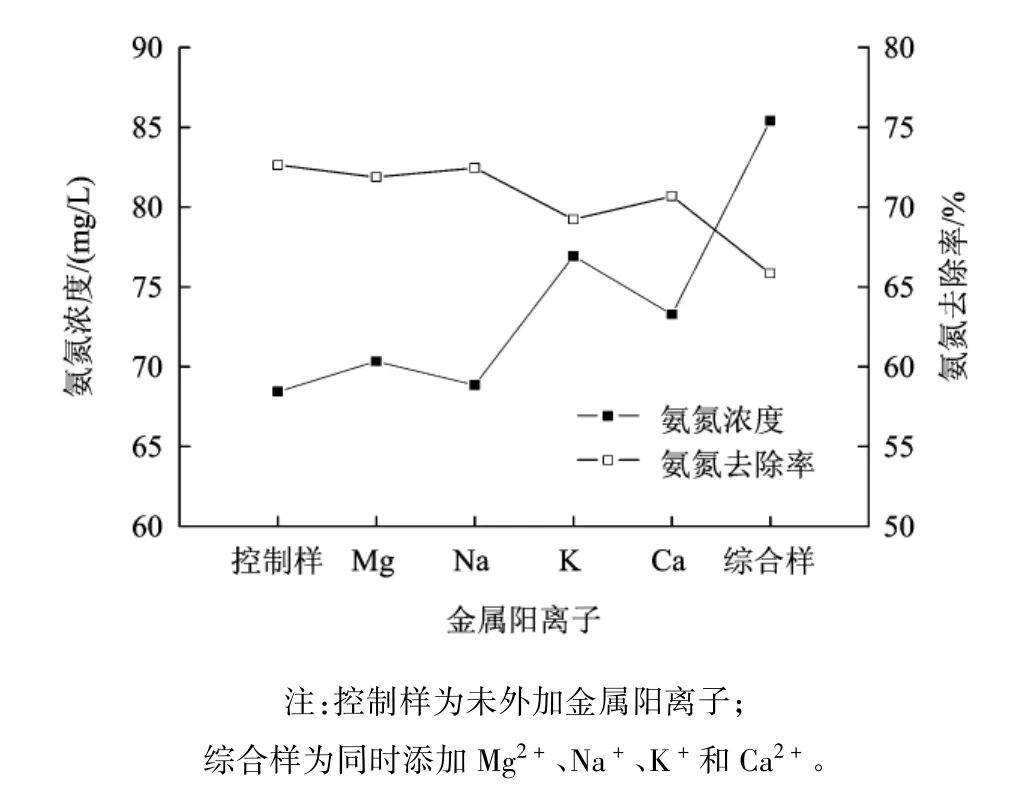
图9 金属阳离子对吸附的影响Fig.9 The effects of metal cation to adsorption
3 结论
(1)沸石对氨氮的等温吸附过程更适合用Langmuir公式进行拟合,最大吸附容量为12.903 mg/g。与进行交换的主要金属阳离子为Na+和Ca2+,二者占离子交换总量的93%以上。
(2)不同粒径沸石对氨氮的吸附过程均符合准二级动力学模型,沸石对氨氮的吸附速率随沸石粒径增加而减小,且沸石粒径越小交换出来的总金属阳离子越多。
(3)在快速吸附过程中,沸石对氨氮的去除率与沸石投加量成正比,交换出来的总金属阳离子随着投加量的增加而增加,但主要是Na+的增加,其与NH4
+吸附去除量的比值由1.222增至1.383。
(4)在快速吸附过程中,液体中40 mg/L的Na+和Mg2+对沸石吸附氨氮几乎没有影响,而K+的影响最大,其次是Ca2+,40 mg/L的K+可使沸石的交换容量下降5%。
[1] 李旭东,李广贺,张旭,等.沸石床处理农田暴雨径流氮磷中试研究[J].环境污染治理技术与设备,2003,4(9):22-26.
[2] 张曦,陆轶峰.天然沸石吸附技术防治暴雨径流氮磷污染[J].云南环境科学,2003,22(1):48-50.
[3] 屠巍.沸石界面物理化学性质的研究[D].上海:华东师范大学,2006.
[4] 温东辉.天然沸石吸附:生物再生技术及其在滇池流域暴雨径流污染控制中的试验与机理研究[M].北京:中国环境科学出版社,2003.
[5] 国家环境保护总局.水和废水监测方法[M].4版.北京:中国环境科学出版社,2002.
[6] WANG Y Q,LIU S J,XU Z,et al.Ammonia removal from leachate solution using natural Chinese clinoptilolite[J].Journal of Hazardous Materials,2006,136(3):735-740.
[7] HUO H X,LIN H,DONG Y B,et al.Ammonia-nitrogen and phosphates sorption from simulated reclaimed waters by modified clinoptilolite[J].Journal of Hazardous Materials,2012,229/230:292-297.
[8] 张志军,刘炯天,冯莉,等.基于Langmuir理论的平衡吸附量预测模型[J].东北大学学报,2011,32(5):749-755.
[9] 田震,李奕怀,沈娇雯,等.天然斜发沸石对水中氨氮的吸附研究[J].上海第二工业大学学报,2013,30(1):25-30.
[10] 蔡蕙兰,樊培仁,郑小明,等.缙云沸石的开发应用[M].北京:地质出版社,1992.
[11] 徐丽花,周琪.天然沸石去除氨氮研究[J].上海环境科学,2002,21(8):506-508.
[12] 王浩,陈吕军,温东辉.天然沸石对溶液中氨氮吸附特性的研究[J].生态环境,2006,15(2):219-223.
[13] 刘玉亮,罗固源,阙添进,等.斜发沸石对氨氮吸附性能的试验分析[J].重庆大学学报,2004,27(1):62-65.
[14] 张曦,吴为中,温东辉,等.氨氮在天然沸石上的吸附及解吸[J].环境化学,2003,22(2):166-171.
[15] 须藤隆一.水环境净化废水处理微生物学[M].俞辉群,全浩,译.北京:中国建筑工业出版社,1988.
[16] ADAMS J A.Identification of heterotrophic nitrification in strongly acid larch humuns[J].Soil Biol Biochem,1986,18(3):339-342.
[17] McVEIGH R J,WEATHERLY L R.Effect of other cations in wasterwaters on the ion-exchange removal of ammonium ion[J]. Developments in Chemical Engineering Mineral Processing,1999,7(1/2):69-84.○
Study on Quick Adsorption Characteristics of Ammonia on Natural Clinoptilolite
LI Yuan-zhi1,2,3,SHEN Zhi-qiang2,3,ZHOU Yue-xi2,3,ZHOU Ji-hong1,LIU Jia1,2,3
1.School of Urban Construction,University of Engineering,Handan 056038,China
2.Research Center of Water Pollution Control Technology,Chinese Research Academy of Environmental Sciences,Beijing 100012,China
3.State Key Laboratory of Environmental Criteria and Risk Assessment,Chinese Research Academy of Environmental Sciences,Beijing 100012,China
The characteristics of ammonia nitrogen adsorption on the clinoptilolite was studied by static shaking table experiment,and the effect of clinoptilolite dosage and metal cations on quick adsorption of ammonium on the clinoptilolite investigated.The results indicated that the adsorption of ammonia nitrogen on clinoptilolite was fitted well with the Langmuir isotherm,and the maximum adsorption capacity was 12.903 mg/g.The removal rate increased with the decrease of the clinoptilolite size,and the adsorption process followed the pseudo-second-order kinetics model.Ammonium cations were exchanged with Na+primarily,and then Ca2+.With the increase of ammonia nitrogen concentration and the extension of absorption time,the ratio of Na+to removeddecreased,and vice versa of Ca2+to removed.Clinoptilolite dosage was proportional to the ammonia nitrogen removal rate and the total metal cations released to water.With increasing dosage of the clinoptilolite,the ratio of Na+to removedincreased from 1.222 to 1.383.The inhibitory effect of clinoptilolite adsorption of ammonia nitrogen was in the order of K+>Ca2+>Na+>Mg2+,when the adsorption solution was added with four cations respectively.
clinoptilolite;ammonium nitrogen;quick adsorption;metal cations
X703.1
A
10.3969/j.issn.1674-991X.2014.04.045
1674-991X(2014)04-0275-07
2013-12-14
国家“十二五”科技支撑计划项目(2012BAJ21B01-02);中国博士后科学基金(2012M520351)
李元志(1988—),男,硕士,主要从事水污染控制技术研究,superstarlyz@qq.com
*责任作者:周岳溪(1964—),男,研究员,博士,主要从事水污染控制技术研究,zhouyuexi@263.net
