HepaSphere微球联合Avasting栓塞治疗VX2兔肝癌的实验研究
2014-06-23杜玉清张磊孙学栋顾文权王彬
杜玉清,张磊,孙学栋,顾文权,王彬
(上海市浦东新区浦南医院肿瘤介入科,上海 200125)
·论著·
HepaSphere微球联合Avasting栓塞治疗VX2兔肝癌的实验研究
杜玉清,张磊,孙学栋,顾文权,王彬
(上海市浦东新区浦南医院肿瘤介入科,上海 200125)
目的探讨HepaSphere微球联合Avasting肝动脉栓塞治疗兔移植性肝癌的疗效。方法建立40只兔VX2肝癌模型,随机分为四组,每组10只,A组:肝动脉灌注生理盐水;B组:肝动脉灌注Avasting;C组:肝动脉HepaSphere栓塞;D组:肝动脉HepaSphere+Avasting栓塞。两周后复查CT确定种植成功并计算瘤体大小,免疫组化方法检测肝肿瘤血管内皮生长因子(VEGF)的表达和肿瘤微血管密度(MVD)。所得数据使用SPSS12.0统计软件进行处理,各组间比较采用q检验、χ2检验。结果肿瘤生长抑制D组明显优于其他组(P<0.05);VEGF的表达及MVD计数D组显著低于其他组(P<0.05)。结论HepaSphere微球联合Aasting行兔肝动脉栓塞能抑制移植型肝癌的生长及肝内转移,并对肿瘤组织的微血管和VEGF的表达具有显著的抑制作用。
微球;Avasting;栓塞治疗
经导管肝动脉化疗栓塞术(Transcatheter arterial chemoembolization,TACE)目前已成为公认的治疗不可切除性中晚期肝癌的首选疗法,针对肝癌的富血管性及主要通过肝动脉获取血供的特点,采用药物与碘油乳化制成栓塞剂,阻塞肿瘤血供从而诱导肿瘤死亡,取得了明显的治疗效果,但其远期疗效仍不能令人满意,肝癌TACE术后复发和转移是疗效欠佳的主要原因。肝癌TACE术后复发转移的原因之一是栓塞剂不理想,不能达到真正的末梢及相对永久的栓塞;肿瘤血管形成为另一个主要原因[1-2]。如何做到肿瘤血管完全栓塞及抑制肿瘤新生血管是肿瘤研究的重点和发展方向[3]。本研究采用Aasting联合HepaSphere微球行兔移植性肝癌肝动脉栓塞治疗,探讨HepaSphere微球的栓塞疗效及局部药物抑制肿瘤血管再生的作用,为进一步临床应用研究提供实验依据。
1 材料与方法
1.1 材料选用新西兰大白兔40只,雌雄不限,兔龄约3个月,体重2 kg,由复旦大学动物实验室提供。VX2肿瘤瘤株:由普陀区中心人民医院惠赠。Hepa-Sphere微球:丙烯酸钠与乙烯醇的共聚物,由日本大阪KGT专科医院Hori教授惠赠。检查设备:GE平板DSA(Innova3100),东芝Aquilion one 320排螺旋CT扫描机、Philip Briliance16排螺旋CT扫描机。
1.2 VX2肝癌模型制作和实验方法
1.2.1 VX2肝癌模型的建立兔术前禁食水12 h,以速眠新II(0.2m l/kg)肌注麻醉,完整取出荷瘤种兔腿外侧瘤块,泡于盛有生理盐水的玻璃皿中,用眼科剪剪成约1mm3瘤块备用;将健康实验兔麻醉后,仰卧固定,兔腹脱毛消毒。选取肝左叶实质较厚处为接种部位,CT导向下将18G血管穿刺针刺入兔肝内,调整针尖部位,用13G骨穿针之平头探子将穿刺针内容物推送入肝,反复推送2~3次。推送完毕退出穿刺针及平头探子,局部压迫1~2m in。
1.2.2 TAE治疗VX2肝癌模型制作术后第14天,CT检查确定瘤株种植成功后将实验兔随机分成四组(A、B、C、D组),每组10只。实验兔麻醉固定后,腹股沟区备皮、消毒、铺巾,靠近腹股沟区沿股动脉纵行切开皮肤,暴露股动脉鞘,小心剪开股动脉鞘,分离出1~2 cm长的股动脉,近远端分别用4#丝线穿过备用。提起近端丝线,保持适当张力以暂时阻断血流,用眼科剪在股动脉前壁剪一小“V”形口,将短导丝插入,成功后将自制导管鞘顺导丝插入股动脉并向近端送入约4 cm,结扎近端备用丝线以固定导管鞘。经鞘管引入3F微导管,寻找到腹腔动脉后行造影,确认肝固有动脉,超选择性插管至肝左或肝右动脉进行造影,证实肿瘤染色后按照分组要求注入药物。A组:生理盐水;B组:5mg Avasting;C组:HepaSphere微球;D组:HepaSphere微球+5mg Avasting。术毕将导管撤至腹主动脉时推注青霉素80万U,拔除导管及鞘管,并同时结扎股动脉近远端,逐层缝合切口。
1.2.3 影像学评价CT平扫+增强扫描:VX2肝癌模型制作术后14 d、TACE术后14 d分别行CT平扫加增强,参数设置:100 kV、120mAs、层厚5mm、间距5mm、对比剂总量4~5m l、流速为1 m l/s。确定肝内肿瘤生长,测量肿瘤体积变化[V=ab2/2](a为肿瘤最大径,b为肿瘤最小径),观察肿瘤数量及肿瘤坏死情况。肿瘤坏死程度,按以下标准分为3度:肿瘤坏死<50%为轻度坏死,坏死50%~90%为中度坏死,坏死>90%为重度坏死。
1.2.4 病理及免疫组化检查各组于治疗后14 d CT扫描后处死所有VX2肝癌兔;摘取肝脏,先进行大体观察,然后切取癌灶及其周围肝组织,用4%甲醛将解剖标本浸泡、固定,常规石蜡包埋。尽量取与灌注扫描层面相同的切面切片,然后由病理科专职技术员作HE染色及MVD、VEGF免疫组化染色。由专职从事免疫组化检查的病理学专家观察MVD及VEGF表达情况,免疫组化检查试剂由武汉博士德生物工程有限公司提供。MVD及VEGF表达测定在400倍光学显微镜下取3个“感兴趣区”(阳性细胞分布最密集的区域),取其平均数为该病例的VEGF阳性染色细胞数。MVD记数参照Weidnert的评判标准,选择3个高倍视野血管密度“感兴趣区”区域,任何黄染的细胞或细胞簇即使未显示管状结构,只要和邻近的微血管、肿瘤细胞或其他结缔组织分开均计为1个血管,计算3个“感兴趣区”计数均值。
1.3 统计学方法所有计量数据用均数±标准差(x-±s)表示,采用SPSS12.0软件进行统计学处理。组间比较采用q检验,术前及术后比较采用χ2检验,VEGF的表达比较采用非参数检验,肝肿瘤MVD计数的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 TAE治疗8只实验兔因TACE或肝动脉造影后7 d之内死亡而被剔除,其中A组1只,B组2只,C组3只,D组2只。死亡可能与手术创伤和异位栓塞有关。各组完成所有指标观察的实验兔只数:A=9,B=8,C=7,D=8。TAE术后14 d复查造影:A组和B组治疗前后肿瘤供血无明显变化;C、D组原栓塞的肿瘤供血动脉未见再通,C组肿瘤边缘见明显肿瘤新生血管,D组肿瘤边缘未见或少见肿瘤新生血管。
2.2 肿瘤体积改变D组治疗后肿瘤体积增大明显小于A、B、C组,肿瘤体积变化差异有统计学意义(A、D组:q=62.24,P<0.01;B、D组:q=57.79,P<0.01;C、D组:q=28.38,P<0.01),见表1。
表1 治疗前后肿瘤体积变化(±s)
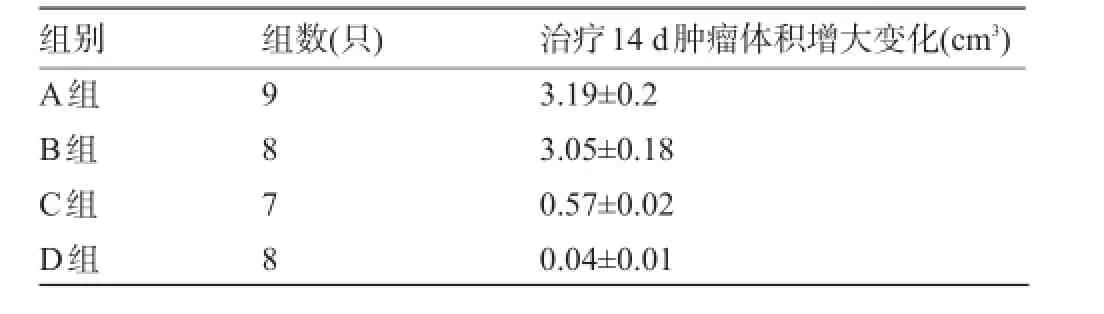
表1 治疗前后肿瘤体积变化(±s)
组别组数(只)治疗14 d肿瘤体积增大变化(cm3) A组B组C组D组9878 3.19±0.2 3.05±0.18 0.57±0.02 0.04±0.01
2.3 治疗前后肿瘤CT强化特点各组均可见肿瘤中心区低密度无强化坏死区,C、D组坏死程度差异无统计学意义(χ2=3.348 2,P=0.067);D组坏死程度重于A、B组(χ2=4.287 5,P=0.038 4;χ2=12.444,P=0.000 4);肿瘤及边缘强化:A、B组肿瘤边缘以中度强化为主,C组肿瘤边缘轻度强化,D组轻度或未见强化,D组肿瘤强化弱于A、B、C组(A、D组:χ2=17.000,P=0.000;B、D组:χ2=16.000,P=0.000 1;C、D组:χ2=4.285 7,P=0.038 4),见表2。
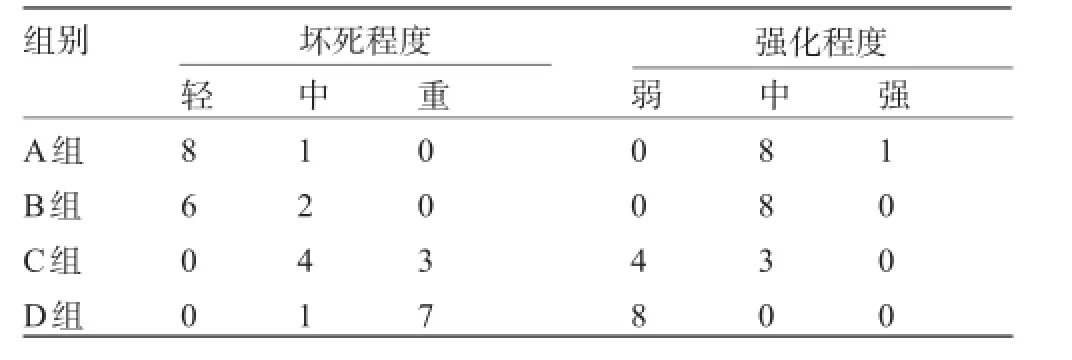
表2 治疗前后肿瘤坏死及CT强化程度(只)
2.4 组织学与免疫组化
2.4.1 组织学检查VX2肿瘤细胞形态不规则,呈巢状分布,多为圆形、梭形,胞质较少,核大而深染,间质较少,瘤细胞异型明显,病理性核分裂象多见;治疗后D组观察肿瘤组织内为结构混乱的异型细胞团,巢状分布的瘤细胞团内可见大片状或多个小片状坏死区,大部分瘤细胞核固缩及核碎裂;C组可见坏死灶周围有较多炎症细胞浸润,间质内有充血、扩张的毛细血管。
2.4.2 免疫组化检查D组中肿瘤微血管稀少,VEGF阳性细胞散在或未见分布;C组肿瘤组织及邻近间质内微血管多而密集,VEGF阳性细胞弥漫分布于癌巢中;B组与A组肿瘤微血管密度及VEGF阳性细胞数居中;D组VEGF表达均较其他组明显减低(A、D组:H=12.210 6,P<0.05;B、D组:H=12.564 6,P<0.05;C、D组:H=13.005 6,P<0.05);MVD计数各组之间差异有统计学意义(P<0.05),见表3。

表3 各组兔肝肿瘤组织中VEGF表达和MVD计数情况(只)
3 讨论
3.1 本研究所使用栓塞剂的特点HepaSphere微球是一种高吸水性聚合物-丙烯酸钠与乙稀醇的共聚物(Acrylic acid sodium salt-polyvinyl alcohol copolyer),呈完全性球体形状、无色透明硬质颗粒,具有几个特点:①在血管内膨胀;②颗粒呈球体;③富有显影性,可作为永久性栓塞材料[4-5]。HepaSphere微球能吸收造影剂并随造影剂在动脉内流动,栓塞过程中可监视栓塞材料的流动状态而防止其返流。Hepa-Sphere微球吸收离子性造影剂后颗粒直径由2倍增至2.5倍。把这些颗粒再移入血清1m in后增大至3.5倍。吸收了离子性造影剂的颗粒则变得柔软而富有变形性,平均直径在0.7mm的颗粒能畅通无阻地通过内径0.53mm的微导管[6]。
3.2 HepaSphere微球行肝动脉栓塞治疗兔移植性肝癌的疗效观察本研究中C与D组均使用Hepa-Sphere微球,不同点为D组吸附Avasting。DSA透视下可见该栓塞剂注入肝动脉后顺血流快速到肿瘤达末梢小动脉内,微球吸收血清后,进一步增大,不留缝隙地充填血管内腔,完全使末梢小动脉及其分支完全性闭塞,栓塞剂在瘤内沉积。复查造影见肿瘤血管及分支完全性闭塞,肿瘤染色消失。栓塞后2周复查DSA:两组均未见栓塞后肿瘤血管再通,但C组见再肿瘤周围有细小肿瘤新生血管。CT及病理显示:D组肿瘤增长最慢,瘤内坏死最明显;C组肿瘤生长略快于D组,坏死范围稍小,但两组比较差异无统计学意义;A组肿瘤生长最快,肿瘤中心坏死最少,B组肿瘤生长速度与肿瘤坏死与A组相似。但A、B组与D组比较无论肿瘤生长还是肿瘤坏死率差异均有统计学意义。因此我们认为HepaSphere微球能选择性到达肿瘤供血动脉并将在肿瘤供血细小动脉及分支内快速增大,达到彻底肿瘤阻断肿瘤供血的作用,具有明显的抑制肿瘤生长的作用,其疗效较为可靠。
3.3 抗肿瘤新生血管作用HepaSphere微球吸附药物可作为一种药物载体,在局部充分发挥药物疗效。Avastin是一种重组人源化抗VEGF的单克隆抗体,通过与循环中VEGF的竞争性结合,阻止VEGF与相应受体结合,进而阻止肿瘤新生血管的发生,且Avasting可使肿瘤及其周围组织的血管分布正常化,因此可通过降低肿瘤组织间质压而有利于化疗药物的传递。Avasting单药治疗晚期肝细胞癌的疗效已初获证实,目前应用于临床抗肿瘤治疗,其抗肿瘤新生血管作用具有浓度与时间依赖性等特征[7],因此临床上主要采用持续静脉滴注配合全身静脉化疗,也有与碘油混合行肝动脉化疗栓塞治疗肝癌的报道[8]。
本研究结果显示,HepaSphere微球联合Avasting栓塞治疗VX2肝癌,有明显移植肿瘤新生血管的作用。在治疗2周后复查DSA、CT及组织病理,D组无论是影像学表现还是VEGF表达水平和MVD值均低于A、B、C组(P<0.05)。
[1]Brown DB,Canlella JF,Sacks D,etal.Quality improvementguidelines for transhepatic arterial chemoembolization,embolization.and chemotherapeutic infusion for hepaticmalignancy[J].JVasc Interv Radiol,2006,17:225-232.
[2]Wang JH.Interventional therapy for hepatocellular carcinoma[J]. Journalof InterventionalRadiology,2005,13(10):721-723.
[3]王滨,徐辉,曹贵文,等.肝动脉化疗栓塞对肝癌肿瘤新生血管生成及血管内皮细胞生长因子表达的影响[J].中华放射学杂志,2005,39(2):204-206.
[4]Osuga K,Khankan AA,Hori S,etal.Transarterial embolization for large hepatocellular carcinomaw ith use of superabsorbent polymer microspheres:initial experience[J].JVasc Interv Radiol,2002,13: 929-934.
[5]Hori S,Hiraishi K,Sugiura T,etal.Hepatocellar carcinoma treated by superabsorbent polymer microspheres(HepaSphere)bland embolization.2007,CIRSE,AnnualMeeting and PostgraduateCourse:305.
[6]杜玉清,堀信一,周为中,等.HepaSphere微球栓塞治疗高流量动静脉畸形[J].中华整形外科杂志,2009,25(3):193-196.
[7]Kountouras J,Zavos C,Chatzopoulos D.Apoptotic and anti-angiogenic strategies in liver and gastrointestinalmalignancies[J].Journalofsurgicaloncology,2005,90:249-259.
[8]Shiva SY,Jing M,Bryan MC.Hepatic tumor grow th:target for angiogenesisinhibition?[J].World JSurg,2005,29:287-292.
Effect of transarterial embolization with Avasting combined with HepaSphere in the treatment of rabbit with VX2 hepati ccarcinoma.
DU Yu-qing,ZHANG Lei,SUN Xue-dong,GU Wen-quan,WANG Bin.Department of Interventional Oncology,ShanghaiPunan Gynecology Hospital,Shanghai 200125,CHINA
ObjectiveTo study the therapeutic effect of transarterial embolization w ith Avasting and hepa-Sphere for rabbitswith VX2 liver carcinoma.MethodsForty rabbits implanted with liver VX2 tumorswere randomly divided into four groups,w ith 10 rabbits in each group.All rabbitswere demonstrated with liver neoplasmas by MSCT and treated w ith transhepatic arterial embolization under the open laparotomy.Group A was given 3m l saline; Group B was infused with 5mg Avasting injection;Group C was embolized w ith hepaSphere;Group D was administrated w ith 5mg Avasting and hepaSphere.Mutislice spiral CT scan w as performed to measure tumor volume and the expression of MVD and VEGF were determinedwith immunohistochem istry on the 14thday after treatment.A llparameter thus gained were com pared among the four groups.ResultsGroup D show ed the grow th of tumor significantly better other three groups(P<0.05).The expression of MVD and VEGF in group D was significantly lower than that in othergroups(P<0.05).ConclusionTransarterial embolizationw ith Avasting combined hepaSphere can effectively inhibitthegrow th ofhepatic tumorand reduce theexpression levelof VEGFand the formation of the tumorvessels.
Microspheres;Avasting;Transarterialembolization
R-332
A
1003—6350(2014)04—0469—03
2013-11-23)
上海市卫生局资助课题(编号:20114176);上海市浦东新区卫生系统重点学科群项目(编号:PWZxkq2011-02)
杜玉清。E-mail:du_yqsh@sina.cn
10.3969/j.issn.1003-6350.2014.04.0183
