恩替卡韦对HBeAg阳性慢性乙型肝炎患者的免疫调节作用
2014-06-23蔺咏梅杨雪亮唐甜甜蔺淑梅
蔺咏梅,杨雪亮,叶 峰,张 曦,孔 颖,唐甜甜,张 健,蔺淑梅
(1.三二○一医院传染科,陕西汉中 723000;2.西安交通大学医学院第一附属医院传染科,陕西西安 710061)
恩替卡韦对HBeAg阳性慢性乙型肝炎患者的免疫调节作用
蔺咏梅1,杨雪亮2,叶 峰2,张 曦2,孔 颖2,唐甜甜2,张 健2,蔺淑梅2
(1.三二○一医院传染科,陕西汉中 723000;2.西安交通大学医学院第一附属医院传染科,陕西西安 710061)
目的探讨恩替卡韦对HBeAg阳性的慢性乙型肝炎患者的免疫调节作用及其机制。方法30例HBe Ag阳性慢性乙型肝炎患者每日给予0.5 mg恩替卡韦治疗,于治疗0、12、24、48周分别检测血清HBV DNA、IFN-γ及IL-4水平,并检测外周血单个核细胞(PBMCs)中B7-H1 mRNA水平。结果①应答组患者PBMCs中B7-H1 mRNA水平在治疗过程中呈进行性下降,且有统计学差异(P=0.005),而无应答组该指标在治疗过程中无显著变化(P=0.466);②应答组患者的血清IFN-γ水平在治疗过程中呈上升趋势(P<0.05),无应答患者的血清IFN-γ水平在治疗过程中虽也呈上升趋势,但均无统计学意义(P>0.05);③应答组患者的血清IL-4水平在治疗过程中表现为持续下降,并具有统计学意义(P<0.05),无应答组患者的血清IL-4水平在治疗过程中虽然有下降趋势,但均无统计学意义(P>0.05)。结论恩替卡韦治疗HBeAg阳性的慢性乙肝患者不仅具有抑制病毒作用,而且具有促进免疫恢复和调节的功能,其机制可能是通过降低患者体内的病毒载量、减少抑制性共刺激分子B7-H1的表达而发挥作用。
恩替卡韦;HBeAg阳性;免疫调节;B7-H1;慢性乙型肝炎;IFN-γ;IL-4
乙型肝炎病毒(hepatitis B virus,HBV)感染是目前威胁人类健康的重要疾病之一,全球3.5~4亿人为慢性HBV感染者[1]。HBV感染人体后易慢性化的机制尚未完全明确。研究发现,Th1/Th2细胞功能失衡可能是HBV感染慢性化的主要原因[2-4],而抑制性共刺激分子B7-H1(the programmed death-1 ligands)是诱发免疫细胞功能失衡的重要因素[5-8]。
核苷类似物作为一种直接抗病毒药物不仅可以显著抑制病毒复制,而且有研究显示这类药物可能具有调节慢性HBV感染者体内的免疫状态的能力,从而促使患者发生HBe Ag血清学转换,乃至HBs Ag血清学转换,但机制尚未明了[9-12]。
为了解恩替卡韦对慢性乙型肝炎患者的免疫调节作用及机制,本研究以应用恩替卡韦治疗的HBe Ag阳性的慢性乙型肝炎患者为研究对象,动态观察治疗过程中血清B7-H1水平的变化,以及由Th1细胞分泌的细胞因子IFN-γ和Th2细胞分泌的细胞因子IL-4的变化,探讨这些细胞因子的变化与抗病毒疗效的关系,进一步明确恩替卡韦对HBeAg阳性慢性乙型肝炎患者的免疫调节作用。
1 材料与方法
1.1 研究对象选择2007年~2011年在西安交通大学医学院第一附属医院就诊的接受恩替卡韦治疗的HBeAg阳性的慢性乙型肝炎(CHB)患者作为研究对象。HBe Ag阳性CHB诊断符合2010年《中国慢性肝炎防治指南》诊断标准,并同时满足以下条件:①年龄18周岁以上;②HBV DNA≥105copies/m L;③血清ALT为80~400 U/L;④血清总胆红素<85.5μmol/L;⑤未曾接受抗乙肝病毒药物及免疫调节剂治疗;⑥所有病例排除HAV、HCV、HEV、HDV及HIV的感染,并排除自身免疫性、酒精性肝病。所有患者均在了解研究方案的基础上自愿签署知情同意书。选择10例健康志愿者作为正常对照组。
1.2 研究分组所有患者均接受恩替卡韦0.5 mg,口服,1次/d。根据治疗24周时HBV DNA应答情况,分为应答组和无应答组,选取应答组15例,无应答组15例。(治疗24周HBV DNA<50 IU/m L则为应答组,HBV DNA≥50 IU/m L为无应答组)
1.3 标本的获取治疗前获取正常对照者及患者的血清和外周血单个核细胞(PBMCs),治疗12、24、48周获取患者的血清和PBMCs。
1.4 血清HBV DNA水平的检测采用Lightcycler实时荧光定量PCR仪(瑞士罗氏公司),检测血清HBV DNA(瑞士罗氏)含量。检测下限为HBV DNA<50 IU/m L。
1.5 血清IFN-γ、IL-4及B7-H1 mRNA水平的检测采用ELISA法检测IFN-γ及IL-4(美国Bender)。提取PBMC中总RNA,将B7-H1 mRNA逆转录成cDNA,采用实时荧光定量PCR扩增目的基因,并回收检测。
1.6 统计学方法应用SPSS 13.0软件进行统计分析。计量资料表示,HBV DNA载量、血清IFN-γ和IL-4水平的比较,采用重复测量资料的方差分析,P<0.05差异具有统计学意义。同组内不同时间点HBV DNA载量、血清IFN-γ和IL-4水平的比较采用Bonferroni法,校正后P<0.008 3为差异具有统计学意义。
2 结 果
2.1 研究对象的临床特征治疗前患者及正常对照组的性别、年龄无统计学差异,应答组和无应答组在ALT及HBV DNA水平上无统计学差异(P>0.05,表1)。

表1 研究对象的基线资料Tab.1 Baseline characteristics of the patients and the controls
2.2 HBV DNA的动态变化恩替卡韦治疗期间,血清HBV DNA定量检测的结果在两组均呈下降趋势,但应答组的下降幅度远大于无应答组(P=0.000,表2)。
2.3 PBMCs中B7-H1 mRNA的检测结果患者PBMCs中的B7-H1 mRNA表达水平显著高于正常对照组[(8.23±0.06)logIU/m L vs.(1.00±0.03) logIU/m L,P=0.000)]。
应答组患者PBMCs中B7-H1 mRNA水平在治疗过程中呈进行性下降(F=10.915,P=0.005)。治疗12周时PBMCs中B7-H1 mRNA表达水平较治疗前下降(P=0.02),24周较12周也有所下降(P= 0.003),48周较24周稍有下降(P=0.080,图1)。

表2 恩替卡韦治疗过程中HBV DNA的动态变化Tab.2 Dynamic changes of HBV DNA during entecavir treatment
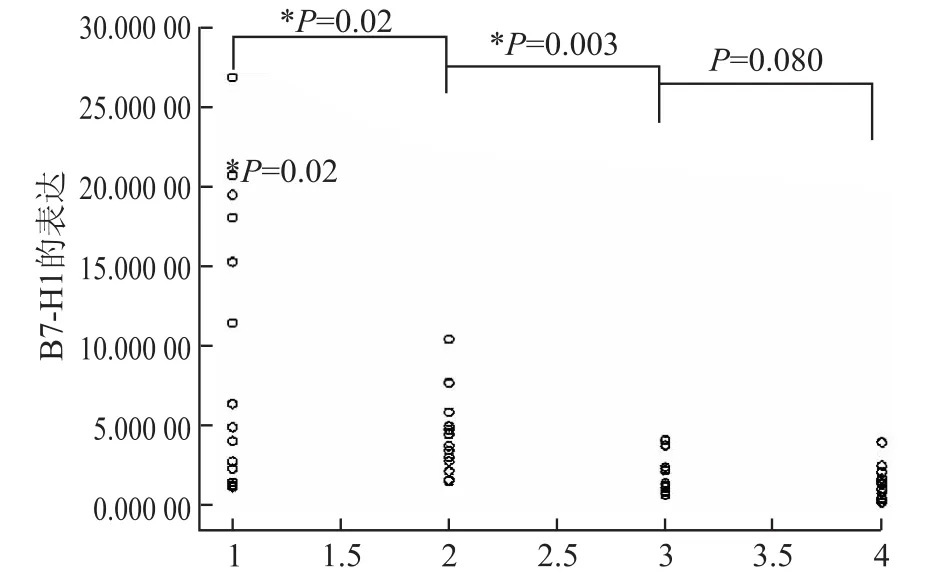
图1 应答组PBMCs中B7-H1 mRNA水平的变化Fig.1 Changes of B7-H1 mRNA of PBMCs in responding group
无应答组PBMCs中B7-H1 m RNA水平在治疗过程中无显著变化(F=0.628,P=0.466)。治疗12周时PBMCs中B7-H1表达水平较治疗前无显著下降(P=0.303),24周与12周、48周与24周比较均无显著变化(P=0.124,P=0.964),而且治疗48周时该指标与基线比较仍无统计学意义(P=0.126,图2)。
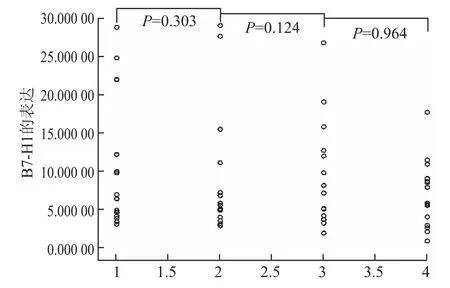
图2 无应答组PBMCs中B7-H1 mRNA水平的变化Fig.2 Changes of B7-H1 m RNA of PBMCs in non-responding group
2.4 血清IFN-γ水平的变化治疗前CHB患者血清IFN-γ水平明显低于正常对照组[(1.80±0.91) pg/m L vs.(6.24±1.45)pg/m L,P=0.02]。
应答组患者的血清IFN-γ水平在治疗过程中处于上升趋势,且不同时间点IFN-γ比较,差异具有统计学意义(F=180.09,P=0.000),其中12、24、48周和基线比较,差异均具有统计学意义(P=0.000);24周与12周比较,差异具有统计学意义(P=0.000);48周与24周比较,差异具有统计学意义(P=0.000,图3)。
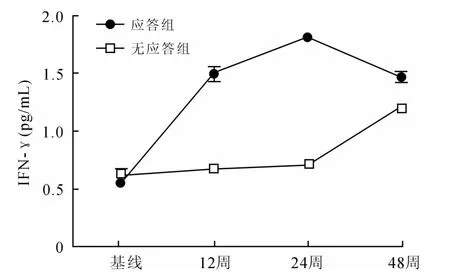
图3 应答组与无应答组血清IFN-γ水平的动态变化Fig.3 Dynamic change of serum IFN-γin responding group and non-responding group
无应答组患者的血清IFN-γ水平在治疗过程中虽然有下降趋势,但均无统计学意义(P>0.05,图3)。
2.5 血清IL-4水平的变化CHB患者血清IL-4水平显著高于正常对照组[(5.83±3.49)pg/m L vs. (4.38±0.37)pg/m L,P=0.04]。
应答组患者的血清IL-4水平在治疗过程中表现为持续下降,并具有统计学意义。治疗12周时血清IL-4水平较治疗前显著下降(P=0.013),24周较12周下降明显(P=0.012),48周较24周下降且具有统计学意义(P=0.034,图4)。
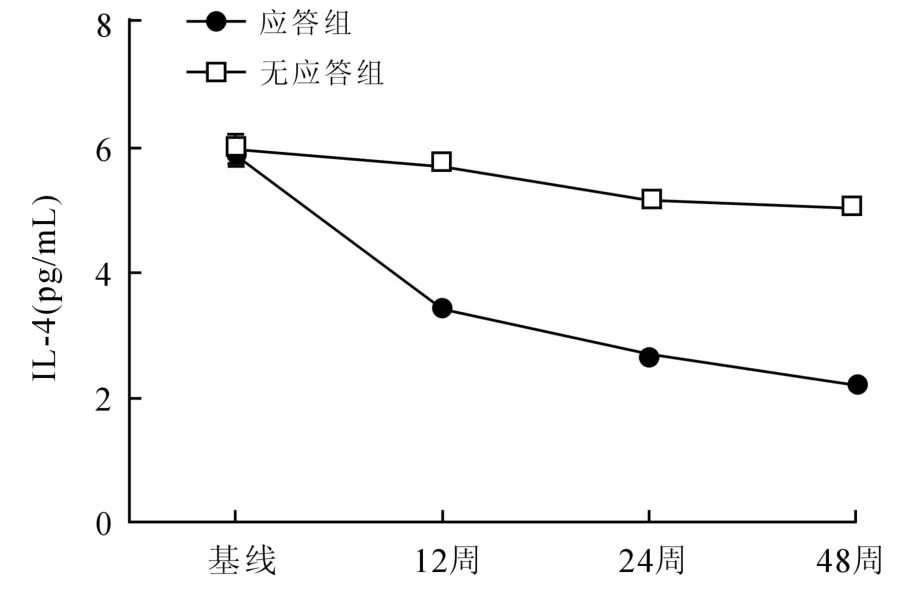
图4 应答组与无应答组血清IL-4水平的动态变化Fig.4 Dynamic change of serum IL-4 in responding group and non-responding group
无应答组患者的血清IL-4水平在治疗过程中虽然有下降趋势,但均无统计学意义。12周时血清IL-4水平与治疗前相比无统计学意义(P=0.069),24周时血清IL-4水平与12周相比也无统计学意义(P= 0.060),48周时血清IL-4水平较24周时有所下降,但差异无统计学意义(P=0.048,图4)。
3 讨 论
HBV感染是一个全球关注的健康问题,也是世界范围内导致慢性肝脏疾病的最常见原因。正常情况下,免疫功能健全的成人感染HBV后可通过天然免疫和适应性免疫应答清除病毒,并获得对HBV再次感染的抵抗力,但是有相当一部分患者由于难于形成针对HBV的有效免疫从而导致感染慢性化[13],TH1和TH2细胞免疫失衡被认为是其中的重要原因。能够影响TH1/TH2细胞功能的因素有很多。近年研究发现,抑制性共刺激分子B7-H1可能是影响HBV感染者T细胞功能的重要因素[14-16]。例如,CHEN等[16]研究发现慢性HBV感染者的T淋巴细胞和mDC细胞上B7-H1表达上调,同时T细胞上PD-1的表达升高。因此,作者认为PD-1/B7-H1途径具有抑制T细胞的功能,包括诱导T细胞的凋亡、降低T细胞的杀伤作用、抑制T细胞的增殖等作用。MAIER等[17]利用特异性B7-H1Ab处理HBV转基因小鼠后,使转基因鼠的IFN-γ表达延迟,进一步证实B7-H1通路能够影响分泌IFN-γ细胞因子的TH1细胞的功能。
本研究也证实,与正常对照组比较,慢性乙型肝炎患者的PBMCs中B7-H1 mRNA表达显著升高,而代表TH1细胞功能的细胞因子IFN-γ在血清中的表达则显著低于正常对照者,代表TH2细胞功能的细胞因子IL-4在血清中的表达则显著高于正常对照者。
但更有意义的研究结果是,随着研究的进展发现随着恩替卡韦抗病毒疗效的发挥,HBV DNA水平呈下降趋势,PBMCs中B7-H1 mRNA表达水平也表现为进行性下降趋势,血清IL-4水平同时下降,而血清中IFN-γ则逐渐上升趋于正常,更重要的是上述这3种因子趋于正常的动态变化在病毒得到良好控制的应答组更加明显。上述结果提示,在慢性HBV感染者的免疫系统中确实存在TH1/TH2细胞免疫失衡,而且抑制性共刺激分子可能与这种失衡有关,恩替卡韦治疗能够促使这种免疫失衡趋于正常,其机制可能是通过降低患者体内病毒载量实现的。也就是说,该结果提示,恩替卡韦通过降低机体的HBV病毒含量而减少了HBV对机体免疫的刺激,进一步减少抑制性共刺激分子B7-H1的表达,从而促使负性免疫调节作用减弱,间接地促进机体清除病毒免疫能力的加强而进一步减少病毒含量,进而使慢性HBV感染者针对HBV的免疫趋于平衡,最终达到免疫控制的目的。其中恩替卡韦抗病毒是始动因素,而真正起作用的可能是机体的免疫系统的自平衡作用。核苷类抗病毒制剂能够间接促使HBV感染者免疫恢复在替比夫定及拉米夫定的研究中也有报道[18-19]。
另外,应答组患者的血清IFN-γ水平48周时在数值上与24周的水平有所下降,原因可能是随着病毒水平的下降,对机体免疫系统刺激作用减弱,相应的细胞因子的表达也有所下降,而无应答组因为病毒载量仍较高,因此仍处于高表达;另一种原因也可能是影响IFN-γ产生的因素非常多,随着病毒水平的下降,免疫网络中的多种因素相互作用而使IFN-γ的表达水平下降,但具体机制仍然需要在后续试验中继续研究[20]。
总之,恩替卡韦用于治疗HBeAg阳性的CHB患者不仅具有直接抑制病毒作用,而且具有促进免疫恢复和调节的功能,其机制可能是通过降低患者体内的病毒载量,减少抑制性共刺激分子B7-H1的表达而发挥作用,但更深一步的机制有待于进一步研究。
[1]NISHIKAWA H,OSAKI Y.Clinical significance of occult hepatitis B infection in progression of liver disease and carcinogenesis[J]. J Cancer,2013,4(6):473-480.
[2]PEI J,TANG Z,ZANG G,et al.Blockage of Notch1 signaling modulates the T-helper(Th)1/Th2 cell balance in chronic hepatitis B patients[J].Hepatol Res,2010,40(8):799-805.
[3]JIANG SS,HE ST,HAN YM,et al.Effect of Shuganlipi decoction on Th1/Th2 cytokines in patients with chronic hepatitis B[J].Nanfang Yike Daxue Xuebao,2010,30(11):2449-2451.
[4]王宏伟,申保生,莫清江.乙型肝炎病毒携带者外周血单个核细胞凋亡和培养上清液中的细胞因子水平测定[J].郑州大学学报:医学版,2008,43(5):997-999.
[5]HAN Y,LI J,JIANG L,et al.Regulation of B7-H1 expression on peripheral monocytes and IFN-gamma secretion in T lymphocytes by HBeAg[J].Cell Immunol,2013,283(1-2):25-30.
[6]JEON S,ST LEGER AJ,CHERPES TL,et al.PD-L1/B7-H1 regulates the survival but not the function of CD8+T cells in herpes simplex virus type 1 latently infected trigeminal ganglia[J].J Immunol,2013,190(12):6277-6286.
[7]CHARLES R,CHOU HS,WANG L,et al.Human hepatic stellate cells inhibit T-cell response through B7-H1 pathway[J]. Transplantation,2013,96(1):17-24.
[8]LIANG SC,GREENWALD RJ,LATCHMAN YE,et al.PD-L1 and PD-L2 have distinct roles in regulating host immunity to cutaneous leishmaniasis[J].Eur J Immunol,2006,36(1):58-64.
[9]PODDAR U,YACHHA SK,AGARWAL J,et al.Cure for immune-tolerant hepatitis Bin children:is it an achievable target with sequential combo therapy with lamivudine and interferon?[J].J Viral Hepat,2013,20(5):311-316.
[10]BONI C,LACCABUE D,LAMPERTICO P,et al.Restored function of HBV-specific T cells after long-term effective therapy with nucleos(t)ide analogues[J].Gastroenterology,2012,143(4):963-973.
[11]CHEN Y,LI X,YE B,et al.Effect of telbivudine therapy on the cellular immune response in chronic hepatitis B[J].Antiviral Res,2011,91(1):23-31.
[12]MA L,CAI YJ,YU L,et al.Treatment with telbivudine positively regulates antiviral immune profiles in Chinese patients with chronic hepatitis B[J].Antimicrob Agents Chemother,2013,57(3):1304-1311.
[13]GUIDOTTI LG,CHISARI FV.Immunobiology and pathogenesis of viral hepatitis[J].Annu Rev Pathol,2006,1:23-61.
[14]GREENWALD RJ,FREEMAN GJ,SHARPE AH.The B7 family revisited[J].Annu Rev Immunol,2005,23:515-548.
[15]CHEN L.Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity[J].Nat Rev Immunol,2004,4(5):336-47.
[16]CHEN L,ZHANG Z,CHEN W,et al.B7-H1 up-regulation on myeloid dendritic cells significantly suppresses T cell immune function in patients with chronic hepatitis B[J].J Immunol,2007,178(10):6634-6641.
[17]MAIER H,ISOGAWA M,FREEMAN GJ,et al.PD-1:PDL1 interactions contribute to the functional suppression of virus-specific CD8+T lymphocytes in the liver[J].J Immunol,2007,178(5):2714-2720.
[18]MA SW,LI YY,ZHANG GW,et al.Complementarity-determining region 3 size spectratypes of T cell receptor beta chains in CD8+T cells following antiviral treatment of chronic hepatitis B[J].Antimicrob Agents Chemother,2011,55(2):888-894.
[19]LEUNG N.Recent data on treatment of chronic hepatitis B with nucleos(t)ide analogues[J].Hepatol Int,2008,2(2):163-178.
[20]ISHIKAWA T.Immunoregulation of hepatitis B virus infection--rationale and clinical application[J].Nagoya J Med Sci,2012,74(3-4):217-232.
(编辑 卓选鹏)
Immunoregulation of entecavir for patients with HBeAg-positive chronic hepatitis B
LIN Yong-mei1,YANG Xue-liang2,YE Feng2,ZHANG Xi2,KONG Ying2,TANG Tian-tian2,ZHANG Jian2,LIN Shu-mei2
(1.Department of Infectious Diseases,No.3201 Hospital,Hanzhong 723000;2.Department of Infections Diseases,the First Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo study the immunoregulation and mechanism of entecavir for patients with HBe Agpositive chronic hepatitis B.MethodsThirty patients with HBe Ag-positive chronic hepatitis B took 0.5 mg entecavir every day.Then we detected the levels of serum HBVDNA,IFN-γ,IL-4 and B7-H1 m RNA of PBMCs in baseline at12,24,48 and weeks,respectively.Results①The level of B7-H1 m RNA of PBMCs after treatment decreased progressively in responding group,with a significant difference(P=0.005).It decreased slowly in nonresponding group,without significant difference(P=0.466).②The level of serum IFN-γafter treatment increased progressively in responding group,with a significant difference(P<0.05).But it increased slowly in nonresponding group,with no significant difference(P>0.05).③The level of serum IL-4 after treatment decreased progressively in responding group,with a significant difference(P<0.05),but decreased slowly in non-responding group with no significant difference(P>0.05).ConclusionEntecavir used to treat patients with HBe Ag-positive chronic hepatitis B not only suppressed HBVDNA replication but also promoted the recovery and regulation of the immune system.The mechanisms may be related to reducing HBVDNA loads and decreasing B7-H1 expression.
entecavir;HBe Ag-positive;immunoregulation;B7-H1
R512.6
A
1671-8259(2014)05-0655-04
10.7652/jdyxb201405017
2013-12-26
2014-03-269
国家“十二五”重大传染病防治科技重大专项(No.2012ZX10002004-007) Supported by the Major Infectious Diseases Prevention and Control Science and Technology Project of the Major National“Twelfth Five-Year”(No.2012ZX100020004-007)
蔺淑梅,教授.E-mail:linshumei123@126.com
蔺咏梅(1968-),女(汉族),副主任医师.研究方向:肝脏疾病.E-mail:linym35@163.com
时间:2014-05-16 15∶56 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140730.1848.001.html
