人PIF1及其截短体重组蛋白的真核表达及其细胞内定位
2014-06-23李珊珊王建校刘晓丹周平坤顾永清
李珊珊,刘 旭,张 莹,王建校,刘晓丹,王 豫,周平坤,顾永清,
◇基础研究◇
人PIF1及其截短体重组蛋白的真核表达及其细胞内定位
李珊珊1,刘 旭1,张 莹1,王建校1,刘晓丹2,王 豫2,周平坤2,顾永清1,2
(1.石河子大学医学院,新疆石河子 832003;2.军事医学科学院放射与辐射医学研究所,北京 100850)
目的构建人PIF1及其C末端解螺旋酶模序(PIF1C)和N末端PINT结构域(PIF1N)截短体真核表达重组质粒,进行真核表达,并确定PIF1、PIF1C、PIF1N在细胞内定位。方法以HeLa cDNA为模板PCR获取PIF1、PIF1C、PIF1N编码区cDNA,将其插入pCMV-Tag 2B质粒中构建PIF1、PIF1C、PIF1N真核表达重组质粒;通过lipofectamine2000将重组质粒转染人293细胞中,Western blot方法检测其在真核细胞内的表达,用免疫荧光法检测其细胞内定位。结果成功构建了PIF1及其截短体真核表达重组体,并在真核细胞内成功表达。确定PIF1定位于核内,PIF1C定位于整个细胞,呈弥散分布,PIF1N主要定位于核内。结论在真核细胞中成功表达了PIF1、PIF1C、PIF1N,且发现PIF1N对PIF1的入核起重要作用,为进一步研究其PIF1及其各结构域奠定了实验基础。
解螺旋酶;PIF1;重组质粒;蛋白表达;免疫荧光;真核表达
ression
DNA双链内部的碱基序列中存在着大量的生物遗传信息,几乎所有的DNA双链都要被瞬间解开形成单链,以露出碱基作为模板来进行核酸代谢的过程。而解螺旋酶可诱发DNA双链解开,是维持基因组稳定所必须,在几乎所有的核酸代谢过程中都有重要作用[1]。解螺旋酶的突变会导致人类遗传病[2]。PIF1解螺旋酶家族从酵母到人的进化中非常保守,PIF1C具有高度保守性,是一种5'至3'解螺旋酶。PIF1蛋白最早通过参与线粒体DNA的重组而被分离出来。酵母PIF1具有DNA修复、调节端粒长度、维持DNA复制和保持遗传稳定性的作用[3-6]。对于人类PIF1蛋白作用的生物化学机制所知甚少,在生物化学方面的研究数据非常有限。但PIF1解螺旋酶可以参与DNA的损伤修复。我们的前期研究显示,PIF1的N末端也有一定的保守性,命名为PINT结构域(PIF1 N-terminal domain),并且PINT结构域具有与解链活性相反的链退火活性,使DNA单链复性形成双链,从而使PIF1具有解链和复性这一矛盾的双重活性[7],提示PIF1具有重要生理功能。本研究通过构建PIF1及其截短体重组质粒,并进行表达,旨在研究PIF1功能及其PIF1C、PIF1N对其功能、细胞内定位的调节作用,为深入研究PIF1功能及分子机制奠定实验基础。
1 材料与方法
1.1 材料p CMV-Tag 2B质粒、293细胞均由军事医学科学院放射与辐射医学研究所实验室保存;DNA聚合酶:KOD-Plus-Neo、KODFXNeo购自TOYOBO公司;XhoⅠ、HindⅢ内切酶、T4连接酶购自Bio Labs公司;Lipofectamine2000脂质体购自Invitrogen公司;DH5α感受态大肠杆菌、高纯度质粒小提中量试剂盒、BCA蛋白质定量试剂盒购自TIANGEN公司;DNA凝胶回收试剂盒购自东盛公司;Flag标签抗体购自SIGMA公司;PIF1抗体购自Proteintech公司;PIF1C抗体(自制)[8],PIF1N(自制)[7];二抗山羊抗小鼠IgG/辣根酶标记、二抗山羊抗兔IgG/辣根酶标记购自中杉金桥公司;引物合成与重组质粒的测序由北京奥科鼎盛生物科技有限公司完成。
1.2 PIF1及其截短体cDNA的获得根据PIF1蛋白的结构域,分别设计PIF1(1~1 926)、PIF1C(498~1 926)、PIF1N(1~540)(括号内数字表示核苷酸位置)引物,以He La细胞c DNA为模板,PCR扩增PIF1全长及其截短体片段,引物序列见表1,在上游引物中引入HindⅢ酶切位点,下游引物引入XhoⅠ酶切位点,运行PCR,获得目的片段。
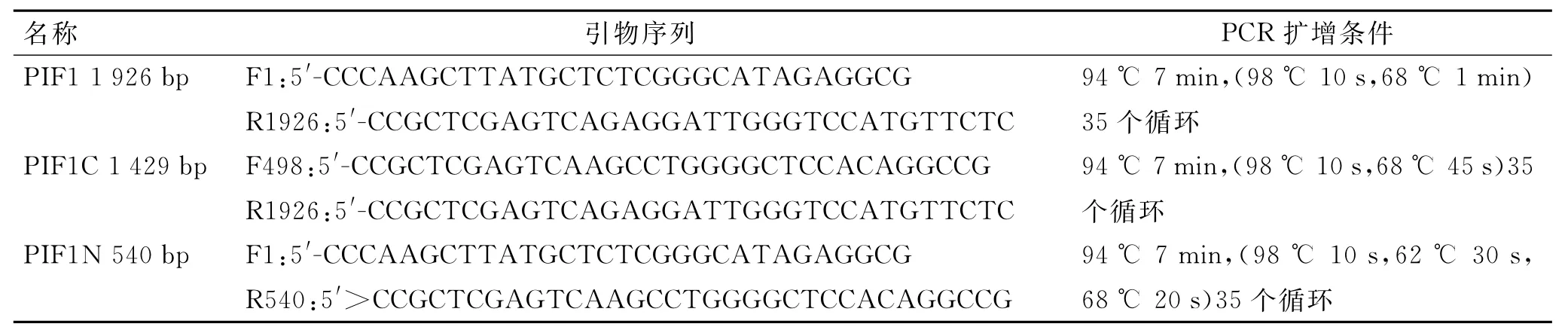
表1 PIF1及其截短体反应体系及扩增条件Tab.1 The reaction system and amplification conditions of PIF1 and its truncated mutants
1.3 重组表达载体的构建限制性内切酶HindⅢ和XhoⅠ双酶切PCR产物和带flag标签的p CMVTag 2B载体,凝胶回收纯化后,连接目的片段与线性化p CMV-Tag 2B载体,构建带flag标签的PIF1、PIF1C、PIF1N重组融合质粒,送北京奥科鼎盛生物科技有限公司进行测序鉴定。
1.4 真核细胞转染及蛋白提取当293细胞(60 mm)密度约60%~80%时进行转染。转染前1 h,将培养基换成Opti-MEM培养基于培养箱培养。质粒m/脂质体v为2~2.5易于转染,PIF1质粒8μg,PIF1C质粒4μg,PIF1N质粒8μg。将脂质体与质粒分别加入Opti-MEM培养基中,静止5 min,后将两者混匀,静止20 min,再将混合液轻轻滴入培养液中混匀,继续培养4~6 h,换正常培养液。培养48 h后,吸出培养液,用预冷的PBS洗2~3次,用刮刀刮下细胞,4℃、3 000 r/min,离心5 min。弃上清,留沉淀(细胞)。
加蛋白裂解液60~100μL,冰上裂解10 min, 4℃、12 000 r/min离心10 min。将上清吸入新的EP管中。按BCA蛋白质定量试剂盒说明进行蛋白定量,待Western blot检测。
1.5 Western blot检测按40μg总蛋白上样量,100 g/L SDS-PAGE凝胶浓度电泳,先80 V电泳30 min,调整电压为120 V,时间为1 h。20 V恒压半干转膜(NC膜)30 min,封闭液(50 g/L脱脂奶粉)室温摇床上孵育1 h。PIF1多克隆抗体(R)、PIFC抗体(R)、PIF1N抗体(R)封闭液稀释1∶1 000,Flag单克隆抗体(M)封闭液稀释1∶5 000,Actin内参抗体(M)封闭液稀释1∶1 000,4℃,过夜孵育。TBST洗膜3次,每次10 min。二抗封闭液稀释1∶4 000,室温,摇床孵育1 h,TBST洗膜3次,每次10 min。ECL显色检测PIF1、PIF1C、PIF1N蛋白表达变化。
1.6 免疫荧光分析将瞬转后的细胞玻片置于6孔板中,PBS洗3次,预冷的40 g/L多聚甲醛4℃固定备用。PBS洗3次,每次5 min,低速震荡。2.5 mL/LTrinton 100破膜处理,室温20 min。10 g/L BSA封闭30 min。Flag抗体10 g/L BSA稀释1∶200,湿盒4℃过夜。PBS洗3次,每次5 min,低速震荡。二抗10 g/L BSA稀释1∶1 000,室温1 h,湿盒避光。PBS洗3次,每次5 min,低速震荡。核染,PBS稀释1∶1 000,室温20 min,湿盒,避光。100 m L/L甘油封片,湿盒避光保存。激光共聚焦显微镜观察。
2 结 果
2.1 PIF1及其截短体重组质粒的构建及鉴定以 He La细胞cDNA为模板,PCR扩增PIF1全长、PIF1C和PIF1N cDNA,经琼脂糖电泳鉴定,与目的片段大小相符,分别为1 926、1 429、540 bp(图1A)。PCR产物与带flag标签的真核表达载体pCMV-Tag 2B经HindⅢ、XhoⅠ双酶切后,连接转化,行菌落PCR鉴定,阳性候补质经测序鉴定,证明与GenBank数据库序列完全一致,命名为PIF1、PIF1C、PIF1N。3个带flag标签的重组融合表达质粒被HindⅢ、XhoⅠ双酶切后,行琼脂糖电泳,可见条带大小与目的片段相符(图1B)。

图1 PIF1及其截短体重组质粒的构建Fig.1 Construction of the recombinant plasmids of human PIF1,its C terminal helicase motif(PIF1C)and N terminal PINT domain(PIF1N)
2.2 PIF1截短体重组蛋白的诱导表达及鉴定将测序正确的PIF1、PIF1C、PIF1N质粒分别瞬时转染入293细胞中,转染48 h后,细胞行常规裂解,Western blot检测PIF1及其截短体蛋白表达。未转染和转染p CMV-Tag 2B空载的293细胞中均未能检测到条带(图2)。PIF1转染细胞,由Flag抗体和商品化PIF1抗体在约70 ku均可检测到特异蛋白(图 2A),与PIF1预期蛋白大小一致。PIF1C转染细胞,由Flag抗体和自制PIF1C抗体在约55 ku均可检测到特异蛋白(图2B),与PIF1C预期蛋白大小一致。PIF1N转染细胞,由flag抗体和自制PIF1N抗体在约22 ku均可检测到特异蛋白(图2C),与PIF1N预期蛋白大小一致。由此可见,构建的带Flag标签的PIF1及其重组体蛋白在真核细胞中得到表达。

图2 PIF1及其截短体在真核细胞中的表达Fig.2 The expression of PIF1 and its truncated mutants in the eukaryotic cells
2.3 PIF1及其重组体在细胞内的定位将测序正确的PIF1、PIF1C、PIF1N质粒分别瞬转入293细胞中,Flag标签抗体标记,免疫荧光激光共聚焦显微镜检测PIF1、PIF1C、PIF1N在细胞中的定位(图3)。未转染细胞Flag抗体标记未见荧光信号,说明Flag抗体具有较好的特异性(3A)。PIF1在细胞核内表达,呈弥散分布,表达量较高(图3B)。PIFC定位于整个细胞中,呈弥散分布(图3C)。PIF1N主要定位于细胞核,细胞核内也呈弥散状分布(图3D)。

图3 激光共聚焦免疫荧光检测PIF1及其截短体在细胞内的定位Fig.3 Intracellular location of human PIF1 and its truncated recombinant protein
3 讨 论
解螺旋酶因为广泛参与核酸代谢,在生物体内具有非常重要的生理功能。一些解螺旋酶的突变会导致人类遗传病,包括Werner综合征(Werner syndrome,WS)、Bloom综合征(Bloom syndrome,BS)、Rothmund-Thomson综合征(Rothmund-Thomson syndrome,RTS)等[2]。
DNA解螺旋酶的一个重要特征是在解螺旋酶的一级结构中存在一些高度保守的氨基酸序列,被称作解螺旋酶模序(helicase motif),对解螺旋酶的功能起重要作用。PIF1解螺旋酶家族在从酵母到人的进化中非常保守,在其跨越300~500氨基酸范围的解螺旋酶模序的序列中有高达60%的保守性。既往研究显示,酵母对基因组稳定性的维持具有重要作用,参与DNA损伤修复、端粒长度调节、冈崎片段成熟等众多生理功能[9-10]。
但人PIF1蛋白的研究起步较晚,对其功能知之甚少。我们前期的研究显示,PIF1蛋白除了其解螺旋酶模序高度保守以外,其N末端也具有一定的保守性,我们将其命名为PINT(PIF1 N-terminal)结构域[7]。经过研究我们还意外地发现,PIF1N具有非常重要的生理功能,PIF1N能够促进PIF1对单链DNA的结合从而增加PIF1的解链活性,而且PIF1N具有与解链相反的使单链DNA复性形成双链的能力,从而使PIF1具有使双链DNA解链形成单链以及使单链DNA复性形成双链这一矛盾的双重功能。目前为止,只有引起人类疾病的Rec Q家族的解螺旋酶,如WRN(werner syndrome protein)、BLM(Bloom syndrome protein)和RecQ4等具有解开双链和使单链复性的矛盾的双重功能,这3种蛋白发生突变可分别导致Werner综合征、Bloom综合征和Rothmund-Thomson综合征。这3种疾病均以基因组不稳定以及易罹患肿瘤为特点。以上结果提示PIF1具有非常重要的生理功能。
为了研究PIF1解螺旋酶的生理功能,了解其PIF1C、PIF1N的功能及对PIF1的调节作用,本研究构建了3种PIF1重组质粒:PIF1、PIF1C、PIF1N,并在真核细胞中进行了表达。同时激光共聚焦免疫荧光分析了PIF1及其各结构域在细胞中的定位,结果显示PIF1全长蛋白位于细胞核,PIF1C弥散定位于整个细胞中,PIF1N位于细胞核。该结果提示了PIF1N对PIF1的入核具有重要的调节作用,没有PIF1N,PIF1不能入核与DNA结合发挥功能。
本研究首次报道PIF1N对其定位的调节作用,该结果揭示了与一般认识相反,PIF1的解螺旋酶模序外的PINT结构域,除赋予PIF1新的生化活性,即退火活性外,还对PIF1的分布具有重要调节作用。因此,推测PIF1N还可以通过蛋白间相互作用指导PIF1功能。本研究从分子水平对进一步探讨PIF1的功能奠定了实验基础。
[1]MATSON SW,GEORGE JW,BEAN DW.DNA helicases:enzymes with essential roles in all aspects of DNA metabolism[J]. Bioessays,1944,16(1):13-22.
[2]HANADA K,HICKSON ID.Molecular genetics of RecQ helicase disorders[J].Cell Mol Life Sci,2007,64(17):2306-2322.
[3]BOCHMAN ML,SABOURI N,ZAKIAN VA.Unwinding the functions of the PIF1 family helicases[J].DNA Repair (Amst),2010,9(3):237-249.
[4]SHIMADA K,GASSER SM.DNA replication:PIF1 pulls the plug on stalled replication forks[J].Curr Biol,2012,22(10):404-405.
[5]WANG J,ENGLUND PT,JENSEN RE.TbPIF8,a trypanosoma brucei protein related to the yeast Pif1 helicase,is essential for cell viability and mitochondrial genome maintenance[J].Molmicrobiol,2012,83(3):471-485.
[6]SCHULDT A.DNA replication:Pif1 overcomes a quadruplex hurdle[J].Nat Rev Mol Cell Biol,2011,12(7):402-408.
[7]GU Y,MASUDA Y,KAMIYA K.Biochemical analysis of human PIF1 helicase and functions of its N-terminal domain[J]. Nucleic Acids Res,2008,39(19):6295-6308.
[8]顾永清,KAMIYA K.人类重组PIF1解螺旋酶C-末端多肽的纯化及其抗体制备[J].农垦医学,2012,30(6):449-452.
[9]MAKOVETSS,BLACKBUM EH.DNA damage signaling prevents deleterious telomere addition at DNA breaks[J].Nat Cell Biol,2009,11(11):1383-1386.
[10]PIKE JE,BURGERS PM,CAMPBELL JL.Pif1 helicase lengthens some Okazaki fragment flaps necessitating Dna2 nuclease/helicase action in the two nuclease processing pathway[J].J Biol Chem,2009,284(37):25170-25180.
(编辑 国 荣)
The eukaryotic expression and intracellular location of human PIF1 and its truncated recombinant protein
LI Shan-shan1,LIU Xu1,ZHANG Ying1,WANG Jian-xiao1,LIU Xiao-dan2,WANG Yu2,ZHOU Ping-kun2,GU Yong-qing1,2
(1.School of Medicine,Shihezi University,Shihezi 832003;2.Institute of Radiology and Radiation Medicine,the Chinese Academy of Military Medicine,Beijing 100850,China)
ObjectiveTo construct the recombinant eukaryotic expression plasmids of human PIF1,its C terminal helicase motif(PIF1C)and N terminal PINT domain(PIF1N),and to explore the intracellular location of PIF1,PIF1C and PIF1N.MethodsBy using Hela c DNA as template,the c DNAs encoding PIF1,PIF1C and PIF1N were amplified by PCR and inserted into p CMV-Tag 2B plasmid to construct recombinant plasmids named PIF1,PIF1C and PIF1N.The recombinant plasmids were transfected into 293 cells using lipofectamine 2000.The protein expressions and the intracellular locations of the inserted genes were confirmed by Western blot and immunofluorescence,respectively.ResultsThe recombinant eukaryotic expression plasmid of human PIF1 and its truncated mutants were successfully constructed and transfected into eukaryote cells.PIF1 was located in the nucleus and PIF1C was found in the whole cell and was dispersively distributed,while PIF1N was located in the nucleus.ConclusionPIF1,PIF1C and PIF1N were successfully expressed in eukaryote cells.PIF1N plays a central role in the nucleus entrance of PIF1.The present study provides important experimental evidence for further study on PIF1 and its domains.
helicase;PIF1;recombinant plasmid;protein expression;immunofluorescence;eukaryotic exp
Q78
A
1671-8259(2014)05-0595-04
10.7652/jdyxb201405006
2013-12-25
2014-04-12
国家自然科学基金资助项目(No.30960093,31160183,31270894)
Supported by the National Natural Science Foundation of China(No.30960093,31160183,and 31270894)
顾永清,博士,教授.E-mail:yqgu96@163.com;周平坤,博士,教授.E-mail:zhoupk@nic.bmi.ac.cn
李珊珊(1988-),女(汉族),硕士,主要研究方向:DNA损伤修复.E-mail:lssttxx@163.com
时间:2014-07-21 18∶00 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140814.1747.001.html
