内生大麻素受体激动剂抑制异动症大鼠纹状体单胺类神经递质的释放
2014-06-23张格娟王会生
王 勇,张格娟,王 涛,王会生,刘 健
(西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
内生大麻素受体激动剂抑制异动症大鼠纹状体单胺类神经递质的释放
王 勇,张格娟,王 涛,王会生,刘 健
(西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
目的观察内生大麻素受体激动剂WIN 55,212-2对帕金森病左旋多巴相关异动症模型大鼠纹状体内单胺类神经递质释放的影响。方法采用脑内微透析和高效液相色谱在线递质测量法观察WIN 55,212-2腹腔内注射对异动症模型大鼠左旋多巴相关异动症状和纹状体内单胺类神经递质释放的影响。结果与溶剂注射相比,WIN 55,212-2注射显著抑制异动症模型大鼠左旋多巴皮下注射后的异动样症状(F1263=44.071,P<0.001),同时明显减少纹状体内多巴胺的释放(F1263=5.091,P<0.05)。结论纹状体内生大麻素受体可能通过抑制性的调节单胺类神经递质的释放来影响异动症模型大鼠的异动样症状。
帕金森病;异动症;纹状体;多巴胺;去甲肾上腺素;大鼠;大麻素受体激动剂
帕金森病(Parkinson's disease,PD)是一种临床常见的中枢神经系统变性疾病[1]。PD的基础病理改变是脑内多巴胺(dopamine,DA)及去甲肾上腺素(norepinephrine,NE)能神经元变性缺失和纹状体内单胺类神经递质含量降低[2]。左旋多巴(L-3,4-dihydroxyphenylalanine,L-DOPA)是单胺类神经递质合成的前体物质,在脑内可以通过特定的酶促反应转化为DA和NE等神经递质[3]。L-DOPA是目前临床治疗PD的最常用药物[4]。PD患者长期服用LDOPA后通常会出现L-DOPA相关的异动症(LDOPA-induced dyskinesia,LID)。LID的出现会严重影响PD患者的生活质量[5-6]。阐明LID的病理生理机制和有效控制LID样症状是目前PD基础和临床研究的重要课题[4]。新近在动物实验中发现,内生大麻素受体激动剂可以明显抑制LID动物模型的LID样症状,但其具体机制尚未阐明[7]。本实验通过给LID模型大鼠腹腔内注射内生大麻素受体激动剂WIN 55,212-2(WIN),同时采用脑内微透析和高效液相色谱在线递质测量法观察WIN注射对LID大鼠纹状体内单胺类神经递质释放的影响,探讨内生大麻素受体激动剂治疗LID的神经生物学机制。
1 材料与方法
1.1 动物和药品20只健康雄性Sprague-Dawley大鼠(220~250 g),由西安交通大学医学院实验动物中心提供。大鼠在标准环境中饲养,室温20~25℃,24 h昼夜循环光照,自由摄食饮水,预养1周。LDOPA(L-3,4-dihydroxyphenylalanine methyl ester hydrochloride)、苄丝肼(benserazide hydrochloride)、6-OHDA(6-Hydroxydopamine hydrobromide)、WIN (WIN 55,212-2 mesylate salt)购自Sigma公司(Sigma-Aldrich,MO,USA)。
1.2 大鼠PD模型制备大鼠在40 g/L水合氯醛(400 mg/kg,i.p.)麻醉下进行内侧前脑束(medial forebrain bundle,MFB)内6-OHDA注射。将大鼠头部固定于脑立体定位仪上(SN-2N,Narishige),严格颅平位。术前先给大鼠注射地昔帕明(25 mg/kg,i.p.)以保护NE能神经元。依据Paxinos-Watson大鼠脑定位图谱确定左侧MFB三维坐标位置是前囟后AP 4.0 mm;矢状缝左L 1.2 mm;颅骨膜下D 7.7 mm[8]。6-OHDA溶于含0.2 g/L抗坏血酸的生理盐水中,用前配制,4℃避光保存。微量注射使用尖端与玻璃微电极相连的10μL Hamilton微量注射器,在MFB内注射6-OHDA,总量12μg/4μL,给药速度1μL/min,注射完毕后将玻璃微电极留置5 min后缓慢退出。6-OHDA注射后第14天,对大鼠分别进行阿扑吗啡(0.05 mg/kg,s.c.)诱导的旋转试验。接受阿扑吗啡注射后,5 min内对侧旋转大于20圈的大鼠被视为成功的PD模型。
1.3 L-DOPA注射和行为学检测检测成功的PD模型大鼠接受1次/d,共21 d的L-DOPA和苄丝肼注射。L-DOPA(6 mg/kg,s.c.)和苄丝肼(12 mg/kg,s.c.)于临用前溶于生理盐水[9]。在L-DOPA注射的第21天,通过异动症评分(abnormal involuntary movements,AIMs)来选取成功的LID大鼠模型。AIMs评分在L-DOPA注射后180 min内每10 min进行1次,共19次。包括躯干、上肢、口舌和对侧旋转等4项异动样症状的累计评分。根据症状程度从轻到重每项症状的评分可为0~4分(无:0分;异动症状出现时间短于观测时间的50%:1分;症状出现时间长于观测时间的50%:2分;异动症状持续出现:3分;异动症状持续出现且不被外来感觉刺激打断:4分)。每观测时间点的最高评分为16分,总分为304分[10]。经检测,表现出明显LID样症状的大鼠被纳入进一步实验。
1.4 WIN 55,212-2的亚慢性注射经检测成功的LID模型大鼠被随机分为WIN注射组(n=6)和对照组(VEH,n=6)。从第22天到第24天WIN组和VEH组大鼠在L-DOPA注射前20 min分别接受1次/d,连续3 d的WIN(1 mg/kg,i.p.)或空白溶剂(VEH,5%/5%/90%of Tween 80/PEG/saline)注射[7]。在第24天观察WIN对异动症模型大鼠AIMs评分和纹状体内DA和NE神经递质释放的影响。
1.5 脑内微透析液采集和递质含量的测定在LDOPA注射的第21天,大鼠在40 g/L水合氯醛(400 mg/kg,i.p.)麻醉下进行微透析导管植入手术。微透析导管(CMA/12,CMA Microdialysis,Kista,Sweden)被植入左侧纹状体内(AP+0.6 mm,L 3.5 mm,D 3.5 mm)并使用2个不锈钢螺钉和玻璃离子体水门汀将导管固定于颅骨上[8,11]。术后将大鼠单笼饲养,在微透析液采集的前1 d将微透析探针(CMA 12 MD Elite Probe,4 mm membrane length,CMA Microdialysis,Kista,Sweden)置入套管内[12]。在WIN注射的第3天进行微透析液采集。将大鼠置入清醒动物用微透析液采集桶(CMA 120,CMA Microdialysis,Kista,Sweden)内。使用聚乙烯软管连接微透析探针和微透析泵(CMA 402 Syringe Pump,Kista,Sweden),并使用林格液(147 mmol/L NaCl、2.7 mmol/L KCl、1.2 mmol/L CaCl2和0.85 mmol/L MgCl2)充灌整个微透析系统[13]。微透析速度为1.5μL/min,每10 min收集1个透析样品。首先收集3个透析样品作为前对照,之后进行L-DOPA注射(6 mg/kg,加苄丝肼12 mg/kg,s.c.)。L-DOPA注射后每10 min收集1个透析样品并记录实时的AIMs评分,共进行180 min的透析样品采集。微透析液收集完毕的大鼠在过量麻醉后,经左心室灌注生理盐水100 m L,随后用40 g/L多聚甲醛150 m L灌注固定;取脑连续冠状面冷冻切片,确定透析管的置入位置。并行黑质致密部(substantia nigra pars compacta,SNc)酪氨酸羟化酶(tyrosine hydroxylase,TH)免疫组织化学染色确定DA能神经元的毁损程度[14]。将采集到的透析液注入HPLC(AlexysUhplc,Antec,Zoeterwoude,the Netherlands)系统中实时测定透析液中的DA和NE递质含量,并换算出脑内DA和NE的实际含量。我们在实验中还分别采集了DA和NE含量在L-DOPA注射后的峰值(ΔCmax)、峰值出现时间(Tmax)和峰值半衰期(t1/2),这些代谢动力学参数反映了L-DOPA注射后纹状体内DA和NE代谢速度的变化。
1.6 统计学分析TH染色阳性神经元计数、DA和NE代谢动力学参数的比较使用t检验。L-DOPA注射后不同组动物间AIMs分值和递质含量水平的比较使用双因素重复测量方差分析(Two-way RMANOVA)的方法统计,post hoc检验使用Holm-Sidak检验。使用SigmaStat 3.5软件进行统计分析,以P<0.05表示差异有统计学意义。
2 结 果
SNc内TH染色阳性神经元计数显示,MFB内6-OHDA注射后,大鼠毁损侧SNc内TH染色阳性神经元显著减少至对侧的(2±3)%(P<0.001,t检验,图1)。

图1 单侧SNc损毁大鼠SNc内TH免疫组织化学染色显微图片Fig.1 Photomicrographs of TH immunocytochemical slices that showed the staining of the SNc in a 6-OHDA-lesioned rat
19只检测成功的6-OHDA损毁大鼠在接受21 d L-DOPA注射后有12只大鼠表现出典型的LID样症状,纳入LID组做进一步实验。另外7只6-OHDA损毁大鼠无典型的LID症状,为non-LID大鼠(图2A~D)。Two-way RM ANOVA统计显示,LID和non-LID组大鼠AIMs评分在组间(F1398= 331.086,P<0.001)、不同时间点(F20398=99.980,P<0.001)及时间×组间交互作用(F20398=93.867,P<0.001)均存在统计学差异。使用Holm-Sidak法进一步的比较不同时间点组间差异,结果显示LDOPA注射后有15个时间点LID组和non-LID组AIMs评分有统计学差异(图2E)。
纳入LID组的12只大鼠被随机分为WIN注射组(n=6)和VEH注射组(n=6),接受3 d的药物注射。在第3天比较两组AIMs评分和纹状体内DA与NE释放水平的差异。Two-way RM ANOVA统计显示,WIN和VEH组大鼠AIMs评分在组间(F1263=44.071,P<0.001)、不同时间点(F21263= 150.448,P<0.001)及时间×组间交互作用(F21263=14.354,P<0.001)均存在统计学差异。使用Holm-Sidak法进一步比较不同时间点组间差异,结果显示L-DOPA注射后有12个时间点WIN组和VEH组AIMs评分有统计学差异(图3A)。
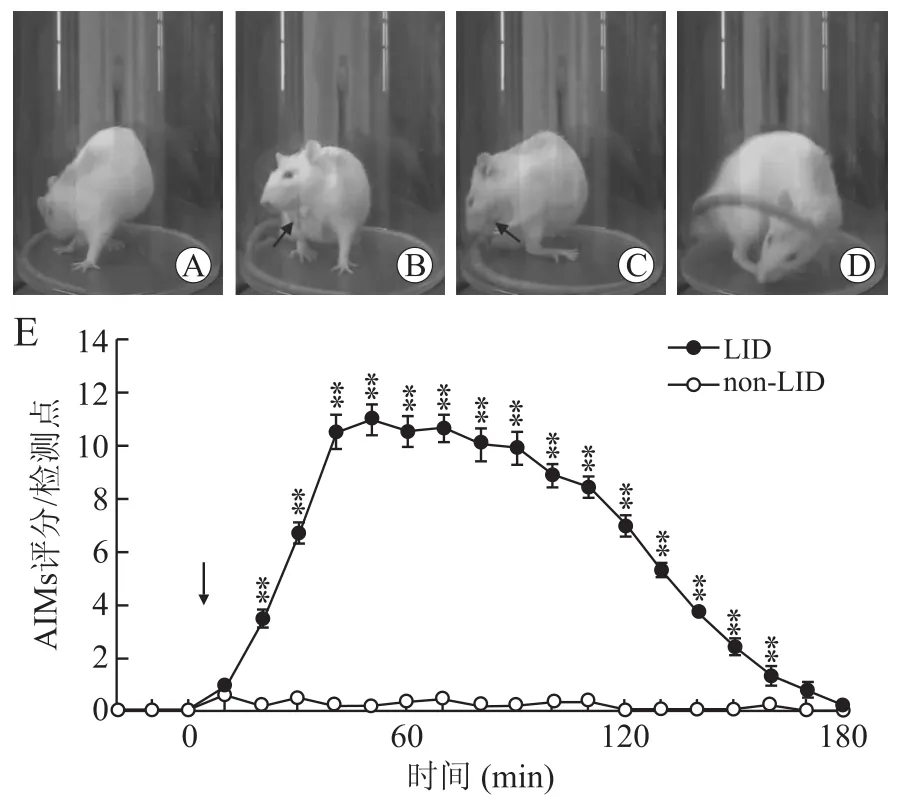
图2 L-DOPA注射后LID大鼠的异动样行为Fig.2 Effects of L-DOPA administration on rat dyskinetic behavior
L-DOPA注射后WIN组和VEH组大鼠DA与NE释放均明显增加。Two-way RM ANOVA统计显示,WIN和VEH组大鼠纹状体DA水平在组间(F1263=5.091,P<0.05)、不同时间点(F21263= 31.029,P<0.001)及时间×组间交互作用(F21263= 6.091,P<0.001)均存在统计学差异。使用Holm-Sidak法进一步比较不同时间点组间差异,结果显示L-DOPA注射后有6个时间点WIN组和VEH组DA水平有统计学差异(图3B)。DA代谢动力学参数中ΔCmax和t1/2在WIN组和VEH组有统计学差异(图3D~F)。Two-way RM ANOVA统计显示,WIN和VEH组大鼠纹状体NE水平在组间无统计学差异(F1263=0.195,P>0.05),但不同时间点(F21263= 13.657;P<0.001)及时间×组间交互作用(F21263= 2.560,P<0.001)均存在统计学差异。使用Holm-Sidak法进一步比较不同时间点的组间差异,结果显示L-DOPA注射后有2个时间点WIN组和VEH组的NE水平有统计学差异(图3C)。NE代谢动力学参数中Tmax和t1/2在WIN组和VEH组有统计学差异(图3D~F)。

图3 WIN对LID大鼠AIMs评分和纹状体内DA与NE释放的影响Fig.3 Effects of WIN on AIMs score and extracellular DA and NE release in LID rats
3 讨 论
本实验结果显示,多数6-OHDA损毁的PD模型大鼠在接受21 d的L-DOPA慢性注射后会出现与LID患者类似的不自主运动症状,这与以往的文献报道一致。LID的主要症状包括了躯干、上肢、口面舌的不自主运动,对于偏侧的LID模型大鼠还会出现不自主的对侧旋转运动[10]。PD患者和PD模型动物出现LID的原因目前尚未完全阐明。目前的研究显示,LID的出现与纹状体内的突触可塑性改变密切相关。这种改变涉及到纹状体内突触前膜和突触后膜的一系列变化。PD状态下,由于DA和NE等单胺能传入纤维的损毁,使LID模型动物的纹状体突触前末梢对单胺类递质的存储和清除能力下降。在接受L-DOPA注射后会出现纹状体内DA等递质水平的骤升和骤降过程,这一现象与LID的出现密切相关[9]。在纹状体内的突触后膜上有DA能D1受体表达。有研究显示,纹状体内单胺类递质的动态变化会对突触后膜的D1等相关受体产生病理性的刺激。有研究报道,LID模型动物的纹状体内D1受体m RNA表达上调,D1受体调节的胞内G蛋白信号通路也表现活性上调。外源性的给予D1类受体激动剂可以抑制LID样症状。除了单胺能和谷氨酸能递质系统外,内生大麻素递质系统可能在LID的出现过程中发挥重要作用[15]。纹状体内的突触后细胞可以合成内源性类大麻素递质N-花生四烯酸氨基乙醇(N-arachidonoylethanolamine,AEA)和2-花生四烯酸甘油(2-arachidonoylglycerol,2-AG)。这类递质可以作用于纹状体突触前膜的内生大麻素CB1受体,进而抑制突触前递质的释放。有研究显示,CB1受体结合类递质上调的小鼠在同样接受L-DOPA处理时LID症状较正常小鼠显著减轻。LID大鼠接受CB受体激动剂后其LID样症状也会出现显著减轻[4]。这些结果都提示,内生大麻素递质系统参与LID的产生过程,CB受体激动剂可能成为治疗或控制LID症状的药物。CB受体激动剂减轻LID症状的机制目前仍不清楚。在本研究中,我们通过建立LID大鼠模型,观察其在接受CB受体激动剂WIN后纹状体单胺类递质释放的改变,并探讨CB受体激动剂抑制LID症状的作用机制。实验结果显示,CB受体激动剂WIN可以显著抑制L-DOPA注射后纹状体内DA和NE递质的释放过程。而且,这一过程与AIMs评分的下降时相一致。CB受体激动剂对DA和NE释放的抑制可能与其对单胺能突触前末梢的抑制作用有关。表达于纹状体突触前的CB受体为抑制性受体,该受体兴奋时可抑制突触前膜的兴奋过程,进而抑制突触前递质的释放[16]。由于LID的出现与L-DOPA注射后突触前膜DA等递质的短时大量释放有关,因而,CB受体激动剂WIN对LID样症状的抑制作用可能与其对L-DOPA注射后纹状体内DA和NE等单胺类递质释放的抑制有关。
综上所述,本研究结果提示CB受体激动剂类药物可能通过抑制L-DOPA给予后纹状体内单胺类递质的峰释放过程,进而抑制LID样症状的出现。
参考文献:
[1]GALVAN A,WICHMANN T.Pathophysiology of parkinsonism[J].Clin Neurophysiol,2008,119(7):1459-1474.
[2]BLANDINI F,NAPPI G,TASSORELLI C,et al.Functional changes of the basal ganglia circuitry in Parkinson's disease[J]. Prog Neurobiol,2000,62(1):63-88.
[3]CARLSSON A,LINDQVIST M,MAGNUSSON T.3,4-Dihydroxyphenylalanine and 5-hydroxytryptophan as reserpine antagonists[J]. Nature,1957,180(4596):1200.
[4]CALABRESI P,DI FILIPPO M,GHIGLIERI V,et al.Levodopa-induced dyskinesias in patients with Parkinson's disease:filling the bench-to-bedside gap[J].Lancet Neurol,2010,9 (11):1106-1117.
[5]FAHN S.The spectrum of levodopa-induced dyskinesias[J].Ann Neurol,2000,47(4 Suppl 1):S2-S9.
[6]BEZARD E,BROTCHIE JM,GROSS CE.Pathophysiology of levodopa-induced dyskinesia:potential for new therapies[J]. Nat Rev Neurosci,2001,2(8):577-588.
[7]MORGESE MG,CASSANO T,CUOMO V,et al.Anti-dyskinetic effects of cannabinoids in a rat model of Parkinson's disease:role of CB(1)and TRPV1 receptors[J].Exp Neurol,2007,208(1):110-119.
[8]PAXINOSG,WATSON C.The rat brain in stereotaxic coordinates[M].Sydney:Academic Press,2005:1-367.
[9]LINDGREN HS,ANDERSSON DR,LAGERKVIST S,et al. L-DOPA-induced dopamine efflux in the striatum and the substantia nigra in a rat model of Parkinson's disease:temporal and quantitative relationship to the expression of dyskinesia[J]. J Neurochem,2010,112(6):1465-1476.
[10]WINKLER C,KIRIK D,BJÖRKLUND A,et al.L-DOPA-induced dyskinesia in the intrastriatal 6-hydroxydopamine model of Parkinson's disease:relation to motor and cellular parameters of nigrostriatal function[J].Neurobiol Dis,2002,10(2):165-186.
[11]DEUMENS R,BLOKLAND A,PRICKAERTS J.Modeling Parkinson's disease in rats:an evaluation of 6-OHDA lesions of the nigrostriatal pathway[J].Exp Neurol,2002,175(2):303-317.
[12]BUCK K,FERGER B.Intrastriatal inhibition of aromatic amino acid decarboxylase prevents l-DOPA-induced dyskinesia:a bilateral reverse in vivo microdialysis study in 6-hydroxydopamine lesioned rats[J].Neurobiol Dis,2008,29(2):210-220.
[13]BUCK K,FERGER B.Comparison of intrastriatal administration of noradrenaline and l-DOPA on dyskinetic movements:a bilateral reverse in vivo microdialysis study in 6-hydroxydopamine-lesioned rats[J].Neuroscience,2009,159(1):16-20.
[14]WANG Y,ZHANG Q,LIU J,et al.Changes in firing rate and pattern of GABAergic neurons in subregions of the substantia nigra pars reticulata in rat models of Parkinson's disease[J]. Brain Res,2010,1324:54-63.
[15]WANG Y,ZHANG Q,WANG H,et al.Genome-wide microarray analysis identifies a potential role for striatal retrograde endocannabinoid signaling in the pathogenesis of experimental l-DOPA-induced dyskinesia[J].Syanpse,2014,68(8):332-343.
[16]GERDEMAN G,LOVINGER DM.CB1 cannabinoid receptor inhibits synaptic release of glutamate in rat dorsolateral striatum[J].J Neurophysiol,2001,85(1):468-471.
(编辑 韩维栋)
Cannabinoid receptor agonist WIN 55,212-2 inhibits striatal monoamine release in a rat model of L-DOPA-induced dyskinesia
WANG Yong,ZHANG Ge-juan,WANG Tao,WANG Hui-sheng,LIU Jian (Department of Physiology&Pathophysiology,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo explore the effects of cannabinoid receptor agonist WIN 55,212-2 on striatal monoamine release in a rat model of L-DOPA-induced dyskinesia(LID).MethodsEffects of WIN 55,212-2 on striatal monoamine release in LID rats were observed by intracerebral microdialysis and high-performance liquid chromatography.ResultsThe dyskinetic behavior related to L-DOPA was inhibited significantly by the injection of cannabinoid receptor agonist WIN 55,212-2(F1263=44.071,P<0.001),accompanied by significant decrease of striatal dopamine release(F1263=5.091,P<0.05).ConclusionThe Results suggest that cannabinoid receptor may be involved in mediating the dyskinetic behavior related to L-DOPA through the regulation of striatal monoamine release.
Parkinson's disease;dyskinesia;striatum;dopamine;norepinephrine;rat;cannabinoid receptor agonist
R741
A
1671-8259(2014)05-0586-05
10.7652/jdyxb201405004
2014-03-22
2014-04-25
国家自然科学基金资助项目(No.81100837);中国博士后科学基金(No.2013M532059) Supported by the National Natural Science Foundation of China(No.81100837)and China Postdoctoral Science Foundation(No. 2013M532059)
刘健,教授.E-mail:liujian@mail.xjtu.edu.cn
王勇(1978-),男(汉族),生理学博士,主要从事帕金森病的病理生理学研究.E-mail:yongwang@mail.xjtu.edu.cn
时间:2014-07-22 18∶22 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1822.021.html
