Toll样受体4信号通路过度激活在大鼠激素性股骨头坏死中的作用
2014-06-23周东生樊立宏王坤正
田 雷,周东生,孙 水,张 晨,樊立宏,王坤正
(1.山东大学附属山东省立医院骨外科,山东济南 250021;2.西安交通大学医学院第二附属医院骨科,陕西西安 710004)
Toll样受体4信号通路过度激活在大鼠激素性股骨头坏死中的作用
田 雷1,周东生1,孙 水1,张 晨2,樊立宏2,王坤正2
(1.山东大学附属山东省立医院骨外科,山东济南 250021;2.西安交通大学医学院第二附属医院骨科,陕西西安 710004)
目的建立大鼠激素性股骨头坏死模型并研究Toll样受体4(TLR4)信号通路在激素性股骨头坏死中的作用机制。方法成年雄性SD大鼠随机分为模型组、干预组,每组各24只,按照甲强龙20 mg/kg的剂量给予双侧臀大肌交替肌注造模,1周1次,共8周。其中干预组在每次激素注射后,同时给予10 mg/kg TAK242药物静脉注射;另12只大鼠设为对照组,仅在同等条件下给予生理盐水肌注。在激素注射后的8、10、12周时分别以过量麻醉法处死各组动物,采用ELISA测定血清中抗酒石酸酸性磷酸酶(TRAP)的含量,并对股骨头进行组织病理学观察和TRAP特异性染色观察。分别提取各组大鼠股骨头总mRNA和总蛋白,采用RT-PCR和Western blot技术检测TLR4、髓样细胞分化因子88(MyD88)、NF-κB p65和单核细胞趋化蛋白(MCP-1)的m RNA及蛋白的表达。结果模型组股骨头坏死的组织病理学表现明显,其中血清TRAP含量、TRAP特异性染色面积、各因子的m RNA和蛋白含量表达均较其他两组有统计学差异(P<0.05)。干预组与空白对照组的各指标检测结果差异均无统计学意义(P>0.05)。结论
大剂量激素的使用可以引起TLR4信号通路过度激活从而介导激素性股骨头坏死的发生。
股骨头坏死;Toll样受体4(TLR4);破骨细胞;激素;抗酒石酸酸性磷酸酶(TRAP);髓样细胞分化因子88 (My D88);NF-κB p65;单核细胞趋化蛋白(MCP-1);大鼠
非创伤性股骨头坏死常常导致进行性的关节塌陷甚至发生创伤性关节炎。激素类药物的临床应用产生肥胖、高脂血症、骨质疏松症和Cushing综合征等副作用[1]。长期使用大剂量激素是非创伤性股骨头坏死的最常见诱因,并逐渐成为首要发病原因,而激素性股骨头坏死的发病机制迄今仍未完全明晰[2-5],也缺乏得到证实的预防及治疗方法。研究表明,激素性骨坏死的发病机制可能为多因素相互联系、互为影响的结局,包括骨质疏松学说、脂肪栓塞学说、血管内凝血异常学说、基因及蛋白表达异常学说等[6]。
Toll样受体4(TLR4)是Toll样受体家族中最重要和研究最广泛的成员。作为一种模式识别受体,TLR4与自身免疫性疾病或炎性疾病联系紧密[7]。骨骼系统的稳定依赖于成骨细胞参与的骨形成和破骨细胞参与的骨吸收之间的动态平衡,而这个平衡受机体多个系统的严格调控。长期大剂量应用激素类药可能会干扰正常的免疫反应,导致骨代谢失衡,造成病理性骨吸收增加。本实验通过研究TLR4信号通路以进一步阐明激素性股骨头坏死的发病机制。
1 材料与方法
1.1 实验动物选用成年雄性SD大鼠(年龄8~12周),体质量230~250 g,购自西安交通大学医学院动物实验中心。所有大鼠均为无特定病原动物(SPFA),清洁饲养,温度控制在室温(22±2)℃,相对湿度为(50±5)%,不限制食物和供水,光照每隔12 h循环给予。
1.2 大鼠激素性股骨头坏死模型的建立及TAK242干预所有实验操作均遵照国家卫生部以及科技部制定的规章制度执行。本动物实验也已经通过了西安交通大学医学院伦理委员会的批准。各组间动物经方差分析检验无统计学差异。48只大鼠随机分为干预组和模型组,均给予甲强龙20 mg/kg左右臀大肌交替注射,1周1次,共8周。干预组大鼠在每次激素注射后均给予10 mg/kg TAK242(瑞沙托维)静脉注射,所用剂量参照TAK 242在人类Ⅲ期药物临床试验中所使用的剂量,通过人与大鼠按体表面积药物剂量换算公式计算得出。空白对照组12只大鼠在相同条件下饲养,但每次仅给予同等剂量生理盐水注射。
1.3 动物取材及标本处理所有动物分别在第1次激素注射后8、10、12周时采用过量麻醉法处死,下腔静脉采血2 mL并立即离心,取上清液保存在—70℃低温冰箱中以备进行酶联免疫吸附实验(ELISA)测定。
无菌条件下取双侧股骨头,其中左侧股骨头取出后立即保存于—70℃冰箱,右侧股骨头又随机分为2个亚组,分别用100 mL/L中性甲醛溶液或25 mL/L戊二醛溶液固定备用。
1.4 ELISA检测TRAP含量所有血清样品均采用ELISA试剂盒进行测定。各组取50μL血清样品至微量培养板中,然后加入50μL生物素共轭抗体,37℃孵育2 h。弃去各孔内液体,20~22℃继续孵育2 h。去离子水清洗3次,然后加入100μL辣根过氧化物酶标记物,再次孵育1 h。将培养板清洗干净后加入100μL底物染色液。再次孵育1 h并清洗培养板,加入90μL底物溶液,室温下孵育30 min。最后向各孔内加入50μL反应终止液。读取各孔内波长为λ450 nm的吸光度(A)值,然后计算出每一标准品和样品的平均A值,采用零标准品作为平均值对照。最后根据所得数据利用Graph Pad Prism 5.0软件绘制出曲线方程式并计算出抗酒石酸酸性磷酸酶(TRAP)的实际质量浓度(pg/m L)。
1.5 组织病理学观察及TRAP染色将取出后选定好的新鲜股骨头用磷酸盐缓冲液清洗干净,立即浸入100 m L/L中性甲醛溶液中固定24~48 h,之后放入100 g/L中性EDTA溶液中进行脱钙处理,时间为3~4周。脱钙后石蜡包埋,沿冠状面切成厚度4μm薄片。部分切片进行苏木素-伊红染色并观察组织病理学改变。将其余石蜡切片进行TRAP染色,严格按照说明书操作步骤执行。用eclipse 50i光学显微镜进行图像采集,用Image-Pro-plus图像分析软件进行图像分析。
TRAP阳性染色结果按照说明书给予的结果作为对照,其一般定位于软骨下区域的骨髓组织及骨小梁表面,颜色为肉眼可见的红色或粉红色。另设染色过程中未加入酒石酸溶液的标本组作为阴性对照。染色区域尽量选择相近的位置进行观察。利用染色面积吸光度值进行分析评估,即在一个设定区域内的所有阳性染色强度或密度值的总和[8]。每个样本随机选取10个不同视野观察,取其平均值进行统计学分析。
1.6 RT-PCR技术检测TLR4、MyD88、NF-κB p65和MCP-1的mRNA表达PCR引物合成设计由大连Ta KaRa生物技术公司完成,采用3-磷酸甘油醛脱氢酶(GAPDH)作为内参对照,引物见表1。各样本在冷的磷酸缓冲液中彻底清洗2次,Trizol法提取股骨头内总RNA。吸取0.5μg样品总RNA,利用SuperScript TM II Rnase H逆转录酶100 U和0.5 μg引物片段来合成c DNA第一链。DNA扩增采用25μL包含100 ng cDNA模板反应混合物的PCR Master Mix试剂盒来完成。PCR所有反应试剂包括荧光染料SYBR green均选自DNA Engine Opticon RT-PCR反应体系。每个样本最后的结果均通过与内参GAPDH进行标准化比较。
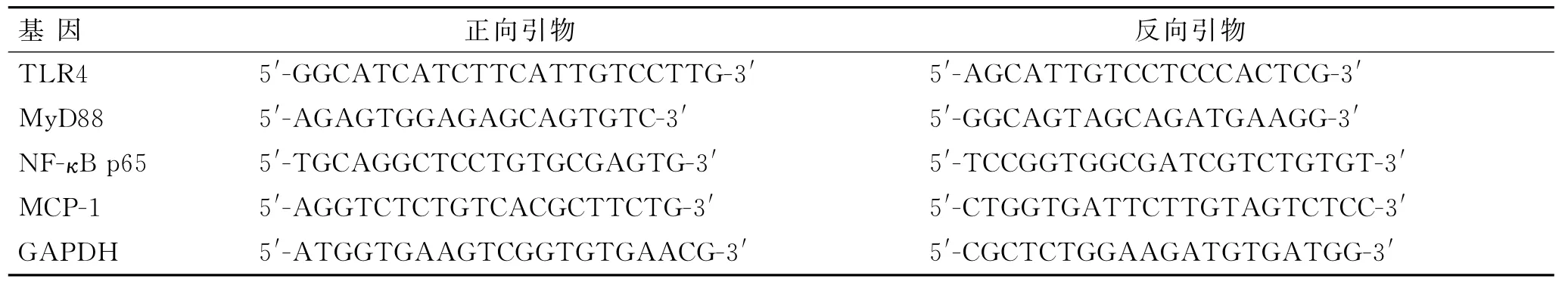
表1 各因子PCR引物序列Tab.1 The PCR primer sequence of each factor
1.7 Western blot检测TLR4、MyD88、NF-κB p65和MCP-1的蛋白表达RIPA蛋白裂解液裂解股骨头后,液体放入离心管12 000 r/min 4℃下离心10 min,收集上清液即为股骨头总蛋白溶液。每次取约10μL总蛋白溶液,按4∶1比例加入SDS上样缓冲液(62.5 mmol/L Tris/HCl,p H 6.8,20 g/L SDS,100 m L/L甘油,50 mmol/L二硫苏糖醇,0.1 g/L溴酚蓝),聚丙烯酰胺凝胶中进行电泳并进行蛋白半干转膜后,50 g/L脱脂牛奶的TBS/Tween20(0.05 mol/L Tris,0.15 mol/L NaCl,p H 7.6;10 m L/L Tween20)室温下封闭膜1 h,加入各因子一抗(rabbit anti-rat,1∶1 000)4℃孵育过夜。将膜在TBS/ Tween20溶液中清洗3次,避光下加入辣根过氧化酶标记的二抗(goat anti-rabbit,1∶5 000)室温下摇床孵育2 h。采用辣根过氧化物酶标记的β-actin作为内参对照。利用化学发光试剂盒进行暗室下发光并采集图像信息,利用图像分析软件进行图像分析处理。
1.8 统计学分析应用SPSS 17.0统计软件包进行数据分析处理。所有数据采用均值±标准差表示,3组间的比较先采用方差分析,当P<0.05时,可采用LSD t检验进行组间的两两比较。P<0.05表示差异有统计学意义。
2 结 果
2.1 血清中TRAP含量测定图1显示根据A值计算得出的各组各时间点TRAP浓度值,且可信度高(R2=0.988 7)。与空白对照组相比较,模型组TRAP浓度随时间延长增加(P<0.05),但干预组的TRAP浓度虽然也有增长,但与空白对照组相比差异无统计学意义(P>0.05)。模型组与干预组相比较,TRAP含量在各时间点差异均有统计学意义(P<0.05)。
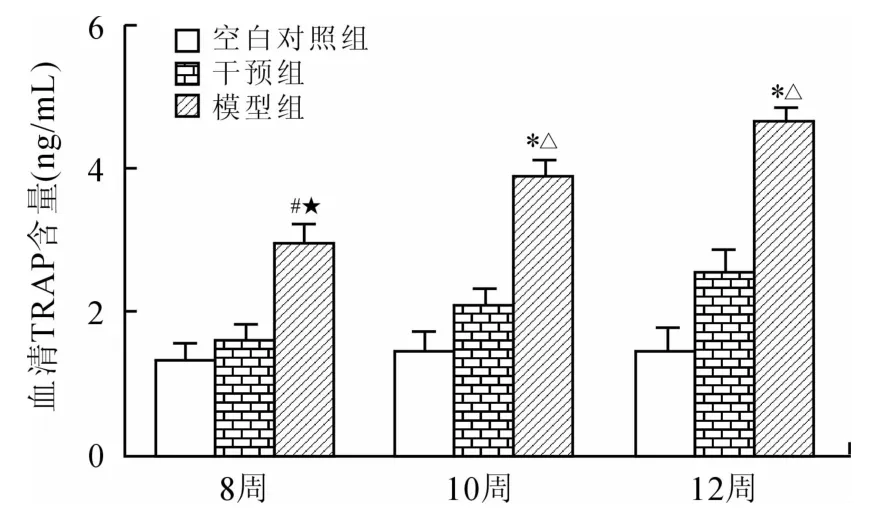
图1 各组大鼠外周血清TRAP含量Fig.1 The concentration of TRAP in the peripheral serum of all rats
与对照组比较,*P<0.01,#P<0.05;与干预组比较,ΔP<0.01,★P<0.05。
2.2 骨坏死组织病理学观察股骨头坏死的组织病理学诊断依据为骨小梁内骨细胞核固缩、消失,空骨陷窝形成且伴随有骨髓组织坏死纤维化。激素注射后干预组和模型组骨坏死发生率分别为20.8%(5只)和45.8%(11只),其中7只出现了双侧股骨头坏死。两组出现坏死的股骨头内空骨陷窝率分别为10.21%和36.97%。各组股骨头的组织病理学观察(图2)显示,干预组骨小梁内出现了少数空骨陷窝,髓腔内有轻度脂肪细胞堆积,并出现少数骨髓造血细胞坏死及骨髓纤维化,多核巨细胞及破骨细胞增加不明显。模型组骨小梁变得稀疏,部分断裂,骨小梁内空骨陷窝较多;骨髓腔内出现造血细胞的坏死,骨髓纤维化;大量脂肪细胞变性聚集,部分融合成泡;破骨细胞大量活化增殖,可以观察到部分破骨细胞附着在骨小梁表面吞噬坏死骨质。模型组骨坏死表现随时间延长逐渐加重。空白对照组内未观察到明显的骨坏死表现,空骨陷窝及骨髓坏死均不明显。

图2 HE染色观察造模后股骨头坏死表现Fig.2 Femoral head osteonecrosis observed by HE staining
2.3 TRAP染色观察空白对照组阳性染色面积较少,干预组较多,而模型组阳性染色结果最强(图3)。干预组与空白对照组相比,在8周时差异有统计学意义(P<0.05),但10周和12周时差异无统计学意义(P>0.05)。模型组与空白对照组相比在各时间点差异均有统计学意义(P<0.05)。模型组与干预组相比较,在8周时差异无统计学意义(P>0.05),但在10周和12周时差异明显(P<0.05)。
2.4 各组各时间点TLR4、MyD88、NF-κB p65和MCP-1的mRNA表达变化与空白对照组相比较,模型组股骨头内所有因子mRNA表达明显增加,差异有统计学意义(P<0.05);干预组内各时间点各因子mRNA表达差异均无明显统计学意义(P>0.05);模型组与干预组相比较,TLR4和单核细胞趋化蛋白(MCP-1)在各时间点差异有统计学意义(P<0.05),NF-κB p65在12周时有差异(P<0.05),而髓样细胞分化因子88(My D88)在各时间点差异均无统计学意义(P>0.05,图4)。
2.5 各组各时间点股骨头内TLR4、MyD88、NF-κB p65和MCP-1的蛋白表达Western blot检测显示,模型组内各因子蛋白表达随时间延长显著增加。与空白对照组相比较,模型组各因子在各时间点差异均有统计学意义(P<0.05),而干预组与空白对照组相比差异均无统计学意义(P>0.05);模型组与干预组相比较,TLR4蛋白表达在8周、12周时差异有统计学意义(P<0.05),My D88、NF-κB p65在各时间点差异均有统计学意义(P<0.05),MCP-1在10周、12周差异有统计学意义(P<0.05,图5)。
3 讨 论
国内外众多学者研究了多种动物模型以进一步阐明激素性股骨头坏死的发病机制。目前最常用的造模方法是脂多糖(LPS)联合甲强龙[9]。然而,这种造模方法与临床上激素性股骨头坏死患者的发病机制存在一定的偏倚,并不能精确反映出骨坏死患者的实际病理学特征。大鼠股骨头拥有和人类相同的前倾角和颈干角结构,因此股骨头的生物力学较其他造模动物与人类更为相近。本实验采用对成年SD大鼠大剂量单纯注射临床上最常用的大剂量激素类药物甲强龙方法进行股骨头坏死造模,从而使动物模型尽量与人类发生骨坏死相近。
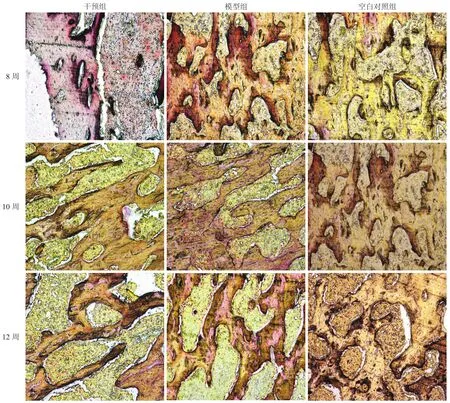

图3 各组大鼠股骨头内TRAP阳性染色结果Fig.3 The TRAP positive staining in the femoral head of all rats(×100)
本实验成功构建了大鼠激素性股骨头坏死模型,模型组骨坏死病理学表现和破骨细胞活化增殖均比较明显。而干预组骨坏死表现及破骨细胞活性均较模型组明显减轻,并且与空白对照组相比差异无统计学意义,从而反向证实了免疫学信号通路在激素性股骨头坏死中的重要意义,通过抑制可以减缓骨坏死的发生。从8周到12周,可以明显观察到模型组骨坏死的组织病理学表现逐渐加重,坏死骨细胞增多,骨小梁稀疏变细,部分断裂,骨髓组织坏死纤维化明显;软骨下骨骺区域也出现了坏死后修复的表现。而应当指出的是,大鼠的股骨头骨骺线是终身存在而不闭合的,此结构和人类是有一定区别。此外,大鼠股骨头坏死后很难出现明显的关节面塌陷,而在人类则较为常见,这可能跟大鼠组织修复能力较强有关[10]。

图4 各组大鼠股骨头内各因子的mRNA表达结果Fig.4 The mRNA expressions of all factors in the femoral head of all rats
TLR4作为一种主要的模式识别受体,主要表达在单核/巨噬细胞系以及树突状细胞表面,可鉴定病原微生物、识别疾病相关分子模式、参与机体先天性或获得性免疫反应。TLR4也可以在骨细胞中表达,它的过度活化可以引起破骨细胞的大量分化增殖。目前研究发现,TLR4信号通路分为MyD88依赖型和非依赖型两种,其中TLRs参与My D88依赖型模式较多。MyD88在MyD88依赖性TLR4信号通路中可以介导TLR4信号通道下游NF-κB的激活,NF-κB也可以通过募集MyD88等相关因子进行相应信号转导[11],并且联合其他相关因子参与了破骨细胞的活化。NF-κB作为一种重要的转录因子,可以调节多种炎症反应及免疫基因的表达,目前已证实活化的NF-κB广泛存在于血管内皮细胞、单核/巨噬细胞系和平滑肌细胞等细胞[12]。在破骨细胞增殖和破骨前体细胞分化成熟过程中,NF-κB参与的信号通路发挥最主要作用。此外,NF-κB还可激活MCP-1,诱导单核/巨噬细胞系分化,最终产生大量的破骨细胞。MCP-1是一种存在于骨髓组织中的重要细胞因子,在促使单核/巨噬细胞系向破骨细胞转化过程中扮演着重要角色,并且可以募集大量的破骨细胞到骨组织表面引起骨破坏。同时,在单核/巨噬细胞向骨细胞活化过程中也可以分泌MCP-1等一系列相关因素介导骨溶解,这是进行骨重建的一个重要过程。TAK 242是一种选择性的TLR4受体拮抗剂,目前已经通过Ⅲ期临床药物实验观察阶段。可以通过竞争性抑制TLR4与其配体的结合来抑制胞内结构域的信号传导[13-14],但是并不影响TLR4蛋白质片段互补的二聚化作用[15],使其不能进行信号的下游传导[16-17],从而抑制TLR4信号通路下游重要的转录因子——NF-κB及其配体的激活,进而可减少破骨细胞的活化。这也是一种针对TLR4所介导的相关疾病的较新的治疗途径。我们利用TLR4的特异性拮抗剂——TAK 242作为干预对照组。
本研究发现,模型组TLR4信号通路内的关键因子表达在应用大剂量激素后随时间延长明显增加,较其他两组有明显差异,而干预组内各因子表达较对照组增加无明显差异。表明激素类药物可以诱导TLR4信号通路的过度激活,引起一种免疫级联效应,使大量破骨细胞活化增殖,最终引起骨质疏松,造成股骨头坏死。此外,模型组血清中TRAP含量以及股骨头内TRAP、MCP-1的表达随时间延长明显增加,较其他两组有明显差异,而干预组内以上指标变化较对照组未见明显差异,证明了激素可以促进单核/巨噬细胞系的破骨化效应,从而引起破骨细胞的大量活化增殖[18]。激素可以打破体内正常的免疫调节状态,扰乱正常的免疫反应,破坏免疫内环境的稳态,进而通过TLR4受体通路活化大量破骨细胞,使正常的骨代谢失衡。然而,本实验最长的观察时间仅为12周,如果能适当延长造模后观察时间可以对激素性股骨头坏死的发病机制进行更好研究。
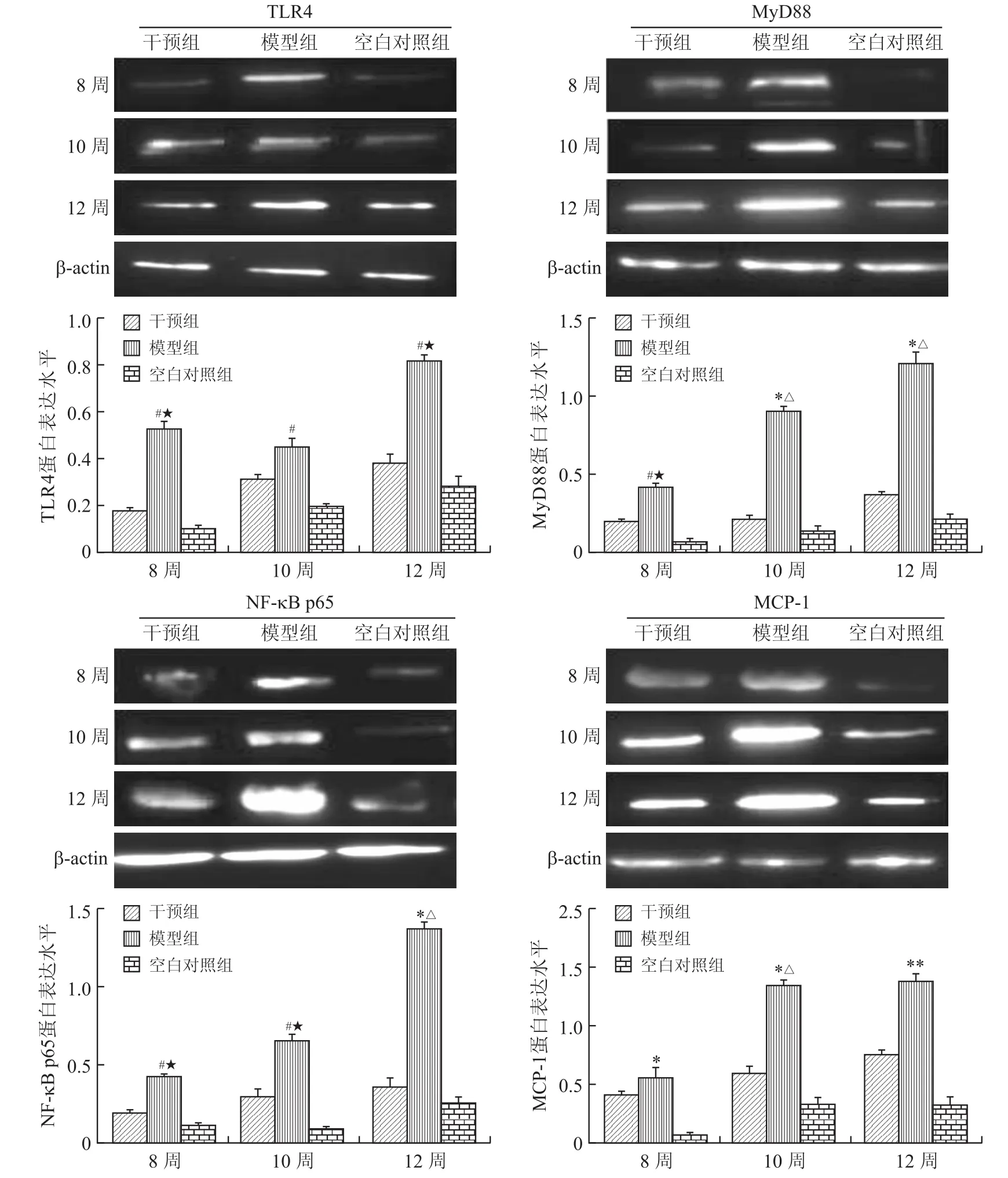
图5 各组大鼠股骨头内各因子的蛋白表达结果Fig.5 The protein expression levels of all factors in the femoral head of all rats
一般说来,骨骼系统终生处于骨形成和骨吸收共同作用的动态平衡中,成骨细胞和破骨细胞各自发挥着重要作用,维持钙磷代谢和骨骼完整。破骨细胞的过度激活使骨吸收大于骨形成,破坏骨小梁的正常结构,在受到外界应力的影响下很容易导致股骨头内微骨折的发生。骨组织在遭到破坏损伤的同时,其自身修复过程也会随之在相邻区域内启动。然而,一旦骨吸收破坏作用占据主导,就会加重骨组织损伤,并且形成一种恶性循环,造成软骨下骨小梁不可逆的进行性破坏,最终导致关节面的塌陷[19]。免疫系统中的多个因子都在骨髓中产生,骨组织也可以通过释放多种细胞因子来合理调节免疫反应。因此,骨坏死的发病机制与免疫系统有一定的关联,两者之间起到了一种相互关联的双向调节作用。本实验力在阐明了一种关于骨坏死发病机制的较新颖理论,将骨骼系统与免疫系统较好的结合起来,初步证实了骨坏死中也存在着免疫相关机制,在一定程度上也促进了骨免疫学理论的研究进展[20-21]。正常骨代谢稳态的维持需要多个系统多因子之间的协调控制,这其中就包含有免疫系统的作用,使其处在一种正常的动态平衡之中。
总之,TLR4信号通路在激素性股骨头坏死中扮演着重要角色,过度激活可以使破骨细胞大量活化增殖从而导致股骨头坏死。因此,研制出针对于体内免疫通路的合理调节、减轻对破骨细胞分化影响的相关药物及生物制剂,可能在将来会更有效地降低临床上因长期大剂量应用激素类药物患者的骨坏死发病率。
[1]COMPSTON J.Glucocorticoid-induced osteoporosis[J].Hormone Res,2003,60(3):77-79.
[2]MONT MA,JONES LC,HUNGERFORD DS.Nontraumatic osteonecrosis of the femoral head:ten years later[J].J Bone Joint Surg Am,2006,88(5):1117-32.
[3]ALDRIDGE JM 3rd,URBANIAK JR.Avascular necrosis of the femoral head:etiology,pathophysiology,classification,and current treatment guidelines[J].Am J Orthop,2004,33 (7):327-332.
[4]BABIS GC,SAKELLARIOU V,PARVIZI J,et al.Osteonecrosis of the femoral head[J].Orthopedics,2011,34(1):39-48.
[5]ORBAN HB,CRISTESCU V,DRAGUSANU M.Avascular necrosis of the femoral head[J].A JClin Med,2009,4(1):26-34.
[6]DRESCHER W,WEIGERT KP,BUNGER MH,et al.Femoral head blood flow reduction and hypercoagulability under 24h megadose steroid treatment in pigs[J].J Orthop Res,2004,22 (3):501-508.
[7]LI H,SUN B.Toll-like receptor 4 in atherosclerosis[J].J Cell Mol Med,2007,11(1):88-95.
[8]MENDONCA DM,CHIMELLI L,MARTINEZ AM.Quantitative evidence for neurofilament heavy subunit aggregation in motor neurons of spinal cords of patients with amyotrophic lateral sclerosis[J].Braz J Med Biol Res,2005,38(6):925-933.
[9]OKAZAKI S,NISHITANI Y,NAGOYA S,et al.Femoral head osteonecrosis can be caused by disruption of the systemic immune response via the toll-like receptor 4 signalling pathway[J].Rheum,2009,48(3):227-232.
[10]ICHISEKI T,UEDA Y,KATSUDA S,et al.Oxidative stress by glutathione depletion induces osteonecrosis in rats[J].Rheumatology,2006,45(3):287-90.
[11]TAKAYANAGI H.Osteoimmunology:shared mechanisms and crosstalk between the immune and bone systems[J].Nat Rev Immunol,2007,7(4):292-304.
[12]COMINACINI L,FRATTA PA,GARBIN U,et al.Oxidized low density lipoprotein(ox-LDL)binding to Ox-LDL receptor-1 in endothelial cells induces the activation of NF-k B through an increased production of intracellular reactive oxygen species[J].J Biol Chem,2000,275(17):12633-12638.
[13]II M,MATSUNAGA N,HAZEKI K,et al.A novel cyclohexene derivative,ethyl(6R)-6-[N-(2-Chloro-4-fluorophenyl) sulfamoyl]cyclohex-1-ene-1-carboxylate(TAK-242),selectively inhibits toll-like receptor 4-mediated cytokine production through suppression of intracellular signaling[J].Mol Pharmacol,2006,69(4):1288-1295.
[14]KAWAMOTO T,II M,KITAZAKI T,et al.TAK-242 selectively suppresses Toll-like receptor 4-signaling mediated by the intracellular domain[J].Eur J Pharmacol,2008,584:40-48.
[15]TAKASHIMA K,MATSUNAGA N,YOSHIMATSU M,et al.Analysis of binding site for the novel small-molecule TLR4 signal transduction inhibitor TAK-242 and its therapeutic effect on mouse sepsis model[J].Br J Pharmacol,2009,157:1250-1262.
[16]KANZLER H,BARRAT FJ,HESSEL EM,et al.Therapeutic targeting of innate immunity with Toll-like receptor agonists and antagonists[J].Nat Med,2007,13(5):552-559.
[17]BARR TA,BROWN S,RYAN G,et al.TLR-mediated stimulation of APC:Distinct cytokine responses of B cells and dendritic cells[J].Eur J Immunol,2007,37(11):3040-3053.
[18]KIM YY,KIM SH,OH S,et al.Increased fat due to estrogen deficiency induces bone loss by elevating monocyte chemoattractant protein-1(MCP-1)production[J].Mol Cells,2010,29(3):277-82.
[19]SAMUEL JP,NIALL S.Osteonecrosis of the femoral head:Part 1—Aetiology,pathogenesis,investigation,classification[J].Current Orthopaedics,2007,21(6):457-463.
[20]TAKAYANAGI H.The unexpected link between osteoclasts and the immune system.Osteoimmunology:interactions of the immune and skeletal systems:advances in experimental medicine and biology[J].Medicographia,2010,658:61-68.
[21]RAGGATT LJ,PARTRIDGE NC.Cellular and molecular mechanisms of bone remodeling[J].J Biol Chem,2010,285(33):25103-25108.
(编辑 国 荣)
The excessive activation of Toll-like receptor 4 signaling pathway leads to steroid-induced femoral head osteonecrosis in rats
TIAN Lei1,ZHOU Dong-sheng1,SUN Shui1,ZHANG Chen2,
FAN Li-hong2,WANG Kun-zheng2(1.Department of Orthopedic Surgery,Shandong Provincial Hospital Affiliated to Shandong University,Jinan 250021;2.Department of Orthopedic Surgery,the Second Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710004,China)
ObjectiveTo establish a rat model to investigate Toll-like receptor 4(TLR4)signaling pathway associated with the pathogenesis of steroid-induced femoral head osteonecrosis.MethodsAdult male SD rats were randomly divided into model group and intervention group with 24 rats in each,and then were injected intramuscularly with 20 mg/kg methylprednisolone(MP)via bilateral gluteus maximus alternatively once a week for 8 weeks.The rats in intervention group were injected intravenously with 10 mg/kg TAK242 before each MP administration.A control group consisting of 12 rats
saline injection.All animals were sacrificed at week 8,10 or 12 from the first MP injection,respectively.The analyses of histopathology and TRAP staining were performed and the concentration of tartrate-resistant acid phosphatase(TRAP)in serum was tested.The m RNA and protein expressions of TLR4,My D88,NF-κB p65 and MCP-1 were detected by quantitative real-time PCR and Western blot.ResultsFemoral head osteonecrosis was observed in the model rats,and the concentration and positive staining of TRAP,the m RNA and protein expression levels of all the factors were enhanced significantly inmodel group compared with that in intervention group and control group(P<0.05).There was no significant difference in the tested factors between intervention group and control group(P>0.05).ConclusionExcessive dosage of corticosteroids can induce femoral head osteonecrosis via the abnormal activation of TLR4 signaling pathway.
femoral head osteonecrosis;Toll-like receptor 4(TLR4);osteoclast;corticosteroid;tartrate-resistant acid phosphatase(TRAP);My D88;NF-κB p65;MCP-1;rat
R68
A
1671-8259(2014)05-0622-08
10.7652/jdyxb201405011
2013-08-21
2013-12-16
国家自然科学基金资助项目(No.81101363) Supported by the National Natural Science Foundation of China(No.81101363)
王坤正,教授,博士生导师.E-mail:wkzh1955@gmail.com
田雷(1982-),男(汉族),博士.研究方向:骨坏死的基础与临床研究.E-mail:osteotianlei@163.com
时间:2014-07-22 16∶17 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1617.004.html
