颈内动脉阻塞后再通对大鼠慢性脑缺血损伤的保护作用
2014-06-23韩建峰袁兴运宋文峰屈秋民
韩建峰,霍 康,白 艳,袁兴运,宋文峰,屈秋民
(西安交通大学医学院第一附属医院神经内科,陕西西安 710061)
颈内动脉阻塞后再通对大鼠慢性脑缺血损伤的保护作用
韩建峰,霍 康,白 艳,袁兴运,宋文峰,屈秋民
(西安交通大学医学院第一附属医院神经内科,陕西西安 710061)
目的通过建立慢性脑缺血动物模型,证实慢性脑缺血恢复血流可改善动物模型认知功能和神经细胞凋亡。方法经颈外动脉线栓法双侧颈内动脉阻塞术制备慢性脑缺血模型,并通过神经功能缺陷评分验证动物模型,恢复血流后用Morris水迷宫测试大鼠的空间学习能力和空间记忆能力,再将脑组织固定和染色,用HE染色和Nissl染色观察神经元数量变化情况,利用Fluoro-Jade C染色法特异性标记脑片中正在发生变性的神经元,观察阻断后及再通后变性的神经元数目的变化,通过观察双侧颈内动脉阻塞及再通后脑组织Bcl-2及Caspase 3的表达变化反映神经元的变性和丢失。结果双侧颈内动脉血流阻断能造成慢性脑缺血,引起神经元变性和死亡,导致大鼠感觉运动及空间学习记忆功能损害。脑血流的恢复能促进抗凋亡基因Bcl-2和Caspase 3的表达,从而逆转了慢性缺血对脑组织的损害,减缓了神经元的变性和丢失,有利于大鼠感觉运动和空间认知功能恢复。结论慢性脑缺血恢复血流可改善动物模型认知功能和神经细胞凋亡。
慢性脑缺血;认知功能;神经细胞凋亡;Bcl-2;Caspase 3
过去进行的症状性脑血管狭窄的研究中,大多数关注的是终点事件。例如,卒中、血管性死亡、心梗等,过多关注的重点是心脑血管病的复发[1-3]。但是,我们知道症状性颅内动脉狭窄所导致的不仅仅是急性血管病事件(TIA、梗塞),很多情况下会导致慢性脑供血障碍,临床上可以出现痴呆、MCI、认知功能下降,甚至精神行为异常,这些现象产生的原因是由于颅内外动脉狭窄导致大脑慢性缺氧、灌注下降造成的,常常会造成患者神经功能的缓慢下降,使致残率增加。慢性脑缺血发生、发展可使脑组织产生不同程度的病理损伤,从而导致不同程度的神经功能障碍。因此,本次实验研究利用大鼠慢性脑缺血模型,观察了慢性脑缺血后大鼠脑结构和功能的损伤,脑血流恢复对脑组织和神经功能损伤的逆转作用,为临床治疗此类疾病提供理论基础和实验依据。
1 材料与方法
1.1 实验动物健康成年Sprague-Dawley(SD)大鼠80只,体质量280~320 g,雄性,由西安交通大学医学院实验动物中心提供。大鼠购回后饲养于温度22~26℃、湿度40%~60%环境中一周后进行实验。假手术组20只作为对照,每组10只分别于4周、8周处死,其余60只分4组,双颈内动脉阻塞后2周、4周、8周后再通组及不再通组各15只。
1.2 大鼠颈内动脉(internal carotid artery,ICA)阻塞及再通模型制备的方法
1.2.1 经颈外动脉线栓法行颈内动脉阻塞术 大鼠经10 m L/L水合氯醛腹腔注射麻醉(40 mg/kg)后,仰卧位固定于大鼠手术台上,剪毛,常规消毒颈部皮肤,取颈部正中切口切开皮肤及皮下组织,分别分离双侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。分离后,电凝阻断ECA的分支并结扎远心端,随后从结扎处的远侧切断ECA,拉向下方;分别用动脉夹夹闭ICA和CCA,手术显微镜下,用显微剪在ECA近动脉分叉处剪一小口,将准备好的栓线经ECA插入ICA内(栓线为直径0.2 mm的黑色鱼线,其头端已烧制成光滑的均匀棒状),进入长度为距CCA分叉处约5 mm。随后,在ECA处用医用缝线结扎固定栓线以阻止出血并确保阻断ICA血流。逐层缝合皮下组织及皮肤,灯照取暖保温,保持呼吸道通畅,待麻醉苏醒后送回动物房,常规饲养。1.2.2 颈内动脉阻塞后的再通 ICA阻塞后4周,选择经神经功能缺陷评分确定的有脑缺血症状的大鼠进行ICA再通手术。动物麻醉固定于手术台,切开颈部皮肤,分离ECA,寻找栓线尾端,用动脉夹夹闭CCA和ICA,经ECA拔出栓线,靠近CCA分叉处结扎ECA,确保无出血,逐层缝合伤口、保温,麻醉苏醒后,常规饲养8周。
1.3 神经功能缺陷评分(neurological deficit score,NDS)参考BECK等[4]的方法,对双侧颈内动脉阻塞及再通后大鼠的感觉运动功能缺陷进行评价,评价项目包括斜面反射、握持反射、触须反射、跌落反射、角膜反射、耳廓反射、自发性运动、转圈运动、前肢弯曲、扭身反射及噬咬反射,正常大鼠总得分为21分,感觉运动缺陷大鼠得分显著降低。
1.4 Morris水迷宫Morris水迷宫用于测试颈内动脉阻塞及再通后大鼠的空间学习记忆功能的变化。大鼠游泳的圆形水池直径为120 cm,水深50 cm,水温为(24±2)℃,水池被分为4个象限,在其中一个象限中央放置一隐藏于水面下2 cm的透明平台,水中加入牛奶以避免动物看见平台。水池上方中央安放摄像头,连结至电脑和记录软件,用以记录和分析动物的游泳时间和运动轨迹(附图6A)。测试分为定位航线实验和空间探索实验两部分。定位航线实验共4 d,经8个训练段,每个训练段游泳4次。每次训练随机选取一个象限,将大鼠头朝向池壁放入水中,观察和记录120 s内大鼠寻找水下平台的运动轨迹和时间(即逃避潜伏期,escape latency),用于测试大鼠的空间学习能力。空间探索实验于第5天进行,撤去平台,将大鼠于平台对面象限放入水中,记录大鼠在120 s中在平台象限的停留时间及穿经平台次数,用于测试大鼠的空间记忆能力。
1.5 脑组织固定和染色
1.5.1 大鼠脑组织灌注固定 将接受颈内动脉阻塞后4周、阻塞后再通8周和假手术组动物进行灌注固定。100 m L/L水合氯醛(40 mg/kg体质量)腹腔注射麻醉后,开胸,暴露心脏,左心室插管,剪开右心耳,用9 g/L氯化钠溶液200 m L快速灌注冲洗出血液,至流出液体清亮;再用500 m L含40 g/L多聚甲醛的0.1 mol/L磷酸缓冲液(PB,p H 7.4)灌注固定1 h;断头取脑,修整成厚约1 cm的冠状脑块,放入40 g/L多聚甲醛中,4℃后固定过夜,然后移入300 g/L蔗糖溶液中,至其沉入容器底部。
1.5.2 冰冻切片 处理好的脑块置于样本座上,用OCT包埋,放入恒冷箱切片机内快速冷冻,然后行冠状切片,片厚20μm,锚定于铬钒明胶包被的载玻片上,用于HE、Nissl和Fluoro-Jade C染色。
1.5.3 HE染色 冰冻切片复至室温,蒸馏水洗去片上的OCT,浸入苏木素染液内,室温30 min;流水洗去多余染液,用10 g/L盐酸乙醇分色,浸入自来水中复蓝;浸入伊红染液内1 min,流水洗去残余染液;经梯度乙醇脱水、二甲苯透明后,中性树胶封片、晾干,显微镜观察和照相。
1.5.4 Nissl染色 主要用于显示脑片上的神经元。切片放入5 g/L甲苯胺蓝(700 m L/L乙醇配制)中染色10 min,700 m L/L酒精分色,至切片为淡蓝色;脱水、透明、中性树胶封片,显微镜观察和照相。
1.6 Fluoro-Jade C染色Fluoro-Jade C是一类新近发展的阴离子荧光配体染料,它可以与中枢神经系统内正发生变性的神经元结合,特异性标记脑内的变性神经胞体及其突起,具有染色时间短、不易衰减、高对照性等优点。是一种快速、敏感及可靠的荧光染料,可方便的用于变性神经元的检测和定位[5-7]。图像采集分析是在荧光显微镜下观察Fluoro-Jade C阳性细胞并照相。
1.7 Western blot蛋白检测蛋白提取→BCA法蛋白浓度测定→蛋白电泳样品制备→SDS聚丙烯酰胺凝胶电泳及蛋白的电转移→免疫学染色→数据采集和结果分析:应用BioRad凝胶成像系统采集数据,采用ImageJ计算每个条带的积分吸光度值(IA),用目标蛋白与内参蛋白(β-Actin)条带的积分吸光度比值表示目标蛋白的相对表达量,进行进一步的统计学分析。
1.8 统计学分析实验数据以均数±标准差()表示,应用SPSS 16.0进行数据分析,样本均数间的比较采用配对t检验或成组t检验,检验水准取0.05。
2 结 果
2.1 双侧颈内动脉阻塞及再通后神经功能缺陷评分的变化为了观察双侧颈内动脉阻塞及再通后大鼠的感觉运动功能变化,评价模型是否成功,参照文献报道的方法,我们在手术后不同时间点对大鼠进行了神经功能缺陷评分。研究结果显示,ICA阻塞后1周动物的评分与假手术组未见显著变化;ICA阻塞后2周,约50%的动物评分显著降低;ICA阻塞后4周,约70%的动物的评分显著低于假手术组。因此,我们选择了阻塞后4周评分显著降低的动物进行后续的再通实验。颈内动脉再通后,动物的评分有所升高,在ICA再通后4周和8周显著高于ICA阻塞4周组(图1)。
2.2 利用Morris水迷宫实验评价双侧颈内动脉阻塞后对大鼠空间认知能力的影响Morris水迷宫实验是显示脑损伤后大鼠空间学习记忆功能变化的主要方法之一。利用该方法进一步评价双侧颈内动脉阻塞后对大鼠空间认知能力的影响及颈内动脉再通后的变化。定位航线实验的统计结果显示,ICA阻塞后4周动物的逃避潜伏期显著高于假手术组;ICA再通后4周,其逃避潜伏期在第4到第8个测试段中显著下降,但仍明显高于假手术组;ICA再通后8周的逃避潜伏期继续下降,但与ICA再通后4周相比,没有统计学差异,提示ICA阻塞可损伤大鼠的空间学习功能,而ICA再通可促进其空间学习功能恢复(图2)。定位航线实验显示,ICA阻塞4周组动物在平台象限的停留时间明显少于假手术组,ICA再通后,动物的平台象限停留时间逐渐提高,在ICA再通4周和8周组显著高于ICA阻塞4周组,但仍然低于假手术组,提示ICA阻塞可损伤大鼠的空间记忆能力,而ICA再通可促进其空间记忆能力的恢复(图3)。

图1 大鼠颈内动脉阻塞及再通后的神经功能缺陷评分Fig.1 Neurological deficit scores of rats after ICA occlusion and reperfusion

图2 大鼠颈内动脉阻塞及再通后Morris水迷宫实验的逃避潜伏期的变化Fig.2 Changes of escape latency in the Morris water maze test after ICA occlusion and reperfusion

图3 大鼠颈内动脉阻塞及再通后Morris水迷宫实验的平台象限停留时间的变化Fig.3 Changes of platform quadrant stay time in the Morris water maze test after ICA occlusion and reperfusion
2.3 HE及Nissl染色观察双侧颈内动脉阻塞及再通后脑组织的形态学变化为了观察双侧颈内动脉阻塞及再通后脑组织的形态学变化,我们选取了颈内动脉供血区的额叶皮质,进行了HE和Nissl染色。HE染色结果显示(图4),假手术组大鼠脑组织中的神经元形态正常,表现为细胞核光滑,淡染后有明显的核仁;ICA阻塞4周的脑组织切片上神经元数量明显减少,有散在的形态异常神经元,出现了较多的空泡,部分空泡中有固缩的核染色质;另外,与假手术组相比,切片上出现了较多的核小且浓染的浸润炎性细胞。ICA再通后8周,切片上神经元数量未见明显增加;但炎性细胞较ICA阻塞4周组明显减少;可观察多个管腔较大的增生血管。到
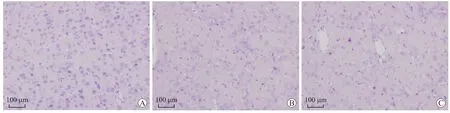
图4 大鼠颈内动脉阻塞及再通后脑组织的形态学变化Fig.4 Morphological changes of brain slices after ICA occlusion and reperfusion
Nissl染色的主要目的是显示脑片的神经元变化。结果显示(图5),对照组(假手术组)动物切片上可见神经元形态正常,胞质内Nissl体明显,细胞核大,轮廓平滑,染色质疏松,核仁清晰。ICA阻塞4周,脑切片上出现了数个损伤神经元,表现为核固缩浓染,胞体萎缩变形,且有神经元丢失后遗留的空泡。ICA再通后8周,存活神经元形态正常,有散在的固缩细胞核和空泡。

图5 大鼠颈内动脉阻塞及再通后脑组织的Nissl染色Fig.5 Nissl staining of brain slices after ICA occlusion and reperfusion
2.4 利用Fluoro-Jade C染色法特异性标记脑片中正在发生变性的神经元在荧光显微镜下,Fluoro-Jade C染色阳性细胞呈绿色荧光,损伤神经元的胞体和突起均清晰可见,但已经死亡神经元及其他细胞不能被标记。本研究显示,假手术组动物的脑切片上未见标记的染色阳性神经元;ICA阻塞4周后,切片上可见到Fluoro-Jade C阳性神经元,其数量为(11.5 ±2.2)个/视野;ICA再通8周后,脑片上的阳性细胞数显著降低为(3.2±1.1)个/视野(图6)。

图6 大鼠颈内动脉阻塞及再通后脑组织的Fluoro-Jade C染色Fig.6 Fluoro-Jade C staining of brain slices after ICA occlusion and reperfusion
2.5 双侧颈内动脉阻塞及再通后脑组织Bcl-2及Caspase 3的表达变化Bcl-2和Caspase 3是细胞内两种重要的抗凋亡基因,其在细胞内表达或含量的变化与损伤后神经元存活与凋亡有着密切的关系。本研究利用Western blot方法,显示了颈内动脉阻塞及再通后脑组织内Bcl-2和Caspase 3在蛋白水平的变化。结果显示,ICA阻塞后,Bcl-2表达显著降低,与对照组相比,P<0.05,与颈内动脉阻塞4周组相比,P<0.05,ICA再通后,Bcl-2显著上调(图7)。同样,其下游分子Caspase 3的含量与对照组相比,P<0.05,与颈内动脉阻塞4周组相比,P<0.05。ICA再通后,Caspase 3显著上调(图8)。

图7 Western blot显示大鼠颈内动脉阻塞及再通后脑内Bcl-2表达的变化Fig.7 The expression of Bcl-2 protein detected by Western blot after ICA occlusion and reperfusion in rats

图8 Western blot显示大鼠颈内动脉阻塞及再通后脑内Caspase 3表达的变化Fig.8 The expression of Caspase 3 protein detected by Western blot after ICA occlusion and reperfusion in rats
3 讨 论
慢性脑缺血的动物模型常用的方法是双侧颈动脉结扎,两血管法(2-vessels occlusion,2VO)慢性脑缺血模型最早是由TORTE等建立,该模型通过结扎大鼠双侧颈总动脉,阻断了双侧颈内动脉的血流,使脑血流量降低52%~64%,造成大脑的慢性低灌注状态[8-9]。本研究为观察颈内动脉血流恢复后大鼠的神经功能及脑组织病理变化,将上述方法改良为经颈外动脉向颈内动脉内放置线栓的方法,阻断颈内动脉血流;再通过二次手术经颈外动脉取出栓线的方法恢复颈内动脉血流,与DUAN等[7]的方法相比,血流再通的成功率大大提高,解决了因长期结扎颈总动脉后引起血管闭塞而不能再通的问题;与结扎颈总动脉然后再吻合血管的方法相比,手术操作难度显著降低。因此,本模型可作为研究慢性脑缺血后血流再通的理想工具。
既往研究表明[8-10],阻断大鼠双侧颈内动脉血流后,最初并没有表现出明显的脑结构和功能损伤,随着缺血时间的延长,在缺血后2周逐渐出现不同程度的神经功能障碍,在缺血后4~6周,在脑组织切片上就可以观察到明显的神经元损伤。我们的研究结果表明,缺血4周大鼠的神经功能缺陷评分显著降低,Morris水迷宫的逃避潜伏期显著延长,脑组织切片上也出现了明显的变性和坏死神经元。在荧光显微镜下,Fluoro-Jade C染色阳性细胞呈绿色荧光,损伤神经元的胞体和突起均清晰可见,但已经死亡神经元及其他细胞不能被标记;ICA阻塞4周后,切片上可见到Fluoro-Jade C阳性神经元,ICA再通8周后,脑片上的阳性细胞数显著降低,提示再通可明显减少神经元变性。这些与文献报道的结果基本一致[11-15],也证实慢性脑缺血随着缺血时间的延长,会造成实验动物行为学的异常和神经元的变性改变。
在本实验中,作为一种治疗手段,我们在阻断颈内动脉血流4周后恢复了脑血流。脑血流的恢复可能会带来两方面的影响。一方面,有利于脑能量和物质代谢功能的恢复,从而改善慢性脑缺血状态,恢复脑功能;另一方面,也可能造成脑的再灌注损伤,加重脑损伤。因此,我们进一步观察了脑血流恢复后不同时间脑结构和神经功能的变化。结果表明,慢性脑缺血大鼠脑血流的有效恢复可显著促进大鼠感觉运动功能和空间认知障碍的改善,提示慢性脑缺血后脑血流恢复能够有效逆转脑功能障碍,有利于神经功能恢复。我们的研究也提示,由于神经元不具备再生能力,脑血流的恢复不能逆转脑组织结构的损伤,血流恢复后神经功能的改善更多地是由于减少了神经元的损伤和丢失,而脑内其他正常神经元进行了有效的功能代偿。说明恢复正常血流可明显改善患者慢性脑缺血所造成的神经元的损伤,减少神经元细胞的凋亡速度。
总之,双侧颈内动脉血流阻断能造成慢性脑缺血,引起神经元变性和死亡,导致大鼠感觉运动及空间学习记忆功能的损害。脑血流的恢复能促进抗凋亡基因Bcl2和Caspase 3的表达,从而逆转了慢性缺血对脑组织的损害,减缓了神经元的变性和丢失,有利于大鼠感觉运动和空间认知功能的恢复。
[1]丁建平,王拥军,华扬,等.缺血性脑血管病患者颅内外动脉狭窄发生率的对比研究[J].中华外科杂志,2002,40(12):9-11.
[2]CHIMOWITZ MI,KOKKINOS J,STRONGE J,et al.Stenting versus aggressive medical therapy for intracranial arterial stenosis[J].N Engl J Med,2011,365(11):993-1003.
[3]DERDENYN CP,CHIMOWITZ MI,LYNN M,et al.Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis(SAMMPRIS):the final Results of a randomized trail[J].N Engl J Med,2013,223 (10):787-793.
[4]BECK J,STUMMER W,LEHMBERG J,et al.Activation of leukocyte-endothelial interactions and reduction of selective neuronal death after global cerebral ischemia[J].Neurosci Lett,2007,414(2):159-164.
[5]王莲,刘永红,魏玲.Fluoro-Jade C染色在小鼠匹罗卡品癫痫模型中的应用[J].中华神经外科疾病研究杂志,2012,1(3)216-220.
[6]EHARA A,UEDA S.Application of Fluoro-Jade C in acute and chronic neurodegeneration models:utilities and staining differences[J].Acta Histochem Cytochem,2009,42(6):171-179.
[7]DUAN W,ZHANG CQ,ZHENG J,et al.Relief of carotid stenosis improves impaired cognition in a rat model of chronic cerebral hypoperfusion[J].Acta Neurobiol Exp,2011,71:233-243.
[8]顾兵,程翔,金建波,等.脑缺血动物模型及其实验治疗学应用[J].中国临床药理学与治疗学,2010,15(9):1074-1080.
[9]TAOGOSHI T,NOMURA A,MURAKAMI T,et al.Transport of prostaglandin El across the mood-brain barrier in rats[J].J Pharm Pharmaco1,2005,57(1):6l-66.
[10]TORRE JC,FORTIN T,PARK GA,et al.Chronic cerebrovascular insufficiency induces dementia-like deficit in age rats[J].Brain Res,1992,582(2):186-195.
[11]BENNETT S,TENNISWOOD M,CHEN JH,et al.Chronic cerebral hypoperfusion elicits neuronal apoptosis and behavioral impairment[J].Neuro Report,1998,9:161-166.
[12]TOYRAN N,ZORLU F,DTINMEZ G,et al.Chronic hypoperfusion alters the content and structure of proteins and lipids of rat brain homogenates:a Fourier transform infrared spectroscopy study[J].Eur Biophys J,2004,33(6):549-554.
[13]YANG PB,CHEN XL,ZHAO JJ,et al.Effect of histamine on regional cerebral blood flow of the parietal lobe in rats[J]. Lasers Med Sci,2010,10(4):783-788.
[14]张沛琳,娄季宇,范波胜,等.环杷明对急性脑梗死大鼠血管再生的影响[J].西安交通大学学报:医学版,2013,34(3):357-360.
[15]MARKS MP,MARCELLUS ML.Intracranial angioplasty without stenting for symptomatic atherosclerotic stenosis:long-term followup[J].AJNR,2005,26(7):525-530.
(编辑 韩维栋)
Protective effects of internal carotid artery vascular recanalization on rats after chronic cerebral ischemia
HAN Jian-feng,HUO Kang,BAI Yan,YUAN Xing-yun,SONG Wen-feng,QU Qiu-min
(Department of Neurology,the First Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo establish the chronic cerebral ischemia animal model so as to prove that chronic cerebral vascular ischemia recanalization may improve cognitive function and decrease neuronal apoptosis in the animal model.MethodsThe rats underwent chronic cerebral ischemia by using external carotid artery embolic suture methods.All rats were evaluated for neurological deficit score.After blood flow restoration,spatial learning ability and spatial memory ability of the rats were evaluated by the Morris water maze test.The rat brain tissues were fixed and stained to observe pathological changes.The neuron numbers were compared between blocked and recanalization groups.HE staining and Nissl staining were used to observe the change in the number of neurons. Fluoro-Jade C staining was used to label the degenerating neurons on brain slices.The expressions of Bcl2 and Caspase 3 in rats pretreated with external carotid artery embolic sutureMethodswere observed for the neuronal degeneration and loss.ResultsBilateral carotid artery blocking could induce chronic cerebral ischemia which led to neuronal degeneration and death.Spatial learning ability and spatial memory ability in rats were damaged. Cerebral blood flow restoration could promote anti-apoptotic Bcl2 gene and Caspase 3 gene expression,thereby reversing the damage of chronic ischemia to brain tissue and slowing down the degeneration and loss of neurons. Carotid artery vascular recanalization in rats helped the recovery of movement and spatial cognitive function in rats.ConclusionChronic ischemic vascular recanalization may improve cognitive function and decrease neuronal apoptosis in the animal model.
chronic cerebral ischemia;cognitive function;neuronal apoptosis;Bcl-2;Caspase 3
R743.32
A
1671-8259(2014)05-0605-06
10.7652/jdyxb201405008
2014-02-27
2014-04-07
陕西省科技攻关项目(No.2011K12-05-12) Supported by the Science and Technology Project of Shaanxi Province(No.2011K12-05-12)
韩建峰(1972-),男(汉族),临床医学博士,主治医师.研究方向:脑血管病、脑血管介入治疗.E-mail:rabbit1110@163.com
时间:2014-07-22 18∶19 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1819.020.html
