HS-SPME-GC-MS分析石榴酒中易挥发性成分
2014-06-21李美萍苗潇潇张生万
李美萍,苗潇潇,张生万*
(山西大学生命科学学院,山西 太原 030006)
石榴系石榴科石榴属,落叶灌木或小乔木,又名安石榴、丹若、金婴、天浆等[1],果实富含糖类、氨基酸、维生素和矿物质等营养物质[2],有“天下奇果,九州名果”的美誉。在我国已有两千多年的栽培历史[3]。而石榴酒是以石榴为原料经破碎、榨汁、低温发酵、陈酿老熟而成的色泽金黄、清澈透明、口味酸饴、果香浓郁、酒体醇厚[4-5]的低度果酒,备受人们青睐。
石榴酒易挥发成分是构成和影响其风味、质量及典型性的主要因素。而石榴酒的成分复杂,对其组成分析时,需要进行分离、富集。固相微萃取(solid phase micro-extraction,SPME)技术由于其突出的优点成为目前国内外使用较多的对样品进行分离富集方法之一,已在环境、食品、生化、医学等领域得到广泛应用[6-8],且顶空固相微萃取-气质联用分析(head space-SPME-gas chromatography-mass spectrometry,HS-SPME-GCMS)技术是一种被用于分析各种酒中易挥发成分的常用方法[9-12]。目前,对石榴的研究主要是对其种质资源的评价和利用[13-15],而对其挥发性物质的研究也多为对石榴果实、石榴皮及石榴籽等方面[16-18],还未见对石榴酒挥发性成分的相关报道。本实验以石榴酒为研究对象,重点对HS-SPME条件进行选择,优化GC-MS分析条件,对石榴酒易挥发性成分进行定性和定量分析,旨在建立石榴酒中易挥发性成分的HS-SPME-GC-MS分析方法,为石榴酒香气特征研究、感官风味评价以及产品质量控制提供科学的理论依据。
1 材料与方法
1.1 材料、试剂与仪器
精品原浆石榴酒(酒精度10% 2012年1月14日生产)西安丹若尔石榴酒业有限责任公司。
NaCl(分析纯) 天津市光复科技发展有限公司。
50/30 μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS、85 μm PA固相微萃取头及萃取手柄美国Supelco公司;7890A-5975C气相色谱-质谱联用仪美国Agilent公司;DF-101S集热式恒温加热磁力搅拌器郑州长城科工贸有限公司。
1.2 方法
1.2.1 顶空固相微萃取的分离富集方法
准确移取8.0 mL酒样置于20 mL顶空瓶中,再按0.30 g/mL的质量浓度加入NaCl,然后用带有橡胶隔垫的瓶盖密封,放入集热式恒温加热磁力搅拌器中,在45 ℃搅拌平衡30 min,然后将50/30 μm DVB/CAR/PDMS微萃取头插入顶空瓶中距液面1 cm处,在45 ℃萃取50 min,待定性与定量分析。
1.2.2 GC-MS联用分析条件
GC条件:进样口温度250 ℃;载气He,流速1 mL/min;分流比20∶1;FFAP色谱柱(30 m×0.25 mm,0.25 μm);程序升温条件:33 ℃保持3 min,12 ℃/min升至60 ℃,6 ℃/min升至140 ℃,10 ℃/min升至230 ℃,保持5 min。
质谱条件:电子电离(electron ionization,EI)源;电子电离能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质量扫描范围m/z 22~500;质谱库为NIST 05;溶剂延迟4.5 min;扫描模式为全扫描。
1.2.3 定性与定量分析方法
在1.2.2节GC-MS联用分析条件下,将HS-SPME后的萃取头插入GC进样口,在进样口250 ℃解吸4 min,随后进行色谱扫描,再对每一组分的质谱图进行解析并与NIST 05质谱库对比,根据匹配度确定各易挥发性成分的结构,同时采用峰面积归一化法计算各组分的相对含量。
1.2.4 条件优化试验设计
1.2.4.1 单因素试验
选取对萃取效果有明显影响的因素,分别进行单因素试验,以物质出峰数目和总峰面积为主要考察指标,确定试验萃取头(50/30 μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS、85 μm PA)、萃取时间(20、30、40、50、60 min)、样品用量(4.0、6.0、8.0、10.0 mL)、加盐量(0.20、0.25、0.30、0.35 g/mL)、解吸时间(2、3、4、5 min)、平衡时间(10、20、30、40、50 min)、萃取温度(30、35、40、45、50 ℃)条件。考察其中单一因素条件时,固定其他因素条件如下:准确移取8.0 mL酒样4份置于20 mL顶空瓶中,再按0.30 g/mL的质量浓度加入NaCl,然后用带有橡胶隔垫的瓶盖密封,放入集热式恒温加热磁力搅拌器中,于40 ℃条件下搅拌平衡20 min,然后将50/30 μm DVB/CAR/PDMS萃取头插入相应顶空瓶距液面1 cm处,萃取吸附40 min、解吸3 min。
1.2.4.2 正交试验
对显著影响萃取效果的各因素进行正交试验,综合分析不同条件对挥发性成分分析的影响,并进行验证实验,最终确定HS-SPME-GC-MS分析石榴酒中易挥发性成分的分析条件。
2 结果与分析
2.1 HS-SPME条件的选择
2.1.1 萃取头的选择

表 1 不同萃取头对萃取效果的影响Table 1 Effect of different SPME fiber types on the extraction Table 1 Effect of different SPME fiber types on the extraction指标 萃取头50/30 μm DVB/CAR/PDMS 65 μm PDMS/DVB 75 μm CAR/PDMS 85 μm PA峰个数 58 48 35 17总峰面积 5.98×108 3.61×108 3.55×108 4.93×107
从表1可知,50/30 μm DVB/CAR/PDMS萃取头所得峰总面积和峰个数均为最大,故本实验选择该萃取头用于石榴酒易挥发性成分的分离富集。
2.1.2 萃取时间的选择
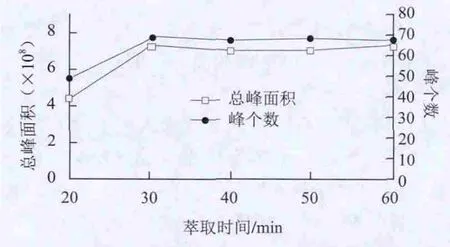
图 1 萃取时间对萃取效果的影响Fig.1 Effect of extraction times on the extraction
由图1可知,随着萃取时间的延长,萃取效果逐渐改善,但萃取时间达到30 min时萃取的化合物数量及总峰面积最大,且萃取时间继续增加其峰个数和总峰面积没有明显增大,所以选萃取时间为30 min。
2.1.3 样品用量的选择
由图2可知,样品用量为8.0 mL时,萃取的化合物相对数量较多,总峰面积也最大,故样品用量选为8.0 mL。
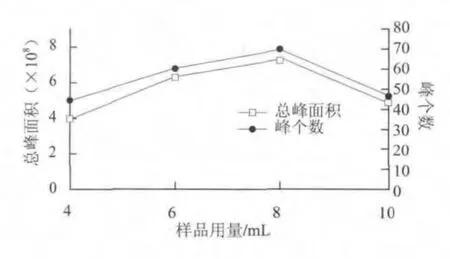
图 2 样品用量对萃取效果的影响Fig.2 Effect of amounts of sample on the extraction
2.1.4 加盐量的选择
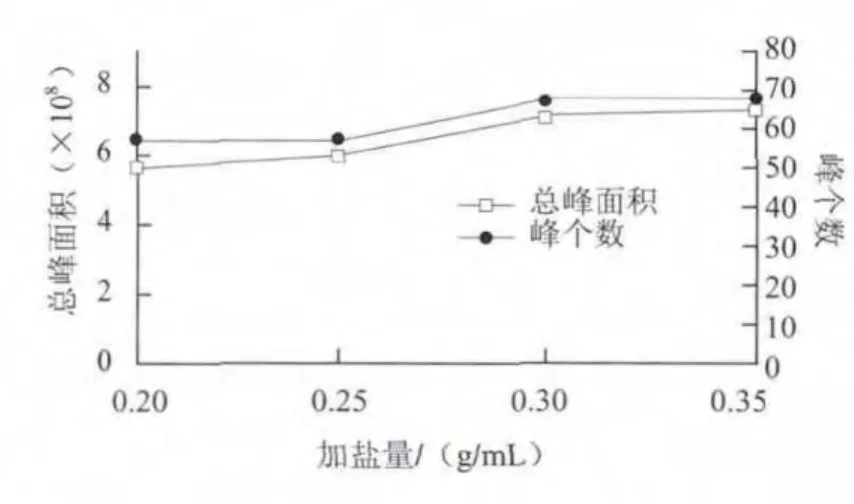
图 3 加盐量对萃取效果的影响Fig.3 Effect of amounts of added salt on the extraction
由图3可知,随着加盐量增加,挥发性物质的种类数和总峰面积都在增加,当加盐量为0.30 g/mL时,溶液达到饱和,再增大加盐量,萃取效果没有明显改善,故加盐量选为0.30 g/mL。
2.1.5 解吸时间的选择

图 4 解吸时间对测定结果的影响Fig.4 Effect of desorption times on the extraction
由图4可知,解吸时间为4 min时峰个数和总峰面积达到最大,再延长解吸时间没有明显地变化,故解吸时间选为4 min。
2.1.6 平衡时间的选择
由图5可知,在30 min时,萃取得到的挥发性物质种类数目和总峰面积相对较多,故平衡时间选为30 min。

图 5 平衡时间对萃取效果的影响Fig.5 Effect of equilibrium times on the extraction
2.1.7 萃取温度的选择
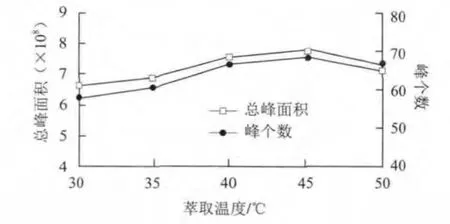
图 6 萃取温度对萃取效果的影响Fig.6 Effect of extraction temperatures on the extraction
由图6可知,萃取温度在45 ℃时萃取的化合物相对数量较多,总峰面积也较大,故萃取温度选为45 ℃。
2.1.8 正交试验
因解吸时间、平衡时间对萃取效果影响不明显,而加盐量为0.3 g/mL时,在萃取温度为45 ℃时已达到饱和,故加盐量选为0.30 g/mL。但萃取头种类、萃取时间、萃取温度及样品用量相互之间对萃取效果有较大的影响,所以在单因素试验的基础上,设计了如表2所示的四因素四水平的正交试验。正交试验结果与分析如表3、4所示。
从表4可知,当以峰面积为考察指标时,各因素对萃取效果影响的大小顺序为A>B>C>D,即萃取头种类影响最大,萃取时间次之,较优组合为A1B4C3D4;当以总峰个数为考察指标时,各因素对萃取效果影响的大小顺序为A>C>B>D,即萃取头种类>萃取时间>样品用量>萃取温度,较优组合为A1B4C3D3。由以上可知,萃取头种类对峰个数和总峰面积影响最大,50/30 μm DVB/CAR/PDMS萃取头效果最好;萃取时间和样品用量次之;萃取温度对峰个数和总峰面积也有一定影响。综合考虑,最终确定较优组合为A1B4C3D3,即选用50/30 μm DVB/CAR/PDMS萃取头,加盐量按0.30 g/mL的质量浓度,在45℃萃取50 min。将最终确定的较优组合与正交表中第3组试验结果进行比较验证,较优组合得到76个色谱峰,总峰面积为8.327×108,证明最终确定的较优组合效果更好。

表 2 正交试验因素与水平Table 2 Factors and coded levels used in orthogonal array design Table 2 Factors and coded levels used in orthogonal array design水平 因素A萃取头 B萃取时间/min C样品用量/mL D萃取温度/℃1 50/30 μm DVB/CAR /PDM 20 4.0 35 2 65 μm PDMS/DVB 30 6.0 40 3 75 μm CAR/PDMS 40 8.0 45 4 85 μm PA 50 10.0 50表 3 正交试验设计及结果Table 3 Results of orthogonal array experiments试验号 A B C D 空列 峰个数 总峰面积1 1 1 1 1 1 53 6.050×108 2 1 2 2 2 2 57 6.628×108 3 1 3 3 3 3 63 8.245×108 4 1 4 4 4 4 61 7.864×108 5 2 1 2 3 4 47 4.346×108 6 2 2 1 4 3 43 5.317×108 7 2 3 4 1 2 50 5.088×108 8 2 4 3 2 1 54 6.281×108 9 3 1 3 4 2 33 2.186×108 10 3 2 4 3 1 32 2.435×108 11 3 3 1 2 4 29 1.988×108 12 3 4 2 1 3 37 2.766×108 13 4 1 4 2 3 22 5.676×107 14 4 2 3 1 4 21 2.931×107 15 4 3 2 4 1 25 1.075×108 16 4 4 1 3 2 21 5.033×107表 4 正交试验对峰个数和总峰面积影响的极差分析Table 4 Range analysis for peak number and total peak area Table 4 Range analysis for peak number and total peak area指标 峰个数 总峰面积A B C D A B C D k1 59 38 36 40 7.197×1083.287×1083.465×1083.549×108 k2 49 38 42 40 5.258×1083.668×1083.704×1083.866×108 k3 33 42 43 41 2.344×1084.099×1084.251×1083.882×108 k4 23 43 41 40 6.099×1074.354×1083.989×1084.111×108 R 36 5 7 1 6.587×1081.066×1087.865×1075.617×107较优水平 A1 B4 C3 D3 A1 B4 C3 D4主次因素 A>C>B>D A>B>C>D
2.2 石榴酒易挥发成分分析
按1.2.1节HS-SPME分离富集方法所得样品,在GC-MS联用仪上,参照文献[16-17]及结合本课题组对白酒分析的经验[19],对色谱分离条件进行了选择,发现按实验方法的条件,被测酒样中易挥发成分能够得到很好的分离。其总离子流色谱图如图7所示,解析结果见表5。

图 7 石榴酒挥发性成分总离子流色谱图Fig.7 Total ion current chromatogram of the volatile components of pomegranate wine

表 5 HS-SPME-GC-MS分析石榴酒挥发性成分结果T able 5 HS-SPME-GC-MS analytical results of the volatile T able 5 HS-SPME-GC-MS analytical results of the volatile composition of pomegranate wine ne序号 保留时间 化合物 相对分子质量 匹配度/% 相对含量/%1 4.666 3-甲基-1-丙醇 74.07 81 0.75 2 5.008 乙酸-3-甲基正丁醇 130.10 90 0.31 3 5.481 1-丁醇 74.07 72 0.06 4 6.602 3-甲基正丁醇 88.09 83 19.37 5 7.032 己酸乙酯 144.12 95 1.76 6 7.445 苯乙烯 104.06 97 0.46 77.969 — — —0.22 8 8.021 3-羟基-2-丁酮 88 80 0.08 9 8.206 4-己烯酸乙酯 142.1 96 2.18 10 8.389 3-己烯酸乙酯 142.1 87 0.07 11 8.775 2-庚醇 116.12 78 0.15 12 9.246 2-羟基丙酸乙酯 118.06 78 0.44 13 9.429 1-己醇 102.1 83 0.64 14 10.046 3-己烯-1-醇 100.09 93 0.29 15 10.806 2-辛醇 130.14 80 0.05 16 11.093 辛酸乙酯 172.15 90 10.18 17 11.510 醋酸 60.02 91 2.57 18 11.830 糠醛 96.02 95 0.53 19 12.019 反-3,5-庚二烯-2-酮 110.07 90 0.18 20 12.099 2,4-己二烯酸乙酯* 140.08 96 0.22 21 12.234 2-乙基己醇 130.14 80 0.10 2212.458 — — —0.20 23 12.598 2,4-己二烯酸乙酯* 140.08 95 12.09 24 12.855 2-壬醇 144.15 72 0.40 25 13.910 苯甲醛 106.04 95 0.14 26 13.161 壬酸乙酯 186.29 96 0.06 27 13.282 2,3-丁二醇* 90.07 90 0.55 28 13.430 3,7-二甲基-1,6-辛二烯-3-醇 154.14 49 0.18 29 13.612 1-辛醇 130.14 91 0.12 30 13.874 2-甲基丙酸 88.05 72 0.13 31 14.046 2,3-丁二醇* 90.07 80 0.07 32 14.386 4-甲基-1-异丙基-3-环己烯醇 154.14 89 0.08 33 14.962 2-糠酸乙酯 140.05 90 0.08 34 15.214 癸酸乙酯 200.18 95 1.47 35 15.643 1-壬醇 144.15 86 0.14 36 15.720 苯甲酸乙酯 150.07 95 4.82 37 15.874 2-甲基丁酸 102.07 59 0.23 38 16.021 丁二酸二乙酯 174.09 91 1.07 39 16.233 9-癸烯酸乙酯 198.16 90 0.12 40 16.306 1-甲基-4-异丙醇-环己烯 154.14 90 0.35 41 16.726 2,2-二乙氧基-乙基苯 194.13 72 0.14 4217.067萘128.06810.05 43 17.253 2-甲基-5-丙烯基-环己酮 152.12 53 0.10 4417.316 — — —0.08 45 17.810 苯甲肟 151.06 83 0.28 46 18.025 苯乙酸乙酯 164.08 90 2.00 4718.208 — — —0.06 48 18.563 乙酸苯乙酯 164.08 83 0.86 49 19.154 己酸 116.08 83 0.72 50 19.643 苯甲醇 108.06 96 0.06 51 19.715 苯丙酸乙酯 178.1 97 0.11 5220.043 — — —0.05 53 20.159 苯乙醇 122.07 94 16.44 54 20.339 4-己烯酸 114.07 76 0.36 55 20.722 2-乙基己酸 144.12 86 0.07

续表5
采用HS-SPME-GC-MS联用技术分析石榴酒中的挥发性成分,只需少量的原料即可得到满意的结果。由表5可见,石榴酒挥发性成分的色谱图上共分离得到76 种化合物,确定结构67 种(包括4 种异构体),占石榴酒挥发性成分的99.39%。其中包括酯类化合物23 种(含量41.17%)、醇类化合物16 种(含量39.51%)、酸类化合物14 种(含量16.01%)、醛酮类化合物5 种(含量1.01%)以及酚类和其他化合物9 种(含量1.69%)。这些易挥发成分中相对含量在1%以上的主要是己酸乙酯、4-己烯酸乙酯、辛酸乙酯、2,4-己二烯酸乙酯、苯甲酸乙酯、苯乙酸乙酯、癸酸乙酯、丁二酸二乙酯、邻苯二甲酸异丙酯辛酯、3-甲基正丁醇、苯乙醇、醋酸、辛酸、苯甲酸、山梨酸等。
3 讨论与结论
3.1 在HS-SPME中,不同涂层的萃取头所吸附的挥发性物质的种类和含量各不相同,欲使固相微萃取纤维头形成最大吸附效果,需要在顶空瓶内达到吸附与解吸的动态平衡,同时样品用量的多少、液面上部空间的大小、微萃取头可承载量、加盐量、样品的平衡时间、萃取温度等因素会直接影响挥发性成分的萃取效果。如果取样量小,含量低的物质检测不到;取样量太大,由于分子间的竞争吸附以及与吸附剂亲和力强、易挥发的物质超载,导致被吸附的化合物种类反而会减少。对于在样品中加入适量盐,是由于大部分有机物因盐析效应会降低其在水中的溶解度,从而有利于有机物的溢出,增大溶液上部空间的压强,促进萃取头吸附平衡正移动,提高挥发性物质的吸附量。而萃取温度则能有效地影响萃取头吸附挥发性物质的种类数和总含量,随着温度的升高,一方面某些低温条件下不挥发的半挥发性物质会挥发,另一方面萃取头上的挥发性物质浓度也会增加,并在一定温度条件下达到平衡,此时达到萃取头的最大吸附量;但升高温度也会增加萃取头固有组分的解吸,从而降低萃取头萃取分析的能力。同时,HS-SPME-GCMS方法分析石榴酒中易挥发性成分还受色谱柱、样品在GC进样口的解吸时间、温度、进样方式的影响。挥发性物质在高温条件下有利于解吸,但也可能会使一些挥发性物质发生反应,故需适宜的解吸时间;色谱柱和进样方式会影响到物质的分离效果及峰形。通过本实验方案,得出利用HS-SPME-GC-MS分析石榴酒易挥发性成分的较优条件:FFAP色谱柱、50/30 μm DVB/CAR/PDMS萃取头、样品用量8.0 mL/20.0 mL样品瓶、加盐量0.30 g/mL、萃取时间50 min、萃取温度45 ℃、平衡时间30 min、解吸时间4 min。
3.2 在本实验选定的测定条件下,利用HS-SPME-GCMS方法分离鉴定石榴酒中易挥发性成分,共得到76 种化合物,确定结的67 种,其含量占总挥发性成分总量的99.39%。其中含量和种类最多的依次是酯类、醇类和酸类。石榴经发酵酿酒后,酸类及酯类化合物含量增大,醛酮类化合物含量减少。而前者对石榴酒的香气有较大的影响,如辛酸呈水果香气,辛酸乙酯有清凉的水果香味[20],己酸乙酯有强烈的果香和酒香香气[20],苯乙酸乙酯有显著而甜蜜的玫瑰花香和似蜂蜜气味,癸酸乙酯有椰子香味等。而苯乙醇是果酒发酵中酵母的代谢产物,质量浓度合适就会给酒体带来宜人的果香和花香[21],石榴酒中这些挥发性成分赋予该酒酒香、果香,并与花香搭配协调,共同构成其风味。但是由于每种香气物质对石榴酒香气的贡献,除了与该物质的含量有关外,还与该物质的感官阈值及各物质之间的相互影响有关。这些分析有待进一步开展工作研究。
[1]熊亚, 李敏杰, 覃懿. 石榴酒发酵生产工艺及褐变研究[J]. 食品工业科技, 2013, 34(9): 179-182.
[2]SEYED H M, MAJID R. Seasonal. Changes of mineral nutrients and phenolics in pomegranate (Punicagranatum L.)fruit[J]. Scientia Horticulturae, 2007, 111(2): 120-127.
[3]汪小飞, 向其柏, 尤传楷. 石榴品种分类研究进展[J]. 果树学报,2007, 24(1): 94-97.
[4]孙小波, 花旭斌, 林巧, 等. 不同澄清剂澄清石榴酒效果的比较[J].中国酿造, 2009, 28(4): 109-111.
[5]濮智颖, 翟文俊, 杨春霞, 等. 全发酵石榴酒的营养价值和保健作用[J].食品科技, 2007, 32(8): 278-281.
[6]司波, 陈野. 固相微萃取技术及其在食品分析上的作用[J]. 中国酿造, 2012, 31(11): 4-7.
[7]李鑫, 刘登勇, 李亮, 等. SPME-GC-MS法分析金华火腿风味物质的条件优化[J]. 食品科学, 2014, 35(4): 122-126.
[8]陈明, 阴永光, 邰超, 等. 顶空固相微萃取-气相色谱-质谱联用快速测定环境水样中的硝基苯、苯和苯胺[J]. 科学通报, 2006, 51(11):1359-1362.
[9]张明霞, 赵旭娜, 杨天佑, 等. 顶空固相微萃取分析白酒香气物质的条件优化[J]. 食品科学, 2011, 32(12): 49-53.
[10]张妮, 肖作兵, 于海燕, 等. 顶空固相微萃取-气质联用测定樱桃酒中的挥发性成分[J]. 食品科学, 2011, 32(10): 97-102.
[11]RIU-AUMATELL M, MIR P, SERRA-CAYUELA A, et al.Assessment of the aroma profiles of low-alcohol beers using HSSPME-GC-MS[J]. Food Research International, 2014, 57(3): 196-202.
[12]游义琳, 王秀芹, 战吉宬, 等. HS-SPME-GC/MS方法在白兰地香气成分分析中的应用研究[J]. 中外葡萄与葡萄酒, 2008(6): 8-13.
[13]吴中军, 夏晶晖. 成熟期石榴果实营养成分的变化[J]. 果树学报,2001, 18(5): 308-309.
[14]吴中军. 不同套袋条件对石榴品质的影响[J]. 湖南农业科技通讯,2004, 5(2): 17-19.
[15]巩雪梅, 张水明, 宋丰顺, 等. 中国石榴品种资源经济性状研究[J].植物遗传资源学报, 2004, 5(1): 17-21.
[16]苑兆和, 尹燕雷, 李自峰, 等. 石榴果实香气物质的研究[J]. 林业科学, 2008, 44(1): 65-69.
[17]马锞, 陈思嫦, 张瑞萍, 等. 不同发育阶段番石榴果实中挥发物成分变化[J]. 热带作物学报, 2011, 32(2): 320-323.
[18]吴佳. 疆和田石榴化学成分的提取与研究[D]. 乌鲁木齐: 新疆大学, 2011.
[19]MA Yanhong, QIAO Hua, WANG Wei, et al. Variations in physicochemical properties of chinese fenjiu during storage and highgravity technology of liquor aging[J]. International Journal of Food Properties, 2014, 17(4): 923-936.
[20]李志斌, 李净. 浓香型白酒中辛酸乙酯含量及其风味贡献分析[J].酿酒科技, 2013(4): 65-67.
[21]宋柬, 李德美, 邓小明, 等. 京白梨酒发酵与香气分析[J]. 农业机械学报, 2012, 43(6): 133-138.
