基于信号增敏型试纸条三聚氰胺超灵敏检测方法
2014-06-21钟友好赵弟萍朱梦雅
钟友好,赵弟萍,薛 峰,朱梦雅,方 威,陈 伟*
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
2008年8月我国发生了三聚氰胺问题奶粉事件,截至2008年8月27日全国已累计筛查婴幼儿2 238.4万人次,累计报告泌尿系统出现异常的患儿29.4万 人,其中甘肃省食用三聚氰胺污染奶粉泌尿系统结石患病率高达8.96%[1],安徽省人民医院统计泌尿系统结石患病率为7.97%[2],“毒奶粉”事件将三聚氰胺这一化学名词带入普通民众实际生活中,一时大家谈“奶粉”色变。
三聚氰胺化学名1,3,5-三嗪-2,4,6-三胺,是一种三嗪类含氮杂环有机化合物,重要氮杂环有机化工原料[3],主要用作生产三聚氰胺甲醛树脂的原料还可作为甲醛清洁剂、减水剂、阻燃剂等[4]。 目前所使用的“凯氏定氮法”[5]存在着无法测出氮来源的缺陷。通过添加三聚氰胺会使以凯氏定氮法测定的蛋白质虚涨,因而三聚氰胺常被不法商人用作添加剂,以提升蛋白质含量指标[6]。三聚氰胺毒性轻微,但人体长期摄入,尤其是婴幼儿,会造成生殖、泌尿系统的损害,膀胱、肾部结石,并可进一步诱发膀胱癌[7]。目前三聚氰胺的检测已成为乳制品检测中的一项必检项目。
金纳米粒子也称为胶体金,是指一种分散相粒径在1~150 nm之间的金溶液,属于多相不均匀体系,其颜色随粒径大小不同从而呈现出由橘红色到紫红色的变化。胶体金在药物小分子检测、抗原抗体标记、分子生物学和化学反应催化等方面得到了广泛的应用[8]。金纳米粒子常用于标记特定的抗原抗体制备出的胶体金标记物从而开发出被分析物的快速免疫检测的方法,如胶体金免疫层析法。
胶体金免疫层析(gold immunochromatography assay,GICA)是20世纪90年代出现的一种快速检测技术,是一种将胶体金标记技术、免疫检测技术和层析分析技术等多种方法有机结合起来的一种固相标记免疫检测技术[9],其原理是:将特异性的抗原或抗体固定于硝酸纤维素(nitrocellulose,NC)膜等固相载体的一端,而后将此端浸入待检样品溶液中,然后以NC膜为载体,利用微孔膜的毛细管作用,使滴加在膜一端的液体慢慢向膜的另一端渗移,在此迁移过程中,各种免疫反应试剂进行特异性结合,最后通过目测胶体金标记物的显色情况从而到达目标物的检测,并且胶体金可与抗体分子形成较牢固的结合物,并且不影响抗体的生物特性[10]。与其他免疫分析方法相比,GICA具有不需要专用仪器、检测速度快、操作简单方便、可长期保存实验结果、易于实现现场检测等优点,主要作为定性或半定量筛选检测手段[11-12]。目前,GICA法已经广泛应用于各种毒素,生物大分子和抗生素的检测[13-15]。梅占龙等[16]成功建立利用胶体金免疫层析试纸条对塑料水杯中双酚A的快速超灵敏检测方法。
1 材料与方法
1.1 材料与试剂
99.9%三聚氰胺(化学纯)、柠檬酸三钠(分析纯)、磷酸氢二钠(分析纯)、磷酸二氢钠(分析纯)、甘氨酸(Gly)、赖氨酸(Lys) 国药集团化学试剂有限公司;牛血清白蛋白(bovine serum albumin,BSA,纯度大于98%)、人血清白蛋白(human serum albumin,HSA) 北京拜尔迪生物科技公司;氯金酸百灵威科技有限公司;硝酸纤维素膜(NC膜)、玻璃纤维膜、吸水垫、聚氯乙烯(polyvinyl chloride,PVC)底板 上海金标生物科技有限公司;三聚氰胺人工抗原、羊抗鼠二抗、三聚氰胺人工抗原小鼠腹水单克隆抗体、BSA抗体均由江苏省出入境检验检疫局提供。
1.2 仪器与设备
Heraeus Fresco 17高速冷冻离心机 美国赛默飞科技公司;2802 UV/Vis紫外分光光度计 山东宝莱科技股份有限公司;XYZ3000金标点样仪、CM4000金标切条机美国Bio-Dot公司。
1.3 方法
1.3.1 胶体金的制备与鉴定
本实验中所使用的胶体金采用柠檬酸三钠还原法[17]制备。取250 mL锥形瓶先用水洗干净,再用王水浸泡24 h后洗净烘干备用。锥心瓶中加入50 mL质量浓度为0.1 g/L的氯金酸溶液,加双蒸水置50 mL放于磁力搅拌器上加热至沸腾。维持1 300 r/min的搅拌转速不变,迅速加入一定体积的质量浓度为10 g/L的柠檬酸三钠溶液[18]。溶液的颜色在2 min内发生明显变化,至颜色不变后继续加热煮沸5 min。冷却后加双蒸水补至50 mL,放在0~4 ℃条件下保存待用。不同的金纳米粒子粒径所用的柠檬酸三钠量的关系及颜色如表1所示。

注:本实验中所用为理论粒径25 nm的胶体金颗粒。
通过紫外-可见分光光度计扫描胶体金在350~850 nm处的吸光度,获得胶体金紫外吸收光谱,测得最大吸收波长[19]。30 d后再进行颜色和吸收光谱确证。
1.3.2 胶体金-三聚氰胺单克隆抗体复合物的制备
1.3.2.1 常规标记与重悬纯化
用0.1 mol/L K2CO3溶液将制得的胶体金溶液pH值调至8.0,然后加入一定量的三聚氰胺抗体,在室温条件下孵育1 h后再向其中加入100 μL质量分数为10% BSA溶液 ,混合溶液再继续反应30 min后即得到胶体金-三聚氰胺单克隆抗体复合物。将复合物于4 ℃,9 500 r/min离心7 min,移去上清液,沉淀用重悬液重悬,即制成胶体金-三聚氰胺单克隆抗体复合物浓缩液。
1.3.2.2 增敏标记与重悬纯化
向1 mL已调pH值的胶体金中加入10 μL抗BSA抗体,混匀静置1 h,之后加入80 μL质量分数10%的人血清白蛋白,混匀静置30 min。在4 ℃,9 500 r/min离心7 min,移去上清液,沉淀物用重悬液进行重悬,即制成增敏标记复合物浓缩液。
1.3.3 试纸条原料的预处理
1)将作为结合垫的玻璃纤维膜置于金标垫预处理液中浸泡2 h,取出放于37 ℃烘干后切成4 mm×5 mm,将6 μL胶体金-三聚氰胺单克隆抗体复合物滴加在金标垫上,于25 ℃干燥完成后放于4 ℃条件下保存;2)样品垫在样品垫预处理液中浸泡2 h后取出于37 ℃条件下烘干待用;3)将不同浓度的三聚氰胺人工抗原和羊抗鼠二抗用喷膜仪包被在NC膜上,形成间隔5 mm的检测线(test line,T线)和质控线(control line,C线),37 ℃条件下烘干3 h,取出置于4 ℃避光干燥保存。
1.3.4 三聚氰胺检测试纸条的组装
上述已处理过的样品垫、NC膜、吸水垫按顺序分别粘贴在PVC底板上,用切条机切成4 mm宽的条状,置于4 ℃避光干燥贮存。如图1所示,结合垫和增强垫组装在试纸条上完成试纸条的全部组装步骤,便可用于检测。此外,为了保证实验过程中结果的可重复性,在制备半成品试纸条、识别垫及增强垫时数目可达上百,之后用铝箔纸封闭置于恒温恒湿环境中贮存备用。

图 1 增敏型免疫层析试纸条结构图Fig.1 Structure of the enhanced sensitivity test strip
1.3.5 试纸条结果判定标准在T线和C线处均出现红色线条判定为阴性;T线处出现浅红色线条判定为弱阳性;T线处未出现线条,C线处出现红色或浅红色线条判定为阳性;C线处未出现线条,无论T线是否出现线条,均判定为检测无效。
1.3.6 试纸条的优化
1.3.6.1 抗体加入量在同样体积已调pH值胶体金溶液中加入不同体积的三聚氰胺单克隆抗体,实验设计见表2。

表 2 复合物偶联抗体加入量实验设计Table 2 Experimental design for the amount of complex coupled antibody Table 2 Experimental design for the amount of complex coupled antibody序号 胶体金溶液/mL 三聚氰胺单克隆抗体/μL 1 1 4 2 1 6 3 1 8 4 1 10 5 1 12 6 1 14
1.3.6.2 反应体系的优化
采用了超纯水、磷酸缓冲溶液(10 mmol/L,pH 7.4)两种反应体系。将三聚氰胺标准溶液分别用这两种溶液配制成100 μg/L的标准液,用于试纸条检测,观察记录T、C线的显色强度和显色稳定时间。
1.3.6.3 金标垫上复合物滴加量
在4 mm×5 mm的金标垫上分别滴加3、4、5、6、7 μL的偶联复合物,干燥待用。
该优化实验中所用三聚氰胺样品均为用10%乙醇溶液助溶的三聚氰胺标准样品液,样品液质量浓度梯度为0、10、50、100、500、1 000 μg/L,5、10、50、100、500、1 000 mg/L。
1.3.7 试纸条特异性实验
将含氨基有机化合物Gly、Lys、4-ATP和d-NTP分别用PBS缓冲溶液配制成质量浓度为1 mg/L溶液,用质量浓度为50 μg/L的三聚氰胺标准样品和PBS缓冲溶液作为对照组,用试纸条检测,观察试纸条显色情况。
1.3.8 食品样品中三聚氰胺残留检测
1)从超市购入新鲜牛奶经液相色谱确证阴性后,取10 mL牛奶加入不同量的三聚氰胺标准样品使牛奶中三聚氰胺添加量达到500、200、100、50 μg/L,编号为食品样品1、2、3、4;2)取新鲜牛奶样品为食品样品5,作为空白对照。加入标样处理1 h后,在4 ℃、4 000 r/min离心15 min,除去上层脂肪即可用于检测[20];3)样品检测:在三聚氰胺胶体金试纸条样品垫上滴加样品80 μL,反应5~10 min后,读取并判定结果。每个样品重复3 次。
2 结果与分析
2.1 胶体金的评价与鉴定
通过肉眼观察,制备的胶体金溶液呈现透亮无杂质的酒红色,符合25 nm粒径的胶体金溶液颜色特征,扫描350~850 nm波长范围吸光度,结果如图2所示。可以看出25 nm胶体金溶液在520 nm左右有特征峰,峰形尖锐平滑,说明制得的胶体金粒径均一,形状规则。为了进一步验证实验中所制备的胶体金的稳定性,将制备的胶体金取出一部分后贮存用于4 ℃条件下检验其稳定性。胶体金存放30 d后的紫外图谱,与现制胶体金紫外图谱基本一致,表明所制胶体金稳定性比较好。
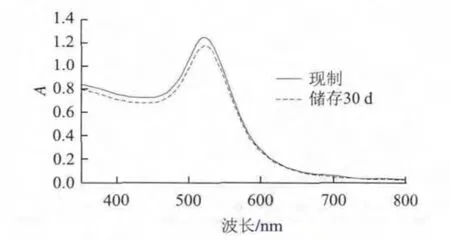
图 2 25 nm现制胶体金溶液与储存30 d后紫外-可见吸收光谱图Fig.2 UV-visible spectrum of synthesized 25 nm gold nanoparticles after being stored for 30 d
2.2 实验参数的优化
2.2.1 抗体加入量对检测结果的影响
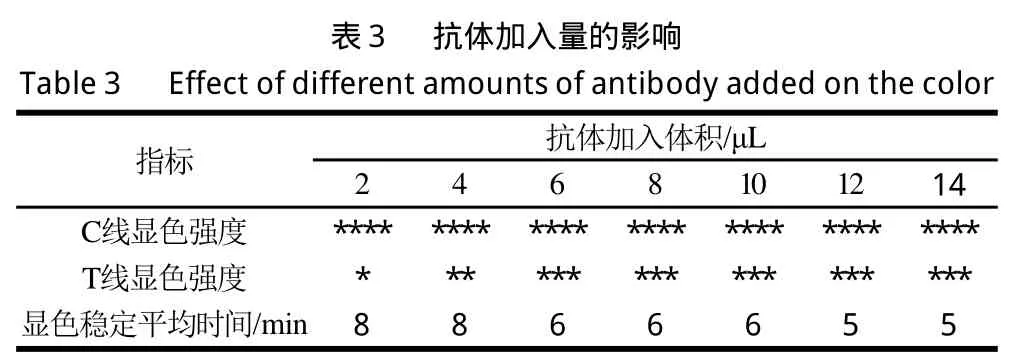
注:*.数量多少表示显色的深浅程度。下同。
从表3可见,C线显色强度稳定能够有效;T线显色程度先随着抗体加入体积的增加而增加,6 μL后显色强度趋于稳定。根据免疫层析试纸条检测原理,在试纸条上抗体-包被原结合部位的金颗粒达到一定数量(107粒/mm2)时,肉眼即可观察到红色斑点或线条的出现[21]。经分析这种显色变化是由于胶体金上抗体和包被原之间反应的饱和性导致,2 μL和4 μL组是由于加入抗体较少,三聚氰胺大量与抗体结合,使能够与T线处包被原充分接触反应的抗体减少导致在T线处捕获固定的金纳米颗粒较少,影响了线条出现产生不同的显色强度;而6 μL组能够满足抗原与抗体之间的充分接触反应达到饱和,T线处包被原全部与抗体发生反应,大量的金纳米粒子聚集使显色强度增加,8、10、12 μL组的抗体已处于过饱和状态,过量标记过的抗体随着毛细作用流向吸水垫,因而与6 μL组显色相近。因此从经济性和有效性考虑选择6 μL为抗体最适加入量。
2.2.2 反应体系对试纸条检测的影响

表 4 上样缓冲液体系的影响Table 4 Impact of sample buffer systems on the color reaction Table 4 Impact of sample buffer systems on the color reaction指标 反应体系超纯水 磷酸缓冲溶液显色强度 *** ****显色稳定平均时间/min 8 5
从表4可以看出,磷酸缓冲液组的显色强度与超纯水组相比更强,而且达到显色稳定所需时间短,是因为磷酸缓冲溶液能够为抗原抗体反应提供更好的pH值,使整个免疫反应在一个稳定适合的体系中进行,因而显色效果要优于超纯水体系,并且加快了反应速度,因此选择磷酸缓冲溶液作为后续实验反应体系。
2.2.3 结合垫上滴加量对结果的影响

表 5 结合垫上滴加量对试纸条检测结果的影响Table 5 Effect of different quantities of pad added on test strip Table 5 Effect of different quantities of pad added on test strip指标 结合垫滴加量/μL 3 4 5 6 7 C线显色强度 *** *** *** *** ***T线显色强度 * ** *** **** ****显色稳定平均时间/min 11 10 8 6 5
由表5可知,随着金标垫上胶体金与抗体偶联物量的增加,T线显色强度逐渐增强,C线强度稳定,并且达到显色稳定所需时间短。当金标垫滴加量为6 μL和7 μL时T线显色效果都很好且7 μL组显色稳定所需时间更短,所以选择金标垫滴加量为7 μL作为后续实验滴加量。
2.3 传统型试纸条和增敏型试纸条检测灵敏度

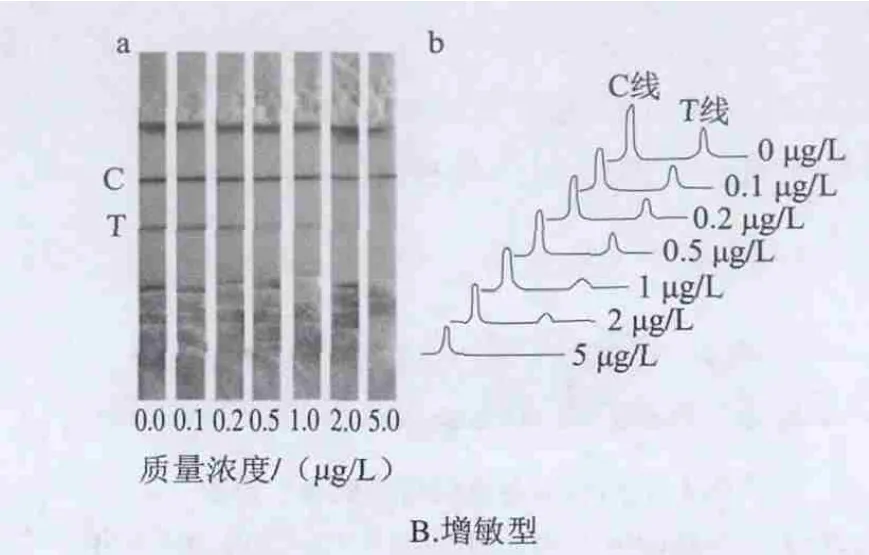
图 3 传统型和增敏型试纸条对比Fig.3 Comparison of sensitivity between the traditional and the enhanced strips
从图3A可知,传统型试纸条在0~10 μg/L范围随着检测物质量浓度的增加,试纸条T线显色逐渐减弱,减弱趋势与三聚氰胺质量浓度呈现负相关。10 μg/L时T线减弱十分明显;随着三聚氰胺质量浓度的增加,C线峰面积基本不变,T线随着质量浓度增加峰面积逐渐减小。
从图3B可知,增敏型试纸条在0~5 μg/L范围内随着三聚氰胺质量浓度增加C线显色清晰,显色强度强、颜色深、背景轻,这是因为增强垫上胶体金表面偶联的抗BSA抗体可与C线表面捕获的胶体金表面的BSA相结合,使C线处固定的胶体金增多,因而增敏后C线显色明显增强,线显色逐渐减弱,灵敏度明显提高,当三聚氰胺质量浓度达到0.5 μg/L时T线减弱已很明显,因此可将其作为增敏型试纸条肉眼的最低检测限;对于C、T检测线结果的灰度扫描结果与C线的峰面积基本一致,T线峰面积呈现一定的线性减弱趋势。
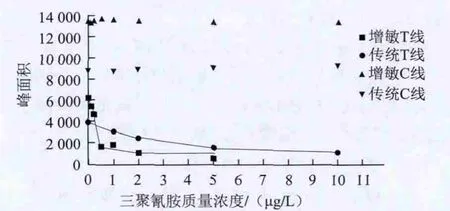
图 4 传统型和增敏型试纸条灰度扫描C、T线峰面积曲线Fig.4 Grayscale scanning peak areas of C and T lines for the traditional and the enhanced strips
对两种类型试纸条检测结果峰面积曲线的对比(图4)显示两种试纸条的C线峰面积均不随着三聚氰胺质量浓度增加而增加,基本保持一致,传统型试纸条T线在0~10 μg/L的线性较好,最低检测限为10 μg/L,而增敏型试纸条检测在0~0.5 μg/L存在比较好的线性,最低检测限为0.5 μg/L,相比传统型试纸条将检测限提高了20倍。
以上结果表明这种增敏方法对试纸条检测灵敏度具有较强的增敏效果,由此可见已成功建立一种基于胶体金免疫层析试纸条的三聚氰胺增敏检测新方法。
2.4 特异性实验
图5a显示:C线均显色清晰,强度好,试纸条背景干净;在检测质量浓度为50 μg/L的三聚氰胺样品时,T线基本消线,其他含氨基待检测物(Gly、Lys、4-ATP和dNTP质量浓度均为1 000 μg/L)以及上样缓冲液PBS都不能使T线减弱,说明除增敏型试纸条对三聚氰胺具有很高的特异性;图5b中对于试纸条检测线的灰度扫描结果也显示除三聚氰胺外其他含氨基物质均无法使T线消线;图5c中柱状图更直观的显示了这种方法检测特异性好,发生交叉反应率低。特异性实验结果表明含氨基类化合物无法与三聚氰胺单克隆抗体发生免疫反应,不能干扰检测结果,这种增敏的免疫层析检测方法具有优异的特异性。
2.5 食品样品中三聚氰胺残留检测
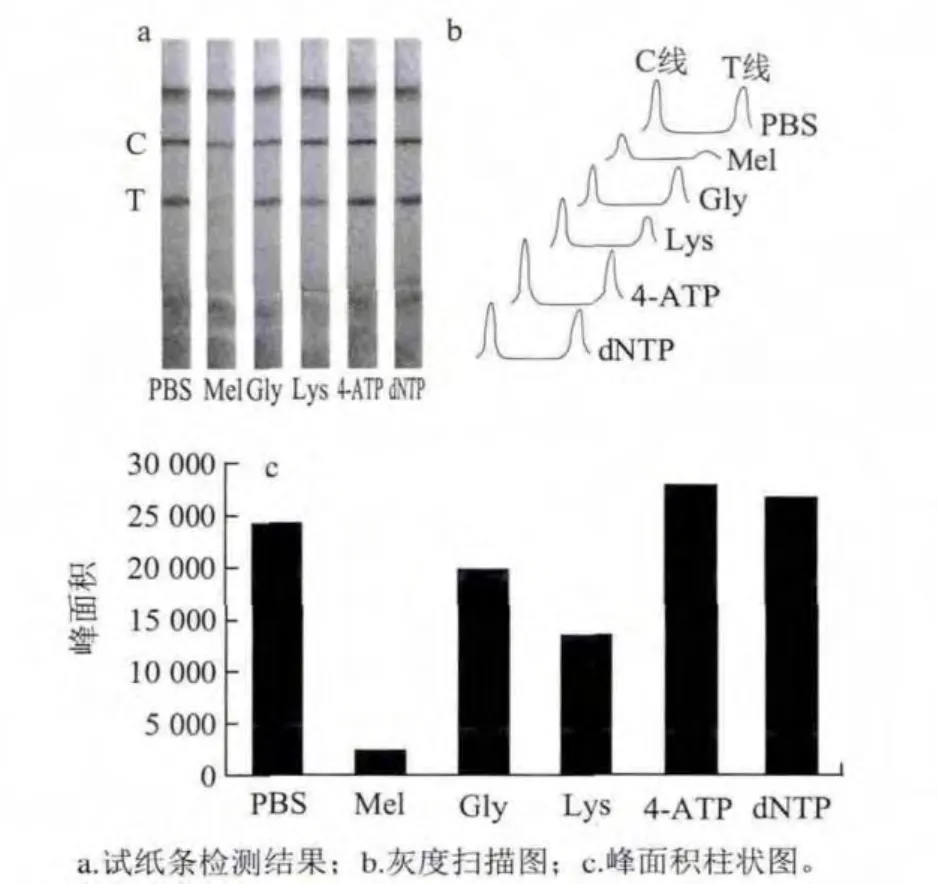
图 5 特异性实验Fig.5 Specificity testing
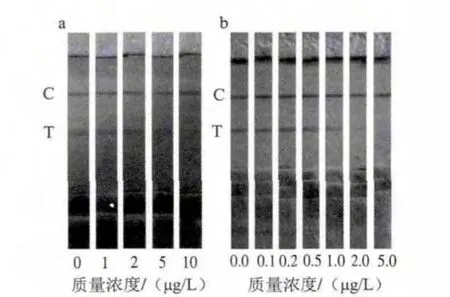
图 6 牛奶样品三聚氰胺检测结果Fig.6 Test results for melamine in milk samples
由图6a可知,随牛奶中三聚氰胺质量浓度(0、1、2、5、10 μg/L)的增加传统型试纸条T线显色逐渐减弱,符合T线强度与三聚氰胺质量浓度的负相关关系,C线显色强度一致,试纸条整体显色清晰背景干净,检测结果辨识度高,在三聚氰胺质量浓度为10 μg/L时T线完全消线,可见传统型试纸条对于实际样品最低检测限为10 μg/L;由图6b可知,增敏型试纸条对牛奶实际样品的检测,增敏型试纸条C、T线显色清晰,背景弱,T线显色随着牛奶中三聚氰胺质量浓度(0、0.1、0.2、0.5、1、2、5 μg/L)增加而逐渐减弱,在三聚氰胺质量浓度为2 μg/L时,传统试纸条T线无法消线,而增敏试纸条T线能够完全消线,可判定增敏型试纸条对于实际样品的最低检测限为2 μg/L。由于实际样品检测时,实际样品的pH值、盐离子以及其他杂质的影响,相比于实验条件下抗体的效价会有减弱,所以检测灵敏度提高效果不及标准样品实验条件下灵敏度提高的效果好,增敏效果略有减弱,因此相比于传统型试纸条检测这一结果灵敏度只提高了5 倍。这一检测结果远低于国家标准对于婴儿配方奶粉中三聚氰胺含量不得高于1 mg/kg、液态奶及成人奶粉中不高于2.5 mg/kg的规定[22],也远低于市面上快灵生物、德诺泰克、绿洲生化和华安麦科等公司所售试纸条对于奶粉及液态奶的1 000 μg/L的检测灵敏度,同时也表明这种新方法也适用于实际样品检测。
3 讨论与结论
胶体金免疫层析技术是以胶体金标记技术、免疫技术和层析技术为基础发展出来的一项快速检测技术[23]。由于其具有高效性、快速性、简便性,在现场筛查、高通量快速检测中得以广泛应用。本实验研发的三聚氰胺胶体金免疫层析试纸条利用的是抗原抗体特异性反应原理[24-25],在传统的基于竞争法的三聚氰胺免疫层析试纸条基础上通过增加增强垫建立了一种能够显著提高灵敏度的半定量检测新方法,与传统检测方法相比,既保留了检测样品无需预处理、检测快速等优点,又显著地提高了检测灵敏度。在最优化条件下增敏型试纸条对于三聚氰胺的最低检测限为0.5 μg/L,检测范围为0.1~5 μg/L,检测时间10 min,检测特异性好,假阳性出现率低,同时也适用牛奶样品中三聚氰胺残留检测。
这种新方法能够有效解决目前试纸条检测灵敏度低的缺点,将极大地拓展免疫层析试纸条的应用范围,对于提升我国现场检测和食品监测水平提供重要的技术参考。
[1]王伟, 包军胜, 吴恭瑾, 等. 甘肃省食用添加三聚氰胺污染奶粉婴幼儿结石发病情况调查[J]. 中国循证医学杂志, 2009, 9(11): 1165-1168.
[2]胡世莲, 吴蕾, 陈尹, 等. 安徽中部地区食用含三聚氰胺超标奶粉婴幼儿泌尿系结石发病情况调查[J]. 中国循证医学杂志, 2008, 8(12):1039-1042.
[3]赵亚华, 李勇. 三聚氰胺的毒性及其检测方法研究进展[J]. 安徽预防医学杂志, 2013, 19(4): 283-288.
[4]刘世鹏, 雷迎, 黄国旺, 等. 三聚氰胺检测方法的研究进展[J]. 畜牧与饲料科学, 2012, 33(3): 50-53.
[5]夏骏, 赖卫华, 涂继平, 等. 三聚氰胺胶体金免疫层析方法的建立[J].食品科学, 2013, 34(20): 139-144.
[6]和丽华, 刘驰青, 狄小兰, 等. 昆明市五华区2009—2011年健康人群麻疹抗体水平监测情况分析[J]. 卫生软科学, 2012, 26(2): 149-150.
[7]何绮霞. 正确认识三聚氰胺[J]. 广东饲料, 2008, 17(10): 32-34.
[8]孙凤霞. 三聚氰胺单克隆抗体制备及其高灵敏快速检测技术研究[D].无锡: 江南大学, 2011.
[9]M E I Z h a n l o n g, D E N G Yi, C H U H u a q i n, e t a l.Immunochromatographic lateral flow strip for rapid and on-site detection of BPA in water samples[J]. Microchim Acta, 2013, 180(3/4):279-285.
[10]孔繁徽, 黄印尧, 赖清金, 等. 免疫胶体技术及其发展前景[J]. 福建畜牧兽医, 2012, 24(7): 11-13.
[11]MICHAEL G W. Immunochromatographic techniques: a critical review[J]. Journal of Analytical Chemistry, 2000, 366: 635-645.
[12]WESTAGARD J O. Point of care in using statistics in methods comparison studies[J]. Clinical Chemistry, 1998, 44(11): 2240-2245.
[13]VERHEIJEN R, OSSWALD I K, DIETRICH R, et al. Development of a one step strip test for rhe detection of (dihydro) streptomycin residues in raw milk[J]. Food and Agricultural Immunology, 2000,12(1): 31-40.
[14]GUO Yirong, LIU Shaoying, GUI Wenjun, et al. Gold immunochromatographic assay for simultaneous detection of carbofuran and triazophos in water samples[J]. Analytical Biochemistry, 2009, 389(1): 32-39.
[15]LAI Weihua, FUNG DANIEl Y C, YANG Xu, et al. Development of a colloidal gold strip for rapid detection of ochratoxin A with mimotope peptide[J]. Food Control, 2009, 20(9): 791-795.
[16]MEI Zhanlong, CHU Huaqin, CHEN Wei, et al. Ultrasensitive onestep rapid visual detection of bisphenol A in water samples by labelfree aptasensor[J]. Biosensors and Bioelectronics, 2013, 39(1): 26-30.
[17]FRENS G. Preparation gold dispersions of varying particle size:controlled nucleation for the regulation of the particle size in monodisperse gold solutions[J]. Nature Physical Science, 1973, 241:20-22.
[18]MEI Zhanlong, DENG Yi, CHU Huaqin, et al. One-step signal amplified lateral flow strip biosensor for ultrasensitive and on-site detection of bisphenol A (BPA)[J]. Biosensors and Bioelectronics,2013, 49: 457-461.
[19]孙秀兰, 赵晓联, 汤坚. 单分散性胶体金的制备工艺优化[J]. 免疫学杂志, 2004, 20(2): 151-154.
[20]杨挺, 王妹婷, 郭逸蓉, 等. 动物源食品中氯霉素残留速测金标试纸条的研制[J]. 中国农学通报, 2007, 23(11): 156-161.
[21]陈小锋, 刘曙熙. 胶体金标记免疫分析及其在小分子化合物快速检测中的应用[J]. 药物生物技术, 2004, 11(4): 278-280.
[22]卫生部. 关于三聚氰胺在食品中的限量值的公告[EB/OL]. 卫生部公告2011年第10号(2011-04-06). http://www.china.com.cn/news/txt/2011-04/22/content_22423009.htm.
[23]王自良, 王建华, 杨艳艳, 等. 抗氯霉素单克隆抗体杂交瘤细胞株的筛选及金标试纸检测方法的建立[J]. 西北农林科技大学学报: 自然科学版, 2006, 34(5): 6-11.
[24]赖卫华, 熊勇华, 陈高明, 等. 应用胶体金试纸条快速检测赭曲霉毒素A的研究[J]. 食品科学, 2005, 26(5): 204-207.
[25]SHYU R H, SHYU H Y, LIU H W, et al. Colloidal gold-based immunochromatographic assay for detection of ricin[J]. Toxicon,2002, 40(3): 255-258.
