非离子表面活性剂对生物丁醇发酵的影响
2014-06-19侯同刚张跃冬陈秀芳关静牟新东中国科学院青岛生物能源与过程研究所中国科学院生物基材料重点实验室山东青岛266101
侯同刚,张跃冬,陈秀芳,关静,牟新东中国科学院青岛生物能源与过程研究所 中国科学院生物基材料重点实验室,山东 青岛 266101
两次石油危机以后,能源供应安全问题引起世界各国的广泛关注。发展生物能源,促进能源供应多元化,是保障国家能源安全的重要举措。生物丁醇是生物能源的重要组成部分,它比生物乙醇更有优越性[1-2]:生物丁醇的蒸汽压力更低,与汽油混合时对杂质水的宽容度更大,腐蚀性更小,与现有的生物燃料相比,能够与汽油达到更高的混合比而无需对车辆进行改造。
然而传统的丙酮-丁醇 (ABE) 生产工艺中,由于存在反馈抑制作用,丁醇的终浓度一般不超过2.0 wt%,后期分离需要大量能耗,这就影响了该过程的经济性,限制了生物丁醇的大规模生产[3]。为提高该工艺经济性,许多研究针对发酵菌体的抗性基因改造以及产物的在线分离展开[4-6]。
四川大学李伟佳等[7]采用紫外线诱变处理,河南农业大学王风芹等[8]利用低温等离子体和亚硝基胍先后处理,都得到了高产的诱变菌株。另外,利用基因工程的手段进行菌种的改造,也是当前的研究热点。例如Mermelstein等[9]通过构建了含有新基因的质粒,转化丙酮丁醇梭菌Clostridium acetobutylicumATCC 824后,丙酮、丁醇和乙醇的产量分别提高了 95%、37%和 90%,而且转化菌株更加稳定。在生产工艺的改进方面,Ishizaki等[10]以甲基化的天然棕榈油为萃取剂进行在线分离,可将 47%左右的总溶剂萃取出来,葡萄糖的消耗率可由 62%提高到83%,丁醇产量由15.4 g/L提高到20.9 g/L。杨立荣等[11]从13种有机物中选出了油醇和混合醇作为萃取剂,最终总溶剂浓度可达到33.63 g/L。Ezeji等[12]研究了在线气提分离工艺,与间歇发酵相比,溶剂产率和产量分别能够提高200%和118%。Ezeji等[13]发现,与气提整合的发酵可以利用199 g/L的葡萄糖,可以产生69.7 g/L的总溶剂。另外,与膜蒸馏[14-15]、渗透汽化[16-19]等耦合的在线分离手段研究也有报道。但到目前为止,提高该过程经济性的研究仍处于实验室阶段。
随着分离手段的不断进步,表面活性剂在生物发酵中的应用也越来越多。有研究发现,在液液萃取过程中添加少量的表面活性剂会影响到萃取效率,一般认为表面活性剂处于两个液相界面处,可以促进或者阻止液液界面溶质的交换。Pursell等[20]研究了液液萃取过程中表面活性剂和生物质之间的相互作用。结果表明,不同的表面活性剂对传质的影响不同,极性表面活性剂可以促进界面的传质,而非极性表面活性剂一般会降低界面处的溶质传递。当发酵菌体表面吸附有带负电荷的表面活性剂时,表面活性剂会影响界面的稳定性。
表面活性剂不仅能影响到液液的传质过程,还能够通过在细胞表面的吸附来调节细胞的表面性质。有研究显示不动杆菌自身产生的生物表面活性剂能够促进菌株在有机污染物液滴上的吸附。Hua等[21]报道,一株南极假丝酵母表面的疏水性会在其自身产生的表面活性剂作用下增强。也有表面活性剂降低菌体表面疏水性的报道,Arino等[22]考察了一株铜绿假单胞菌表面性质的变化,发现细胞的憎水性在甘油培养基中发酵 200 h后开始减弱并最终下降到原来的一半。Ahimou等[23]认为表面活性剂分子极性端易吸附到弱疏水性的细胞膜表面,而非极性端易吸附到强疏水性细胞膜表面,从而伸向细胞外侧的分子基团使得细胞表面的亲疏水性能与原来的相反。除此之外,很多发酵过程中会遇到泡沫问题,除机械除泡外,一般通过添加表面活性剂作为消泡剂使用,通常也会对发酵产量带来不利的影响[12]。
在上述的发酵工艺过程中,相比于发酵液或萃取剂而言,表面活性剂的添加量非常小,一般都低于1%。但即使是如此少量的添加,也会对菌体产生一定的毒害作用[24],因此未见关于添加大量表面活性剂的研究报道。由于丁醇对菌体的毒害作用主要来自于丁醇在细胞膜内的溶解,导致细胞膜流动性受到影响,膜上的酶遭到破坏。如果表面活性剂可以吸附到细胞膜上并改变其表面性质,则可能会影响丁醇的毒害作用。另外,表面活性剂形成的胶束对丁醇会有一定的增溶作用。基于上述考虑,本文考察了高添加量的小分子非离子表面活性剂对生物丁醇发酵过程的影响,重点研究了表面活性剂的增溶效果和对菌体表面性质的影响。
1 材料与方法
1.1 化学试剂
葡萄糖、酵母提取物、磷酸二氢钾、磷酸氢二钾、醋酸铵、对氨基苯甲酸、维生素B1、维生素 H、醋酸钠、硫酸铵、7水合硫酸镁、1水合硫酸锰、7水合硫酸亚铁、氯化钠、油醇等药品均为分析纯,购自上海溶剂厂;硝酸钴、硫氰酸铵、二氯甲烷、十六烷等购自上海创赛科学仪器有限公司;非离子表面活性剂吐温、司盘系列购自上海申宇医药化工有限公司,纯度高于99%。
1.2 微生物和发酵条件
本实验采用常用的丙酮丁醇发酵菌种丙酮丁醇梭菌ATCC 824。菌体以孢子悬浮液的形式存于 4 ℃冰箱内。开始培养前,将孢子悬浮液在80 ℃保温10 min,然后接种到蛋白胨/葡萄糖/酵母提取物培养基中。活化后的菌体接种到MP2培养基中,37 ℃下厌氧培养24 h,得到的菌体用于发酵。每升MP2培养基的主要成分和含量为:7水合硫酸镁 0.2 g,1水合硫酸锰0.01 g,7水合硫酸亚铁0.01 g,氯化钠0.01 g,维生素B1 0.01 g,维生素H 0.1 g,磷酸二氢钾和磷酸氢二钾各0.5 g,硫酸铵2.0 g以及少量醋酸钠,溶于蒸馏水中。
1.3 毒性测试
利用摇瓶实验测试溶剂或表面活性剂的生物相容性。每个摇瓶中将活化好的菌体接种到葡萄糖基生长培养基中,摇瓶具塞密闭,摇床转速低于100 r/min,定期利用针头放气,以免炸裂。37 ℃下摇床培养24 h后,取10 mL发酵液添加到25 mL已灭菌的并添加一定量葡萄糖的MP2培养基中,然后加入5 mL溶剂或表面活性剂,在摇床下培养6 h,这时菌体处于快速生长阶段。接下来的24 h中,利用水取代法检测每个摇瓶的产气量。
1.4 吐温80的菌体吸附及菌体表面性质测试
菌体在含有 6%葡萄糖作为碳源的 MP2培养基中培养100 h,10 000 r/min离心10 min。收集到的菌体用MP2培养基清洗3次后,再用MP2培养基溶解。每5 mL菌体悬浮液与5 mL含有吐温80的MP2溶液混合,在100 r/min的水浴振荡器中振荡90 min。然后10 000 r/min离心分离菌体和水相,检测水相中吐温80的浓度,通过吸附前后浓度的变化,计算吸附量,空白实验用于计算吸附在摇瓶壁的菌体数量。
离心后得到的菌体进一步用改进的 BATH(Bacterial adhesion to hydrocarbons) 法测定其亲疏水性质[25]。菌体用MP2培养基清洗两次后再由MP2培养基重新分散,利用紫外分光光度计在400 nm下检测其吸光度。4 mL菌体悬浮液与1 mL十六烷混合于10 mL离心管内,旋涡振荡1 min后,在室温下自然分层。菌体疏水性通过式 (1) 计算。

其中Rbath表示基于空白的疏水性改变的百分比,Aini表示初始菌体悬浮液的吸光度,不含表面活性剂,Amix表示与表面活性剂混合后水相的吸光度。
1.5 分析方法
发酵液中丁醇含量由气相色谱 (GC Hewlett) 测定,色谱带有自动进样系统,火焰离子检测器。毛细管柱 (2 m×2 mm packed with 100/120 Carbopack B AW/6.6 wt% PEG20M;Superco Inc., Bellefonte, Pa.),箱内温度以每分钟16 ℃程序升温从100 ℃至210 ℃,进样器和检测器温度都为 200 ℃,载气为氮气,每分钟20 mL流量。
丁醇在含有表面活性剂的溶液中,其浓度由顶空气相色谱测定 (GC, Varian model 3700,USA),顶空瓶为 20 mL,在 37 ℃下平衡30 min,配置丁醇浓度从1 g/L到20 g/L。取2 mL溶液放入顶空瓶中,做 3次平行,用色谱图峰面积取3次平均值。
胶束增溶通过两个参数表征,增溶量χ和胶束水分配系数K。χ为单位质量胶束能够增溶的溶质质量。可以根据胶束增溶公式如式 (2):

式中St表示溶质总溶解度,Sw表示在含有胶束的水溶液中,溶质在水中的溶解度,Cs表示溶液中表面活性剂的浓度,cmc表示临界胶束浓度。
K表示溶质在胶束内和胶束外的比例,如式 (3):

2 结果与分析
2.1 表面活性剂的生物相容性
在ABE发酵过程中,同时会产生氢气和二氧化碳等气体,气体的产量可以作为菌体活性的一个指标[26]。图 1显示了添加不同种类溶剂时,发酵后的气体产量变化。从图中可以看到,油醇样品在发酵初始的6 h (空白) 和发酵终了(斜线),其产气量都要低于相同条件下的空白样品。实验表明,在发酵初始6 h中,生成的丁醇浓度低于4 g/L,这一浓度不会对菌体产生抑制。添加油醇的样品在这一时期产气量低于空白,则说明油醇本身对菌体有一定的毒害作用。相应的含有表面活性剂的所有样品,在发酵初始的6 h和整个发酵结束后,其产气量都不低于空白。这说明表面活性剂对菌体不仅没有毒性,而且会解除部分由丁醇产生的毒性作用。
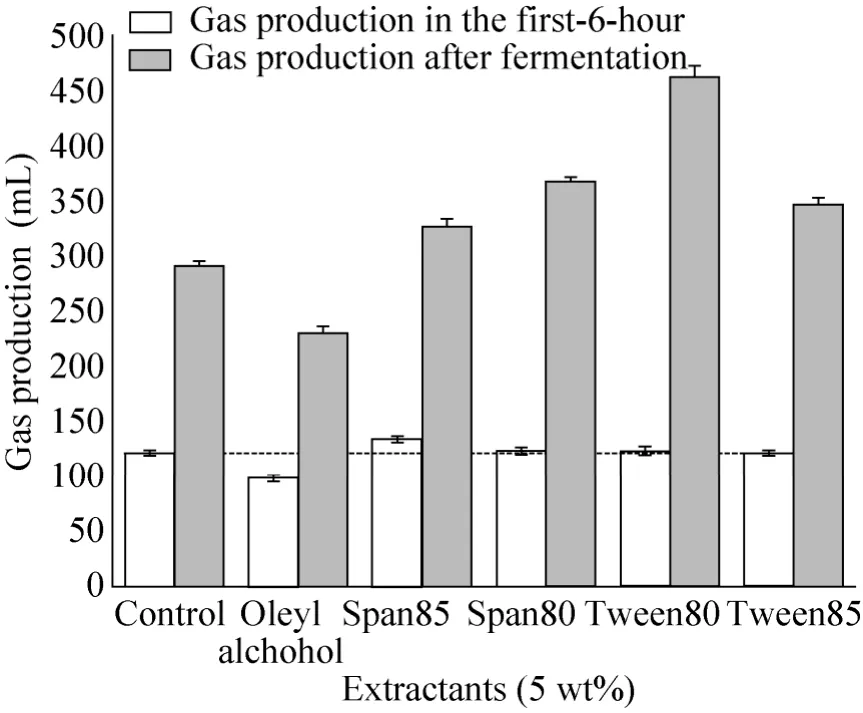
图1 溶剂种类对丁醇发酵产气量的影响Fig. 1 Effect of different solvents on gas production of ABE fermentation. Horizontal: gas production in the first 6-hour. Slash: gas production when fermentation finished.
实验以吐温80为代表,考察了不同添加量对发酵的影响,见图2。从图中可见,随着吐温80添加量不断提高,发酵气体的产量与丁醇浓度变化趋势相似。当吐温80添加量低于0.1 wt%时,气体产量与丁醇浓度都低于空白;而当吐温80的添加量超过0.1 wt%时,气体产量与丁醇浓度都随着吐温80的添加量增加而呈现上升趋势,高于空白。这现象说明在低添加量下,吐温80对菌体表现出毒性,而在高添加量下则没有。

图2 表面活性剂添加量对生物丁醇发酵的影响Fig. 2 Effect of surfactants amount on ABE fermentation.
这可能与吐温 80的临界胶束浓度有一定关系。吐温80在25 ℃下,在水相中的临界胶束浓度为0.14 wt%,如果溶液中存在丁醇等物质时,其临界胶束浓度会变小。可以认为当添加量为0.1 wt%时,吐温80在水溶液中并没有形成胶束。
上述实验表明胶束的形成有利于缓解丁醇对菌体的毒害作用,而且高添加量的表面活性剂本身不表现出毒性作用。由于吐温80的毒性转折点出现在其临界胶束浓度附近,有必要对吐温80胶束的增溶作用进行进一步研究。
2.2 表面活性剂胶束的增溶作用
吐温80可以形成胶束,并且对丁醇有一定的增溶作用。由于丁醇浓度比较低,而且实验中使用的吐温80为低分子表面活性剂,因此很难依照文献的方法对胶束的增溶特性进行表征。等式 (2) 变形可得:

St为丁醇在溶液中的真实浓度,该浓度可通过实验准确制备得到。当St为一固定值时,该浓度下临界胶束浓度cmc也会是一个固定值,根据等式 (4),如果胶束增溶量χ不变,那么Sw和Cs就会呈现出线性关系。此时可以根据斜率值推算出该条件下的临界胶束浓度。
为表征丁醇在吐温80胶束中的增溶情况,本实验利用顶空气相色谱,通过气相中丁醇的含量反推溶液中未被增溶的、游离的丁醇浓度,即水相中丁醇的浓度Sw。其前提假设为增溶到胶束内部的丁醇不会产生蒸汽压。另外,根据拉乌尔定律,将表面活性剂的增加带来的蒸汽压下降计算在内,实验结果见图3。

图3 不同表面活性剂添加量对增溶效果的影响Fig. 3 Effect of surfactants amount on butanol’s solubilization.
从图3中可见,当吐温80添加量较少时,其浓度与水相中的丁醇浓度比较符合直线关系,根据公式 (4),可得到χ值和cmc值。当丁醇浓度较低时,得到cmc的值为12 g/L,与文献报道接近。随着初始丁醇浓度增加,cmc值变小,而χ值增大。cmc是表面活性剂非常重要的参数之一,表面活性剂在溶液中的浓度到达及超过该值后,其分子或离子自动缔合成的胶体大小的聚集体质点微粒,cmc值会受到溶液中醇类分子的影响而变化,有报道证明cmc在丁醇存在时会下降,与我们的实验结果相吻合。χ值的变化应该是因为胶束形成后,随着表面活性剂的进一步增加,其胶束形状不再均一,而是出现各种不同形状的胶束,从而导致丁醇在其中增溶量发生变化。从图3中还可以看到,χ值非常小,这表明单位质量的胶束能增溶的丁醇质量非常有限。例如,初始丁醇浓度10.43 g/L时,添加50 g/L的表面活性剂仅仅能使丁醇的浓度较低0.48 g/L。因此,图1和图2中丁醇的增加量大部分并没有增溶进入胶束的内部。
2.3 表面活性剂在菌体表面的吸附
吐温 80形成的胶束对丁醇的增溶量非常少,因此高添加量下吐温80对菌体的减毒作用不仅仅是胶束增溶的影响。图 4显示了表面活性剂在菌体细胞表面的吸附以及对细胞表面疏水性的影响。从图中可以发现,当吐温80添加量少于0.1 wt%时,其相对疏水性随着浓度的变化会发生剧烈变化。而当吐温 80浓度高于0.1 wt%时,其亲疏水性质基本不发生变化。这一趋势与吐温80在细胞表面的吸附趋势一致,因此可以认为表面活性剂的亲疏水性的变化是由于吐温80的吸附造成的。
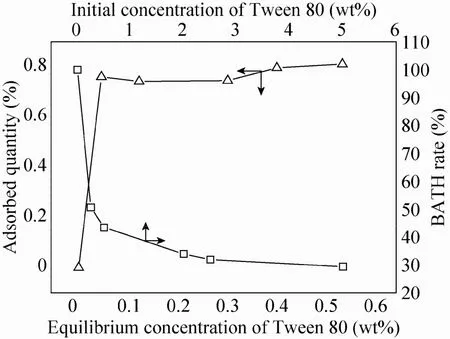
图4 吐温80在菌体表面的吸附及疏水性变化Fig. 4 Adsorption of Tween 80 on cell surface and its effect to surface hydrophobicity.
吐温80对菌体表面亲疏水性的影响,与其对菌体的毒性作用非常类似。有报道表明,丁醇对菌体的毒性主要是由于其对细胞膜以及细胞膜上的酶造成的影响导致的,且毒性的大小与其化学结构关系不大,主要在于其在细胞膜上的溶解浓度。当吐温80浓度较低时,与丁醇在细胞膜内的溶解类似,其分子中的疏水基团会溶解于细胞膜,这时吐温80和丁醇共同作用于细胞膜,从而表现出毒害作用。随着吐温 80浓度进一步增加,溶液中除游离吐温80分子外,还形成了胶束,形成的胶束亲水基团外露,这些胶束会与已经吸附在细胞膜上的吐温80的亲水基团相互作用,从而减轻了吸附胶束的毒害作用。从图4中可以看到,随着吐温80平衡浓度的提高,有机相中吸附的菌体量增加,即菌体表面的疏水性增强了,但由于 BATH法测试本身需要使用有机溶剂,该测试方法影响到了游离表面活性剂及胶束的活动,因此无法得到菌体表面亲疏水性受胶束影响的变化,而只能得到菌体吸附单层表面活性剂后的疏水性质。这也说明了图4中,吐温80添加量较高时其亲疏水性质基本不变的原因。
2.4 不同发酵条件对批式发酵丁醇终点浓度的影响

图5 不同发酵条件对批式发酵丁醇终点浓度的影响Fig. 5 ABE batch fermentation under different conditions.
在上述研究基础上,利用5 L发酵罐,对比了有表面活性剂和没有表面活性剂的发酵结果。初始葡萄糖浓度为100 g/L,发酵过程持续超过100 h,结果见图5。从图中可以看到,发酵终了,没有添加表面活性剂的空白样中丁醇浓度只能达到8 g/L左右,这可能是由于长期低温保藏,导致了菌种退化。而同样的菌体,添加表面活性剂的样品,其丁醇浓度超过了16 g/L,证明了表面活性剂对丁醇的促进作用。从图 5中可以看到,带有表面活性剂的样品,其丁醇的产生要迟于空白样品。一方面由于表面活性剂在菌体表面的吸附,可能会影响到细胞对葡萄糖、水等物质的可及性,另一方面也可能影响到丁醇向胞外的分泌。总之,由表面活性剂在菌体表面的吸附对菌体的影响是比较复杂的,需要进一步深入的研究。
另外,受表面活性剂添加的影响,发酵过程中丁酸、乙酸、丙酮、乙醇等的浓度随发酵时间的变化趋势与未添加表面活性剂的样品也稍有不同 (图中未标出),其变化趋势与丁醇类似。但发酵结束后,产物丁醇、丙酮、乙醇三者的质量比与未添加表面活性剂的样品基本一致。实验所用的吐温系列表面活性剂溶于水,而司盘80和司盘85都是不溶于水的,在实验中发现,该类表面活性剂的少量添加会在溶液表面形成几个小油滴。随着发酵进行,直到发酵结束,觉察不到油滴数量的减小,而相应的样品产气量也都高于空白。综上可以认为表面活性剂并没有参与到代谢过程。
3 总结
丙酮丁醇发酵过程中,非离子小分子表面活性剂添加量低时会降低丁醇的浓度,而添加量较高时则可以提高丁醇浓度。丁醇浓度的提高不仅仅是因为表面活性剂形成的胶束对丁醇的增溶作用,实验结果表明,单位质量的胶束中丁醇的量非常少。吐温80分子可以吸附到菌体表面,改变菌体表面的亲疏水性,这可能是其增加丁醇产量的主要原因。
[1]Huang GS, Li ZY, Zhang LB, et al. Performance advantage and technology progress in biobutanol.Petrochem Technol Appl, 2012, 30(3): 254–259 (in Chinese).
黄格省, 李振宇, 张兰波, 等. 生物丁醇的性能优势及技术进展. 石化技术与应用, 2012, 30(3):254–259.
[2]Swana J, Yang Y, Behnam M, et al. An analysis of net energy production and feedstock availability for biobutanol and bioethanol. Bioresour Technol,2011, 102(2): 2112–2117.
[3]Ranjan A, Moholkar VS. Biobutanol: science,engineering and economics. Int J Energy Res, 2012,36(3): 277–323.
[4]García V, Päkkilä J, Ojamo H. Challenges in biobutanol production: how to improve the efficiency? Renew Sust Energy Rev, 2011, 15(2):964–980.
[5]Kumar M, Gayen K. Developments in biobutanol production: new insights. Appl Energ, 2011, 88(6):1999–2012.
[6]Kharkwal S, Karimi IA, Chang MW, et al. Strain improvement and process development for biobutanol production. Recent Pat Biotechnol,2009, 3(3): 202–210.
[7]Li WJ, Chen CY, Cui HD, et al. Optimization of fermentation condition forClostridium acetobutylicum. China Brew, 2013, 32(2): 13–16(in Chinese).
李伟佳, 陈春燕, 崔海娣, 等. 丙酮丁醇梭菌发酵条件优化研究. 中国酿造, 2013, 32(2): 13–16.
[8]Wang FQ, Yuan H, Xie H, et al. Mutation breeding of butanol high-yielding strain and its fermentation condition optimization. China Brew, 2011, 230(5):84–86 (in Chinese).
王风芹, 原欢, 谢慧, 等. 丁醇高产菌株诱变育种及发酵条件优化研究. 中国酿造, 2011, 230(5):84–86.
[9]Mermelstein LD, Papoutsakis ET, Petersen DJ, et al. Metabolic engineering ofClostridium acetobutylicumATCC 824 for increased solvent production by enhancement of acetone formation enzyme activities using a synthetic acetone operon.Biotechnol Bioeng, 1993, 42(9): 1053–1060.
[10]Ishizaki A, Michiiwaki S, Crabbe E, et al.Extractive acetone-butanol-ethanol fermentation using methylated crude palm oil as extractant in batch culture ofClostridium saccharoperbutylacetonicumN1-4 (ATCC 13564).J Biosci Bioeng, 1999, 87(3): 352–356.
[11]Yang LR, Cen PL, Zhu ZQ. Study on acetone/butanol fermentation within-situsolvent extraction. J Zhejiang Univ: Nat Sci Ed, 1992,26(4): 388–398 (in Chinese).
杨立荣, 岑沛霖, 朱自强. 丙酮/丁醇间歇萃取发酵. 浙江大学学报: 自然科学版, 1992, 26(4):388–398.
[12]Ezeji TC, Qureshi N, Blaschek HP. Production of acetone, butanol and ethanol byClostridium beijerinckiiBA101 andin siturecovery by gas stripping. World J Microb Biot, 2003, 19(6):595–603.
[13]Ezeji TC, Qureshi N, Blaschek HP. Acetone butanol ethanol (ABE) production from concentrated substrate: reduction in substrate inhibition by fed-batch technique and product inhibition by gas stripping. Appl Microbiol Biot,2004, 63(6): 653–658.
[14]Banat FA, Al-Shannag M. Recovery of dilute acetone–butanol–ethanol (ABE) solvents from aqueous solutions via membrane distillation.Bioprocess Eng, 2000, 23(6): 643–649.
[15]Elkina IB, Gilman AB, Ugrozov VV, et al.Separation of mineral acid solutions by membrane distillation and thermopervaporation through porous and nonporous membranes. Ind Eng Chem Res, 2013, 52(26): 8856–8863.
[16]Li SY, Srivastava R, Parnas RS. Study of in situ 1-butanol pervaporation from A-B-E fermentation using a PDMS composite membrane: validity of solution-diffusion model for pervaporative A-B-E fermentation. Biotechnol Progr, 2011, 27(1):111–120.
[17]Qureshi N, Blaschek HP. Butanol recovery from model solution/fermentation broth by pervaporation:evaluation of membrane performance. Biomass Bioenergy, 1999, 17(2): 175–184.
[18]Liu GP, Wang W, Wu H, et al. Pervaporation performance of PDMS/ceramic composite membrane in acetone butanol ethanol (ABE)fermentation–PV coupled process. J Membrane Sci,2011, 373(1/2): 121–129.
[19]Liu GP, Wang W, Wu H, et al. Pervaporation membranes for biobutanol production. ACS Sustainable Chem, Eng, 2013, 2(4): 546–560.
[20]Pursell MR, Mendes MA, Stuckey DC. Interactions
http://journals.im.ac.cn/cjbcn between surfactants and biomass during liquid–liquid extraction. Biotechnol Prog, 2009,25(6): 1686–1694.
[21]Hua Z, Chen J, Lun S, et al. Influence of biosurfactants produced byCandida antarcticaon surface properties of microorganism and biodegradation of n-alkanes. Water Res, 2003,37(17): 4143–4150.
[22]Arino S, Marchal R, Vandecasteele JP.Identification and production of a rhamnolipidic biosurfactant by aPseudomonas species. Appl Microbiol Biotechnol, 1996, 45(1/2):162–168.
[23]Ahimou F, Jacques P, Deleu M. Surfactin and iturin A effects onBacillussubtilissurface hydrophobicity. Enzyme Microb Technol, 2000,27(10): 749–754.
[24]Yang Y, Zhang LY, Shi ZP, Improvement of extractive fermentation performance of butanol by adding surfactacts into fermentation medium. Chin J Bioprocess Eng, 2008, 6(4): 25–30 (in Chinese).
杨影, 张龙云, 史仲平, 添加表面活性剂改善丁醇萃取发酵性能. 生物加工过程, 2008, 6(4):25–30.
[25]Zhang YM, Maier WJ, Miller RM. Effect of rhamnolipids on the dissolution, bioavailability and biodegradation of phenanthrene. Environ Sci Technol, 1997, 31(8): 2211–2217.
[26]Niu XL. Study on butanol extractive fermentation with oleyl alcohol and recovery product in extraction raffinate[D]. Wuxi: Jiangnan University,2008 (in Chinese).
牛晓乐. 以油醇为高效萃取剂的丁醇萃取发酵和回收萃余液中溶剂产物的研究[D]. 无锡: 江南大学, 2008.
