紫杉二烯人工酵母的代谢组学分析
2014-06-15闫慧芳丁明珠元英进天津大学化工学院制药工程系系统生物工程教育部重点实验室天津300072
闫慧芳,丁明珠,元英进天津大学化工学院制药工程系 系统生物工程教育部重点实验室,天津 300072
紫杉二烯人工酵母的代谢组学分析
闫慧芳,丁明珠,元英进
天津大学化工学院制药工程系 系统生物工程教育部重点实验室,天津 300072
为了更深入地从代谢角度研究萜类合成人工酵母的内在差异,以紫杉二烯人工酵母为例,利用代谢组学的方法对其发酵指数中期胞内代谢物的变化进行了测定。结果表明,与对照菌W303-1A相比,紫杉二烯的生产会对胞内糖酵解、三羧酸循环中间物及一些氨基酸的含量产生不同程度的影响,进而对其生长产生一定抑制作用。其中柠檬酸因紫杉二烯功能模块的引入下降明显,降幅达90%以上,因此可以作为后续功能酵母研究的标志性代谢物。紫杉二烯人工酵母细胞代谢组的研究可以为萜类化合物异源合成的优化提供更多的信息和帮助。
代谢组学,紫杉二烯,酵母,氨基酸,TCA循环
系统生物学包括基因组学、转录组学、蛋白组学和代谢组学等多个方面,可以用来研究生物体系在特定条件下DNA、RNA、蛋白质和代谢物等的相互关系和动态变化过程[1-2]。组学可以实现从不同层次全面探究细胞内部的变化,并从不同角度解释这些生物过程[3]。其中,代谢物作为细胞调控过程的终产物,其含量变化可被认为是细胞对基因水平或外界环境变化的最终响应,是细胞系统信息的表型特征[4-5]。因此,代谢组学的研究能够更加直观、系统地表达生物体系在环境中的变化。
代谢组学越来越广泛地被应用于生命科学研究的各个领域,如新药的研发[6-7]、脏器移植监控[8]、探究疾病发生机制[9]、发酵过程分析及优化[10-16]、转基因作物的分析[17]等。以往的研究工作和日趋完善的代谢组分析技术都为代谢组学研究的发展提供了借鉴和支持。
萜类化合物的酵母异源合成成为近年来研究的热点,研究者已经利用合成生物学成功地获得了许多功能人工细胞[18-25]。本研究中,以紫杉二烯人工酵母为例,利用代谢组学的分析方法探究外源功能模块对酵母底盘细胞代谢产生的影响,更深入地解释外源模块与底盘细胞相互作用,并为后续研究中人工细胞合成外源化合物的优化提供帮助。
1 材料与方法
1.1 试剂
提取液:甲醇:水=1:1,V/V (甲醇,色谱纯,Merck公司,Germany)。
内标:以milli-Q水配制的浓度为0.2 mg/mL的氘标记琥珀酸混合液 (Succinic d4 acid,Fluka公司,Buchs, Switzerland)。
衍生化试剂:20 mg/mL甲氧基铵盐酸盐/吡啶溶液 (甲氧基铵盐酸盐,O-methoxamine hydrochloride,色谱纯,Fluka公司,Buchs, Switzerland;吡啶,pyridine,色谱纯,Sigma公司,St. Louis,MO,USA)。N-甲基-N-三甲硅烷基-三氟乙酰胺 (N-methyl-N-(trimethylsilyl)-trifluoroacetamide,MSTFA,色谱纯,Fluka公司,Buchs, Switzerland)。
1.2 菌株与培养基
原始酵母细胞W303-1A(MATa {leu2-3,112 trp1-1 can1-100 ura3-1 ade2-1 his3-11,15})为实验室保存。紫杉二烯人工酵母细胞SyBE_001109、SyBE_001110和SyBE_001111均为之前研究中所构建,它们的区别是使用的GGPPS来源不同,分别来源于红豆杉(GGPPSbc)、酿酒酵母 (GGPPSsc) 和草生欧文氏菌 (GGPPSeh),具体菌株信息见表1。
YPD固体培养基:酵母浸粉 10 g/L,蛋白胨 20 g/L,葡萄糖 20 g/L,琼脂粉 20 g/L。
YPD液体培养基:酵母浸粉 10 g/L,蛋白胨 20 g/L,葡萄糖 20 g/L。
SD-drop固体培养基:去氨基酵母氮源6.7 g/L;drop-out氨基酸混合物 2 g/L;葡萄糖20 g/L;琼脂粉20 g/L。

表1 实验使用的菌株列表Table 1 Strains used in this study
SD-drop液体培养基:去氨基酵母氮源6.7 g/L;drop-out氨基酸混合物2 g/L;葡萄糖20 g/L。
1.3 酵母发酵方法
将保存的阳性克隆菌在SD固体平板培养基上划线筛选。挑取单克隆接入5 mL SD-drop液体培养基中,220 r/min、30 ℃培养至OD600值为4.0左右。转接至50 mL YPD液体培养基(250 mL三角瓶) 中,使得初始OD600值为0.05, 200 r/min、30 ℃持续发酵至平台期。
1.4 胞内小分子代谢物的提取
参照Ding等[26]在研究中的提取方法。
1) 在细胞生长指数中期取发酵液2 mL,收集菌体并清洗2次, 将清洗后的细胞置于液氮中1 min淬灭。
2) 在细胞中加入1 mL甲醇-水提取液,涡旋1 min混匀;置入液氮中冻融 1 min,重复3次。
3) 12 000 r/min冷冻离心5 min,吸取上层清液于新的离心管中;下层细胞残留物中再加入0.5 mL甲醇-水提取液,冻融3次,12 000 r/min离心5 min,吸取上清液与之前收集的清液混合。
4) 残留的酵母细胞则置于80 ℃烘箱中烘干,以称量干重。
1.5 样品衍生化
参照Ding等[11]在之前研究中的样品处理方法。
在100 µL 提取液中加入10 µL内标混合液,混匀后真空冷冻干燥;在干燥的样品中加入50 µL甲氧基铵盐酸盐/吡啶溶液,置于40 ℃水浴反应80 min;再加入80 µL N-甲基-N-三甲硅烷基-三氟乙酰胺 (MSTFA),置于40 ℃水浴反应80 min,12 000 r/min离心3 min,吸取上清100 µL于样品瓶中待检测。
1.6 代谢物的检测
代谢物样品采用Waters GC-TOF-MS CAB051进行检测,包括安捷伦公司的7683自动进样器,安捷伦公司的6890气相色谱 (GC,Agilent Technologies,Palo Alto,CA,USA) 和沃特世公司的飞行时间质谱 (TOF/MS,Waters Corp.,USA)[26]。
色谱条件:DB-5MS 毛细管色谱柱(30 m×0.25 μm×0.25 mm);升温程序:初始温度70 ℃,保持2 min,以5 /min ℃升至290 ℃,290 ℃保持3 min;进样口温度260 ℃,分流进样(分流比10:1),进样量1 μL;恒压模式91 kPa;色谱-质谱接口温度280 ℃。
质谱条件:EI+电离源;电子能量70 eV;离子源温度250 ℃;溶剂延迟时间5 min;质量扫描方式:全离子扫描。
1.7 代谢物的定性和定量分析
代谢物的定性和定量是借助Masslynx (version 4.1) 软件完成的。将质谱的碎片峰和NIST数据库 (National Institute of Standards and Technology mass spectral library,2005) 比较,对色谱图中的各个峰进行定性。通过Masslynx软件将总离子流图中的各峰进行自动积分,同时辅以手动修正,可得到各个代谢物和内标的原始峰面积数据。并采用内标法对各代谢物进行定量,即将代谢物的峰面积与内标的峰面积进行比值计算,并除以相应物质在空白对照W303-1A中的含量 (即W303-1A中的含量均视作1),进而得到各代谢物的相对含量,这些代谢物的相对含量被用于进一步的数据分析。

图1 酵母发酵过程生长曲线Fig. 1 The growth curves.
2 结果与分析
2.1 不同外源功能模块对人工酵母细胞生长的影响
对能合成紫杉二烯的功能人工酵母SyBE_001109(GGPPSbc),SyBE_001110(GGPPSs c),SyBE_001111(GGPPSeh)和原始底盘W303-1A(空白对照)进行发酵过程生长曲线的测定,4种菌株的生长曲线见图1。
从这4种酵母的生长曲线可以看出,与W303-1A相比,在发酵初期3种紫杉二烯人工细胞的生长状况与W303-1A差别并不明显,而到了指数中期以后,则均显现出不同程度的抑制,最终OD600值也均小于W303-1A。这可能因为在发酵的初期,紫杉二烯的浓度还很低,不会对细胞造成压力,而随着紫杉二烯的积累,带给酵母细胞的压力越来越大,就逐渐显现了生长状况受影响的现象。通过进一步的比较发现,3种功能酵母之间的生长状况也存在一定差异,其中SyBE_001110的生长受到的抑制最小,它的生长与空白菌W303-1A差别不大,而SyBE_001109的生长明显受到抑制,终止OD600要比SyBE_001110低16%。在之前的研究中,3种功能酵母生产紫杉二烯的产量存在差异,其中采用红豆杉源GGPPS的SyBE_001109产量最高,而采用草生欧文氏菌GGPPS和酿酒酵母GGPPS的菌株差别不大,后者紫杉二烯产量最低。因此,这3种功能酵母生长状况的差异恰好与紫杉二烯产量的差异一致,因此也同样证明了紫杉二烯对于酵母细胞生长的影响,而浓度越高,影响越大。但需要指出的是,紫杉二烯对细胞的生长并未起到很大的抑制作用,因此在酵母密度可以接受的前提下,还是可以选择效果更好的外源模块,实现高产紫杉二烯的目的。
2.2 糖酵解路径相关氨基酸分析
糖酵解和TCA循环属于细胞的中心碳代谢环节,其代谢流较大,且其中的关键中间代谢物乙酰CoA是参与包括TCA循环在内的诸多生物催化的重要前体[27],同时糖酵解中的代谢物也是一些氨基酸合成的前体,糖酵解路径、TCA循环、相关氨基酸合成及紫杉二烯合成途径的代谢网络见图3,可见糖酵解可以视为MVA途径的一个上游路径,而TCA循环可以视为MVA途径的竞争路径。因此分析糖酵解和TCA循环中相关代谢物含量的变化,有助于分析MVA路径代谢的变化。
通过测定W303-1A底盘与3种不同来源GGPPS的外源模块组合的3种人工酵母与糖酵解有关的氨基酸,发现了这3种外源模块引入时,人工酵母细胞与原始底盘W303-1A相比发酵中代谢的变化。以糖酵解途径中间体为前体合成的氨基酸包括丝氨酸、苯丙氨酸、缬氨酸、丙氨酸等(图2)。对这4种氨基酸的测定发现,除了丝氨酸在SyBE_001109中的含量比空白对照W303-1A的含量高以外,其他3种菌株中各氨基酸含量均低于W303-1A的含量 (图3)。这说明外源模块的引入对酵母糖酵解途径相关氨基酸的合成产生了一致的影响,使它们的产量降低,这可能由于外源模块的引入需要占用一部分碳源进行化合物的合成,从而使分流到各氨基酸合成的代谢流稍微降低。另外,之前有研究表明,中心代谢水平的降低可能是对不同压力的响应[28],因此通过这几种氨基酸的响应,可以认为紫杉二烯的存在对细胞造成了一定的压力,从而表现出了代谢组上一定的表观现象。

图2 酵母中糖酵解、TCA循环及紫杉二烯合成代谢网络Fig. 2 Metabolic network of glycolytic pathway, TCA cycle and taxadiene synthetic pathway.

图3 糖酵解途径相关氨基酸含量Fig. 3 Relative contents of amino acids related to glycolytic pathway.
2.3 TCA循环相关代谢物分析
2.3.1 TCA循环直接中间代谢物分析
TCA循环是糖类、脂类、氨基酸及核苷酸等的最终代谢通路,又是这几者代谢联系的重要枢纽[29]。TCA循环对于细胞维持自身存活、功能十分重要。由于它以乙酰CoA为起点,因而成为MVA途径的竞争路径之一(图2)。事实上,作为酵母细胞的中心碳代谢的一环,TCA循环的代谢通量一定是远大于MVA等一系列途径的,所以一方面TCA循环代谢通量的微小差异,也可能对MVA途径产生影响;另一方面,外源紫杉二烯合成途径的引入也可能对TCA循环造成一定影响。

图4 三种功能酵母和W303-1A中TCA循环直接代谢物含量Fig. 4 The relative contents of TCA cycle metabolites.

图5 发酵指数中期三种功能酵母TCA循环直接代谢物横向比较Fig. 5 TCA cycle metabolites of three functional yeast strains in log phase.
共检测到TCA循环中间直接代谢物4种,包括柠檬酸、ɑ-酮戊二酸、琥珀酸和富马酸,它们在4种酵母中相对含量见图4。其他几种TCA循环中间体未检测出,可能因为相对含量过低。这几种中间代谢物,规律最为明显的是柠檬酸,在发酵指数中期,3种功能酵母中柠檬酸含量最高的也仅为W303-1A的10%,这说明外源紫杉二烯模块的引入使柠檬酸的含量大大降低,一方面这可能由于紫杉二烯合成途径与TCA循环产生了竞争关系,分走一部分代谢流,从而TCA循环的代谢通量受到一定影响,但TCA循环原本的代谢流就强于MVA路径,所以这种影响显然不会太大;另一方面则可能因为紫杉二烯的产生会产生抑制柠檬酸合成的效果,因此柠檬酸可以作为后续研究中研究功能酵母的标志性代谢物。琥珀酸和富马酸也是TCA循环的关键中间体,分析显示功能酵母中琥珀酸含量比W303-1A略有下降,而富马酸的规律并不一致,SyBE_001111中的含量反而高于W303-1A,这可能与引入模块间的差异有关。
借助雷达图 (图5) 对3种功能酵母进行横向比较,通过所围的面积可以明显看出SyBE_001109中4种代谢物总量最少,这说明采用红豆杉源GGPPS的外源模块引入对TCA循环造成的影响最明显,事实上,该功能酵母的紫杉二烯产量也是最高的,因此这说明也可能由于紫杉二烯对TCA循环有一定抑制作用。
2.3.2 TCA循环相关氨基酸的分析
TCA循环的中间体也是一些氨基酸合成的前体。对4种酵母细胞发酵指数中期与TCA循环一些相关的氨基酸进行分析 (图6),其中天冬酰胺、异亮氨酸、脯氨酸和羟化脯氨酸的含量,均为功能酵母中含量低于空白酵母W303-1A,而鸟氨酸和谷氨酸则为功能酵母中含量更高,这两种氨基酸水平提高可能与相关蛋白质降解加速有关,有研究表明,当细胞面对压力时,会提高蛋白质降解速率[28,30]。这说明外源紫杉二烯模块的引入对这6种氨基酸的合成会造成影响,且3种功能模块造成的影响一致,因此,这几种氨基酸也可以作为后续功能酵母研究的标志性代谢物。对紫杉二烯产量最高的SyBE_001109进行着重的分析,发现它的6种氨基酸含量与W303-1A相比变化比例均是最大的 (图6),SyBE_001109包含了较强的紫杉二烯功能模块,从而对各类氨基酸合成造成的影响最大,这也进一步验证了我们的观点,即这6种氨基酸含量的变化确实由于紫杉二烯合成模块的引入而导致,同时,较强的功能模块对氨基酸合成的影响更大。
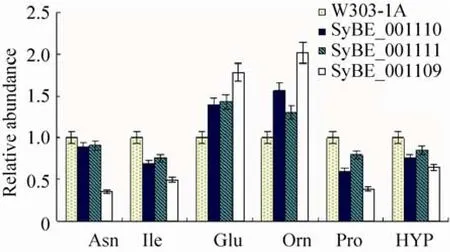
图6 三种功能酵母和W303-1A中TCA循环相关氨基酸含量Fig. 6 Relative contents of related amino acids of TCA cycle.
3 结论
通过对紫杉二烯功能酵母与W303-1A在发酵过程中的代谢组学比较分析发现,紫杉二烯功能模块的引入会对酵母细胞的代谢产生显著影响,进而对生长产生一定的抑制效果,且紫杉二烯产量越高,这种抑制相对越明显。与空白W303-1A相比,紫杉二烯功能酵母中与糖酵解相关的氨基酸含量大部分都有所降低,这说明紫杉二烯模块的引入对糖酵解相关氨基酸的合成产生一定影响。
紫杉二烯功能酵母中TCA循环中柠檬酸的含量与W303-1A相比有明显降低,降低幅度达90%以上,这说明外源模块的引入会对柠檬酸的含量造成巨大影响,因而柠檬酸可以发展为后续功能酵母研究中的一个标志性代谢物。此外,TCA循环相关的6种氨基酸也不同程度地增多或减少,且功能模块越强,这种影响越明显,因此这些氨基酸也可以作为后续功能酵母研究中的标志性代谢物。
代谢组学分析可以发现人工酵母内部代谢物变化规律,提供更多外源模块与底盘细胞相互作用的信息,因而可以发展为萜类化合物异源合成研究中通用的策略。本文为合成生物学研究中外源功能模块与底盘细胞如何更好适配提供了新的思路和方法。
REFERENCES
[1] Hood L, Heath JR, Phelps ME, et al. System biology and new technologies enable predictive and preventative medicing. Science, 2004, 306(5696): 640–643.
[2] Kitano H. Systems biology: a brief overview. Science, 2002, 295(5560): 1662–1664.
[3] Petranovic D, Vemuri GN. Impact of yeast systems biology on industrial biotechnology. J Biotechnol, 2009, 144(3): 204–211.
[4] Fiehn O. Metabolomics-the link between genotypes and phenotypes. Plant Mol Biol, 2002, 48(1/2): 155–171.
[5] Smedsgaard J, Nielsen J. Metabolite profiling of fungi and yeast: from phenotype to metabolome by MS and informatics. Soc Experiment Biol, 2005, 56(410): 273–286.
[6] Wishart DS. Applications of metabolomics in drug discovery and development. Drugs R D, 2008, 9(5): 307–322.
[7] Wishart DS, Knox C, Guo AC, et al. DrugBank: a knowledgebase for drugs, drug actions and drug targets. Nucleic Acids Res, 2008, 36(suppl 1): D901–D906.
[8] Wishart DS. Metabolomics: a complementary tool in renal transplantation. Contrib Nephrol, 2008, 160: 76–87.
[9] Wishart DS, Knox C, Guo AC, et al. HMDB: a knowledge base for the human metabolome. Nucleic Acid Res, 2009, 37(suppl 1): D603–D610.
[10] Xia JM, Yuan YJ. Comparative lipidomics of four strains of Saccharomyces cerevisiae reveals different responses to furfural, phenol, and acetic acid. J Agricul Food Chem, 2009, 57(1): 99–108.
[11] Ding MZ, Zhou X, Yuan YJ. Metabolome profiling reveals adaptive evolution of Saccharomyces cerevisiae during repeated vacuum fermentations. Metabolomics, 2010, 6(1): 42–55.
[12] Devantier R, Scheithauer B, Villas-Boas SG, et al. Metabolite profiling for analysis of yeast stress response during very high gravity ethanol fermentations. Biotechnol Bioeng, 2005, 90(6): 703–714.
[13] Ding MZ, Cheng JS, Xiao WH, et al. Comparative metabolomics analysis on industrial continuous and batch ethanol fermentation process by GC-TOF-MS. Metabolomics, 2009, 5(2): 229–238.
[14] Ding MZ, Li BZ, Cheng JS, et al. Metabolome analysis of differential responses of diploid and haploid yeast to ethanol stress. Omics-A J Integra Biol, 2010, 14(5): 553–561.
[15] Ding MZ, Tian HC, Cheng JS, et al. Inoculum size-dependent interactive regulation of metabolism and stress response of Saccharomyces cerevisiae revealed by comparative metabolomics. J Biotechnol, 2009, 144(4): 279–286.
[16] Lin FM, Tang Y, Yuan YJ. Temporal quantitative proteomics of Saccharomyces cerevisiae in response to a nonlethal concentration of furfural. Proteomics, 2009, 9(24): 5471–5483.
[17] Barros E, Lezar S, Anttonen MJ, et al. Comparison of two GM maize varieties with a near-isogenic non-GM variety using transcriptomics, proteomics and metabolomics. Plant Biotechnol J, 2010, 8(4): 436–451.
[18] Zhou YJ, Gao W, Rong QX, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production. J Am Chem Soc, 2012, 134(6): 3234–3241.
[19] Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 69–74.
[20] Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(13): 940–943.
[21] Engels B, Dahm P, Jennewein S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards taxol (Paclitaxel) production.Metabol Eng, 2008, 10(3/4): 201–206.
[22] Chang MC, Keasling JD. Production of isoprenoid pharmaceuticals by engineered microbes. Nat Chem Biol, 2006, 2: 674–681.
[23] Dai ZB, Liu Y, Huang LQ, et al. Production of miltiradiene by metabolically engineered Saccharomyces cerevisiae. Biotechnol Bioeng, 2012, 109(11): 2845–2853.
[24] Huang QL, Roessner CA, Croteau R, et al. Engineering Escherichia coli for the synthesis of taxadiene, a key intermediate in the biosynthesis of taxol. Bioorg Med Chem, 2001, 9(9): 2237–2242.
[25] Oswald M, Fischer M, Dirninger N, et al. Monoterpenoid biosynthesis in Saccharomyces cerevisiae. FEMS Yeast Res, 2007, 7(3): 413–421.
[26] Ding MZ, Wang X, Yang Y, et al. Comparative metabolic profiling of parental and inhibitors-tolerant yeasts during lignocellulosic ethanol fermentation. Metabolomics, 2012, 8(2): 232–243.
[27] Deckert G, Warren PV, Gaasterland T, et al. The complete genome of the hyperthermophilic bacterium Aquifex aeolicus. Nature, 1998, 392: 353–358.
[28] Jozefczuk S, Klie S, Catchpole G, et al. Metabolomic and transcriptomic stress response of Escherichia coli. Mol Syst Biol, 2010, 6: 364.
[29] Schousboe A, Westergaard N, Waagepetersen HS, et al. Trafficking between glia and neurons of TCA cycle intermediates and related metabolites. Glia, 1997, 21(1): 99–105.
[30] Mandelstam J. Protein turnover and its function in economy of cell. Ann NY Acad Sci, 1963, 102: 621–635.
(本文责编 陈宏宇)
Metabolomics analysis of taxadiene producing yeasts
Huifang Yan, Mingzhu Ding, and Yingjin Yuan
Key Laboratory of Systems Bioengineering, Ministry of Education, Department of Pharmaceutical Engineering, School of Chemical Engineering & Technology, Tianjin University, Tianjin 300072, China
In order to study the inherent difference among terpenes producing yeasts from the point of metabolomics, we selected taxadiene producing yeasts as the model system. The changes of cellular metabolites during fermentation log phase of artificial functional yeasts were determined using metabolomics methods. The results represented that compared to W303-1A as a blank control, the metabolites in glycolysis, tricarboxylic acid cycle (TCA) cycle and several amino acids were influenced. And due to the changes of metabolites, the growth of cells was inhibited to a certain extent. Among the metabolites identified, citric acid content in taxadiene producing yeasts changed the most, the decreasing amplitude reached90% or more. Therefore, citric acid can be a marker metabolite for the future study of artificial functional yeasts. The metabolomics analysis of taxadiene producing yeasts can provide more information in further studies on optimization of terpenes production in heterologous chassis.
metabolomics, taxadiene, yeast, amino acid, TCA cycle
May 9, 2013; Accepted: July 8, 2013
Mingzhu Ding. Tel: +86-22-27406491; Fax: +86-22-27403888; E-mail: mzding@tju.edu.cn
闫慧芳, 丁明珠, 元英进. 紫杉二烯人工酵母的代谢组学分析. 生物工程学报, 2014, 30(2): 223-231.
Yan HF, Ding MZ, Yuan YJ. Metabolomics analysis of taxadiene producing yeasts. Chin J Biotech, 2014, 30(2): 223-231.
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2012AA02A701), National Basic Research Program of China (973 Program) (No. 2012CB721105).
国家高技术研究发展计划(863计划) (No. 2012AA02A701),国家重点基础研究发展计划(973计划) (No. 2012CB721105) 资助。
