猪CuZnSOD基因启动子的克隆鉴定及分析
2014-06-15石元陈伟曾勇庆祝洪磊徐正刚张哲杨云张天阳山东农业大学动物科技学院动物育种学实验室山东泰安271018
石元,陈伟,曾勇庆,祝洪磊,徐正刚,张哲,杨云,张天阳山东农业大学动物科技学院 动物育种学实验室,山东 泰安 271018
猪CuZnSOD基因启动子的克隆鉴定及分析
石元*,陈伟*,曾勇庆,祝洪磊,徐正刚,张哲,杨云,张天阳
山东农业大学动物科技学院 动物育种学实验室,山东 泰安 271018
猪铜锌超氧化物歧化酶 (CuZnSOD) 是一种重要的抗氧化酶,其功能已被广泛研究,但CuZnSOD基因的转录调控尚不明确。为了研究猪CuZnSOD基因的核心启动子区域,并对其转录调控机制进行探讨,运用PCR方法从猪基因组克隆CuZnSOD基因5′上游调控区853 bp的片段,然后通过巢式PCR方法获得5′末端逐渐缺失的启动子系列片段,并将这些片段定向插入到荧光素酶报告基因表达载体 (pGL3-Basic) 中。瞬时转染小鼠胚胎细胞 (NIH/3T3),利用双荧光素酶报告基因检测不同长度启动子活性。检测结果显示,在CuZnSOD基因5′上游调控区-87 bp和-266 bp处分别存在2个潜在转录起始位点,-383 bp~+67 bp启动区活性最强,进一步缺失分析发现-75 bp~-32 bp区域内含有猪CuZnSOD基因转录所必需的基础启动子序列,其中存在多个潜在的转录因子结合位点,研究结果提示这些转录因子结合位点可能是参与CuZnSOD基因转录的重要调控序列。关键词: 猪,CuZnSOD基因,启动子,双荧光素酶报告基因
超氧化物歧化酶 (Superoxide dismutase, SOD) 是一种广泛存在于生物体中的金属酶,能够清除机体内氧化过程中产生的多余的超氧阴离子自由基,因此在维持生物体内氧自由基平衡方面起着重要作用[1]。SOD可缓解或者抑制自由基的负面效应,提高商品猪的抗氧化能力,进而改善商品猪的肉质[2-3]。目前,已从哺乳动物体内分离出3种SOD:位于细胞质基质的CuZnSOD (SOD1)、位于线粒体的MnSOD (SOD2) 和位于细胞外基质的EC-SOD (SOD3)[4]。CuZnSOD广泛分布于细胞质基质中,约占SOD总量的90%[5]。随着生物技术的发展,许多物种的CuZnSOD基因组序列已被克隆出来。杜金芳等[6]利用RACE的方法克隆得到了猪CuZnSOD基因的cDNA全长序列。Fridovich[7]的研究发现在小鼠、大鼠、人的CuZnSOD基因近端启动子区存在TATA-box、CCAAT-box以及几个富含GC的高度保守区域。人类的CuZnSOD基因的启动子已得到研究并发现了许多假定转录因子结合位点[8]。Minc等[9]已经证明sp1和Egr-1转录因子对人的CuZnSOD基因的基础表达和诱导表达发挥重要作用。目前对猪CuZnSOD基因的表达调控机制还未见报道。本研究以莱芜猪为试验对象,克隆了猪CuZnSOD基因启动子区不同长度的缺失序列,通过双荧光素酶表达载体分析启动子区的活性,旨在进一步探索CuZnSOD基因的结构与功能,为揭示CuZnSOD基因对猪抗氧化性能的影响,以及为研究其转录调控机制提供科学依据。
1 材料与方法
1.1 材料
载体pGL3-Basic、pGL 4.74及荧光素酶检测试剂盒Dual-Luciferase® Reporter Assay System均购自Promega公司。转染试剂X-tremeGENE HP购于Roche公司。限制性内切酶和Taq DNA聚合酶等常用分子生物学试剂均购自TaKaRa公司。胶回收与质粒提取试剂盒购自天根生化科技有限公司。DMEM-F12细胞培养基和新生牛血清购自Gibco公司 (美国)。莱芜猪耳组织基因组DNA、大肠杆菌DH5α和小鼠NIH/3T3细胞株均由本实验室保存。
1.2 方法
1.2.1 生物信息学分析
使用Web Promoter Scan Service (http://wwwbimas.cit.nih.gov/molbio/proscan/) 预测CuZnSOD 5′端转录起始位点;使用Primer5.0软件里的motif模块进行TATA-box、CAAT-box、GC-box的预测;使用Transcription Element Search System (http://www.cbil.upenn.edu/cgibin/tess/tess) 预测潜在的转录因子结合位点;使用TFSEARCH (http://www.cbrc.jp/htbin/nphtfsearch) 在线软件对潜在的转录因子结合位点进行预测。
1.2.2 猪CuZnSOD基因5′上游853 bp启动子序列的克隆扩增
根据NCBI基因数据库中猪CuZnSOD基因5′上游序列,设计合适的引物。上游引物SOD-F:5′-ACTCTAACCTCCTTGACGGC-3′,下游引物SOD-R:5′-AGCTCGAAGTAG ATGGTGCC-3′。使用PrimeSTAR HS DNA Polymerase,以猪基因组DNA为模板,PCR扩增CuZnSOD基因5′上游853 bp片段。
PCR扩增体系:5×PrimeSTAR缓冲液10 μL,dNTP Mixture (各2.5 mmol/L) 4 μL,上游引物(10 μmol/L) 1 μL,下游引物 (10 μmol/L) 1 μL,DNA聚合酶0.5 μL,模板DNA 1 μL,灭菌蒸馏水32.5 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,66 ℃退火30 s,72 ℃延伸60 s,共计30个循环;最后72 ℃延伸10 min。使用胶回收试剂盒回收目的PCR片段,连接到pMD18-T载体上,构建重组质粒pMD18-T-SOD1,转化至大肠杆菌DH5α中,氨苄青霉素平板涂板后培养过夜进行抗性筛选,阳性克隆经酶切鉴定,使用通用引物对其进行测序。
1.2.3 CuZnSOD基因启动子不同长度片段重组载体的构建
以测序鉴定正确的重组质粒pMD18-T-SOD1为模板,设计7条上游引物,在其上、下游引物的5'端分别引入了MluⅠ和BglⅡ酶切位点,用巢式PCR的方法扩增不同长度的5′端缺失序列,引物信息见表1。PCR扩增体系如1.2.2。反应条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,共计30个循环;最后72 ℃延伸10 min。PCR产物经分离纯化后,用限制性内切酶MluⅠ和BglⅡ进行双酶切,然后连接到同样经过MluⅠ和BglⅡ双酶切处理过的pGL3-Basic线性载体上,阳性重组子经双酶切鉴定及测序保证正确。获得7个插入CuZnSOD基因启动子不同长度片段的重组表达质粒,分别命名为pGL3-A、pGL3-B、pGL3-C、pGL3-D、pGL3-E、pGL3-F和pGL3-G。
1.2.4 细胞培养及转染
NIH/3T3细胞在含有10%新生牛血清的DMEM-F12培养基中,于37 ℃、含5%的CO2的条件下培养。转染前,将所培养细胞按照大约每孔1×105细胞接种到24孔板,待细胞完全贴壁生长至70%–90%密度时可用于转染试验。
按照Roche公司的X-tremeGENE HP转染试剂盒说明书进行转染,将猪CuZnSOD启动子报告基因质粒与内参照质粒pGL 4.74共转染至NIH/3T3细胞中。转染时每孔加入报告基因质粒0.5 μg,内参照质粒pGL 4.74 0.012 5 μg,脂质体1.5 μL,每个实验组设置4个重复,pGL3-Basic质粒和内参照质粒pGL 4.74共转染作为阴性对照。转染48 h后收集细胞,检测荧光素酶活性。
1.2.5 双荧光素酶活性测定
按Promega公司提供的Dual-luceferase Assay System试剂盒进行双荧光素酶的检测,启动子活性用相对荧光素酶值 (萤火虫荧光素酶激发底物释放荧光的数值M1与内参照海肾荧光素酶释放荧光的数值M2的比) 表示。
1.2.6 数据统计分析
各组试验数据均计算平均值及标准误,应用SAS 8.2软件进行方差分析,采用Duncan法进行均数间多重比较,统计学分析P<0.05为差异显著。

表1 PCR引物序列Table1 Primers sequence of PCR
2 结果与分析
2.1 猪CuZnSOD基因5′端序列的生物信息学分析
本研究采用PCR方法从猪基因组克隆得到CuZnSOD基因5′上游调控区853 bp的片段,用生物信息学软件分析发现,在猪CuZnSOD基因5′端-87 bp和-266 bp处存在2个潜在转录起始位点 (TSS),缺乏经典的CAAT-box和GC-box保守序列,但检测到一个TATA-box (图1)。

图1 猪CuZnSOD基因5′端调控序列及预测分析Fig. 1 Prediction of potential regulatory sequences of pig CuZnSOD 5'-flanking region. TSS: transcriptional start site.

图2 PCR扩增CuZnSOD基因5′端不同长度缺失片段Fig. 2 PCR amplification of various length deletion fragments of CuZnSOD gene promoter. M: 2 000 bp DNA marker; 1: 853 bp; 2: 753 bp; 3: 653 bp; 4: 533 bp; 5: 453 bp; 6: 353 bp; 7: 233 bp.
2.2 CuZnSOD基因启动子及缺失片段的克隆
以重组质粒pMD 18-T-SOD1为模板,以不同的引物扩增不同长度的5′侧翼序列,片段预期长度分别为853 bp、753 bp、653 bp、533 bp、453 bp、353 bp和233 bp,琼脂糖凝胶电泳分析显示得到了预期大小的片段 (图2),PCR扩增产物与预期片段大小相符。
2.3 荧光素酶表达载体的构建及酶切鉴定
构建的荧光素酶报告基因载体经限制性内切酶MluⅠ和BglⅡ双酶切,酶切产物经1.2%琼脂糖凝胶电泳分离 (图3)。检测结果表明,酶切下的目的片段大小与预期吻合。将重组载体进行测序,测序结果亦表明插入片段序列及方向正确无误。
2.4 5′端缺失片段的双萤光素酶活性检测
将上述构建的含CuZnSOD不同长度启动子的7种表达载体与内参照pGL 4.74载体分别共转染NIH/3T3细胞,以pGL3-Basic和pGL 4.74共转染作为阴性对照,48 h后收集细胞,测定荧光素酶的相对表达活性。结果表明,pGL3-E活性最强,启动子活性都显著性高于其他载体 (P<0.05)。从pGL3-E到pGL3-G,相对活性出现了显著下降 (P<0.05),pGL3-F的相对荧光素酶活性是pGL3-E的75%,pGL3-G的相对荧光素酶活性是pGL3-E的33%。pGL3-F和pGL3-G相对于pGL3-E都缺少了-385~-285 bp区域,提示-385~-285 bp区域内存在正调控区域或增强子。
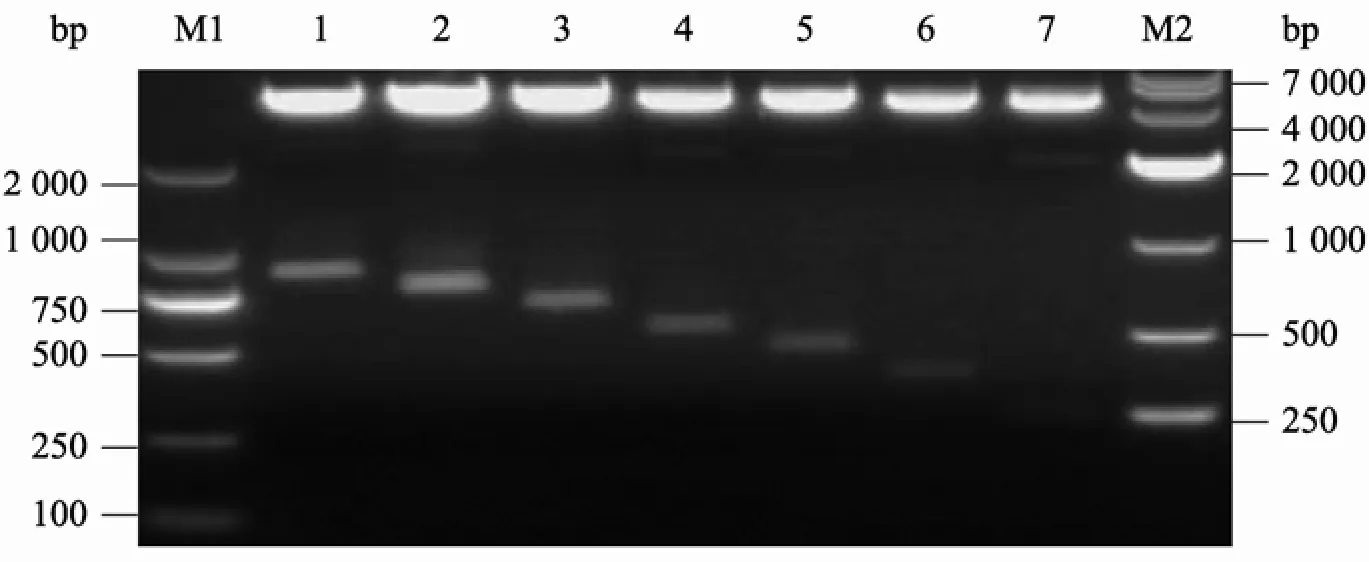
图3 重组载体的酶切鉴定Fig. 3 Identification of recombinant plasmids with digestion. M1: 2 000 bp DNA marker; M2: 10 000 bp DNA marker; 1: 853 bp; 2: 753 bp; 3: 653 bp; 4: 533 bp; 5: 453 bp; 6: 353 bp; 7: 233 bp.

图4 猪CuZnSOD基因5′侧翼序列的启动子活性检测Fig. 4 Results of 7 fragments analyzed with dual-luciferase reporter system. pGL3-A-G: the activity of A-G in pGL3-Basic vector, respectively; pGL3-Basic: negative control, the activity in blank vector. Different letters indicate significant difference (P<0.05).
2.5 核心启动子的确立
根据CuZnSOD基因调控区7个缺失片段相对活性的检测结果,我们以重组载体pGL3-G为模板,再次设计4条上游引物SOD1-G1、SOD1-G2、SOD1-G3和SOD1-G4 (表1),预期得到片段大小分别为192 bp、174 bp、143 bp和100 bp,按照上述相同的方法构建重组载体,依次命名为pGL3-G1、pGL3-G2、pGL3-G3和pGL3-G4 (图5)。按照同样的方法分别转染细胞检测荧光素酶活性。结果发现,从pGL3-G到pGL3-G4,启动子相对活性出现了显著下降(P<0.05),重组载体pGL3-G2与pGL3-G3相差了31个碱基,但两者的相对活性差异不显著(P>0.05)。pGL3-G3与pGL3-G4的启动子相对活性差异显著 (P<0.05),但pGL3-G4的启动子活性与pGL3-Basic无显著差异 (P>0.05) (图6)。这表明在-75~-32 bp范围内存在调控基础转录活性元件。为了进一步确定该调控序列,使用在线软件TESS对该区域进行预测,表明这一区域有RAF (TCGG)、T-Ag (GCGGC)、ADR1 (TCTCC)、MAZ (CCCTCCC)、CTCF (CCCTC)、 AP-2和AP-2α (CCMNSSS) 等重要转录因子的潜在结合位点;用TFSEARCH分析这一序列含有HSF、Egr-1和ADR1等转录因子结合位点。

图5 二次构建的重组载体双酶切鉴定Fig. 5 Identification of 4 recombinant plasmids with digestion. M1: 2 000 bp DNA marker;M2: 10 000 bp DNA marker; 1: 100 bp; 2: 143 bp; 3: 174 bp: 4: 192 bp.
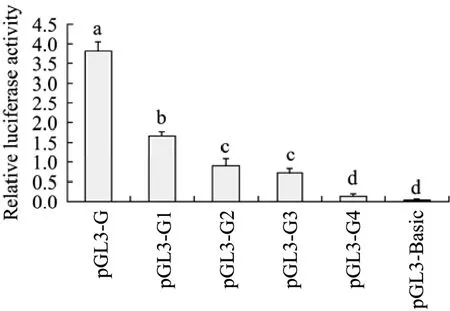
图6 二次构建的重组载体的启动子活性Fig. 6 Results of 4 fragments analyzed with dual-luciferase reporter system. Different letters indicate significant difference (P<0.05).
3 讨论
超氧化物歧化酶是一种重要的细胞内抗氧化酶,能够保护细胞以抵御超氧化物自由基的侵害,它能将超氧阴离子自由基快速歧化为H2O2和O2[10]。许多刺激都可以影响CuZnSOD基因的表达,例如应激、促炎性细胞因子、生长因子[11-12]等。Park等[13]研究结果表明,CuZnSOD基因的5′侧翼含有一个抗氧化反应元件 (ARE);ARE是一个DNA基序,它存在于一些因应答氧化应激而被活化的解毒基因的上游调控区域中[14]。
真核生物启动子属于mRNA基因启动子,相对复杂,位于结构基因5′端上游,主要包括TATA-box、起始子、CAAT-box和GC-box等,其中的TATA-box和起始子被称为核心启动子[15],TATA-box是转录因子TF II D的TBP亚基的结合位点。本研究利用PCR技术克隆了CuZnSOD基因5′上游启动子区853 bp (-785 bp~+67 bp)长度的片段,并通过DNA序列分析证实了其序列无突变。生物信息学软件分析发现距起始密码子ATG上游105 bp处含有一个TATA-box,符合真核生物基因的典型启动子结构。
分析启动子活性,需要将启动子插入到报告基因的上游构建表达载体,通过转染细胞来检测启动子对报告基因表达水平的影响。韩凤桐等[16]和张东杰等[17]采用这种方法分别对牛Sry基因和猪MC4R基因的核心启动子区进行了分析,均发现了一段对目的基因基础转录活性起重要作用的序列。Ruan等[18]对猪生长激素基因启动子进行了研究,发现该基因的最小启动子区为-110 bp~+61 bp;Ling等[19]研究表明在猪脂联素基因启动子-1 671 bp~-1 455 bp区域内存在着对脂联素基因高表达所需的潜在调控元件。本研究利用巢式PCR的方法获得一系列5′末端逐渐缺失的CuZnSOD基因启动子,并将这些片段定向连接到pGL3-Basic载体上,然后与内参质粒pGL 4.74共转染细胞以检测启动子的活性。pGL3-Basic含有萤火虫荧光素酶报告基因,不含启动子,其荧光素酶活性直接反映了克隆区域内启动子的活性;内参质粒pGL 4.74含有海肾荧光素酶报告基因,用来校正转染效率。为消除实验误差,每次转染和测定都做重复样。检测结果表明:第一次构建的7种载体中pGL3-E活性最强,启动子活性都显著性高于其他载体 (P<0.05),pGL3-A次之,pGL3-G活性最弱,但也显著性高于pGL3-Basic (P<0.05),从pGL3-E到pGL3-G,相对活性逐渐下降。为进一步缩小区域以确定该基因启动子重要调控区域,本研究利用相同方法又构建了4个不同长度启动子的重组载体。荧光素酶活性分析表明,从pGL3-G到pGL3-G4相对活性出现了显著下降,pGL3-G3和pGL3-G4之间差异显著 (P<0.05),但pGL3-G4已不再具有启动活性,因此认为pGL3-G4相对pGL3-G3所缺少的-75 bp~-32 bp这一片段中包含着CuZnSOD基因的重要调控序列。
Minc等[9]研究表明人CuZnSOD基因启动子-71~+1 bp区域对基础水平的转录是必需的,并且已经确认-59~-48 bp区域能够结合SP-1和Egr-1。本研究利用TESS生物信息学软件分析-75~-32 bp这一区域,发现在这44 bp的片段里存在多个潜在转录因子的结合位点,如RAF (TCGG)、T-Ag (GCGGC)、ADR1 (TCTCC)、MAZ (CCCTCCC)、CTCF (CCCTC)、AP-2和AP-2α (CCMNSSS) 等潜在结合位点;利用TFSEARCH软件分析发现该区域含有HSF、Egr-1和ADR1等转录因子结合位点,这提示乙醇脱氢酶基因调节因子ADR1可能参与猪CuZnSOD基因的转录调控。Kim等[20]研究表明AP2、CREB和HSF可能参与鼠CuZnSOD基因表达;Gralla等[21]研究表明铜依赖性转录因子ACE1能够激活酵母CuZnSOD基因的表达;Minc等[9]和Seo等[22]研究都表明sp1在人CuZnSOD基因的表达调控中起着关键作用,说明不同物种CuZnSOD基因的表达中起关键转录调控因子可能有所不同。
本研究通过构建缺失片段的荧光素酶报告基因重组载体,将猪的CuZnSOD基因启动子区核心元件定位在-75~-32 bp区域内,研究结果不仅为详细阐明猪CuZnSOD基因的表达调控机制奠定了基础,而且也将为研究与猪CuZnSOD基因启动子区结合的转录因子提供数据参考。
REFERENCES
[1] Zyracka E, Zadrag R, Koziol S, et al. Yeast as a biosensor for antioxidants: simple growth tests employing a Saccharomyces cerevisiae mutant defective in superoxide dismutase. Acta Biochim Pol, 2005, 52(3): 679-684.
[2] Li H, Zeng YQ, Wei SD, et al. Changes of superoxide dismutase activity and malondialdehyde level in postmortem muscle and their association with meat quality in pigs. Acta Vet Zootech Sin, 2010, 41(3): 257-261 (in Chinese).李华, 曾勇庆, 魏述东, 等. 猪宰后肌肉SOD与MDA的变化及其对肉质特性的影响. 畜牧兽医学报, 2010, 41(3): 257-261.
[3] Du JF, Zeng YQ, Wang H, et al. CuZnSOD gene expression and its relationship with anti-oxidative capacity and pork quality. S Afr J Anim Sci, 2010, 40(3): 265-272.
[4] Covarrubias L, Hernández-García D, Schnabel D, et al. Function of reactive oxygen species during animal development: passive or active. Dev Biol, 2008, 320(1): 1-11.
[5] Noor R, Mittal S, Iqbal J. Superoxide dismutase-applications and relevance to human diseases. Med Sci Moint, 2002, 8(9): 210-215.
[6] Du JF, Zeng YQ, Chen W, et al. Cloning, expression and functional analysis of CuZnSOD gene in swine. Hereditas, 2010, 32(10): 1037-1042 (in Chinese).杜金芳, 曾勇庆, 陈伟, 等. 猪CuZnSOD基因的克隆、表达及功能分析. 遗传, 2010, 32(10): 1037-1042.
[7] Fridovich I. Superoxide dismutases. Ann Rev Biochem, 1975, 44: 147-159.
[8] Kim HT, Kim YH, Nam JW, et al. Study of 5′-flanking region of human Cu/Zn superoxide dismutase. Biochem Biophys Res Commun, 1994, 201(3): 1526-1533.
[9] Minc E, de Coppet P, Masson P, et al. The human copper-zinc superoxide dismutase gene (SOD1) proximal promoter is regulated by Sp1, Egr-1, and WT1 via non-canonical binding sites. J Biol Chem, 1999, 274(1): 503-509.
[10] Zelko IN, Mariani TJ, Folz RJ. Superoxide dismutase multigene Family: a comparison of the CuZnSOD (SOD1), MnSOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression. Free Radical Biol Med, 2002, 33(3): 337-349.
[11] Chang MS, Yoo HY, Rho HM. Transcriptional regulation and environmental induction of gene encoding copper- and zinc-containing superoxide dismutase. Method Enzymol, 2002, 349: 293-305.
[12] Yoo HY, Chang MS, Rho HM. The activation of the rat copper/zinc superoxide dismutase gene by hydrogen peroxide through the hydrogen peroxide-responsive element and by paraquat and heat shock through the same heat shock element. J Biol Chem, 1999, 274(34): 23887-23892.
[13] Park EY, Rho HM. The transcriptional activation of the human copper/zinc superoxide dismutase gene by 2,3,7,8-tetrachlorodibenzo-p-dioxin through two different regulator sites, the antioxidant responsive element and xenobiotic responsive element. Mol Cell Biochem, 2002, 24(1/2): 47-55.
[14] Mulcahy RT, Wartman MA, Bailey HH, et al. Constitutive and beta-naphthoflavone-induced expression of the human gamma-glutamylcysteine synthetase heavy subunit gene is regulated by a distal antioxidant response element/TRE sequence. J Biol Chem, 1997, 272(11): 7445-7454.
[15] Pedersen AG, Baldi P, Chauvin Y, et al. The biology of eukaryotic promoter prediction. Compute Chem, 1999, 23(6): 91-209.
[16] Han FT, Lin XK, Liu D, et al. Identification of the regulation sequences of bovine sry promoter. SciAgric Sin, 2010, 43(14): 2996-3004 (in Chinese)韩凤桐, 林秀坤, 刘娣, 等. 牛Sry启动子调控序列的鉴定. 中国农业科学, 2010, 43(14 2996-3004.
[17] Zhang DJ, Wang L, Liu D, et al. Cloning an activity analysis of promoter of pi melanocortortin-4 receptor gene (MC4R). J Agr Biotech, 2011, 19(4): 734-739 (in Chinese).张东杰, 汪亮, 刘娣, 等. 猪黑素皮质激素受体-4基因 (MC4R) 启动子克隆及其分析. 农业生物技术学报, 2011, 19(4): 734-739.
[18] Ruan N, Zhang MJ, Ju HM, et al. Cloning an functional analysis of the porcine growth hormon gene promoter. Agr Sci Technol, 2012, 13(4 893-896.
[19] Ling F, Li JQ, Chen YS, et al. Cloning an characterization of the 5′-flanking region of the pig adiponectin gene. Biochem Biophys Res Commun, 2009, 381(2): 236-240.
[20] Kim YH, Yoo HY, Jung G, et al. Isolation and analysis of the rat genomic sequence encoding Cu/Zn superoxide dismutase. Gene, 1993, 133(2): 267-271.
[21] Gralla EB, Thiele DJ, Silar P, et al. ACE1, a copper-dependent transcription factor, activates expression of the yeast copper, zinc superoxide dismutase gene. Proc Nati Acad Sci USA, 1991, 88(19): 8558-8562.
[22] Seo SJ, Kim HT, Cho G, et al. Spl and C/EBP-related factor regulate the transcription of human Cu/Zn SOD gene. Gene, 1996, 178(1/2): 177-185.
(本文责编 陈宏宇)
Cloning and analysis of promoter of pig copper zinc superoxide dismutase gene (CuZnSOD)
Yuan Shi*, Wei Chen*, Yongqing Zeng, Honglei Zhu, Zhenggang Xu, Zhe Zhang, Yun Yang, and Tianyang Zhang
Laboratory of Animal Breeding and Genetics, College of Animal Science and Technology, Shandong Agricultural University, Tai’an 271018, Shandong, China
Pig copper zinc superoxide dismutase (CuZnSOD) is an important antioxidant enzyme. Some studies focused on the function of CuZnSOD gene, but the transcriptional regulation of the CuZnSOD gene is not yet fully elucidated. Therefore, the aims of the study were to determine the core promoter region and to explore its mechanism of transcriptional regulation. The 853 bp DNA sequence of 5′-flanking promoter was amplified by performing PCR. A series of CuZnSOD promoter fragments with gradually truncated 5′-end were produced by nested PCR and inserted into pGL3-Basic vector. The activities of the promoters were measured by the dual-luciferase assay system after transient transfection into the NIH/3T3 cells. The results demonstrated that there were 2 potential transcription start sites in the regions from initiation codon to -87 bp and -266 bp, respectively. The region from -383 bp to +67 bp in CuZnSOD gene promoter showed higher activity than other regions, and further deletion analysis demonstrated that the region from -75 bp to -32 bp contained an essential promoter sequence for pig CuZnSOD gene transcription. In addition, several potential transcription factor binding sites were predicted with bioinformatics method. These results suggest that these transcription factor binding sites may be involved in the transcriptional regulation of CuZnSOD gene.
pig, CuZnSOD gene, promoter, dual-luciferase reporter gene
May 21, 2013; Accepted: August 1, 2013
Yongqing Zeng. E-mail: yqzeng@sdau.edu.cn
石元, 陈伟, 曾勇庆, 等. 猪CuZnSOD基因启动子的克隆鉴定及分析. 生物工程学报, 2014, 30(2): 213-222.
Shi Y, Chen W, Zeng YQ, et al. Cloning and analysis of promoter of pig copper zinc superoxide dismutase gene (CuZnSOD). Chin J Biotech, 2014, 30(2): 213-222.
Supported by: National Transgenic Major Program (Nos. 2011ZX08006-002, 2013ZX08006-002), National High Technology Research and Development Program of China (863 Program) (No. 2008AA101008), Shandong Province Modern Pig Industry Technique System Project (No. SDAIT-06-011-02), Shandong Province Agricultural Animal Breeding Project of China (No. 2011LZ013-03).
*These authors contributed equally to this study.
国家转基因重大专项 (Nos. 2011ZX08006-002,2013ZX08006-002),国家高技术研究发展计划 (863计划) (No. 2008AA101008),山东省现代农业 (生猪) 产业技术体系建设专项 (No. SDAIT-06-011-02),山东省农业良种工程重大项目 (No. 2011LZ013-03) 资助。
时间:2013-08-16 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20130816.1714.004.html
