猪bmp15基因报告载体的构建及其特异性
2014-06-15秦明鸣魏江华俞晓丽张景龙刘晓鹏马晓玲王华岩西北农林科技大学动物医学院陕西省干细胞工程技术研究中心陕西杨凌700陕西万盛肉类加工有限公司陕西杨凌700
秦明鸣,魏江华,俞晓丽,张景龙,刘晓鹏,马晓玲,王华岩 西北农林科技大学动物医学院,陕西省干细胞工程技术研究中心,陕西 杨凌 700 陕西万盛肉类加工有限公司,陕西 杨凌 700
猪bmp15基因报告载体的构建及其特异性
秦明鸣1,魏江华2,俞晓丽1,张景龙1,刘晓鹏1,马晓玲1,王华岩1
1 西北农林科技大学动物医学院,陕西省干细胞工程技术研究中心,陕西 杨凌 712100 2 陕西万盛肉类加工有限公司,陕西 杨凌 712100
为了研究骨形态发生蛋白15 (bmp15) 基因的表达和调控特性,通过克隆猪bmp15基因2.2 kb启动子片段,构建pBMP15-EGFP报告载体,实现监测干细胞向类卵母细胞分化的过程。以猪卵巢组织和中国仓鼠卵巢细胞 (CHO)、成肌细胞 (C2C12)、猪羊水干细胞 (pAFSC) 为材料,通过RT-PCR、免疫荧光、细胞转染、显微注射检测bmp15组织特异性表达,并且通过单层细胞诱导检测该基因体外示踪类卵母细胞获得过程的能力。RT-PCR结果显示bmp15在猪的卵巢组织中特异表达,在CHO中表达,而在C2C12和pAFSC中不表达。卵巢组织切片免疫荧光检测结果显示bmp15表达于卵泡发育的各个阶段。瞬时转染不同细胞发现启动子只在CHO中有活性,而在C2C12和pAFSC中均无活性。显微注射重组质粒片段结果显示增强绿色荧光蛋白(Enhanced Green Fluorecence Protein,EGFP) 在卵母细胞体外成熟18 h启动表达,并能够持续至4-细胞期胚胎。单层细胞诱导结果显示诱导12 d的pAFSC出现携带EGFP的圆形细胞团。说明bmp15具有表达特异性和示踪干细胞诱导分化为类卵母细胞的潜能。
猪,bmp15,启动子,基因表达,猪羊水干细胞
骨形态发生蛋白15 (Bone morphogenetic protein 15,Bmp15) 是一种自分泌生长因子,与生长分化因子9 (Grow differential factor 9,Gdf9) 同属于TGFβ家族成员,在早期卵泡的生长发育及排卵过程中起重要作用[1]。bmp15与gdf9都是卵母细胞发育的特异性基因,它们之间具有高度相似的结构[2],都在卵母细胞成熟和受精过程中发挥重要的作用[3]。Bmp15与颗粒细胞上BMPRII型受体结合,使促卵泡雌激素(Follicle-stimulating hormone, FSH) 受体表达下调,因此抑制了依赖FSH的StAR、P450scc等基因的表达,显示了抑制黄体化的作用[4]。对Bmp15的相关研究能够使研究者更好地理解生殖细胞发生发育分化过程的分子机制,为体外诱导胚胎干细胞 (Embroyonic stem cell, ESC) 和诱导多能干细胞 (Induced pluripotent stem cell, iPSC) 向生殖细胞诱导分化提供了理论基础。
目前,用ESC、iPSC和成体干细胞 (Adult stem cell, ASC) 诱导原始生殖细胞的研究取得了一定进展[5-8],诱导的卵母细胞已具有获得成活的小鼠后代的能力[9]。为了示踪并验证不同时期雌性生殖细胞的产生,一系列与生殖细胞相关的EGFP启动子报告载体被构建出来,其中有Oct4-EGFP[8]、Gdf9-EGFP[10]、Dazl-EGFP[11]和Figlα-EGFP[12]等。因此,利用bmp15基因的EGFP启动子报告载体可作为体外获取卵母细胞的潜在标记。
羊水干细胞是存在于胎儿羊水中的多能性干细胞,来源于胎儿组织[13]。这些细胞呈Oct4阳性,同时表达部分成体干细胞标记,具有强大的增殖能力和向三胚层分化的潜能[14],可在体外分化为脂肪细胞[15]、跳动样心肌细胞等[16],是一种具有重要研究价值的新型干细胞。本研究通过检测bmp15的组织表达特异性、构建启动子报告载体、细胞转染、显微注射等技术手段,检测重组质粒的活性,并用于诱导猪羊水干细胞向类卵母细胞分化过程的示踪。

表1 PCR引物序列Table 1 PCR Primer Sequences
1 材料与方法
1.1 菌种、载体及细胞
大肠杆菌DH5α,质粒pEGFP-1、pEGFP-C1,中国仓鼠卵巢细胞 (CHO)、小鼠成肌细胞(C2C12)、猪羊水干细胞 (Porcine amniotic fluid stem cell,pAFSC) 由陕西省干细胞工程技术研究中心保存。猪卵母细胞 (Porcine oocyte,pO)采集于陕西万盛肉类加工有限公司的屠宰场。pGEM-T Easy载体购自Promega公司。
1.2 试剂及耗材
总RNA提取试剂盒、基因组提取试剂盒、质粒提取试剂盒、凝胶回收试剂盒、多聚赖氨酸处理载玻片等常规试剂,均购自天根公司;DNA marker购自BioLabs公司;限制性内切酶、T4 DNA连接酶、反转录试剂盒和Taq聚合酶均购自Fermentas 公司;Opti-MEM、α-MEM、DMEM和M199培养基均购自Invitrogen 公司;FSH、孕马血清促性腺激素 (PMSG)、人绒毛膜促性腺激素 (HCG) 均购自宁波第二激素厂;非必需氨基酸 (NEAA)、L-谷氨酰胺 (L-Glu)、β-巯基乙醇 (β-ME)、阳离子脂质体 (Lipofectamine 2000)、胎牛血清 (FBS)、表皮生长因子 (EGF)购自Gibco公司;兔抗Bmp15抗体和羊抗兔Cy3二抗均购自Abcam 公司;PCR引物由上海生工生物工程技术服务有限公司合成。
1.3 RT-PCR检测bmp15在成年猪组织和几种细胞系中的表达特异性
从成年猪卵巢、睾丸、胃、肝脏、肌肉、肾脏、心脏、胸腺、肺脏组织中提取总RNA,同时提取CHO、C2C12、pAFSC和pO的总RNA;反转录为cDNA,用RT-PCR方法检测bmp15在成年猪组织和几种细胞系中的表达特异性 (表1)。
1.4 免疫组织化学法定位猪卵巢组织内Bmp15表达
取成年猪卵巢组织,用4%多聚甲醛固定并用石蜡包埋,常规方法制作2 μm石蜡切片。将石蜡切片贴附于多聚赖氨酸处理过的载玻片上。经60 ℃烘片5–6 h,进行免疫荧光染色:切片以二甲苯脱蜡及梯度酒精复水;用0.01 mol/L 枸橼酸钠缓冲液加热至沸腾进行抗原修复;以5% BSA室温封闭30 min;加入兔抗Bmp15抗体4 ℃过夜;PBS pH 7.2–7.4,洗片5 min,重复洗3次加稀释的羊抗兔Cy3二抗工作液,37 ℃孵育30 min;PBS 洗片5 min,重复洗3次加入DAPI染核1 min;PBS 洗片5 min,重复洗3次通过水洗、脱水、透明、中性树胶封片,在荧光显微镜下观察照相。
1.5 猪bmp15启动子片段的分子克隆及报告载体的构建
从猪卵巢组织提取基因组DNA,在猪的bmp15基因序列 (GenBank Accesion No. 448811) 的上游区域设计启动子引物,在设计好的引物上游加入XhoⅠ酶切位点,下游加入Hind Ⅲ酶切位点 (表1)。克隆长度为2.2 kb (-2 166~+0)的bmp15启动子片段。产物用琼脂糖凝胶DNA回收试剂盒进行回收,并与pGEM-T Easy载体连接,连接产物转化到大肠杆菌DH5α中。挑取阳性克隆提取质粒,经限制性内切酶XhoⅠ、Hind Ⅲ双酶切鉴定。酶切鉴定正确的质粒送上海生工生物工程有限公司测序。测序正确的质粒与pEGFP-1使用限制性内切酶XhoⅠ和Hind Ⅲ酶切,胶回收连接后转化,挑取单克隆菌落培养并提取质粒,用限制性内切酶SacⅠ、Hind Ⅲ双酶切鉴定,阳性质粒命名为pBMP15-EGFP。
1.6 猪bmp15启动子在不同细胞系中的表达活性检测
将阳性对照pEGFP-C1和构建好的pBMP15-EGFP报告载体通过脂质体转染法转染培养于24孔板培养皿中的CHO、C2C12、pAFSC。转染前1 d对细胞进行传代,当细胞密度达到80%时即可进行转染。转染前2 h加入0.5 mL含5%血清的培养液对细胞进行饥饿处理。取0.8 μg pBMP15-EGFP和50 μL无血清的稀释液Opti-MEM混合,2 μL脂质体与50 μL Opti-MEM混合;5 min后,将上述两种混合物混合 (总体积100 μL),轻轻混合均匀,在室温下孵育25 min,加入含有适量新鲜培养液的细胞中;放入37 CO℃2培养箱中培养,4–6 h后更换含10% 血清的新鲜培养液;转染24 h后用荧光显微镜观察。
1.7 猪bmp15启动子在卵母细胞中的表达活性检测
从屠宰场收集猪卵巢,32–38 ℃保存在含有青霉素和链霉素的生理盐水中,2 h内运回实验室。用抽吸法采集卵巢卵母细胞,用含青霉素和链霉素的生理盐水冲洗卵巢3–5次,然后抽取3–6 mm卵泡中的猪卵泡液 (Porcine follicle fluid, pFF) 置于离心管中,37 ℃水浴静置数分钟,待卵子沉降后,收取猪卵泡液,离心过滤备用。将卵母细胞用洗卵液洗两遍,实体显微镜下挑取胞质均匀、颗粒细胞层达两层以上的颗粒细胞-卵母细胞复合物 (Cumulus oocyte complex,COC),COC分别在预热的洗卵液和成熟培养液中各洗3次,之后在培养箱中孵育2 h,取出用0.3%透明质酸酶溶液脱去颗粒细胞。将重组质粒用XhoⅠ和NotⅠ酶切,获得pBMP15-EGFP启动子报告基因片段,通过胶回收纯化处理后注射入脱颗粒的卵母细胞中,于18 h时观察卵母细胞绿色荧光的表达情况。之后孤雌激活的卵母细胞转入胚胎培养液中培养,2–3 d后观察卵裂情况,用荧光显微镜观察卵裂细胞绿色荧光的表达。
1.8 猪bmp15启动子在重编程细胞中的检测
将P10–P15代的pAFSC接种至12孔培养板中,在38 ℃、5% CO2条件下用羊水干细胞培养液 (α-MEM+ 10% FBS+ 2 mmol/L L-Glu+ 100 U/mL青霉素+ 100 U/mL链霉素) 培养。待细胞密度达到60%–70%汇合度时,用胰酶消化后,将细胞接种至60 mm细胞培养皿中。待细胞贴壁后,将培养液换为羊水干细胞诱导液(α-MEM+ 5% pFF+ 5% FBS+ 1 mmol/L NEAA+ 1% β-ME+ 1 mmol/L L-Glu+ 1.5 μmol/L EGF)。此时记为0 d,隔天换液,培养12 d,观察诱导细胞的形态变化并对瞬时转染pBMP15-EGFP质粒的细胞绿色荧光进行观察。
2 结果
2.1 猪bmp15组织和细胞表达特异性及内源Bmp15在卵巢组织中的定位
采用RT-PCR方法对猪的卵巢、睾丸、胃、肝脏、肌肉、肾脏、心脏、胸腺、肺脏等9种组织进行了检测,结果显示,bmp15具有组织表达特异性,只在卵巢组织中高表达,而在其他组织中低表达或不表达 (图1A)。对不同来源的细胞进行RT-PCR检测结果显示,在猪卵母细胞以及CHO中表达,而在C2C12和pAFSC中不表达,显示了bmp15在不同细胞中的表达特异性 (图1B)。
通过免疫荧光方法对猪卵巢组织进行检测,结果显示,与未加一抗的阴性对照组 (图2D) 相比,初级卵泡 (图2A)、次级卵泡 (图2B)和成熟卵泡 (图2C) 中均可观察到bmp15阳性细胞的存在,说明Bmp15蛋白表达。这一结果显示Bmp15存在于卵泡发育的各个阶段。
2.2 猪bmp15启动子片段的克隆及pBMP15-EGFP重组质粒的筛选和鉴定
以猪卵巢组织提取的基因组为模板,经PCR扩增得到约2.2 kb的片段 (图3A)。DNA片段测序结果通过BLAST比对表明,克隆序列与预期片段相同,说明克隆的片段为猪bmp15序列的上游启动子片段。将此启动子片段上传NCBI获得GenBank登录号为KF114861。与报告载体pEGFP-1连接的重组质粒,通过限制性内切酶SacⅠ和Hind Ⅲ双酶切获得1 kb和5.3 kb两个片段,结果与预期相符 (图3B),说明重组报告载体构建成功,命名为pBMP15-EGFP (图3C)。

图1 骨形成蛋白15在猪不同组织和细胞系中的表达Fig. 1 RT-PCR analysis of bmp15 expression in porcine tissues and different cells. (A) Nine porcine tissues. 1-9: ovary, testis, stomach, liver, muscle, kidney, heart, thymus and lung. (B) 1-4: pO, CHO, pAFSC and C2C12.
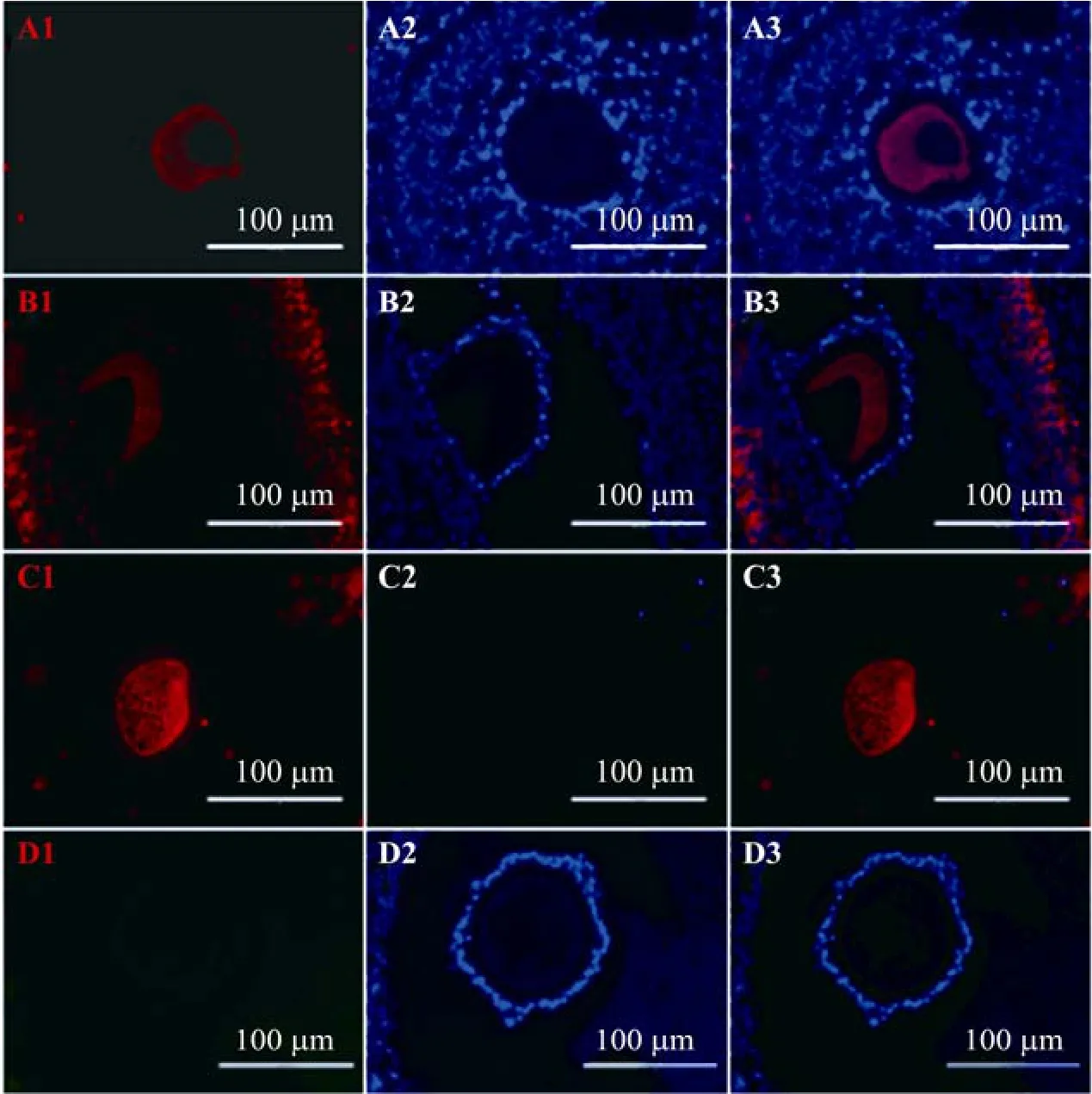
图2 免疫荧光检测Bmp15在猪卵巢组织中的表达Fig. 2 Immunofluorescence assay of Bmp15 expression in porcine ovary. (A) Primary follicle. (B) Secondary follicle. (C) Matured follicle. (D) Negative control without primary antibody. 1: Bmp15 staining; 2: nucleus staining with DAPI; 3: the merged images.

图3 bmp15启动子片段克隆及报告载体构建Fig. 3 Subclone and construction of bmp15 reporter vector. (A) PCR product of bmp15 promoter. (B) SacⅠand Hind Ⅲ digestion of the recombinant plasmid. M: DNA marker. (C) The recombinant plasmid.
2.3 pBMP15-EGFP在不同细胞系和卵母细胞中的活性检测
将重组载体pBMP15-EGFP及阳性对照载体pEGFP-C1分别转染CHO、C2C12、pAFSC等细胞中,24 h后在荧光显微镜下观察,发现转染重组载体及阳性对照载体的CHO细胞均有表达EGFP阳性细胞的存在 (图4A、4D)。在C2C12和pAFSC中,转染pEGFP-C1的细胞均能检测到EGFP的表达 (图4B、4C),而转染重组质粒的细胞均未观察到EGFP阳性细胞的存在 (图4E、4F)。这说明bmp15启动子在CHO中有活性,而在成肌细胞和猪羊水干细胞中没有活性。
为了进一步验证启动子片段在卵母细胞中的活性,将XhoⅠ和NotⅠ双酶切获得BMP15-EGFP片段,显微注射入去颗粒细胞的GV期卵母细胞中。结果显示,在卵母细胞体外成熟至18 h时,绿色荧光出现在大多数卵母细胞中 (图5A)。将注射有DNA片段的卵母细胞进行体外激活,发育至2-4细胞时仍可以检测到微弱的绿色荧光,说明Bmp15在卵母细胞体外成熟过程中发挥功能作用 (图5B、5C)。在未注射BMP15-EGFP片段的GV期猪卵母细胞(图5D)、2-细胞期胚胎 (图5E) 和4-细胞期胚胎 (图5F) 中,均未检测到绿色荧光蛋白的表达。
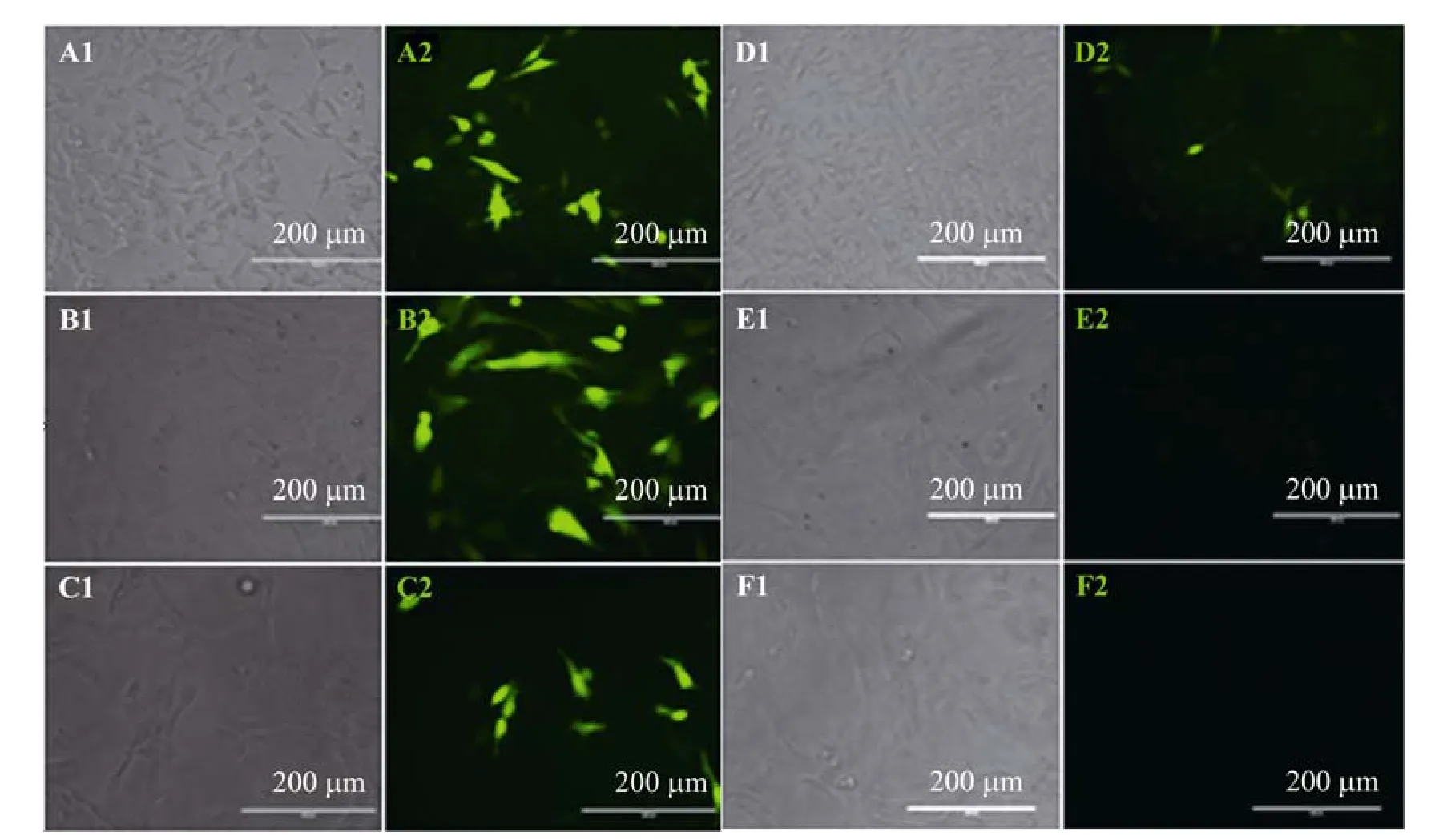
图4 pBMP15-EGFP重组质粒在不同细胞中的表达检测Fig. 4 Identification of bmp15 promoter activity in different cell lines after the transient transfection. (A) CHO cells with pEGFP-C1. (B) pAFSC with pEGFP-C1. (C) C2C12 cells with pEGFP-C1. (D) CHO cells with pBMP15-EGFP. (E) pAFSC with pBMP15-EGFP. (F) C2C12 cells with pBMP15-EGFP. 1: light images; 2: fluorescence images.

图5 BMP15-EGFP片段显微注射入猪卵母细胞Fig. 5 Microinjection of the BMP15-EGFP DNA fragment into porcine oocyte. (A) BMP15-EGFP in matured oocytes in vitro for 18 h. (B) BMP15-EGFP in 2-cell embryos. (C) BMP15-EGFP in 4-cell embryos. (D) Negative control in matured oocytes in vitro for 18 h. (E) Negative control in 2-cell embryos. (F) Negative control in 4-cell embryos. 1: light images; 2: fluorescence images.
2.4 pBMP15-EGFP重组质粒在pAFSC诱导分化过程中的示踪作用
羊水干细胞在诱导液中培养,使其向类卵母细胞转分化。为了示踪分化过程,将pBMP15-EGFP瞬时转染入诱导的类卵母细胞中,在荧光显微镜下观察绿色荧光蛋白。结果显示,经过诱导的猪羊水干细胞在诱导过程中细胞形态发生明显变化,细胞形态由原来的成纤维样转变为圆形。诱导12 d,可见培养皿中存在大量的圆形细胞团,直径在40–60 μm左右(图6A),绿色荧光在圆形细胞团中表达 (图6B),团块中存在可见多个细胞核 (图6C),呈现出类似卵母细胞的细胞结构。

图6 pBMP15-EGFP示踪pAFSC诱导分化Fig. 6 pBMP15-EGFP monitoring the differentiation of pAFSC into OLCs after 12 days induction. (A) The OLCs. (B) The GFP expression after transient transfect pBMP15-EGFP into OLCs. (C) DAPI staining. (D) The merge image.
3 讨论
Bmp15和Gdf9具有相似的结构,同属于TGFβ家族成员。但是,与其他TGFβ超家族成员不同的是,Bmp15和Gdf9均缺乏保守序列中7个半胱氨酸中的第4个半胱氨酸残基,而该半胱氨酸与蛋白质的二硫键形成有关,因此它们通常以单体、异源二聚体或同源二聚体等形式发挥作用[18]。猪bmp15在组织中的表达分布主要集中在卵母细胞中,而gdf9除在卵母细胞中表达外,也可以在猪的其他组织中检测到。显然,bmp15的组织特异性更强,这可能与猪的bmp15基因定位于X染色体上有某种关系[19]。
CHO细胞系是中国仓鼠卵巢上皮细胞,可单层贴壁培养,具有卵巢组织的特异性,因此作为阳性参照细胞。C2C12是小鼠成肌细胞,作为阴性参照细胞,而作为实验组的pAFSC,则验证bmp15启动子是否具有在该细胞内工作的能力。结果显示,此启动子不能在C2C12和pAFSC工作,这与预期相符。绿色荧光蛋白仅在CHO中有表达,可能因为种属差异造成表达量较低。为了进一步验证启动子的工作能力,显微注射BMP15-EGFP片段至体外成熟的卵母细胞中,发现成熟18 h时可见明显绿色荧光,这与Li等实验结果相符。他们检测到Bmp15在体外成熟18 h的猪卵母细胞中表达量达到峰值,之后表达量逐渐减弱[17]。体外成熟至2–4细胞期的孤雌胚胎,绿色荧光蛋白的表达也随着胚胎发育而减弱。猪卵母细胞体内发育过程转录组数据也显示,猪Bmp15在卵母细胞时期的表达量要高于胚胎期的表达量 (数据未发表)。
之前的实验证明,小鼠胚胎干细胞在体外先分化为原始生殖细胞,之后通过诱导产生类卵母细胞[20]。这一分化潜能通过减数分裂相关基因的检测而进一步加以证明[21]。除此之外,猪的皮肤干细胞在卵泡液诱导下也能生出具有卵母细胞样结构的细胞,人的羊水干细胞也具有向卵母细胞诱导分化的潜能,并在此过程中bmp15基因被激活[22]。这些都为bmp15作为生殖细胞标记提供了基础。通过诱导猪羊水干细胞,发现瞬时转染诱导12 d的细胞表达绿色荧光蛋白,同时细胞形态发生明显变化,进一步验证了bmp15启动子作为报告载体的可行性。
本实验证明了bmp15在猪不同组织中的表达特异性,并构建了pBMP15-EGFP报告载体,验证在不同成体细胞和猪卵母细胞中的表达能力,成功构建了可追踪体外诱导生殖细胞的报告载体,为开展干细胞体外向卵母细胞诱导分化奠定了基础。
REFERENCES
[1] Otsuka F, Yao Z, Lee T, et al. Bone morphogenetic protein-15. Identification of target cells and biological functions. J Biol Chem, 2000, 275(50): 39523-39528.
[2] Wu X, Matzuk MM. GDF-9 and BMP-15: oocyte organizers. Rev Endocr Metab Disord, 2002, 3(1): 27-32.
[3] Moore RK, Erickson GF, Shimasaki S. Are BMP-15 and GDF-9 primary determinants of ovulation quota in mammals? Trends Endocrinol Metab, 2004, 15(8): 356-361.
[4] Otsuka F, Yamamoto S, Erickson GF, et al. Bone morphogenetic protein-15 inhibits folliclestimulating hormone (FSH) action by suppressing FSH receptor expression. J Biol Chem, 2001,276(14): 11387-11392.
[5] Chuang CY, Lin KI, Hsiao M, et al. Meiotic competent human germ cell-like cells derived from human embryonic stem cells induced by BMP4/WNT3A signaling and OCT4/EpCAM selection. J Biol Chem, 2012, 287(18): 14389-14401.
[6] Danner S, Kajahn J, Geismann C, et al. Derivation of oocyte-like cells from a clonal pancreatic stem cell line. Mol Hum Reprod, 2007, 13(1): 11-20.
[7] Dyce PW, Shen W, Huynh E, et al. Analysis of oocyte-like cells differentiated from porcine fetal skin-derived stem cells. Stem Cells Dev, 2011, 20(5): 809-819.
[8] Hubner K, Fuhrmann G, Christenson LK, et al. Derivation of oocytes from mouse embryonic stem cells. Science, 2003, 300: 1251-1256.
[9] Hayashi K, Ogushi S, Kurimoto K, et al. Offspring from oocytes derived from in vitro primordial germ cell-like cells in mice. Science, 2012, 338: 971-975.
[10] Salvador LM, Silva CP, Kostetskii I, et al. The promoter of the oocyte-specific gene, Gdf9, is active in population of cultured mouse embryonic stem cells with an oocyte-like phenotype. Methods, 2008, 45(2): 172-181.
[11] Linher K, Dyce P, Li J. Primordial germ cell-like cells differentiated in vitro from skin-derived stem cells. PloS ONE, 2009, 4(12): e8263.
[12] Hu Y, Sun J, Wang J, et al. Characterization of female germ-like cells derived from mouse embryonic stem cells through expression of GFP under the control of Figla promoter. J Cell Biochem, 2012, 113(4): 1111-1121.
[13] Tsai MS, Lee JL, Chang YJ, et al. Isolation of human multipotent mesenchymal stem cells from second-trimester amniotic fluid using a novel two-stage culture protocol. Hum Reprod, 2004, 19(6): 1450-1456.
[14] Prusa AR, Marton E, Rosner M, et al. Oct-4-expressing cells in human amniotic fluid: a new source for stem cell research? Hum Reprod, 2003, 18(7): 1489-1493.
[15] Lu ZJ, Cheng D, Li JH, et al. Porcine amniotic fluid stem cells isolation and induction into adipocytes. J Agr Biotech, 2010, 18(6):1054-1061 (in Chinese).卢志娟, 成德, 李军华, 等. 猪羊水干细胞的分离培养及向脂肪细胞诱导分化. 农业生物技术学报, 2010, 18(6): 1054-1061.
[16] Chen JH, Wei YL, Peng S, et al. Differentiation of porcine amniotic fluid stem cells into the beating cardiomyocytes. Chin J Biotech, 2011, 27(8): 1206-1214 (in Chinese).陈家欢, 魏育蕾, 彭莎, 等. 猪羊水干细胞特异向跳动心肌细胞诱导分化. 生物工程学报, 2011, 27(8): 1206-1214
[17] Li HK, Kuo TY, Yang HS, et al. Differential gene expression of bone morphogenetic protein 15 and growth differentiation factor 9 during in vitro maturation of porcine oocytes and early embryos. Anim Reprod Sci, 2008, 103(3/4): 312-322.
[18] Vitt UA, Hsu SY, Hsueh AJ. Evolution and classification of cystine knot-containing hormones and related extracellular signaling molecules. Mol Endocrinol, 2001, 15(5): 681-694.
[19] Dube JL, Wang P, Elvin J, et al. The bone morphogenetic protein 15 gene is X-linked and expressed in oocytes. Mol Endocrinol, 1998, 12(12): 1809-1817.
[20] Wu MY, Chow SN. Derivation of germ cells from mouse embryonic stem cells. J Formos Med Assoc, 2005, 104(10): 697-706.
[21] Chen HF, Kuo HC, Chien CL, et al. Derivation, characterization and differentiation of human embryonic stem cells: comparing serumcontaining versus serum-free media and evidence of germ cell differentiation. Hum Reprod, 2007, 22(2): 567-577.
[22] Cheng X, Chen S, Yu X, et al. BMP15 gene is activated during human amniotic fluid stem cell differentiation into oocyte-like cells. DNA Cell Biol, 2012, 31(7): 1198-1204.
(本文责编 陈宏宇)
Construction and specificity of porcine bmp15 gene reporter vector
Mingming Qin1, Jianghua Wei2, Xiaoli Yu1, Jinglong Zhang1, Xiaopeng Liu1, Xiaoling Ma1, and Huayan Wang1
1 College of Veterinary Medicine, Shaanxi Center of Stem Cells Engineering and Technology, Northwest A&F University, Yangling 712100, Shaanxi, China 2 Shaanxi Wansheng Meat Processing Co., Ltd., Yangling 712100, Shaanxi, China
The aim of this study is to identify the express specificity of bone morphogenetic protein 15 (Bmp15) in porcine. The pBMP15-EGFP reporter vector was constructed from the 2.2 kb fragment of porcine bmp15 promoter to trace the differentiation process of stem cells into oocyte-like cells. We used porcine ovary and Chinese Hamster Ovary cell line (CHO), mouse myoblast cell line (C2C12) and porcine amniotic fluid stem cell (pAFSC) to investigate the expression and regulation of this gene via RT-PCR, immunofluorescence, cell transfection, and microinjection methods. We also used single layer cell differentiation to detect the application potential of bmp15. The results show that bmp15 gene was specifically expressed in the porcine ovary and CHO rather than in C2C12 and pAFSC. In addition, the characteristic of tissue-specific of Bmp15 was detected on CHO instead of other cell lines by transient transfection. We also detected the expression of Bmp15 in oocyte at different development stages by immunofluorescence of fixed paraffin-embedded ovary sections. Furthermore, microinjection results show that bmp15 expressed in oocytes at 18 h of maturation in vitro, and continued up to 4-cell stage embryos. Most importantly, we found that the expression of Bmp15 started at day 12 after inducing pAFSC into oocyte-like cells by transfection; green fluorescent was visible in round cell masses. It indicated that bmp15 has the expression specificity and the pBMP15-EGFP reporter vector can be used to trace Bmp15 action in the differentiation of stem cells into germ cells.
porcine, bone morphogenetic protein 15, promoter, gene expression, porcine amniotic fluid stem cell
May 4, 2013; Accepted: June 22, 2013
Huayan Wang. Tel: +86-29-87080069; E-mail: hhwang101@163.com
秦明鸣, 魏江华, 俞晓丽, 等. 猪bmp15基因报告载体的构建及其特异性. 生物工程学报, 2014, 30(2): 203-212.
Qin MM, Wei JH, Yu XL, et al. Construction and specificity of porcine bmp15 gene reporter vector. Chin J Biotech, 2014, 30(2): 203-212.
Supported by: National Basic Research Program of China (973 Program) (No. 2009CB941002).
国家重点基础研究发展计划 (973 计划) (No. 2009CB941002) 资助。
时间:2013-08-16 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20130816.1715.005.html
