嗜乙酰乙酸棒杆菌Corynebacterium acetoacidophilum-Δldh缺氧条件下代谢葡萄糖途径的变化
2014-06-15杨倩郑璞于芳刘伟孙志浩
杨倩,郑璞,于芳,刘伟,孙志浩
嗜乙酰乙酸棒杆菌Corynebacterium acetoacidophilum-Δldh缺氧条件下代谢葡萄糖途径的变化
杨倩,郑璞,于芳,刘伟,孙志浩
江南大学生物工程学院 教育部工业生物技术重点实验室,江苏 无锡 214122
缺氧条件下嗜乙酰乙酸棒杆菌Corynebacterium acetoacidophilum ATCC13870生长停滞,却能够代谢葡萄糖产生以乳酸和琥珀酸为主的有机酸。采用以sacB基因为反向筛选标记的同源重组染色体基因敲除系统,敲除嗜乙酰乙酸棒杆菌的乳酸脱氢酶基因,得到的Δldh菌株CCTCC NO. M20122041在缺氧条件下不产乳酸,葡萄糖消耗速率降低了29.3%,产琥珀酸和乙酸浓度分别提高45.6%和182%;NADH/NAD+值小于1 (约0.7);磷酸烯醇式丙酮酸羧化酶和乙酸激酶的比酶活分别提高84%和12倍。说明嗜乙酰乙酸棒杆菌中乳酸合成途径的阻断驱使了琥珀酸和乙酸代谢途径加强,推测加强NADH供给和阻断乙酸产生支路可能是提高C. acetoacidophilum菌株产琥珀酸产量的有效途径。
嗜乙酰乙酸棒杆菌,ldhA-敲除菌,缺氧,琥珀酸,代谢途径
谷氨酸棒杆菌Corynebacterium glutamicum是微生物发酵生产氨基酸工业的经典菌种,近年来通过代谢工程改造谷氨酸棒杆菌生产生物基化学品,成为研究热点[1]。如以C. glutamicum R为出发菌株,通过同时过表达甲基乙二醛合酶基因 (mgs) 和醛酮还原酶基因 (CgR-2242),构建了生产丙二醇菌C. glutamicum RP3[2];通过敲除乳酸脱氢酶基因 (ldh)、木酮糖激酶基因(xylB) 和果糖磷酸转移酶基因 (ptsF),并同时过表达木糖还原酶基因 (CtXR),构建了生产木糖醇菌C. glutamicum CtXR7[3];从模式菌C. glutamicum ATCC13032出发,用L-赖氨酸脱羧酶基因 (cadA) 取代L-高丝氨酸脱氢酶基因(hom),构建生产二元胺尸胺菌C. glutamicum TM45[4];敲除精氨酸阻遏蛋白 (ArgR) 基因和鸟氨酸阻遏蛋白 (ArgF) 基因,并同时过表达鸟氨酸脱羧酶基因 (sprC),构建C. glutamicum ORN1(pVWEx1-speC)生产腐胺[5];过表达谷氨酸脱羧酶基因 (gadB),构建C. glutamicum GAD生产丁氨酸[6]。在利用谷氨酸棒杆菌生产有机酸方面,Dominguez等报道了在氧气供应不足条件下,谷氨酸棒杆菌能产生少量有机酸[7]。Inui等发现缺氧条件下谷氨酸棒杆菌不生长,但是可以代谢葡萄糖产生以乳酸和琥珀酸为主的有机酸,并分析了缺氧条件下谷氨酸棒杆菌的全局代谢情况[8-9]。随后Wendisch等则分析大肠杆菌和谷氨酸棒杆菌产有机酸和氨基酸的代谢工程策略,认为通过基因改造的谷氨酸棒杆菌将会成为一个有前景的产有机酸的生物催化剂[10]。2008年Okino等以C. glutamicum R为出发菌构建了C. glutamicumΔldhA-pCRA717,在高菌体浓度 (50 g DCW/L) 的条件下,分批补加葡萄糖和碳酸氢钠,琥珀酸产量达到目前报道的最高产量,46 h产146 g/L[11]。2012年Litsanov等研究以C. glutamicum ATCC 13032为出发菌,构建C. glutamicum BOL-3,该菌敲除了合成乙酸的多种酶的基因,并过表达3-磷酸甘油醛脱氢酶基因(gapA),可产琥珀酸134 g/L,摩尔转化率为1.67[12]。说明了谷氨酸棒杆菌在生产生物基琥珀酸上具有很大的应用潜力。
嗜乙酰乙酸棒杆菌Corynebacterium acetoacidophilum ATCC13870也属于产谷氨酸棒杆菌[13],本实验室前期研究发现:其在缺氧条件下具有一定的积累琥珀酸优势,其中琥珀酸和乳酸积累的最高浓度分别为22.5 g/L与60 g/L[14]。为消除主要的副产物——乳酸,提高琥珀酸的产率,本文报道了以C. acetoacidophilum ATCC13870为出发菌株,构建敲除了乳酸脱氢酶基因的菌株C. acetoacidophilum-Δldh CCTCC NO. M20122041[15],并考察敲除乳酸脱氢酶基因对菌体生长、生理特性以及代谢途径的影响,以期为实现高效生产琥珀酸提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
菌株嗜乙酰乙酸棒杆菌C. acetoacidophilum ATCC13870,由江南大学生物催化研究室保藏。菌株E. coli JM109购于生工生物工程(上海)股份有限公司。菌株C. acetoacidophilum-Δldh由本研究构建。质粒pMD19-T、pMD18-T购于TaKaRa公司。用于谷氨酸棒杆菌基因组的克隆载体pK19mobsacB由中国人民解放军南京军区军事医学研究所邓小昭教授惠赠。ldh基因敲除质粒pK19mobsacB-Δldh由本研究构建。
1.1.2 试剂和溶液
T4 DNA连接酶、限制性内切酶Hind Ⅲ、碱性磷酸酶购自TaKaRa公司;Taq DNA聚合酶、2×PCR Mix 反应液购自广州东盛生物科技有限公司;细菌DNA提取试剂盒购自捷瑞生物工程 (上海) 有限公司;质粒DNA少量抽提试剂盒、DNA胶回收试剂盒、PCR产物纯化试剂盒和琼脂糖购自生工生物工程 (上海) 有限公司。
1.1.3 培养基
LB培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L。
感受态培养基:LB液体培养基,甘氨酸30 g/L,Tween80 1 g/L。
活化培养基 (LBHIS):酵母粉2.5 g/L,蛋白胨5 g/L,NaCl 5 g/L,脑心浸液18.5 g/L,山梨醇91 g/L。
种子培养基:在LB培养基中添加5 g/L葡萄糖。
菌体培养基:葡萄糖25 g/L,K2HPO41.5 g/L,MgSO4·7H2O 0.6 g/L,FeSO45 mg/L,硫胺素0.2 mg/L,尿素2.5 g/L,玉米浆10 g/L,生物素0.2 mg/L。
转化培养基:K2HPO40.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO46 mg/L,MnSO44.2 mg/L,生物素0.2 mg/L,硫胺素0.2 mg/L。
1.2 方法
1.2.1 C. acetoacidophilum-Δldh的构建
引物设计:根据乳酸脱氢酶基因ldh在谷氨酸棒杆菌基因组 (GenBank Accession No. Nc_006958.1) 中上下游的DNA序列,设计上游引物1、2,下游引物3、4。引物序列见表1。
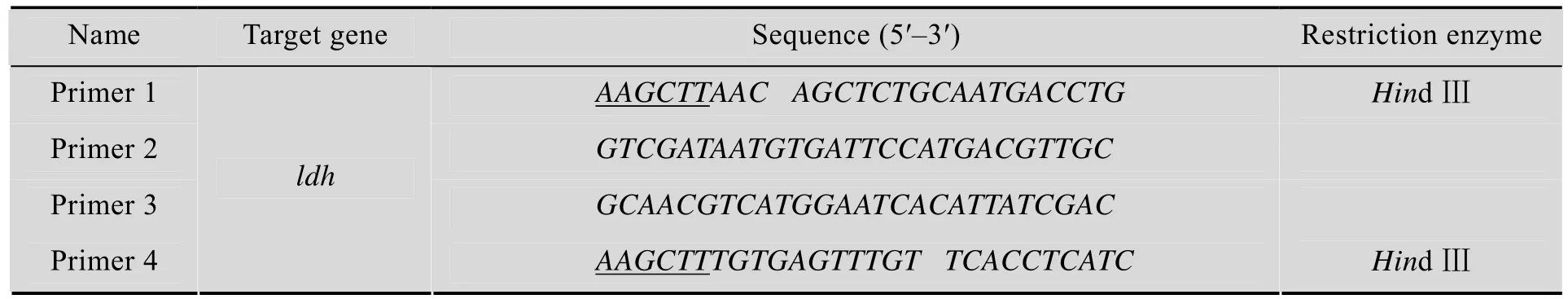
表1 本研究所用引物Table 1 Primers used in this study
基因ldh上下游DNA序列的扩增:以C. acetoacidophilum ATCC13870基因组为模板,引物1、2用于扩增基因ldh的上游序列,引物3、4用于扩增基因ldh的下游序列。上下游序列PCR反应条件相同:95 ℃变性50 s,60 ℃退火40 s,72 ℃延伸1 min,30个循环。反应结束后,1%琼脂糖电泳检测,胶回收纯化试剂盒回收PCR产物。
基因ldh上下游DNA序列的拼接与测序:以基因的上游和下游序列为模板,引物1、4为正向和反向引物,overlap PCR拼接反应条件:95 ℃变性50 s,60 ℃退火40 s,72 ℃延伸90 s,30个循环。胶回收纯化试剂盒回收拼接产物,拼接产物连接到pMD18-T载体中,在16 ℃下连接过夜,转化E. coli JM109。挑取单菌落进行菌落PCR鉴定,阳性克隆提取质粒酶切验证,测序验证。
基因敲除载体pK19mobsacB-Δldh的构建:将上述PCR产物和质粒pK19mobsacB分别进行Hind Ⅲ单酶切,1%的琼脂糖电泳,分别回收酶切的PCR产物和硅胶柱纯化质粒片段,酶切的PCR产物和去磷酸化的质粒片段进行连接,16 ℃条件下连接过夜,转化到E. coli JM109。挑取单菌落进行菌落PCR鉴定,阳性克隆进一步酶切验证。构建好的基因敲除载体命名为pK19mobsacB-Δldh。
基因敲除载体转化C. acetoacidophilum ATCC13870: 将pK19mobsacB-Δldh于1.8 kV、5 ms电击条件下,电转化到C. acetoacidophilum ATCC13870感受态细胞,通过卡那抗性及蔗糖选择压力筛选,得到敲除了乳酸脱氢酶基因的C. acetoacidophilum-Δldh。
1.2.2 C. acetoacidophilum-Δldh产琥珀酸的方法
C. acetoacidophilum种子于30 ℃、200 r/min下耗氧培养24 h,然后以5% (V/V) 的接种量接于菌体培养基中,30 ℃、200 r/min下耗氧培养16 h,培养好的菌体离心富集,以20 g/L (干重)的菌体浓度悬浮于转化培养基中30 ℃、200 r/min下恒温振荡。
1.2.3 有机酸及葡萄糖的测定方法
葡萄糖及有机酸的测定参照文献[16]。
1.2.4 相关酶活测定方法
菌体粗酶液的制备: 将转化过程中的菌体离心去上清液,用缓冲液洗涤2次,缓冲液包括 (100 mmol/L Tris-HCl, pH 7.5, 1 mmol/L MgCl2, 2 mmol/L DTT)。加50 μL 100 g/L的溶菌酶,冰浴下超声破碎25 min,4 ℃、8 000 r/min下离心25 min。取上清液即为粗酶液。
磷酸烯醇式丙酮酸羧化酶 (PEPC)、苹果酸脱氢酶 (MDH)、富马酸酶 (FUM) 酶活测定方法参考文献[17],乳酸脱氢酶 (LDH) 酶活测定方法参考文献[18],乙酸激酶 (AK) 酶活测定方法参考文献[19]。
酶活测定的反应试剂混合后,加入粗酶液启动反应,反应体系为1 mL,在酶标仪(BioTek-Power Wave XS2,Gene公司) 上测定相应的吸光值,PEPC、MDH、LDH、AK测定OD340,FUM测定OD250。
酶活单位定义为在30 ℃下,每分钟使1 nmol底物转化为产物的酶量为1 U。粗酶液中蛋白量的测定通过Bradford法测定,标准物为牛血清白蛋白。比酶活为每毫克蛋白的酶活单位,单位为U/mg。
1.2.5 NADH/NAD+的测定方法
NADH/NAD+的测定方法参照文献[20]。
2 结果与分析
2.1 基因敲除菌C. acetoacidophilum-Δldh的鉴定
按照方法1.2.1获得了乳酸脱氢酶基因敲除菌,以出发菌株ATCC13870为对照,用PCR鉴定法以引物1、4进行验证,鉴定电泳图谱见图1。用同样两条引物扩增,出发菌株ATCC13870的PCR扩增产物为1 500 bp,而敲除菌C. acetoacidophilum-Δldh的PCR产物仅为1 000 bp,两个片段大小区别明显,C. acetoacidophilum-Δldh染色体上被删除的基因序列长度大致为500 bp,表明ldh基因已经被成功敲除。
2.2 ldh基因的敲除对C. acetoacidophilum生长的影响
出发菌ATCC13870和C. acetoacidophilum-Δldh在摇瓶上的生长曲线如图2所示,两者生长良好,生长趋势基本相同,10 h进入稳定期,之后菌体缓慢增长。但是C. acetoacidophilum-Δldh与ATCC13870相比在生物量上稍有降低,10 h后C. acetoacidophilum-Δldh OD660达到34,出发菌株此时OD660达到36。说明ldh基因的敲除对C. acetoacidophilum生长的影响不显著。

图1 C. acetoacidophilum-Δldh的PCR鉴定电泳图谱Fig. 1 PCR indentification of C. acetoacidophilum-Δldh. M: λDNA/ Hind III marker; 1: C. acetoacidophilum ATCC13870 PCR product; 2: C. acetoacidophilum-Δldh PCR product.
2.3 C. acetoacidophilum-Δldh与ATCC13870对葡萄糖的代谢产物
将培养相同时间的C. acetoacidophilum-Δldh与ATCC13870分别离心,进行有机酸转化,其中用于转化的菌体浓度为26.5 g CDW/L,初始葡萄糖浓度为90 g/L,碳酸氢钠浓度为33.6 g/L,转化过程曲线见图3。转化30 h,C. acetoacidophilum-Δldh残留葡萄糖浓度为20.5 g/L,琥珀酸浓度为60.5 g/L,而ATCC13870的残糖5.03 g/L,琥珀酸38.4 g/L,C. acetoacidophilum敲除乳酸脱氢酶基因后,产琥珀酸能力明显增强。

图2 ATCC13870与C. acetoacidophilum-Δldh的生长曲线Fig. 2 Cell growth profiles of ATCC13870 and C. acetoacidophilum-Δldh.
比较两株菌转化12 h的代谢产物及过程参数见表2,与ATCC13870相比,C. acetoacidophilum-Δldh不产乳酸,而琥珀酸、乙酸质量浓度分别增加了45.6%和182%,并且有部分的富马酸产生。理论上1 mol葡萄糖在碳酸氢盐充足的情况下可生成2 mol的琥珀酸[21],这个过程中需要4 mol的NADH的参与,而1 mol葡萄糖完全酵解可产生2 mol的NADH,因此糖酵解代谢过程中产生的NADH不能满足琥珀酸生成所需要NADH的量,而从丙酮酸生成乙酸的过程中也有NADH的产生,因此这可能是代谢产物中乙酸产量增加的原因。C. acetoacidophilum-Δldh另一特点是葡萄糖消耗速率有所下降,比原始菌株降低了29.3%,但糖酸转化率提高了109%,产琥珀酸平均速率增加了65%,说明乳酸脱氢酶基因的敲除使C. acetoacidophilum的代谢途径发生了变化,乳酸途径的消除使得琥珀酸和乙酸途径加强。

图3 ATCC1380与C. acetoacidophilum-Δldh耗糖和产酸曲线Fig. 3 Glucose consumption and the succinic acid production of ATCC13870 and C. acetoacidophilum-Δldh. □: ATCC13870 succinic acid concentration;○: C. acetoacidophilum-Δldh succinic acid concentration; ■: ATCC13870 glucose concentration;●: C. acetoacidophilum-Δldh glucose concentration.
2.4 C. acetoacidophilum-Δldh与ATCC13870在缺氧条件下NADH/NAD+比值的变化
在缺氧条件下NADH的氧化完全依赖于有机酸的生成[22],因此缺氧条件下菌体转化葡萄糖产琥珀酸的过程中NADH起着不可或缺的作用。表3表明ATCC13870和Δldh菌株在缺氧条件下代谢葡萄糖过程中NADH/NAD+的情况。Δldh菌株的NADH/NAD+水平明显低于原始菌株,这可能是由于琥珀酸的生成需要的还原当量NADH多于乳酸生成途径中的消耗量,因此生成琥珀酸较多的体系中,NADH/NAD+水平较低。Δldh菌不产乳酸,琥珀酸的产量是出发菌株的2倍左右,而原始菌株产乳酸及琥珀酸的比率接近1∶1,故C. acetoacidophilum-Δldh在缺氧产酸的过程中NADH/NAD+水平较低。同时,NADH与NAD+的不平衡也会影响到糖酵解代谢,可能造成了Δldh菌的葡萄糖消耗速率下降。

表2 缺氧转化12 h代谢产物及转化过程参数的比较Table 2 Comparison of metabolic products and conversion parameters at 12 h oxygen deprivation culture

表3 两种菌株缺氧转化10 h NADH/NAD+比值Table 3 Rate of NADH/NAD+of the two different strains at 10 h oxygen deprivation culture
2.5 C. acetoacidophilum-Δldh与ATCC13870在缺氧条件下葡萄糖代谢关键酶活性的比较
缺氧条件下嗜乙酰乙酸棒杆菌代谢以产有机酸为主,葡萄糖经糖酵解生成磷酸烯醇式丙酮酸及丙酮酸,从丙酮酸出发分为3条途径,一条经乳酸脱氢酶催化在NADH的参与下生成乳酸,一条经羧化酶催化在碳酸氢盐的参与下生成四碳化合物草酰乙酸,从而进入TCA循化的还原臂一侧生成琥珀酸,一条经丙酮酸脱氢酶复合体催化在NAD+的参与下生成乙酰辅酶A,进而再经过磷酸转乙酰激酶,乙酸激酶的催化生成乙酸 (图4)。缺氧条件下转化产酸过程中测定乙醛酸途径的关键酶异柠檬酸裂合酶(ICL) 酶活,结果出发菌株与敲除菌株均未检测出该酶活。并且在转化过程中分别加入氟乙酸及丙二酸,加入氟乙酸的转化体系产琥珀酸正常,加入丙二酸的转化体系几乎不产琥珀酸。由于丙二酸是TCA还原臂中琥珀酸脱氢酶的强抑制剂,而氟乙酸是柠檬酸合酶的抑制剂,可以说明缺氧条件下嗜乙酰乙酸棒杆菌不能通过柠檬酸循环或乙醛酸循环途径生成琥珀酸。从对代谢途径中关键酶活性的分析,反映阻断了乳酸产生支路后,代谢流转向了琥珀酸和乙酸的产生途径。如图5所示,C. acetoacidophilum-Δldh没有表现出LDH活性,PEPC活性提高了84%,AK活性提高了12倍,FUM活性提高了17.3%,MDH酶活提高了17.4%。PEPC、FUM和MDH活性的增加表明四碳途径的加强。在C. acetoacidophilum中,丙酮酸羧化酶 (PC) 的酶活测定数据不稳定 (数据未列出),这与文献[9,23-25]报道的一致,Inui等[9]也曾证实PEPC是谷氨酸棒杆菌中合成草酰乙酸的关键酶。而AK活性的显著增加,加强了乙酰辅酶A的代谢,从而强化了乙酸途径。Joeri等[26]指出:副产物乙酸的产生可以补给用于琥珀酸生成的还原当量,因此可推测,AK活性以及乙酸产量的增加可能与Δldh菌株在缺氧产酸过程中NADH与NAD+不平衡 (表3) 有关。
3 结论
本文采用以sacB基因为反向筛选标记的同源重组染色体基因敲除系统,敲除嗜乙酰乙酸棒杆菌的乳酸脱氢酶基因,构建C. acetoacidophilum-Δldh菌株。生长培养表明乳酸脱氢酶基因的敲除不会对C. acetoacidophilum菌体的生长造成很大的影响。Δldh菌株不产乳酸,说明C. acetoacidophilum中乳酸脱氢酶并没有其他的同工酶存在。在缺氧条件下,葡萄糖对琥珀酸的转化率提高了109%,产琥珀酸平均速率增加了65%,产琥珀酸和乙酸浓度分别提高了45.6%和182%,PEPC活性提高了84%,AK酶活提高了12倍,说明Δldh菌株葡萄糖代谢流分布发生了变化,乳酸产生支路被阻断后,代谢流更多的偏向了琥珀酸和乙酸产生途径。
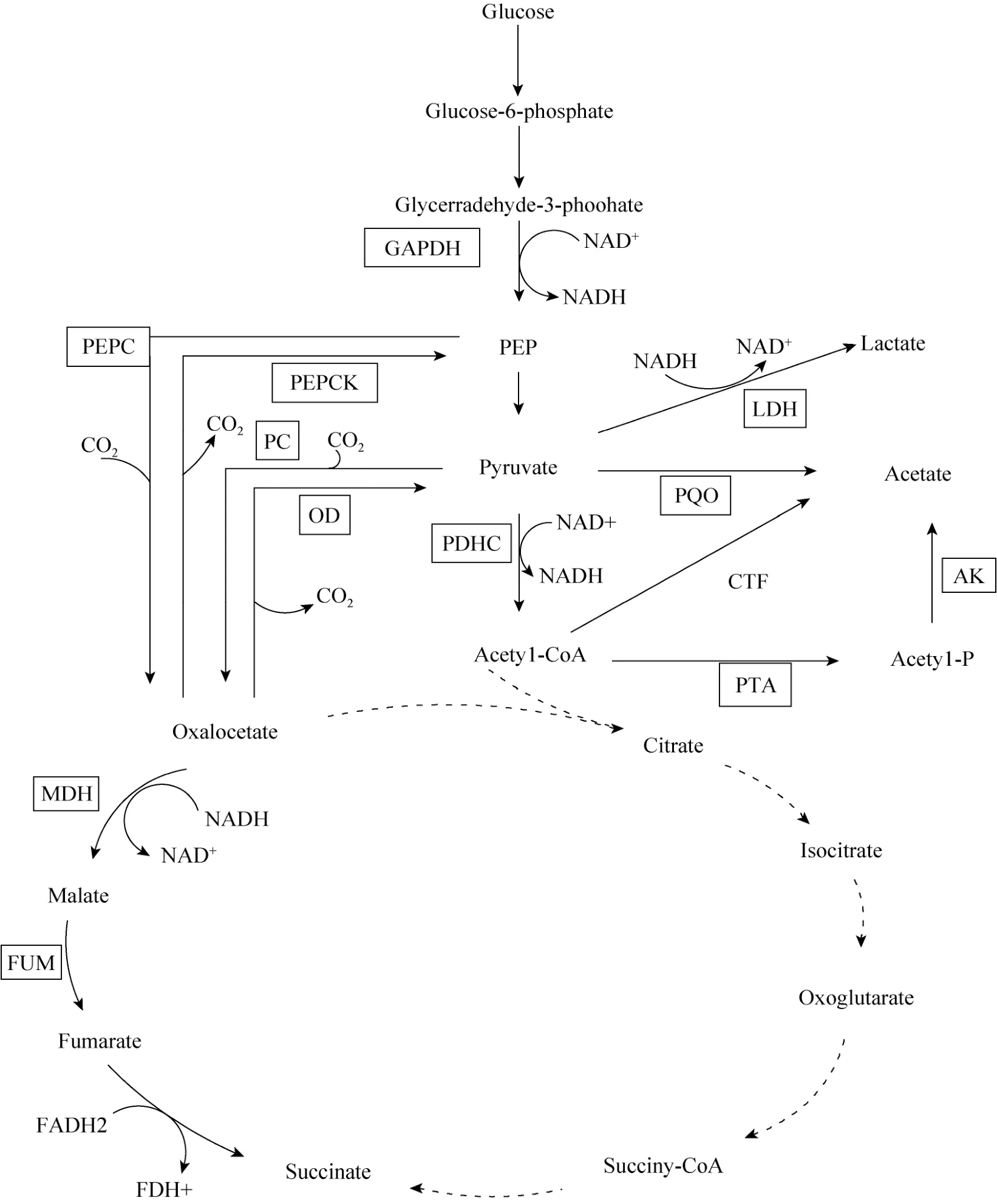
图4 缺氧条件下嗜乙酰乙酸棒杆菌代谢图Fig. 4 Metabolic pathways of C. acetoacidophilum under oxygen deprivation conditions. GAPDH: glyceraldehyde-3-phosphate; PEPC: phosphoenolpyruvatecarboxylase; PEPCK: phosphoenolpyruvat carboxykinase; PC: pyruvate carboxylase; MDH: malate dehydrogenase; FUM: fumarate dehydratase; LDH: lactate dehydrogenase; AK: acetate kinase; PDHC: pyruvate dehydrogenase complex; PTA: phosphotransacetylase.
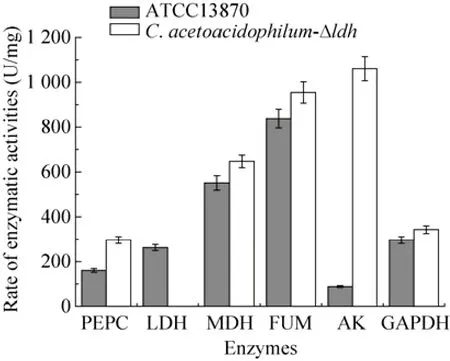
图5 ATCC13870与C. acetoacidophilum-Δldh缺氧条件下比酶活Fig. 5 Enzymatic activities of ATCC13870 and C. acetoacidophilum-Δldh under oxygen-deprived condition.
从代谢途径分析,1 mol葡萄糖完全酵解可产生2 mol的NADH,在碳酸氢盐供应充足的情况下理论上可产生2 mol的琥珀酸,而生成2 mol的琥珀酸需要4 mol的NADH,因此以葡萄糖为底物代谢产琥珀酸的过程中存在氧化还原辅酶的不平衡。本研究也发现C. acetoacidophilum-Δldh产琥珀酸过程中,NADH/NAD+比值小于1,说明Δldh菌产琥珀酸过程中可能存在NADH不足。因此加强NADH的供给和阻断乙酸产生支路,将是构建高效生产琥珀酸菌C. acetoacidophilum的方向。
REFERENCES
[1] Becker J, Wittmann C. Bio-based production of chemicals, materials and fuels-Corynebacterium glutamicum as versatile cell factory. Curr Opin Biotech, 2011, 23(4): 1–10.
[2] Niimi S, Suzuki N, Inui M, et al. Metabolic engineering of 1,2-propanediol pathways in Corynebacterium glutamicum. Appl Microbiol Biotechnol, 2011, 90(5): 1721–1729.
[3] Sasaki M, Jojima T, Inui M. Xylitol production by recombinant Corynebacterium glutamicum under oxygen deprivation. Appl Microbiol Biotechnol, 2010, 86(4): 1057–1066.
[4] Mimitsuka T, Sawai H, Hatsu M, et al. Metabolic engineering of Corynebacterium glutamicum for cadaverine fermentation. Biosci Biotechnol Biochem, 2007, 71(9): 2130–2135.
[5] Schneider J, Wendisch VF. Putrescine production by engineered Corynebacterium glutamicum. Appl Microbiol Biotechnol, 2010, 88(4): 859–868.
[6] Takahashi C, Shirakawa J, Tsuchidate T, et al. Robust production of gamma-amino butyric acid using recombinant Corynebacterium glutamicum expressing glutamate decarboxylase from Escherichia coli. Enzyme Microb Technol, 2012, 51(3): 171–176.
[7] Dominguez H, Nezondet C, Lindley ND, et al. Modified carbon flux during oxygen-limited growth of Corynebacterium glutamicum and the consequences for amino acid overproduction. Biotechnol Lett, 1993, 15(5): 449–454.
[8] Okino S, Inui M, Yukawa H. Production of organic acids by Corynebacterium glutamicum under oxygen deprivation. Appl Microbiol Biotechnol, 2005, 68(4): 475–480.
[9] Inui M, Murakami S, Okino S, et al. Metabolic analysis of Corynebacterium glutamicum during lactate and succinate productions under oxygen deprivation conditions. Mol Microbiol Biotechnol, 2004, 7(4): 182–196.
[10] Wendisch VF, Bott M, Eikmanns BJ. Metabolic engineering of Escherichia coli and Corynebacterium glutamicum for biotechnological production of organic acids and amino acids. Curr Opin Microbiol, 2006, 9(3): 268–274.
[11] Okino S, Noburyu R, Suda M, et al. An efficient succinic acid production process in a metabolically engineered Corynebacterium glutamicum strain.Appl Microbiol Biot, 2008, 81(3): 459–464.
[12] Litsanov B, Brocker M, Bott M. Toward homosuccinate fermentation: metabolic engineering of Corynebacterium glutamicumfor anaerobic production of succinate from glucose and formate. Appl Environ Microbiol, 2012, 78(9): 3325.
[13] Eggeling L, Bott M. Handbook of Corynebacterium glutamicum: Corynebacterium Taxonomy . 2nd ed. Florida: CRC Press Taylor & Francis Group, 2005: 10–20.
[14] Yu F, Zheng P, Ni Y. Influence of bicarbonate on organic acid of glutamic acid-producing bacteria under oxygen deprivation. Chin J Bioproc, 2011, 9(5): 22–26 (in Chinese).
于芳, 郑璞, 倪晔. 碳酸盐对谷氨酸产生菌在缺氧条件下产有机酸的影响. 生物加工过程, 2011, 9(5): 22–26.
[15] Zheng P, Yu F, Yang Q. A Corynebacterium acetoacidophilum and the method of producing succinic acid: CN 201210094742.6. 2013-04-10 (in Chinese).
郑璞, 于芳, 杨倩. 一株嗜乙酰乙酸棒杆菌及其产丁二酸的方法: CN 201210094742.6. 2013-04-10.
[16] Liu YP, Zheng P, Sun ZH. Determination of succinic acid and other metabolites from fermentation broth by Ion-exclusion liquid chromatography. Food Fermn Ind, 2006, 32(12): 119–123 (in Chinese).
刘宇鹏, 郑璞, 孙志浩. 采用离子排斥色谱法分析发酵液中的琥珀酸等代谢产物. 食品与发酵工业, 2006, 32(12): 119–123.
[17] Shogo Y, Masayuki S. Diversity of metabolic shift in response to oxygen deprivation in Corynebacterium glutamicum and its close relatives. Appl Microbiol Biotechnol, 2011, 90(3): 1051–1061.
[18] Bunch PK, Fairoz MJ, Lee N, et al. The ldhA gene encoding the fermentative lactate dehydrog enase of Escherichia coli. Microbiology, 1997, 143(1): 187–195.
[19] Ruan H, Xuan RR. Studies on activities of PTA, AK, ICL and MS enzymes involved in the acetate metabolism of Corynebacterium glutamicum. J Zhejiang Univ, 2003, 29(5): 529–533 (in Chinese).
阮红, 宣日荣. 谷氨酸棒状杆菌乙酸盐代谢PTA, AK, ICL和MS酶活性研究. 浙江大学学报, 2003, 29(5): 529–533.
[20] Li J, Chen KQ, Huang XM. Establishment of the determination of NAD+and NADH in the anaerobic fermentation of organic acids. Food Sci Technol, 2008, 33(12): 255–257 (in Chinese).
李建, 陈可泉, 黄秀梅. 厌氧发酵有机酸体系中NAD+和NADH测定方法的建立. 食品科技, 2008, 33(12): 255–257.
[21] Arndt A, Eikmanns BJ. Regulation of carbon metabolism in Corynebacterium glutamicum. Corynebacteria: genomics and molecular biology. Norwich: Caister Academic Press, 2008: 155–182.
[22] Jojima T, Inui M, Yukawa H. Biorefinery applications of Corynebacterium glutamicum. Microbiol Monogr, 2013, 23: 149–192.
[23] Feir HA, Suzuki I. Pyruvate carboxylase of Aspergillus niger: kinetic study of a biotin-containg carboxylase. Can J Biochem, 1969, 47(7): 697–710.
[24] James AG, Jones KM. Purification and characterization of pyruvate carboxylase from Arthrobacter globiformis. Arch Biochem Biophys, 1977, 179(2): 444–455.
[25] Peters PG, Wendisch VF, Paul S. Pyruvate carboxylase as an anaplerotic enzyme in Corynebacterium glutamicum. Microbiology, 1997, 143(4): 1095–1103.
[26] Joeri JB, Marjan DM, Wim KS. Microbial succinic acid production: natural versus metabolic engineered producers. Proess Biochem, 2010, 45: 1103–1114.
(本文责编 郝丽芳)
Metabolic shift of Corynebacterium acetoacidophilum-Δldh under oxygen deprivation conditions
Qian Yang, Pu Zheng, Fang Yu, Wei Liu, and Zhihao Sun
Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Lactate and succinate were produced by Corynebacterium acetoacidophilum from glucose under oxygendeprivation conditions. To construct knockout mutant, lactate dehydrogenase gene (ldh) of C. acetoacidophilum was deleted by double-crossover chromosome replacement with sacB gene. Comparing with the wild strain ATCC13870, ldhA-deficent mutant produced no lactate with glucose consumption rate decreased by 29.3%, while succinate and acetate concentrations were increased by 45.6% and 182%, respectively. Moreover, the NADH/NAD+rate was less than 1 (about 0.7), and the activities of phosphoenolpyruvate carboxylase and acetate kinase of the ldhA-deficent mutant were enhanced by 84% and 12 times, respectively. Our studies show that succinicate and acetate production pathways are strengthened by blocking lactate synthesis. It also suggests that improving NADH supply and eliminating acetate generation are alternative strategies to get high succinate-producer.
Corynebacterium acetoacidophilum, ldhA-deficent mutant, oxygen deprivation, succinic acid, metabolic
July 30, 2013; Accepted: September 16, 2013
Pu Zheng. Tel: +86-510-85918252; E-mail: zhengpu@jiangnan.edu.cn
杨倩, 郑璞, 于芳, 等. 嗜乙酰乙酸棒杆菌Corynebacterium acetoacidophilum-Δldh缺氧条件下代谢葡萄糖途径的变化.生物工程学报, 2014, 30(3): 435−444.
Yang Q, Zheng P, Yu F, et al. Metabolic shift of Corynebacterium acetoacidophilum-Δldh under oxygen deprivation conditions. Chin J Biotech, 2014, 30(3): 435−444.
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2006AA020301-012).
国家高技术研究发展计划 (863计划) (No. 2006AA020301-012) 资助。
Received: July 30, 2013; Accepted: September 16, 2013
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2006AA020301-012).
Corresponding author: Pu Zheng. Tel: +86-510-85918252; E-mail: zhengpu@jiangnan.edu.cn
国家高技术研究发展计划 (863计划) (No. 2006AA020301-012) 资助。
Received: July 30, 2013; Accepted: September 16, 2013
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2006AA020301-012).
Corresponding author: Pu Zheng. Tel: +86-510-85918252; E-mail: zhengpu@jiangnan.edu.cn
国家高技术研究发展计划 (863计划) (No. 2006AA020301-012) 资助。
