Snail和Raf激酶抑制蛋白与非小细胞肺癌侵袭转移的关系*
2014-06-15杨大运高少伟
齐 战 杨大运 高少伟
Snail和Raf激酶抑制蛋白与非小细胞肺癌侵袭转移的关系*
齐 战1杨大运2△高少伟3
目的 检测非小细胞肺癌(NSCLC)组织中Snail和Raf激酶抑制蛋白(RKIP)的表达情况。方法采用免疫组织化学方法检测124例NSCLC及67例癌旁正常肺组织中Snail和RKIP的表达情况,比较临床病理特征与Snail和RKIP阳性表达率的关系,分析Snail和RKIP的相关关系。结果Snail蛋白在肺癌中表达率为79.03%,高于正常肺组织的19.40%(χ2=63.538,P<0.01);RKIP在肺癌中的表达率为36.29%,低于正常肺组织的77.61%(χ2=29.716,P<0.01)。两者的表达水平均与肺癌的分化程度、TNM分期、淋巴结转移及术后生存时间有关;Snail与RKIP的蛋白表达水平呈负相关(P<0.05)。结论Snail高表达与RKIP低表达可能是NSCLC侵袭转移的重要生物学标志,可作为NSCLC的预后指标。
癌,非小细胞肺;raf激酶类;肿瘤侵润;肿瘤转移;非小细胞肺癌;Snail;Raf激酶抑制蛋白
肺癌是严重威胁人类健康与生命的恶性肿瘤之一,全世界每年有100多万人死于肺癌,其中80%为非小细胞肺癌(NSCLC)患者。由于肺癌的早期临床症状不明显,患者就诊时大部分处于进展期,预后很差,5年生存率仅为15.6%[1],局部复发和远处转移是导致肺癌患者死亡的主要原因。上皮间质转化(EMT)是肿瘤发生侵袭转移的关键步骤,研究调控恶性肿瘤细胞发生EMT过程的分子机制,探索发生EMT的关键分子与肿瘤侵袭转移的关系是当前面临的主要问题。Snail和Raf激酶抑制蛋白(RKIP)与EMT的发生有关,本研究通过检测肺癌组织及癌旁肺组织中Snail蛋白和RKIP蛋白的表达情况,探讨两者与NSCLC临床病理因素以及患者预后的关系。
1 资料与方法
1.1 资料 选择我院2010年7月—2011年7月确诊为NSCLC的癌组织标本124例,其中男98例,女26例。年龄31~78岁,中位年龄60岁。病理类型:鳞癌86例,腺癌38例。分化程度:高分化癌45例,中分化癌38例,低分化癌41例。肺癌分期采用2009年IASLC/UICC公布的第七版TNM分期标准:Ⅰ期38例(Ⅰa18例,Ⅰb20例),Ⅱ期30例(Ⅱa 14例,Ⅱb16例),Ⅲ期56例(Ⅲa43例,Ⅲb13例)。有淋巴结转移52例,无淋巴结转移72例。所有病例术前均未接受放疗或化疗。取癌旁正常肺组织67例为对照。即用型兔抗人Snail多克隆抗体、兔抗人RKIP多克隆抗体(美国Santa Cruz公司),免疫组化试剂盒和DAB显色试剂盒(福州迈新公司)。
1.2 方法
1.2.1 免疫组织化学染色法 标本经10%福尔马林固定,石蜡包埋,制成4µm切片,采用常规二甲苯脱蜡,梯度乙醇水化;采用链菌素抗生物素蛋白-过氧化物酶法(S-P法)检测Snail和RKIP表达情况。首先3%过氧化氢封闭内源性过氧化物酶15 min,高温高压修复抗原,然后依次滴加一抗,生物素标记的二抗和S-P酶,DAB显色3~5 min,苏木精复染,常规封片。同时以福州迈新公司提供的阳性标本切片作为阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
1.2.2 免疫组织化学结果判定 Snail和RKIP以细胞质或(和)细胞核出现棕黄色颗粒为阳性,取任意10个高倍视野,每个视野计数100个细胞,进行如下评分。(1)细胞染色强度评分:基本不着色者0分,着色淡者1分;着色适中者2分,着色深者3分。(2)阳性细胞占计数细胞的比例评分:<5%记0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分。取(1)、(2)两项评分乘积作为总积分:0分为阴性;≥1分为阳性。
1.3 统计学方法 用SPSS 13.0软件进行统计学处理。计数资料用例(%)表示,比较采用χ2检验。采用Spearman法进行等级相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Snail和RKIP在癌旁正常肺组织中及肺癌组织中的表达 在癌旁正常肺组织中,Snail蛋白表达呈阴性或弱阳性;在肺癌组织中,Snail蛋白表达呈中等强度阳性或强阳性,见图1~2,但RKIP在癌旁正常肺组织中高表达,在肺癌组织中低表达,见图3~4。Snail蛋白在癌旁正常肺组织的阳性表达率低于肺癌组织,RKIP在癌旁正常肺组织的阳性表达率高于肺癌组织(P<0.05),见表1。
2.2 Snail与RKIP表达与临床病理特征的关系 在肺癌组织中,Snail蛋白与RKIP的阳性表达均与性别、年龄、吸烟史、肿瘤直径大小及病理类型无关(P>0.05)。肺癌的分化程度越低、TNM分期越高、有淋巴结转移者的Snail蛋白表达率较高,术后生存期<2年患者的Snail蛋白表达率高于生存期≥2年者(均P<0.05);肺癌的分化程度越低、TNM分期越高患者的RKIP表达率较低,术后生存期<2年患者的RKIP表达率低于生存期≥2年者,有淋巴结转移者RKIP表达率低于无转移者(均P<0.05),见表2。
2.3 Snail蛋白与RKIP表达的关系 Snail蛋白与RKIP在NSCLC组织中的表达呈负相关,见表3。
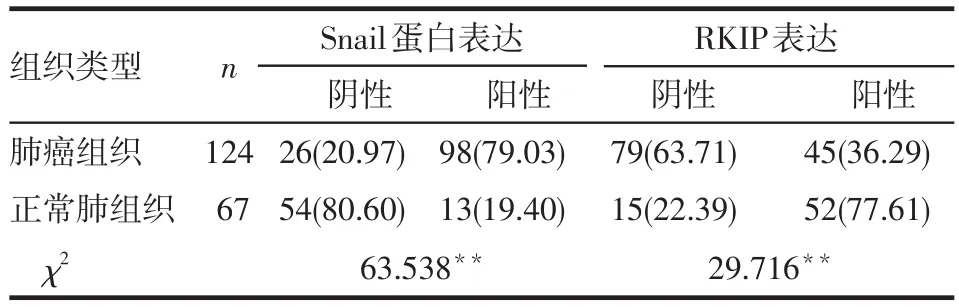
Table1 Expression of Snail and RKIP in lung cancer tissues and normal lung tissues表1 肺癌、正常肺组织中Snail蛋白与RKIP表达结果 例(%)
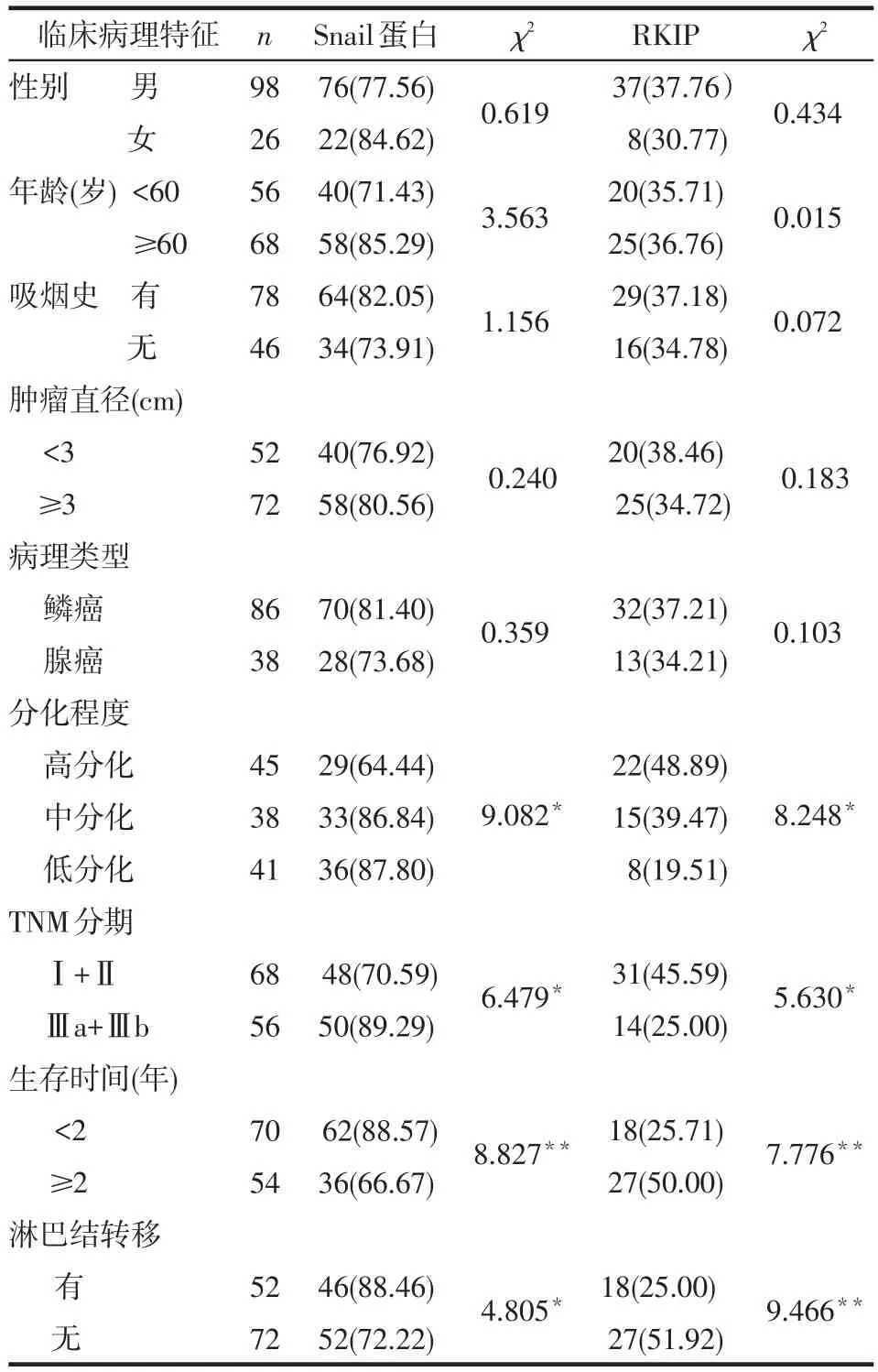
Table 2 Relationship between expressions of Snail and RKIP with clinicopathologic characteristics of lung cancer表2 肺癌组织中Snail蛋白和RKIP阳性表达与临床病理特征的关系 例(%)

Table 3 Relationship of Snail and RKIP expression in lung cancer表3 肺癌中Snail蛋白与RKIP表达的相关性
3 讨论
Snail是一种锌指转录因子,在细胞内起负向转录调节作用,它通过抑制上皮钙黏素E的转录,使细胞间黏附力减弱,细胞彼此分离并获得活动能力,肿瘤细胞易于从原发灶脱落,进而发生肿瘤的侵袭转移。研究发现,Snail在非小细胞肺癌[2]、膀胱癌[3]、乳腺癌[4]等多种肿瘤组织中表达上调。
本研究发现NSCLC中的Snail蛋白阳性表达率为79.03%,明显高于正常肺组织的19.40%。且肺癌的分化程度越高,Snail蛋白的阳性表达率越低,随着临床分期的进展、淋巴结的转移,Snail蛋白的表达率增高,且生存时间<2年者的Snail蛋白表达阳性率高于≥2年者,提示Snail蛋白表达上调与肺癌组织的恶性程度有关。研究显示,Snail蛋白的阳性表达率与不同病理类型有关,腺癌的阳性表达率高于鳞癌[5]。但本研究并未发现Snail蛋白的阳性表达率与病理类型有关,以上不同可能与研究样本量小有关。
肿瘤的侵袭转移是一个多阶段、多步骤、多因素参与的复杂病理过程,通过肿瘤转移相关基因的上调或下调对整个过程进行调控。因此,针对肿瘤转移相关基因,阻断其信号传导通路将成为治疗肿瘤的新策略。RKIP是一种肿瘤转移抑制基因,参与调节ERK、G蛋白、核因子(NF)-κB等多条信号传导通路,具有抑制肿瘤细胞侵袭转移的功能。RKIP在结直肠癌[6]、膀胱癌[7]、胃癌[8]等多种肿瘤组织中表达下调,其表达水平与肿瘤的侵袭转移能力呈负相关。本研究显示,在癌旁正常肺组织中,RKIP在肺泡上皮细胞呈阳性表达,阳性表达率为77.61%,高于在NSCLC中的36.29%。肺癌的分化程度越低,RKIP的表达水平越低,随着临床分期的增加、淋巴结的转移,RKIP的表达水平降低,且生存时间<2年者的RKIP表达水平低于≥2年者,表明RKIP表达下调与肺癌组织的恶性程度及侵袭转移有关。
Snail可直接作用于靶基因上皮性钙黏附蛋白(E-cadherin),抑制其转录活性,促进EMT的发生及肿瘤的侵袭转移[3]。RKIP可通过NF-κB/Snail途径或直接影响E-cadherin的表达,进而抑制EMT的进展,从而发挥其抑制肿瘤细胞侵袭转移的功能。研究还发现,Snail/RKIP比例失衡不仅与肿瘤的侵袭转移有关,而且与瘤细胞对化疗药物的耐药性有关[9-11]。本研究显示,Snail和RKIP在NSCLC组织中的表达呈负相关,提示两种蛋白在肿瘤侵袭转移过程中发挥着不同的作用,有待于进一步探讨研究。
正常组织中癌基因和抑癌基因之间存在着微妙的平衡关系,维持着上皮-间质的稳定。当NF-κB/ Snail/RKIP环路破坏,Snail表达上调,RKIP的表达程度不足以抑制Snail的活性,环路之间的平衡被打破,导致了EMT发生及肿瘤细胞的侵袭转移,因此,EMT过程是Snail和RKIP表达不平衡的结果。通过siRNA靶向干扰Snail或转染RKIP基因,将为肿瘤的靶向治疗提供一个新思路。
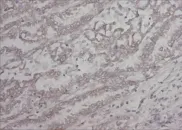
Figure 1 Positive expression of Snail in lung cancer tissue(SP,×200)图1 Snail在肺癌组织阳性表达免疫组化染色图(SP法,×200)
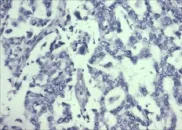
Figure 2 Negative expression of Snail in lung cancer tissue(SP,×200)图2 Snail在肺癌组织阴性表达免疫组化染色图(SP法,×200)
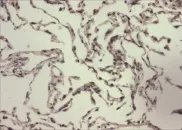
Figure 3 Positive expression of RKIP in normal lung tissue(SP,×200)图3 RKIP在正常肺组织阳性表达免疫组化染色图(SP法,×200)
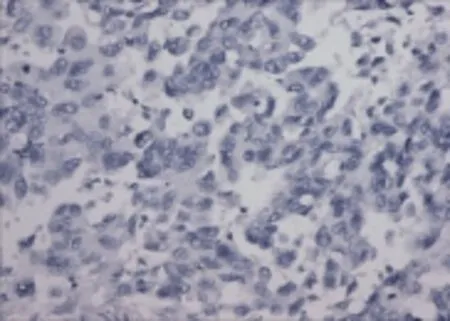
Figure 4 Negative expression of RKIP in lung cancer tissue(SP,×200)图4 RKIP在肺癌组织阴性表达免疫组化染色图(SP法,×200)
[1]Matsuda A,Katanoda K.Five-year relative survival rate of lung cancer in the USA,Europe and Japan[J].Jpn J Clin Oncol,2013,43 (12):1287-1288.
[2]Argast GM,Krueger JS,Thomson S,et al.Inducible expression of TGFβ,Snail and Zeb1 recapitulates EMT in vitro and in vivo in a NSCLC model[J].Clin Exp Metastasis,2011,28(7):593-614.
[3]Shan Y,Zhang L,Bao Y,et al.Epithelial-mesenchymal transition, a novel target of sulforaphane via COX-2/MMP2,9/Snail,ZEB1 and miR-200c/ZEB1 pathways in human bladder cancer cells[J].J Nut Biochem,2013,24(6):1062-1069.
[4]Li W,Liu C,Tang Y,et al.Overexpression of Snail accelerates adriamycin induction of multidrug resistance in breast cancer cells[J]. Asian Pac J Cancer Prev,2011,12(10):2575-2580.
[5]李娟,涂媛,蒋莉莉,等.Snail和Claudin-3在非小细胞肺癌肺癌中的表达及意义[J].中国肺癌杂志,2012,15(10):583-589.
[6]Doyle B,Hagan S,Al-Mulla F,et al.Raf kinase inhibitor protein expression combined with peritoneal involvement a nd lymphovascular invasion predicts prognosis in Dukes'B colorectal cancer patients[J].Histopathology,2013,62(3):505-510.
[7]Afonso J,Longatto-Filho A,Martinho O,et al.Low RKIP expression associates with poor prognosis in bladder cancer patients[J]. Virchows Arch,2013,462(4):445-453.
[8]Yan L,Gu H,Li J,et al.RKIP and 14-3-3ε exert an opposite effect on human gastric cancer cells SGC7901 by regulating the ERK/ MAPK pathway differently[J].Dig Dis Sci,2013,58(2):389-396.
[9]Shin SY,Rath O,Zebisch A,et al.Functional roles of multiple feedback loops in extracellular signal-regulated kinase and Wnt signaling pathways that regulate epithelial-mesenchymal transition[J]. Cancer Res,2010,70(17):6715-6724.
[10]Hsu YL,Chen CY,Lin IP,et al.4-Shogaol,an active constituent of dietary ginger,inhibits metastasis of MDA-MB-231 human breast adenocarcinoma cells by decreasing the repression of NF-κB/Snail on RKIP[J].J Agric Food Chem,2012,60(3):852-861.
[11]Bonavida B,Baritaki S.The novel role of Yin Yang 1 in the regulation of epithelial to mesenchymal transition in cancer via the dysregulated NF-κB/Snail/YY1/RKIP/PTEN Circuitry[J].Crit Rev Oncog,2011,16(3-4):211-226.
(2013-12-18收稿 2014-02-02修回)
(本文编辑 闫娟)
Correlations of Snail and RKIP expressions with Tumor Invasion and Metastasis in Non-Small Cell Lung Cancer
QI Zhan1,YANG Dayun2,GAO Shaowei3
1 Department of Thoracic Surgery,2 Department of Internal Medicine,the Fourth Hospital of Hebei Medical Univercity, Shijia zhuang 050011,China;3 Department of Surgery,Zhao Country Hospital
ObjectiveTo detect Snail and Raf kinase inhibitor protein(RKIP)expressions in NSCLC(Non-Small Cell Lung Cancer)and their relationship with the pathological characteristics of tumor.MethodsImmunohistochemistry was used to detect Snail and RKIP expression in 124 NSCLC samples and 67 paraneoplastic normal lung tissue samples. Snail and RKIP positive expression rates were compared upon clinicopathologic characteristics.Correlation of Snail expression with RKIP expression was also analyzed.ResultsPositive expression rate of Snail was 79.03%in lung cancer,which is higher than that in normal lung tissue 19.40%(χ2=63.538,P<0.01);positive expression rate of RKIP was 36.29%in lung cancer which is lower than that in normal lung tissue 77.61%(χ2=29.716,P<0.01),Snail and RKIP expressions are correlated with tumor differentiation,TNM stage,lymph node metastasis and postoperative survival time(P<0.05,respectively). Snail protein expression is negatively correlated with RKIP expression in NSCLC(P<0.05).ConclusionHigh Snail expression and the low RKIP expression might be important biological markers for invasion and metastasis of NSCLC,which might be used as important prognostic indicators in NSCLC.
carcinoma,non-small-cell lung;raf kinases;neoplasm invasiveness;neoplasm metastasis;NSCLC;snail;Raf kinase inhibitor protein
R734.2
A
10.3969/j.issn.0253-9896.2014.06.021
*河北省科技支撑计划项目(项目编号:12277723)
1河北医科大学第四医院胸外科(邮编050011),2内科;3赵县人民医院外科
△通讯作者 E-mail:ssyydy@sina.com
