Smac参与雷公藤甲素对TGF-β1作用的大鼠系膜细胞凋亡的研究
2014-06-15苏宝凤郦银芳王晓花
苏宝凤 郦银芳 王晓花 张 莉 于 莹
Smac参与雷公藤甲素对TGF-β1作用的大鼠系膜细胞凋亡的研究
苏宝凤 郦银芳 王晓花 张 莉 于 莹
目的 探讨雷公藤甲素(Triptolide)对转化生长因子(TGF)-β1作用下的大鼠系膜细胞凋亡及Smac表达的影响。方法大鼠HBZY-1系膜细胞株分为对照组、TGF-β1组和低、中、高Triptolide组。低、中、高Triptolide组加入含不同浓度Triptolide(0.4、2、10 μg/L)预处理24 h后再加TGF-β1(10 μg/L)培养24 h。TUNEL法检测细胞凋亡;Real-time PCR法检测Smac mRNA表达;Western blot检测Smac蛋白表达;激光共聚焦荧光显微镜检测Smac蛋白亚细胞定位。结果与对照组相比,TGF-β1组系膜细胞凋亡减少,且Smac mRNA及蛋白表达降低(P<0.05);与TGF-β1组相比,Triptolide能够促进系膜细胞凋亡,且高Triptolide组Smac mRNA及蛋白表达量最高(P<0.05)。对照组及TGF-β1组Smac蛋白呈点状分布的线粒体定位,而经过Triptolide处理后Smac蛋白呈胞浆溶解状及染色体浓集。结论Triptolide可通过上调大鼠系膜细胞Smac表达,促进其由线粒体释放至细胞质及细胞核,从而促进TGF-β1作用下的大鼠系膜细胞凋亡。
肾小球系膜细胞;雷公藤内酯;转化生长因子β1;细胞凋亡;Smac
转化生长因子(TGF)-βl能诱导肾脏细胞固有表型转化及促进细胞外基质(ECM)聚积,在肾小球硬化及肾小管-间质纤维化进展中起关键作用。雷公藤的主要有效成分之一雷公藤甲素(Triptolide)可直接抑制海曼肾炎及糖尿病大鼠足细胞的足突融合,促进足突裂孔膜关键分子如Nephrin和Podocin的表达[1-3]、抑制NRK-49F细胞ECM的合成等作用[4]。促凋亡蛋白Smac/Diablo功能类似于果蝇类蛋白质Reaper、Grim、Hid,主要作用于凋亡抑制蛋白(IAPs)[5],解除对caspase-9和caspase-3的抑制,并可增加肿瘤坏死因子(TNF)-α生成,促进TNF相关的凋亡诱导配体(TRAIL)诱导的凋亡[6-7]。Smac在肿瘤的发生、治疗、预后等方面研究较多,而在肾脏方面的报道却较少。本文主要研究Triptolide对大鼠肾小球系膜细胞凋亡的影响及有关Smac的分子机制,为临床上Triptolide治疗肾脏病提供新的理论依据。
1 材料与方法
1.1 材料 (1)大鼠HBZY-1系膜细胞株(由第二军医大学附属上海长征医院赠送)。(2)药品。Triptolide购自南京泽朗医药有限公司,样品纯度大于98%。实验前应用时用培养液新鲜稀释成所需浓度。(3)主要试剂与仪器。RPMI 1640细胞培养粉剂(美国Gibco),胎牛血清(HyClone),重组人TGF-β1(英国PeproTech),RT-PCR试剂盒(杭州BIOER),SYBR Premix Ex TaqⅡ(日本TaKaRa),八联管(荷兰BIOplastics),Smac、β-actin引物(上海生工),小鼠抗大鼠Smac、β-actin单克隆抗体(英国Abcam),DyLight 800-Labeled Antibody To Mouse IgG(美国LI-COR),Cy3标记-Goat anti-mouse IgG二抗(美国Santa cruz),Real-time PCR仪(美国ABI),垂直平板电泳槽、蛋白转膜仪等(美国Bio-RAD),Odyssey双色红外激光成像系统(美国LI-COR),激光共聚焦荧光显微镜(德国Leica)。
1.2 方法
1.2.1 细胞培养及分组 大鼠HBZY-1系膜细胞株用含10%胎牛血清(FBS)RPMI 1640在CO2细胞培养箱(37℃,5% CO2)条件下培养。分为对照组,TGF-β1组,低、中、高剂量Triptolide+TGF-β1组(低、中、高Triptolide组)。
1.2.2 TUNEL法检测细胞凋亡 体外培养HBZY-1系膜细胞株,取3~10代对数生长期系膜细胞接种于12孔板,10% FBS的RPMI 1640培养。当细胞生长至40%~50%融合时,弃上清,低、中、高Triptolide组加入含不同浓度Triptolide(0.4、2、10 μg/L)的2%FBS RPMI 1640培养液预处理24 h后,弃上清,加入TGF-β1(10 μg/L)作用24 h。PBS洗涤,4%多聚甲醛4℃固定25 min,PBS洗涤,0.2%Triton-X 100破膜5 min,PBS洗涤,100 μL平衡缓冲液孵育10 min,滴加DNA末端转移酶及FITC标记的dUTP反应混合液50 μL,同时用ddH2O代替DNA末端转移酶作为阴性对照,37℃湿盒内孵育1 h,2×SSC终止反应15 min,PBS洗涤3次,Hoechst染色15 min,ddH2O洗涤,封片,激光共聚焦荧光显微镜下观察并计数。以上实验独立重复3次。
1.2.3 Real-time PCR检测Smac mRNA的表达 同法处理细胞,Trizol试剂提取细胞总RNA,参照BioRT Two Step RTPCR Kit说明书将mRNA逆转录为cDNA。引物序列β-actin上游5′-TTTAATGTCACGCACGATTTC-3′,下游5′-CCCATCTATGAGGGTTACGC-3′,产物大小150 bp;Smac上游5′-GCACCTCTACCTTTCTGTCTCAA-3′,下游5′-AGTCATCTCAACTCTGGCTCCTA-3′,产物大小182 bp。PCR反应体系20 μL,扩增条件:95℃预变性3 min;PCR反应95℃10 s,61℃30 s,72℃40 s,40个循环;溶解曲线95℃15 s,60℃15 s,95℃15 s。结束后读取Ct值。每次实验设3个复孔,独立重复实验3次。通过2-△△Ct方法分析实验组与正常对照组间mRNA的表达差异,△Ct=目的基因Ct值-管家基因Ct值,△△Ct=各组△Ct-正常对照组△Ct。
1.2.4 Western blot检测各组Smac蛋白的表达 同法处理细胞,加入细胞裂解液冰浴30 min,用细胞刮匙刮取细胞蛋白抽提液,移至1.5 mL EP管,高速低温离心15 min后取上清。用BCA法测蛋白浓度,与5×上样缓冲液混合煮沸5 min后电泳。各泳道分别加彩色预染Marker及样品蛋白进行SDSPAGE电泳,转膜,封闭后加入小鼠抗大鼠β-actin(1∶5 000),Smac(1∶800)单克隆抗体,4℃过夜,次日TBST洗膜,加Dy-Light 800-Labeled Antibody To Mouse IgG二抗(1∶1 000)孵育2 h。Odyssey双色红外激光成像系统扫膜。以上实验独立重复3次。以Smac蛋白与β-actin蛋白条带的比值进行半定量分析。
1.2.5 激光共聚焦荧光显微镜检测Smac蛋白的亚细胞定位 细胞爬片后同法处理细胞。弃培养液,PBS洗涤,4%多聚甲醛固定30 min,PBS洗涤,0.2%Triton X-100破膜15 min,PBS洗涤,5%BSA封闭30 min,加Smac单克隆抗体(1∶50)4℃孵育过夜(以0.01 mol/L PBS代替一抗作为阴性对照),PBS洗涤,加入Cy3标记Goat anti-mouse IgG二抗室温避光孵育2 h,PBS洗涤,Hoechst室温避光孵育5 min,ddH2O洗涤,甘油-Tris封片,4℃避光置湿盒中,激光共聚焦显微镜下观察。
1.3 统计学方法 采用Graphad Prism 5软件进行统计分析。计量资料满足正态分布的用±s表示,多组均数间比较用单因素方差分析,多重比较采用Dunnett-t法。P<0.05为差异有统计学意义。
2 结果
2.1 Triptolide对TGF-β1刺激的系膜细胞凋亡的影响 TGF-β1组细胞凋亡率较对照组减少;而各浓度Triptolide组细胞凋亡率较TGF-β1组显著增加,差异有统计学意义(P<0.05),见表1、图1。
Table 1 The rate of apoptosis in mesangial cells and transcription and expression levels of Smac in five groups表1 各组系膜细胞凋亡率、Smac mRNA和Smac蛋白的比较 (±s)

Table 1 The rate of apoptosis in mesangial cells and transcription and expression levels of Smac in five groups表1 各组系膜细胞凋亡率、Smac mRNA和Smac蛋白的比较 (±s)
**P<0.01;a与TGF-β1组比较,P<0.05
组别对照组TGF-β1组低Triptolide组中Triptolide组高Triptolide组F Smac蛋白80.03±1.36a48.27±1.08 72.16±4.69a95.99±1.58a125.98±4.92a11.90**n3 3 3 3 3细胞凋亡率(%)5.10±4.17a1.73±2.90 27.90±8.33a35.64±1.85a63.79±6.73a189.60**Smac mRNA 100.00±3.21a77.67±1.65 98.65±1.02a114.54±3.99a138.32±1.23a28.76**
2.2 Triptolide对TGF-β1诱导的Smac mRNA表达的影响 与对照组比较,TGF-β1组Smac mRNA表达减低(P<0.05)。各浓度Triptolide组Smac mRNA表达均高于TGF-β1组,差异有统计学意义(P<0.05),见表1。
2.3 Triptolide对TGF-β1诱导的Smac蛋白表达的影响 TGF-β1组Smac蛋白表达量低于对照组(P<0.05)。与TGF-β1组比较,各浓度Triptolide干预后,Smac蛋白表达增加(P<0.05),见表1、图2。
2.4 Triptolide对TGF-β1诱导的Smac蛋白亚细胞定位的影响 对照组及TGF-β1组Smac蛋白阳性信号呈颗粒状分布于线粒体内,且荧光信号强度相对较弱;Triptolide组Smac蛋白阳性信号弥散于细胞质及细胞核中,且信号强度较前增强。见图3。
3 讨论
各种肾小球疾病终末期其共同病理变化是肾小球硬化,其特征是肾小球结构萎缩和ECM在肾组织的过度堆积,肾小球系膜细胞是产生ECM的效应细胞,其过度增殖与凋亡减少与肾小球硬化是密切关联的病理过程[8]。TGF-β1是目前发现的致纤维化最强的细胞因子之一,在肾小球硬化的发生、发展中具有重要作用,其可促进系膜细胞增殖、增加ECM的合成,并抑制系膜细胞凋亡,故如何促进系膜细胞凋亡成为当前研究一热点。
雷公藤含有多种生物活性物质,具有免疫抑制、抗炎及抗肿瘤的作用。Triptolide是其主要活性成分,于1972年首次从雷公藤中分离出并认识其结构特征[9]。在肿瘤研究方面,Triptolide能通过与TRAIL结合,提高抗TRAIL的胆管癌细胞对TRAIL诱导凋亡的敏感性[10];通过下调核因子(NF)-κB抑制人类甲状腺癌细胞血管生成和浸润[11];在免疫抑制方面,Triptolide通过对白细胞介素(IL)-2、IL-2受体的影响,来达到免疫抑制及诱导一定程度的免疫耐受[12],还通过其他机制被用于临床上各种自身免疫性疾病及患者器官和组织移植术后的治疗中[13]。在肾脏病领域,Triptolide对大鼠糖尿病肾病具有显著的治疗作用,能有效地减少蛋白尿,减轻肾组织免疫损伤,促进足细胞病变和裂孔膜蛋白结构的修复[14]。目前Triptolide发挥作用的机制正逐步被人们所认识,但有关其对系膜细胞凋亡的影响及有关Smac机制的研究尚不多见。
Du等[15]从HeLa细胞线粒体中提取一种与细胞色素C和dATP同时存在的因子,该因子在细胞质中能够提高caspases的活性,因此命名为caspase的第二个线粒体激活因子Smac,同时Verhagen等[16]从293T细胞中发现了它的同源物Diablo,即低等电点的IAPs直接结合蛋白,因其可与IAPs蛋白直接结合并具有低等电点而得名。经对比分析,Diablo与Smac蛋白为同一蛋白,合并称为Smac/Diablo。Smac的促凋亡活性取决于其定位而不是加工。
本研究结果显示,TGF-β1能够抑制系膜细胞凋亡,且Smac mRNA及蛋白表达均降低。而Triptolide能够呈浓度依赖性地有效抑制这种效应,细胞凋亡率显著增加,且Smac mRNA及蛋白表达均升高。另外通过对Smac亚细胞定位的研究发现,对照组及TGF-β1组Smac主要存在于线粒体中,呈颗粒状分布,而Triptolide组Smac呈细胞质及染色体浓集。有研究表明,Triptolide能够诱导线粒体膜电位的丢失,促使细胞色素C释放,caspase-9基因敲除的细胞对Triptolide是抵抗的,而caspase-8缺失的细胞对Triptolide却很敏感,提示线粒体途径而不是死亡受体途径在Triptolide发挥促凋亡过程中起关键性的作用[17]。同时,Triptolide也能够通过诱导其他因子发挥促凋亡活性。故笔者推测Triptolide能够启动内源性细胞凋亡途径,诱导线粒体外膜通透性增加(MOMP),跨膜电位丢失,释放线粒体膜间蛋白包括细胞色素C、Smac/Diablo等到细胞质,并与IAPs作用,进一步促进caspase依赖性和非依赖性的凋亡,促进大鼠系膜细胞凋亡。
与大多数学者所报道不完全一致也是本实验创新之处的是:本实验发现凋亡程序启动后Smac不仅仅弥散于细胞质,而且在细胞核中Smac的荧光强度也明显增高,而Smac发挥其促凋亡作用主要在细胞质中。Triptolide使部分Smac转移至细胞核中的机制如何以及该部分的Smac是否有其他作用有待进一步的研究。
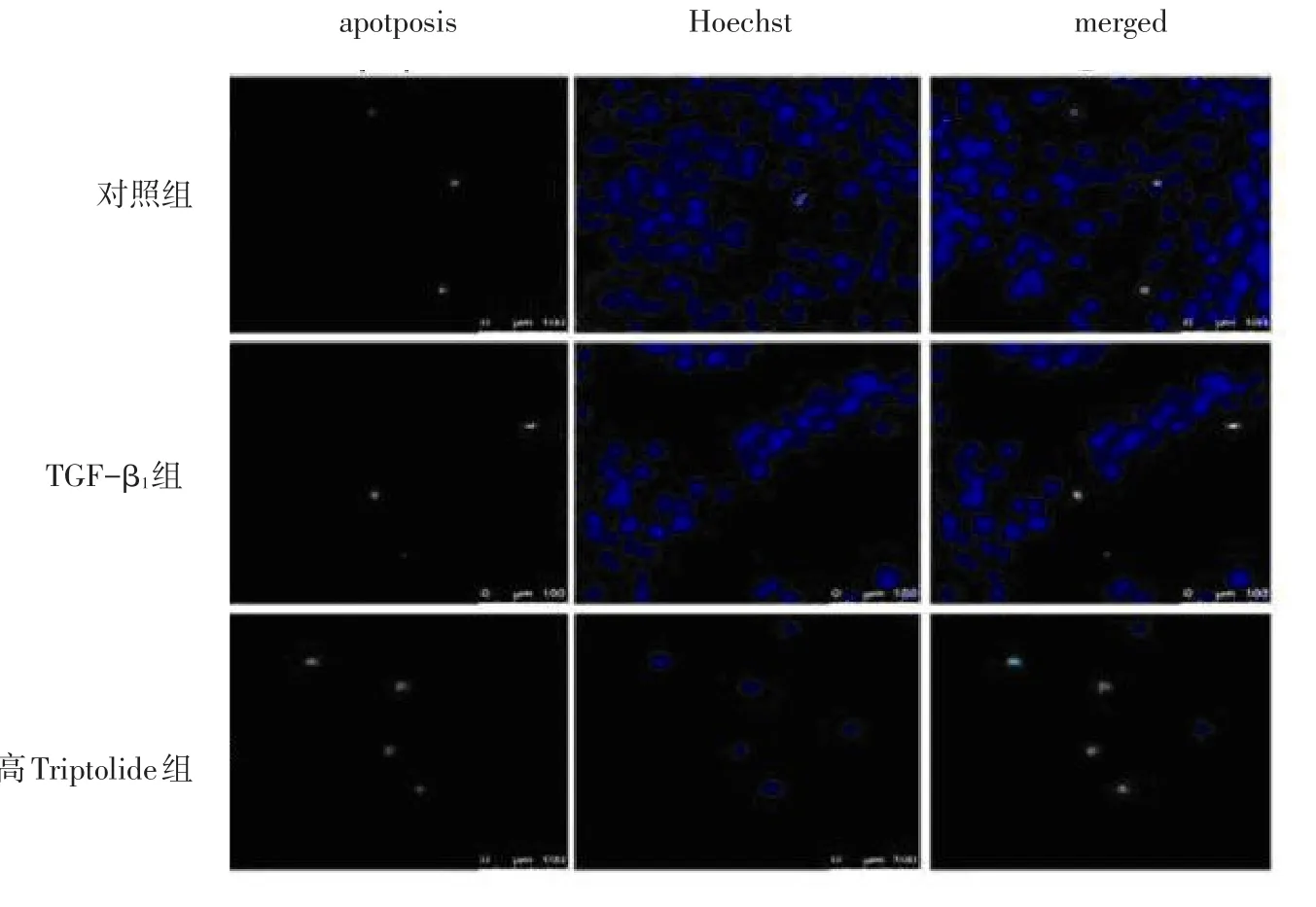
Figure 1 The effect of Triptolide on apoptosis of mesangial cells stimulated by TGF-βl图1 TUNEL法检测各浓度Triptolide对TGF-βl刺激的系膜细胞凋亡的影响(FITC和Hoechst双染,bar=20 μm,绿色荧光即凋亡细胞的细胞核碎片)

Figure 2 Expression levels of Smac in five groups图2 Western blot检测Triptolide对TGF-β1诱导的Smac蛋白表达的影响
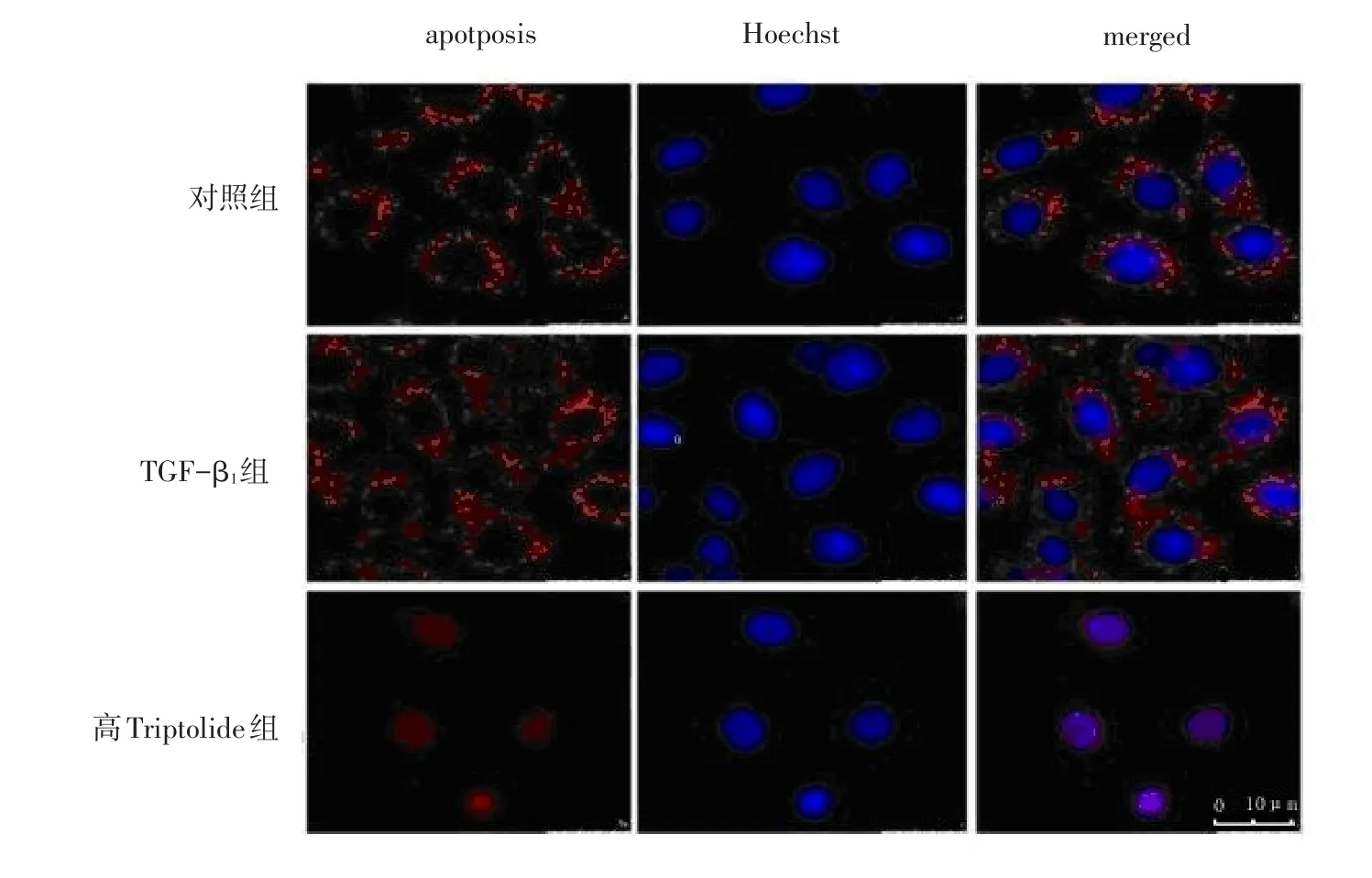
Figure 3 Confocal fluorescence microscopy shows localization of Smac图3 激光共聚焦荧光显微镜检测Triptolide对TGF-β1诱导的Smac蛋白亚细胞定位的影响(bar=5 μm)
[1]Chen BJ.Triptolide,a novel immunosuppressive and antiinflammatory agent purified from a Chinese herb Tripterygium wilfordii Hook F[J].Leuk Lymphoma,2001,42(3):253-265.
[2]Lu N,Liu J,Liu J,et al.Antagonist effect of triptolide on AKT activation by truncated retinoid X receptor-alpha[J].PLoS One 2012,7 (4):e35722.doi:10.1371/journal.pone.0035722.
[3]Chen ZH,Qin WS,Zeng CH,et al.Triptolide reduces proteinuria in experimental membranous nephropathy and protects against C5b-9-induced podocyte injury in vitro[J].Kidney Int,2010,77(6):974-988.
[4]Zhu B,Wang YJ,Zhu CF,et al.Triptolide inhibits extracellular matrix protein synthesis by suppressing the Smad2 but not the MAPK pathway in TGF-β1-stimulated NRK-49F cells[J].Nephrol Dial Transplant,2010,25(10):3180-3191.
[5]Chai J,Du C,Wu JW,et al.Structural and biochemical basis of apoptotic activation by Smac/DIABLO[J].Nature,2000,406(6798): 855-862.
[6]Varfolomeev E,Blankenship JW,Wayson SM,et al.IAP antagonists induce autoubiquitination of c-IAPs,NF-kappaB activation,and TNFalpha-dependent apoptosis[J].Cell,2007,131(4):669-681.
[7]VinceJE,WongWW,KhanN.IAPantagoniststargetcIAP1toinduce TNFalpha-dependentapoptosis[J].Cell,2007,131(4):682-693.
[8]Furuichi K,Hisada Y,Shimizu M,et al.Matrix metalloproteinase-2(MMP-2)and membrane-type 1 MMP(MT1-MMP)affect the remodeling of glomerulosclerosis in diabetic OLETF rats[J].Nephrol Dial Transplan,2011,26(10):3124-3131.doi:10.1093/ndt/gfr125.
[9]Kupchan SM,Court WA,Dailey RG Jr,et al.Triptolide and tripdiolide,novel antileukemic diterpenoid triepoxides from Tripterygium wilfordii[J].J Am Chem Soc,1972,94(20):7194-7195.
[10]Panichakul T,Intachote P,Wongkajorsilp A,et al.Triptolide sensitizes resistant cholangiocarcinoma cells to TRAIL-induced apoptosis[J].Anticancer Res,2006,26(1A):259-265.
[11]Zhu W,Ou Y,Li Y,et al.A small-molecule triptolide suppresses angiogenesis and invasion of human anaplastic thyroid carcinoma cells via down-regulation of the nuclear factor-κB pathway[J].Mol Pharmacol,2009,75(4):812-819.
[12]Zhang Y,Ma XJ.Triptolide inhibits IL-12/IL-23 expression in APCs via CCAAT/enhancer-binding protein alpha[J].J Immunol, 2010,184(7):3866-3877.doi:10.4049/jimmunol.0903417.
[13]戴澄,王平,张新涛,等.雷公藤甲素PG490-88联合环孢素A免疫抑制诱导肾移植急性排斥反应模型大鼠的免疫耐受[J].中国组织工程研究与临床康复,2011,15(5):861-864.
[14]薛晓菲,翟丽慧,刘相,等.雷公藤甲素对2型糖尿病大鼠足细胞的影响研究[J].临床合理用药,2012,5(7c):7-11.
[15]Du CY,Fang M,Li Y,et al.Smac,a mitochondrial protein that promotes cytochrome-dependent caspase activation by elimination IAP inhibition[J].Cell,2000,102(1):33-42.
[16]Verhagen AM,Ekert PG.Identification of DIABLO,a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins[J].Cell,2000,102(1):43-53.
[17]Zhuang XM,Shen GL,Xiao WB,et al.Assessment of the roles of P-glycoprotein and cytochrome P450 in triptolide-induced liver toxicity in sandwich-cultured rat hepatocyte model[J].Drug Metab Dispos,2013,41(12):2158-2165.
(2013-08-07收稿 2014-02-08修回)
(本文编辑 魏杰)
读者·作者·编者
《天津医药》协作办刊单位(排名不分先后)
天津市胸科医院
天津市第三中心医院
天津医科大学总医院
天津市中医药研究院附属医院
天津港口医院
天津医科大学代谢病医院
天津市天津医院
天津市宁河县医院
天津市滨海新区大港医院
天津市儿童医院
天津市第一中心医院
天津医科大学第二医院
天津市第二人民医院
天津市安定医院
天津市人民医院
天津市公安医院
天津华立达生物工程有限公司
天津金耀集团有限公司
天津市第五中心医院
海洋石油总医院
天津海滨人民医院
天津医学高等专科学校
天津市口腔医院
天津市第四中心医院
天津医科大学口腔医院
Smac Involved in Promoting TGF-β1Treated Mesangial Cells Apoptosis Induced by Triptolide
SU Baofeng,LI Yinfang,WANG Xiaohua,ZHANG Li,YU Ying
Department of Pediatrics,Nanjing First Hospital,Nanjing Medical University,Nanjing 210006,China
Objective To investigate the effects of Triptolide on apoptosis of cultured rat mesangial cells treated by TGF-β1and the role of Smac in this process.MethodsThe mesangial cells were pre-treated with different concentrations of Triptolide for 24 hours,then stimulated with TGF-β1for 24 hours.Apoptotic cells were detected by TUNEL assay.Smac transcription level was determined by Real time-PCR analyses.Smac expression level was assessed using Western blot analyses.Localization of Smac was shown by confocal fluorescence microscopy.ResultsCompared with control group,TGF-β1inhibited apoptosis and Smac transcription and expression in rat mesangial cells.By contrast,Triptolide promoted mesangial cells apoptosis.In Triptolide groups,Smac mRNA and protein levels were up-regulated.Additionally,in normal and TGF-β1groups Smac protein was mainly localized in mitochondriawhile in Triptolide groupit was mainly localized in cytoplasm and nucleus with increased fluorescence intensity.ConclusionTriptolide could promote the effect that TGF-β1inhibited apoptosis of mesangial cells,through both up-regulation the expression of Smac and stimulating it translocation from mitochondria to cytoplasm and nucleus.
mesangial cells;Triptolide;transforming growth factor beta1;apoptosis;Smac
R692
A
10.3969/j.issn.0253-9896.2014.06.014
南京医科大学附属南京医院、南京市第一医院儿科(邮编210006)
