负载干细胞抗原的DC联合CIK细胞对乳腺癌荷瘤鼠肿瘤杀伤研究*
2014-06-15庞春淼孙雯雯司玉玲
庞春淼 吕 艳 孙雯雯 司玉玲 庞 华△
负载干细胞抗原的DC联合CIK细胞对乳腺癌荷瘤鼠肿瘤杀伤研究*
庞春淼1吕 艳1孙雯雯2司玉玲2庞 华2△
目的 研究不同乳腺癌细胞抗原负载的树突状细胞(DC)与细胞因子诱导的杀伤细胞(CIK)联合培养后对乳腺癌荷瘤鼠体内肿瘤的杀伤效果。方法分离乳腺癌细胞系MCF-7/ADR中的乳腺癌干细胞并制备冻融抗原,以此冲击由正常人外周血提取的单个核细胞诱导培养的DC和CIK,注入乳腺癌荷瘤鼠模型中,以此为实验组(BCSC-AP-DC+CIK组),并与普通抗原冲击的DC联合CIK组(AP-DC+CIK组)、DC+CIK组、CIK组及生理盐水组(NS组)建立对照实验。观察各组中小鼠肿瘤生长情况,采用免疫组化法检测bcl-2、bax表达,原位末端标记法(TUNEL)检测各组肿瘤组织凋亡。结果各组小鼠肿瘤体积在治疗前后及各组小鼠肿瘤体积在治疗后差异均有统计学意义(P<0.05),NS组小鼠治疗后肿瘤体积最大(3.625±0.093)cm3,BCSC-AP-DC+CIK组肿瘤体积最小(1.234±0.131)cm3。BCSC-AP-DC+CIK组bax强阳性表达,较其他组强;bcl-2弱阳性或不表达,较其他组弱。凋亡指数BCSC-AP-DC+ CIK组>AP-DC+CIK组>DC+CIK组>CIK组>NS组。结论经乳腺癌干细胞抗原冲击的DC与CIK作用后诱导同种乳腺癌细胞凋亡强于经普通乳腺癌细胞抗原冲击的DC联合CIK、单纯DC与CIK共同作用后及单独CIK的治疗效果。
乳腺肿瘤;干细胞;树突细胞;杀伤细胞;基因,bcl-2;bcl-2相关X蛋白;细胞凋亡
乳腺癌是威胁女性健康的重要疾病,乳腺癌干细胞(breast cancer stem cell,BCSC)是在乳腺癌治疗中引起放化疗抵抗、肿瘤转移、复发的重要原因[1]。寻找一种行之有效的杀灭肿瘤干细胞的方法成为肿瘤治疗的新方向。过继免疫疗法是近年来兴起的一种新的肿瘤治疗方法[2],特别适用于放化疗治疗相对不敏感的肿瘤,已经作为临床上一种重要的治疗方法正在逐步推广。本研究通过肿瘤干细胞制备抗原,冲击树突状细胞(DC)后与细胞因子诱导的杀伤细胞(CIK)共培养,研究其对乳腺癌荷瘤鼠肿瘤组织的杀伤情况。
1 材料与方法
1.1 主要材料 (1)SPF级6~8周龄雌性nod-scid小鼠(许可证号:scxk京,2006),体质量(20.461±1.652)g,购自天津医科大学药学院。(2)RPMI-1640培养基购自Hyclone公司,胎牛血清购自天津津浦生物公司,粒细胞-巨噬细胞集落刺激因子(GM-CSF),白细胞介素(IL)-4,IL-2,肿瘤坏死因子(TNF)-α,干扰素(IFN)-γ,均购自美国PEPRO TECH公司;流式抗体FITC-CD44、PE-CD24购自美国Becton Dickinson公司,免疫磁珠抗体CD44、CD24购自德国Miltenyi Biotec公司,免疫组化抗体bcl-2、bax购自北京中杉金桥生物技术有限公司,原位末端标记法(TUNEL)试剂盒购自德国Roche公司,乳腺癌细胞系MCF-7/ADR购自中国医学科学院血液病研究所。
1.2 方法
1.2.1 肿瘤细胞传代培养及干细胞鉴定收集 将MCF-7/ADR细胞加入含10%胎牛血清的RPMI-1640培养基中,置于37℃、5%CO2、饱和湿度条件下传代培养。选择对数生长期的细胞,选取FITC-CD44、PE-CD24流式抗体,采用流式细胞术检测细胞系中CD44+CD24-乳腺癌干细胞所占比例。用免疫磁珠分选法选取CD44+CD24-乳腺癌干细胞,收集备用。
1.2.2 DC和CIK的制备 采集并分离健康人外周血单个核细胞,洗涤后静置培养4 h,分别收集贴壁细胞与非贴壁细胞。贴壁细胞诱导为DC:第1天加入IL-4 500 U/mL,GMCSF 600 U/mL,隔日全量换液并补充上述细胞因子。收集非贴壁细胞用于诱导CIK,并加入IFN-γ 1 000 U/mL,24 h后加入CD3单抗50 mg/L,添加IL-2 300 U/mL,隔日半量换液1次,并补足IL-2。
1.2.3 乳腺癌荷瘤鼠模型的建立 按照随机数字表法将小鼠随机分为5组,每组6只。无菌条件下,将乳腺癌干细胞调整细胞浓度为1×104/mL,注射0.2 mL于小鼠脂肪垫下。待接种部位出现肿瘤结节、质地较硬等指征认定为成瘤。
1.2.4 乳腺癌干细胞抗原及乳腺肿瘤细胞抗原的制备 分别选取上述经磁珠分选提取的MCF-7/ADR肿瘤干细胞和未经干细胞分选的MCF-7/ADR肿瘤细胞,调整细胞浓度至2× 107/mL,反复冻融离心,吸上清,过滤除菌。分别制备乳腺癌干细胞抗原及乳腺肿瘤细胞抗原。
1.2.5 冻融抗原对DC的体外致敏冲击 收集上述诱导培养至第11天的DC,以DC分别与乳腺癌干细胞抗原和乳腺癌细胞抗原的比例1∶10加入冻融抗原,继续培养16 h,第12天收集备用。
1.2.6 各组治疗及对照处理 待上述荷瘤鼠注射肿瘤细胞部位长出肉眼可见的肿瘤后,按照分组分别注射治疗细胞。BCSC-AP-DC+CIK组:将经肿瘤干细胞抗原冲击过的DC与上述培养的CIK以1∶10的比例混合,调整细胞浓度至2× 106/mL,经小鼠尾静脉注射。AP-DC+CIK组:注入经乳腺肿瘤细胞抗原冲击的DC+CIK。DC+CIK组:注入未经抗原冲击的DC+CIK。CIK组:注入单纯成熟CIK。NS组:注入生理盐水。除NS组外每组的细胞浓度均为2×106/mL,各组注入量为0.2 mL/次,频率为1次/周,共治疗4周。
1.2.7 荷瘤鼠肿瘤生长情况监测 从治疗开始,每4 d定时用游标卡尺测量荷瘤鼠模型移植瘤大小,记录a(长径)和b(短径),按公式:体积=a×b×(a+b)/2计算肿瘤体积。各治疗组小鼠于治疗后2周后分别处死,剥离肿瘤组织,甲醛固定,制作石蜡切片。
1.2.8 免疫组织化学法检测bcl-2、bax表达情况 组织切片常规脱蜡及复水后,用H2O2阻断内源酶。再分别滴入相应的bcl-2、bax抗体,4℃冰箱过夜,滴加二抗后DAB显色,苏木精复染、脱水、透明、封片、镜检。
1.2.9 细胞凋亡的检测 利用上述制备的石蜡切片,采用TUNEL法参照说明书步骤进行操作,以DAB试剂做最后显色。细胞核呈棕褐色着染或细胞浆因核DNA逸出呈阳性着染者,为凋亡细胞。每个肿瘤标本于高倍视野下计数200个细胞,每组小鼠凋亡细胞比例的均数为本组的凋亡指数。
1.3 统计学方法 采用SPSS 16.0统计软件分析数据,计量资料数据用±s表示,配对资料采用配对t检验,多组间比较采用方差分析方法,组间多重比较采用Bonferroni法,P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌MCF-7/ADR细胞系中CD44+CD24-细胞比例 FITC-CD44、PE-CD24抗体标记的MCF-7/ ADR细胞系,CD44+CD24-乳腺癌干细胞所占比例为23.4%,见图1。
2.2 荷瘤裸鼠治疗前后肿瘤体积比较 治疗前5组荷瘤裸鼠间肿瘤体积差异无统计学意义,经不同治疗后,BCSC-AP-DC+CIK组、AP-DC+CIK组、DC+ CIK组和CIK组肿瘤体积减小,NS组肿瘤体积增加(P<0.05或P<0.01)。表现为BCSC-AP-DC+CIK组最小,NS组最大,见表1。
2.3 治疗后小鼠肿瘤组织HE染色情况 BCSCAP-DC+CIK组小鼠肿瘤组织可见体积较大,胞浆淡染,胞核较大的乳腺癌肿瘤细胞,其间可见胞体较小,胞质少,细胞核小而圆,呈蓝紫色的淋巴细胞浸润入肿瘤组织中,见图2。
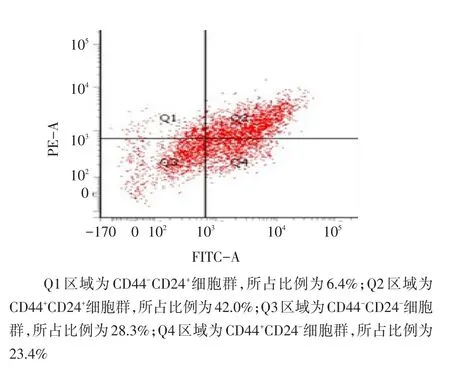
Figure 1 The proportion of CD44+CD24-cells in MCF-7/ADR cell lines图1 MCF-7/ADR细胞系中CD44+CD24-细胞所占比例
Table 1 Comparison of tumor volume between all five groups表1 各组小鼠肿瘤体积治疗前后比较(n=6,cm3,ˉ±s)

Table 1 Comparison of tumor volume between all five groups表1 各组小鼠肿瘤体积治疗前后比较(n=6,cm3,ˉ±s)
**P<0.01;a与(1)比较,b与(2)比较,c与(3)比较,d与(4)比较,P<0.05
组别BCSC-AP-DC+CIK组(1)AP-DC+CIK组(2)DC+CIK组(3)CIK组(4)NS组(5)F治疗前2.436±0.007 2.435±0.009 2.434±0.131 2.435±0.058 2.434±0.011 0.058治疗后45 d 1.234±0.131 1.598±0.042a1.873±0.045ab2.395±0.260abc3.625±0.093abcd721.648**t 21.909**45.404**28.484**3.639*30.159**
2.4 小鼠肿瘤bax、bcl-2表达情况 (1)bax染色情况:BCSC-AP-DC+CIK组bax强阳性表达,AP-DC+ CIK组、DC+CIK组、CIK组、NS组的阳性强度均弱于前者,且有递减趋势。BCSC-AP-DC+CIK组可见小鼠乳腺癌组织中乳腺细胞胞浆呈棕黄色弥漫阳性,胞核显色不清,细胞处于坏死状态,周围侵润的淋巴细胞呈蓝紫色,胞核小而圆,染色清晰,胞质少。DC+CIK组中可见乳腺细胞胞体大,胞浆棕黄色阳性淡染,胞核可见或不可见,肿瘤细胞周围可见蓝紫色淋巴细胞,胞核小,胞质少。NS组可见肿瘤细胞核呈蓝紫色,胞核大,椭圆形或圆形,胞质染色阴性或有少数细胞弱阳性,肿瘤细胞间未见淋巴细胞浸润。见图3A~C。(2)bcl-2染色情况:BCSC-AP-DC+ CIK组bcl-2染色弱阳性,其他各组染色阳性强度呈递增趋势,NS组呈强阳性表达。BCSC-AP-DC+CIK组小鼠乳腺癌组织中乳腺细胞胞浆染色弱阳性,部分区域胞核显色不清,细胞处于坏死状态。DC+CIK组中可见乳腺细胞胞体大,部分细胞胞浆呈棕黄色,胞核大而圆,部分细胞呈坏死状态,肿瘤细胞周围可见蓝紫色淋巴细胞,胞核小,胞质少。NS组小鼠肿瘤细胞胞浆染色强阳性,胞核呈蓝紫色深染,细胞核大,椭圆形。未见淋巴细胞浸润。见图3D~F。
2.5 小鼠肿瘤细胞凋亡情况 肿瘤细胞胞浆淡染,凋亡细胞的细胞核呈棕黄色,非凋亡细胞细胞核深紫蓝色,见图4。BCSC-AP-DC+CIK组、AP-DC+ CIK组、DC+CIK组、CIK组和NS组凋亡指数依次降低,分别为0.595±0.068、0.556±0.046、0.344±0.051、0.260±0.038、0.123±0.017,各组间差异均有统计学意义(F=106.369,P<0.01;多重比较均P<0.05)。
3 讨论
3.1 现阶段乳腺癌治疗中的困难及可能的新治疗方向 在乳腺癌的治疗过程中,通常能杀灭数量众多的乳腺癌细胞,但研究表明乳腺癌干细胞对于放化疗均有一定的抵抗性,治疗后残存肿瘤干细胞的增殖,是导致乳腺癌复发的主要原因[3]。近年来,对乳腺癌干细胞的研究成为寻找乳腺癌治疗的新靶点。肿瘤干细胞的分选方法有侧群分选法[4]、表面标记法[5]、微球体培养法[6]等。现在普遍的观点认为CD44+CD24-细胞是乳腺癌干细胞。本实验中通过流式细胞术测定CD44+CD24-细胞在MCF-7/ADR细胞系中所占比例为23.4%。如能选取靶向杀伤此群细胞的方法,有可能解决乳腺癌治疗中的放化疗抵抗、转移、复发等问题。
3.2 过继免疫疗法在杀伤乳腺肿瘤细胞中的可行性 在肿瘤治疗中,过继免疫疗法已成为继放化疗后肿瘤患者辅助治疗的重要手段之一;广泛应用于治疗白血病[7]、肾癌[8]、胃癌[9]等肿瘤,尤其适用于难治复发型、肿瘤转移的患者,效果优于放疗、化疗。过继免疫疗法通过DC将抗原递呈给CIK,增强了CIK的杀伤活性。寻找一种特异性较强的抗原对DC进行冲击,从而达到靶向杀伤作用是目前的一个研究方向。王小利等[10]利用携带癌胚抗原(CEA)基因的重组人腺相关病毒(rh-AAV)感染DC诱导获得抗原特异性细胞毒性T淋巴细胞(CTL),可杀伤表达CEA的乳腺癌细胞,对CD44+CD24-腺癌干细胞也具有一定的杀伤活性,提示免疫治疗可能是治疗乳腺癌干细胞潜在有效的手段。本研究则试图以乳腺癌干细胞抗原活化DC后与CIK共培养,对乳腺癌干细胞进行靶向性杀伤。通过小鼠肿瘤体积测定、TUNEL检测其对肿瘤的杀伤情况,发现经乳腺癌干细胞抗原冲击活化后的DC+CIK确实具有更强的杀伤乳腺癌细胞的作用。
3.3 过继免疫疗法引起肿瘤细胞凋亡原因 细胞凋亡过程涉及一系列蛋白,如Caspase家族蛋白、bcl-2家族蛋白、P53等。bcl-2家族是在细胞凋亡中有重要作用的一类蛋白质[11]。bcl-2家族蛋白位于细胞线粒体外膜上,该家族包含具有两种截然不同作用的蛋白,一类是抑制凋亡的基因如bcl-2、bclxl、bcl-w等,另一类是促进细胞凋亡的基因如bax、bak、bok等。其中的bcl-2和bax是最具代表性的两类蛋白。bcl-2在人的胚胎组织和肿瘤组织中广泛表达,是公认的抑制凋亡的因子,在实体瘤及血液系统肿瘤的发生中都有重要作用。而bax的作用与bcl-2相反,能够抑制细胞凋亡,并且bax是bcl-2的主要抑制因子。bcl-2和bax的共同作用决定了细胞接受凋亡信号或抑制凋亡信号[12]。细胞凋亡在肿瘤发生和发展中有重要意义,肿瘤的治疗主要是通过诱导肿瘤细胞凋亡来实现。本课题组既往的研究中采用过继免疫疗法对乳腺癌荷瘤鼠的肿瘤组织进行杀伤,已经证实DC+CIK对乳腺癌细胞具有杀伤作用[13]。本研究通过靶向杀伤乳腺癌干细胞的方法对乳腺癌荷瘤鼠模型进行治疗,结果发现负载乳腺癌干细胞抗原的DC+CIK组肿瘤细胞凋亡率高,bcl-2表达最弱,bax阳性表达最强,印证了负载乳腺癌干细胞抗原的BCSC-AP-DC+CIK组相对于负载普通乳腺癌抗原的DC+CIK组及其他各组具有更强的杀伤乳腺癌细胞能力,且其促进细胞凋亡的作用是通过影响bcl-2家族蛋白的表达实现的。但如何制备出更具有特异性的乳腺癌干细胞抗原,从而能够更加具有针对性地杀伤乳腺癌干细胞需要深入研究。
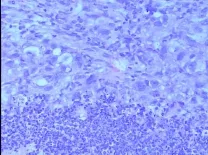
Figure 2 The pathological manifestations of breast cancer tissue in BCSC-AP-DC+CIK group(HE,×40)图2 BCSC-AP-DC+CIK组小鼠乳腺癌组织病理图片(HE,×40)
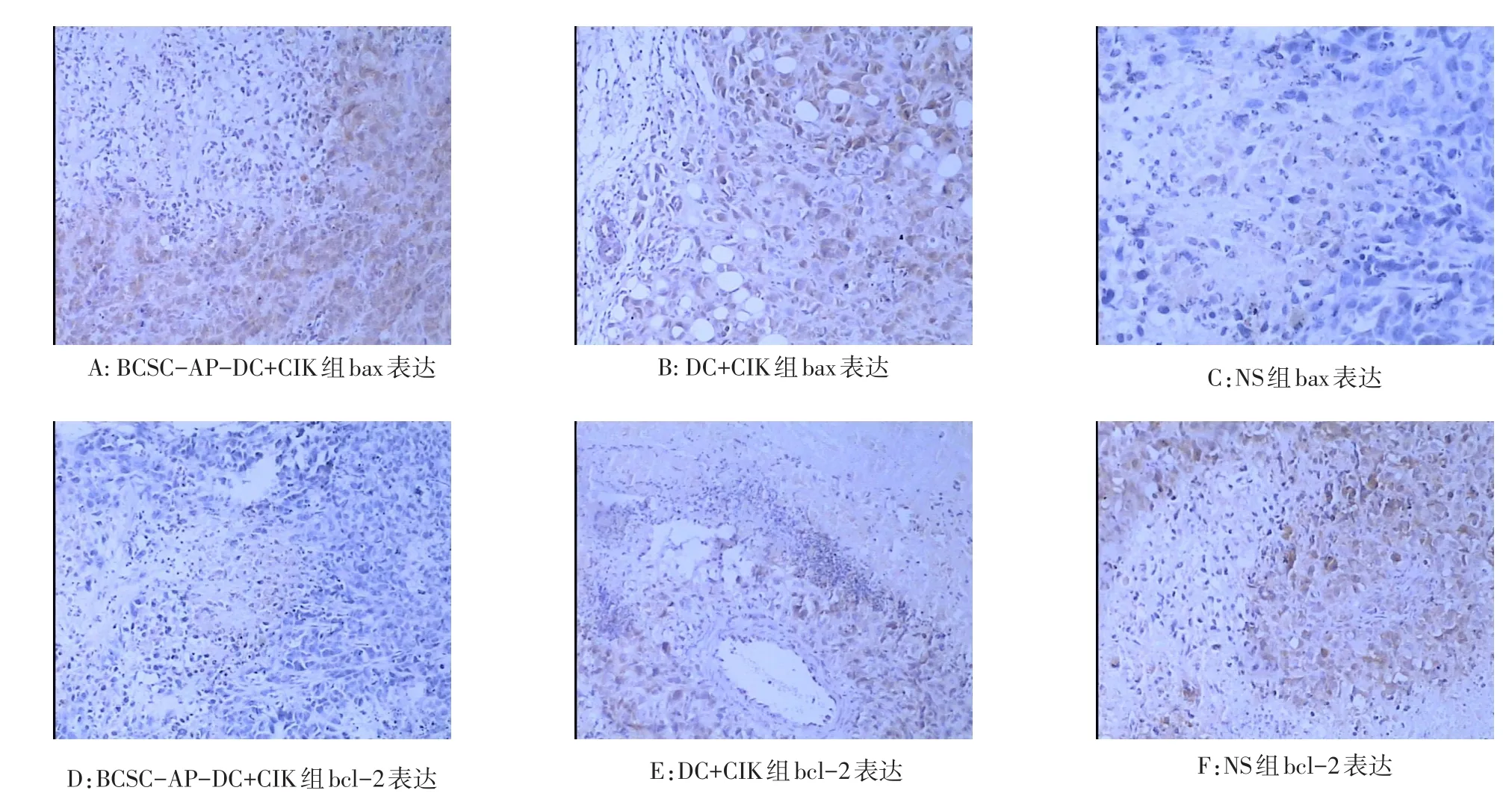
Figure 3 Staining of bcl-2-Associated X Protein tumor-bearing specimens(Immunohistochemitry,×40)图3 荷瘤标本bcl-2相关X蛋白染色(免疫组化,×40)
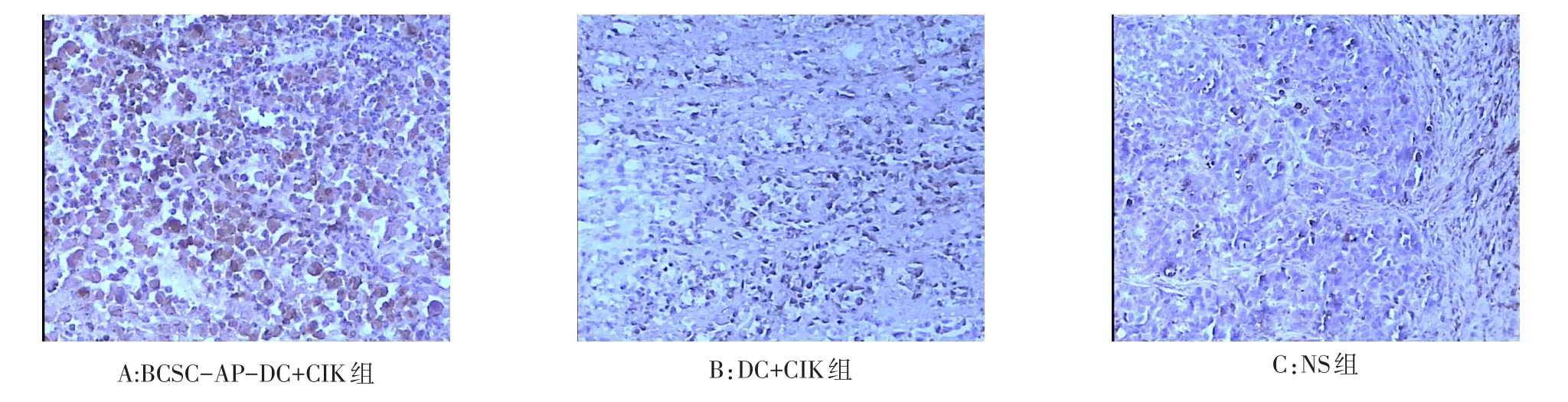
Figure 4 TUNEL staining in tumor-bearing specimens(×40)图4 荷瘤标本TUNEL染色结果(×40)
[1]Al-Ejeh F,Smart CE,Morrison BJ,et al.Breast cancer stem cells: treatment resistance and therapeutic opportunities[J].Carcinogenesis,2011,32(5):650-658.doi:10.1093/car cin/bgr028.
[2]Jiang JT,Shen YP,Wu CP,et al.Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients[J].World J Gastroenterol,2010,16(48):6155-6162.doi:10.3748/wjg.v16.i48.6155.
[3]Croker AK,Allan AL.Inhibition of aldehyde dehydrogenase(ALDH)activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+human breast cancer cells[J].Breast Cancer Res Treat,2012,133(1):75-87.doi:10.1007/s10549-011-1692-y.
[4]Golebiewska A,Brons NH,Bjerkvig R,et al.Critical appraisal of the side population assay in stem cell and cancer stem cell research [J].Cell Stem Cell,2011,8(2):136-147.doi:10.1016/j.stem.2011. 01.007.
[5]Ricardo S,Vieira AF,Gerhard R,et al.Breast cancer stem cell markers CD44+,CD24-and ALDH1+:expression distribution within intrinsic molecular subtype[J].J Clin Pathol,2011,64(11):937-946.
[6]屈洪波,韩明利,范原铭,等.阻断PI3K/Akt信号通路对低氧微环境中BCSCs微球体细胞增殖的影响[J].肿瘤,2013,33(001):36-41.doi:10.3781/j.issn.1000-7431.2013.01.006.
[7]Zheng ZZ,Zhang YN,Zhang HM,et al.clinical study of DC-CIK (dendritic cells and cytokine-induced killer cells)eliminate minimal residual leukemia[J].Blood,2013,122(21):1450-1450.
[8]王舟怡,孙庭,马明.G250-DC-CIK细胞协同索拉菲尼对肾癌细胞的杀伤作用[J].中国生化药物杂志,2011,32(3):225-225.
[9]史颖,彭大为.DC-CIK细胞免疫联合化疗治疗晚期胃癌1例[J].中国热带医学,2012,12(003):272-272.
[10]王小利,马博,贾军,等.rAAV/CEA转染树突状细胞诱导特异性CTL杀伤MCF-7细胞系CD44+CD24-/low乳腺癌干细胞[J].北京大学学报(医学版),2011,43(2):173-178.doi:10.3969/j.issn.1671-167X.2 011.02.003.
[11]Ola MS,Nawaz M,Ahsan H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351 (1-2):41-58.doi:10.1007/s11010-010-0709-x.
[12]Chipuk JE,Moldoveanu T,Llambi F,et al.The BCL-2 family reunion[J].Mol Cell,2010,37(3):299-310.doi:10.1016/j.molcel.2010.01.025.
[13]庞华,司玉玲,綦振家,等.耐药乳腺癌裸鼠模型免疫治疗初探[J].天津医药,2011,39(12):1136-1140.doi:10.3969/j.issn.0253-9896.2011.12.015.
(2013-10-24收稿 2014-02-08修回)
(本文编辑 李鹏)
Study of Antitumor Effect of Combination of CIK with DC both Pulsed by Breast Cancer Stem Cell Antigen in Mice Model with Tumor
PANG Chunmiao1,LYU Yan1,SUN Wenwen2,SI Yuling2,PANG Hua2
1 Graduate School of Tianjin Medical University,Tianjin 300070,China;2 Central Laboratory,Tianjin 4th Central Hospital
Objective To investigate the tumor-inhibitory effect of cytokine-induced killer cells(CIK)co-cultured with dendritic cells(DC)pulsed by breast cancer stem cell antigen on the same tumor-bearing mice.MethodsBreast cancer stem cells were isolated from the cell line of MCF-7/ADR and extract lyses antigen of the stem cell was saved. DC and CIK derived from peripheral blood mononuclear cells of healthy individuals were co-cultured and pulsed or unpulsed by the above antigen lyses.This DC+CIK were injected to breast tumorbearing mice(BCSC-AP-DC+CIK group),and were used to compared with the common breast cancer cell antigen(rather than breast cancer stem cell antigen)pulsed DC+ CIK group(AP-DC+CIK group),DC+CIK group,CIK CIK group and normal saline group(NS group).The tumor-inhibitory effect were evaluated and compared among all 5 groups through the tumor size,TdT-mediated dUTP nick end labeling test (TUNEL),examining expression level of bcl-2 and bax by immunohistochemistry.ResultsThe tumor size in each group before and after therapy and the tumor size after therapy between each group was of significant difference(P<0.05).The maximum size is NS group(3.625±0.093)cm3and BCSC-AP-DC+CIK group is minimum,which is(1.234±0.131)cm3.BCSC-AP-DC+CIK group is of highest expression of bax and apoptotic index value,lowest bcl-2 expression in all 5 groups.ConclusionThe CIK co-cultured with DC pulsed breast cancer stem cell antigen was more effective to induce apoptosis of breast cancer cells than those of CIK cells co-cultured with DC pulsed breast cancer cell antigen,CIK cells co-cultured with DC and CIK cells.
breast neoplasms;stem cells;dendritic cells;killer cells;gene,bcl-2;bcl-2-associated X protein;apoptosis
R737.9
A
10.3969/j.issn.0253-9896.2014.06.012
*天津市自然科学基金资助项目(项目编号:09JCYBJC10600)
1天津医科大学研究生院(邮编300070);2天津市第四中心医院肿瘤血液科及中心实验室
△通讯作者 E-mail:panghua2006@sina.com
