胶质瘤组织中TSSC1的表达及其对胶质瘤U87细胞生物学行为的影响
2014-06-15刘义宾马云富陈建设王银辉
刘义宾 马云富 陈建设 王银辉
胶质瘤组织中TSSC1的表达及其对胶质瘤U87细胞生物学行为的影响
刘义宾 马云富△陈建设 王银辉
目的 研究肿瘤抑制可转移候选基因1(TSSC1)在胶质瘤组织中的表达及其对胶质瘤U87细胞生物学行为的影响。方法采用Real time-PCR和Western blot检测80例胶质瘤(Ⅰ期25例,Ⅱ期32例,Ⅲ期15例,Ⅳ期8例)组织和瘤旁组织中TSSC1的表达,采用化学合成的针对TSSC1基因的2个小干扰RNA(siRNA-TSSC1-1和siRNATSSC1-2)下调该基因的表达,通过MTT和Transwell法分别检测TSSC1对U87细胞增殖、迁移和侵袭的影响。结果TSSC1在胶质瘤组织中的表达低于相应的瘤旁组织,同时在临床分期Ⅲ期、Ⅳ期中较Ⅰ期表达降低,将siRNATSSC1-1和siRNA-TSSC1-2转染入U87细胞后,U87细胞中TSSC1 mRNA和蛋白表达水平都明显降低,细胞增殖能力显著增强,细胞的迁移和侵袭能力显著增强。结论TSSC1有望成为胶质瘤早期诊断和预测预后的生物分子标志物。
神经胶质瘤;RNA,小分子干扰;肿瘤抑制可转移候选基因1;U87细胞
胶质瘤发病率约占脑肿瘤的50%左右,是中枢神经系统最常见的原发性肿瘤,具有侵袭性生长、无控性增殖、易复发的特点[1-2]。其本质上是一种多基因异常疾病,由于原癌基因的过表达,同时伴随抑癌基因的突变缺失,从而使肿瘤细胞逃避了正常生长的调控机制。传统治疗方法(包括手术、化疗和放疗)并没有完全解决胶质瘤侵袭性生长所导致的高复发率和低治愈率难题。针对与胶质瘤发生、发展相关的基因异常的治疗已成为研究热点[3]。肿瘤抑制可转移候选基因1(TSSC1)是一个新发现的肿瘤基因,可能在多种肿瘤的发生发展中起重要作用[4]。 Shore等[5]研究表明,TSSC1可抑制乳腺癌骨转移。Wang等[6]研究发现,TSSC1能转录调节RUNX2启动子的活性,从而抑制乳腺癌骨转移。但有关TSSC1在胶质瘤恶性肿瘤中的表达及其与肿瘤细胞的增殖、迁移和侵袭的关系尚鲜见报道。本研究通过检测胶质瘤原发组织和瘤旁组织中TSSC1的表达,观察TSSC1的表达对胶质瘤细胞系U87生物学行为的影响,为深入研究胶质瘤的分子病理机制及临床治疗提供线索。
1 材料与方法
1.1 材料 U87恶性胶质瘤细胞系购自中国科学院上海细胞生物学研究所细胞库。80例胶质瘤组织标本及对应瘤旁组织取自2001年6月—2009年10月我院收治的胶质瘤患者,按照WHO标准(2008年修改版)将胶质瘤标本分级,所有标本经病理证实,其中Ⅰ期25例,Ⅱ期32例,Ⅲ期15例,Ⅳ期8例。组织样本经液氮速冻后-80℃保存。所有样本采集和使用均征得患者同意并签署知情同意书后由我院伦理委员会同意。
1.2 Real time-PCR检测TSSC1 mRNA的表达 采用TRIZOL一步法快速提取细胞及组织总RNA。取2 μg总RNA于37℃在逆转录酶、RNA酶抑制剂作用下进行反转录合成cDNA,cDNA的合成体系参照文献[7]。引物及探针均由上海生工生物工程公司合成。20 μL反应体系中包括由40 ng总RNA反转录所得的cDNA,10 μL Platinum Quantitative PCR SuperMix-UDG,10 μmol/L的上下游引物和TaqMan探针各0.4 μL。PCR反应条件为50℃温育2 min,95℃预变性3 min,95℃变性30 s,58℃退火延伸1 min,40个循环。CT值为荧光信号达到设定阈值时所经过的循环数。每个样本中每个基因的检测均重复3次。△CT值为各样本中目的基因的CT值与管家基因GAPDH的CT值之差,2-△CT则为该样本中TSSC1相对于GAPDH的mRNA表达量。
1.3 Western blot检测细胞及组织中TSSC1蛋白的表达 制备4%浓缩胶和10%分离胶的聚丙烯酰胺垂直平板凝胶,40 μg总蛋白经80 V电压电泳3 h后,电转70 V 3 h转印至PVDF膜。含5%ECL化学发光试剂盒的TBS-T(pH 8.3)室温封闭1 h后加入鼠抗人TSSC1一抗,以β-actin为内参。4℃平摇过夜,TBS-T洗膜6次后加入辣根过氧化物酶(HRP)标记的二抗,室温孵育1 h,TBS-T洗膜6次,加ECL Western blot检测试剂显色1~2 min,曝光X线胶片。
1.4 siRNA转染 针对TSSC1基因的2个小干扰RNA(siRNA-TSSC1-1和siRNA-TSSC1-2)购自上海吉玛公司,阴性对照(siRNA)由上海吉玛公司赠送。实验分为(1)空白对照组:无处理的U87细胞。(2)阴性对照组:转染siRNA。(3)实验组1:转染siRNA-TSSC1-1。(4)实验组2:转染siRNA-TSSC1-2。U87细胞培养于含10%胎牛血清(FBS)的RPMI-1640培养基(Invitrogen公司),培养基加入100 U/mL青霉素和100 g/L链霉素,于37℃、5%CO2培养至对数生长期或80%饱和度。接种2×105个细胞/孔于6孔板,以无抗生素的含血清培养基培养。100 nmol/L siRNA-TSSC1-1和siRNA-TSSC1-2分别和2 μL Lipofectamine 2000各溶于50 μL培养基,孵育5 min后混合20 min,缓慢滴入置于500 μL OPTI-DMEM无血清培养基的细胞中,6 h后将培养液更换为含血清的RPMI-1640培养液培养。转染48 h后用于基因表达检测、蛋白表达和细胞生物学行为实验。
1.5 MTT检测转染siRNA-TSSC1-1和siRNA-TSSC1-2后细胞增殖能力 U87细胞分别转染脂质体、siControl、siRNATSSC1-1、siRNA-TSSC1-2,48 h后,胰酶消化对数期细胞,终止后离心收集,制成细胞悬液,细胞计数调整至1 000~10 000个细胞/孔。5%CO2、37℃孵育,至细胞单层铺满孔底,设3个复孔,于24、48、72 h后每孔加入10 mL MTT溶液(5 g/L),继续培养4 h,小心用PBS冲2~3遍后。每孔加入100 μL二甲基亚砜,置摇床上低速振荡10 min,在酶联免疫检测仪于570 nm处测量各孔的吸光度(A)值。
1.6 Transwell检测转染siRNA-TSSC1-1和siRNA-TSSC1-2后细胞的迁移和侵袭能力 将悬浮于500 μL无血清培养基的5×104个siControl、siRNA-TSSC1-1和siRNA-TSSC1-2细胞分别接种于含Metrigel和不含Metrigel的transwell上室,下层加入750 μL含10%FBS的细胞培养液,培养8 h。取出transwell小室,用棉签拭去上层未穿过的细胞,苏木素染色后封片,于镜下观察穿孔细胞数目。
1.7 统计学方法 用SPSS 16.0软件进行统计学分析。计量数据以均数±标准差(±s)表示,2组比较采用独立样本t检验,多组比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 TSSC1在胶质瘤组织和正常脑组织表达水平比较 TSSC1在胶质瘤组织较瘤旁正常脑组织中表达下调,见图1、2。
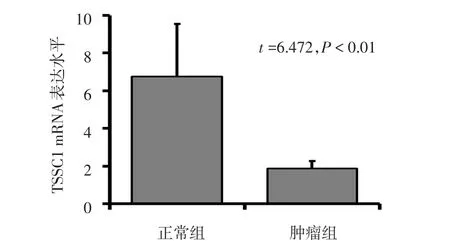
Figure 1 TSSC1 mRNA transcription level in glioma tissue(T) and paraneoplastic normal brain tissue(N)图1 胶质瘤组织及瘤旁正常组织中TSSC1 mRNA表达水平

Figure 2 TSSC1 protein expression levels in glioma tissue(T)and paraneoplastic normal brain tissue(N)图2 胶质瘤组织及瘤旁正常组织TSSC1蛋白表达水平
2.2 TSSC1表达与临床分期的关系 TSSC1在Ⅰ期中表达水平较高,Ⅲ期、Ⅳ期中表达水平明显降低,见图3、4。
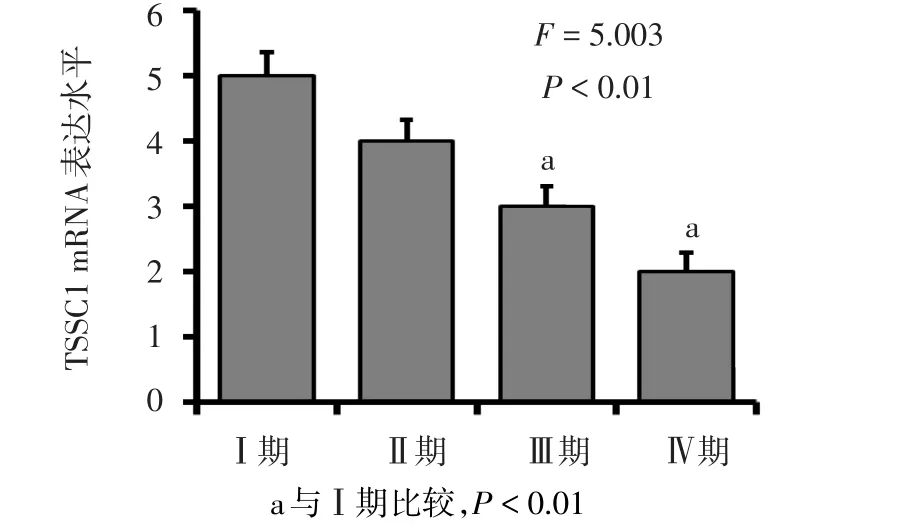
Figure 3 Real time-PCR analysis of TSSC1 mRNA transcription levels in glioma of different grade图3 不同临床分期胶质瘤组织中TSSC1 mRNA表达比较

Figure 4 Western blot anlaysis of TSSC1 protein expression levels in glioma of different grade图4 不同临床分期胶质瘤组织中TSSC1蛋白表达水平
2.3 转染效率的鉴定 实验组1和实验组2中TSSC1 mRNA和蛋白表达水平较空白对照组和阴性对照组降低,见图5、6。
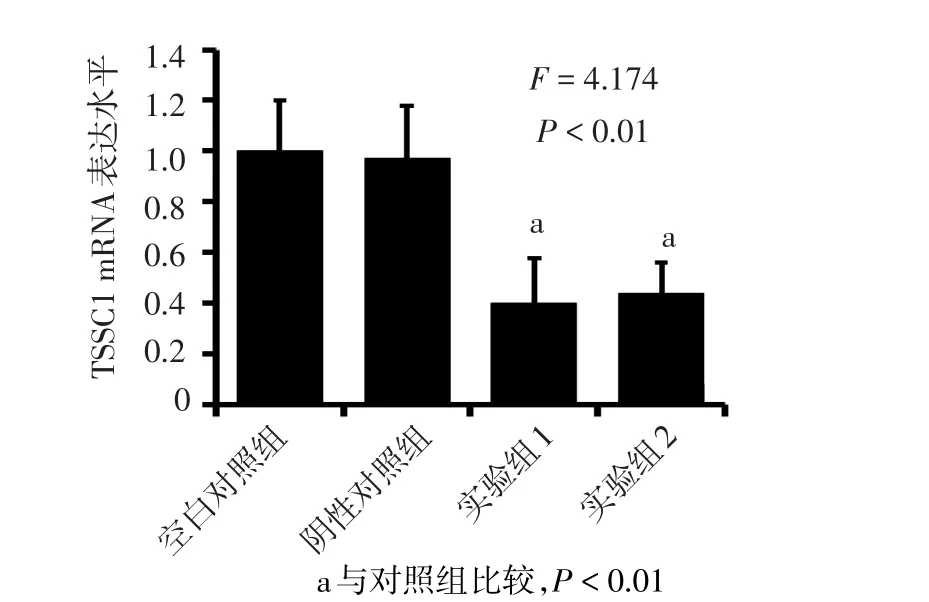
Figure 5 Real time-PCR analysis of TSSC1 mRNA transcription level in TSSC1 siRNAs-transfected and control U87 cells图5 转染siRNA-TSSC1-1和siRNA-TSSC1-2后TSSC1 mRNA表达水平

Figure 6 Western blot analysis of the TSSC1 protein expression in TSSC1 siRNAs-transfected and control U87 cells图6 转染siRNA-TSSC1-1和siRNA-TSSC1-2后TSSC1蛋白表达水平
2.4 沉默TSSC1对细胞增殖的影响 培养1~5 d时,各组细胞增殖率差异无统计学意义,培养7、9 d时,实验组细胞增殖能力较对照组显著增强(P<0.01),见表1。
Table 1 Depletion of TSSC1 promotes U87 cell proliferation shown by MTT assay表1 MTT检测各组吸光度 (n=5,A570±s)
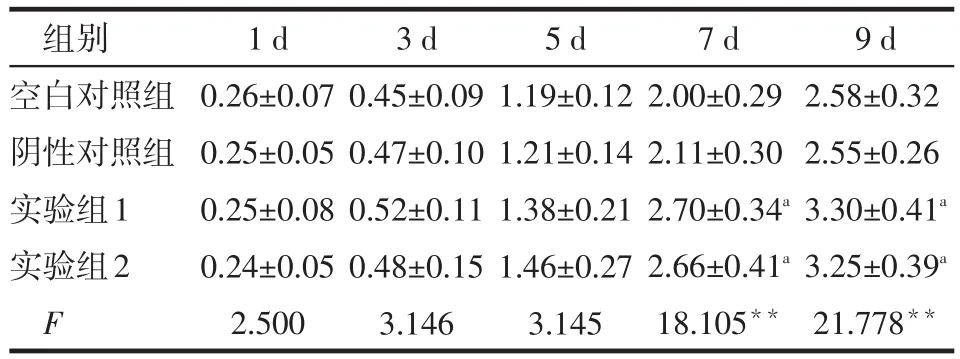
Table 1 Depletion of TSSC1 promotes U87 cell proliferation shown by MTT assay表1 MTT检测各组吸光度 (n=5,A570±s)
**P<0.01;a与对照组比较,P<0.01
组别空白对照组阴性对照组实验组1实验组2 F 1 d 0.26±0.07 0.25±0.05 0.25±0.08 0.24±0.05 2.500 3 d 0.45±0.09 0.47±0.10 0.52±0.11 0.48±0.15 3.146 5 d 1.19±0.12 1.21±0.14 1.38±0.21 1.46±0.27 3.145 7 d 2.00±0.29 2.11±0.30 2.70±0.34a2.66±0.41a18.105**9 d 2.58±0.32 2.55±0.26 3.30±0.41a3.25±0.39a21.778**
2.5 沉默TSSC1对细胞迁移和侵袭能力的影响 转染siRNA-TSSC1-1和siRNA-TSSC1-2组细胞的迁移能力高于对照组(F=22.447,P<0.01),见图7。转染siRNA-TSSC1-1和siRNA-TSSC1-2组细胞的侵袭能力也高于对照组(F=25.671,P<0.01),见图8。

Figure 7 Transwell analysis of the cell migration ability图7 Transwell检测各组迁移能力的改变

Figure 8 Transwell analysis of the cell invasion ability图8 Transwell检测各组侵袭能力的改变
3 讨论
胶质瘤患者预后极差,传统的治疗方法,包括手术、放疗和化疗不能显著改善患者生存。近年来,随着肿瘤分子生物学技术的发展和对肿瘤发病机制的认识不断加深,针对某些关键基因的分子靶向治疗或导入某些抑癌基因成为肿瘤治疗的热点。
TSSC1是近年来新发现的一个肿瘤抑制基因,其基因定位于11q15.5上,编码1.7 ku的蛋白,是癌相关成纤维蛋白,在正常组织中高表达,是肿瘤抑制基因[8]。本研究发现TSSC1在胶质瘤原发组织中的表达量低于瘤旁正常脑组织,且在临床分期Ⅲ期、Ⅳ期中较Ⅰ期表达降低,这与Cai等[9]研究报道TSSC1在乳腺癌组织和发生骨转移的组织中低表达,抑制乳腺癌骨转移结果一致,提示其是一个潜在的分子标志物,可作为临床分期的辅助指标。但TSSC1与患者预后及放化疗敏感性的关系还有待进一步研究。
最新研究表明,在乳腺癌嗜骨转移性细胞系MDA-MB-231中TSSC1 mRNA和蛋白均较正常乳腺细胞低表达,并能抑制乳腺癌细胞增殖、迁移和侵袭等生物学行为,提示其是一个潜在的抑癌基因[6]。同时,Runx2能结合于TSSC1启动子区并转录,抑制TSSC1启动子活性,从而促进乳腺癌细胞发生骨转移[6],TSSC1抑制乳腺癌细胞发生骨转移。本研究通过RNA干扰技术沉默胶质瘤细胞U87中TSSC1的表达,发现其能显著促进胶质瘤细胞的增殖、运动和侵袭等生物学行为。因此笔者推测TSSC1可能参与肿瘤血管生成,在多种肿瘤的发生发展中起着重要作用。
综上,TSSC1在胶质瘤中发挥抑癌基因的作用,其在胶质瘤中具有较高的诊断价值,可能作为脑胶质瘤基因治疗的候选基因,但能否作为胶质瘤治疗的靶基因,及其内在分子生物学机制有待进一步研究。
[1] Alves TR,Lima FR,Kahn SA,et al.Glioblastoma cells:a heterogeneous and fatal tumor interacting with the parenchyma[J].Life Sci, 2011,89(15):532-539.
[2]Norden AD,Drappatz J,Wen PY.Antiangiogenic therapies for highgrade glioma[J].Nat Rev Neurol,2009,5(11):610-620.
[3] Castro MG,Candolfi M,Kroeger K,et al.Gene therapy and targeted toxins for glioma[J].Curr Gene Ther,2011,11(3):155-180.
[4] Zhang L,Hinz AJ,Nadeau JP,et al.Pseudomonas aeruginosa tssC1 Links Type VI Secretion and Biofilm-Specific Antibiotic Resistance [J].J Bacteriol,2011,193(19):5510-5513.
[5] Shore P.A role for Runx2 in normal mammary gland and breast cancer bone metastasis[J].J Cell Biochem,2005,96(3):484-489.
[6]Wang DC,Wang HF,Yuan ZN.Runx2 induces bone osteolysis by transcriptional suppression of TSSC1[J].Biochem Biophys Res Commun,2013,438(4):635-639.
[7]Tian Y,Zhang J,Yan S,et al.FATS expression is associated with cisplatin sensitivity in non small cell lung cancer[J].Lung Cancer, 2012,76(3):416-422.
[8]Scelfo R,Sabbioni S,Barbanti-Brodano G,et al.Subchromosomal assignment1 of the TSSC1 gene to human chromosome band 11p15.5 near the HBB gene cluster[J].Cytogenet Cell Genet,1998,83(1-2): 52-53.
[9]Cai D,Cao J,Li Z,et al.Up-regulation of bone marrow stromal protein 2(BST2)in breast cancer with bone metastasis[J].BMC Cancer,2009,2407(9):102-112.
(2013-10-18收稿 2014-01-21修回)
(本文编辑 闫娟)
Expression of TSSC1 in Glioma Tissue and Its Effect on Cell Biological Behavier of Glioma U87 Cells
LIU Yibin,MA Yunfu,CHEN Jianshe,WANG Yinhui
Department of Neurosurgery,the fourth Affiliated Hospital of Zhengzhou University
ObjectiveTo evaluate the diagnostic value of TSSC1 in glioma patients and its influence on cell biological behavior of glioma U87 cells.MethodsRT-PCR and Western blot were used to examine the expression of TSSC1 in glioma samples,including 80 normal paraneoplastic tissues and 80 primary tumors.MTT and transwell were used to analyze the effect of TSSC1 knockout on proliferation,migration,and invasion in U87 cells.ResultsTSSC1 is down-regulated in glioma compared to its paraneoplastic counterparts and negatively related to higher grade.Furthermore,knockdown of TSSC1 expression results in increased proliferation,migration and invasion in U87 cells in vitro.ConclusionOur results may worked as a marker for early diagnosis and prognosis of glioma.
glioma;RNA,small interfering;TSSC1;U87 cell
R739.4
A
10.3969/j.issn.0253-9896.2014.06.008
郑州大学第四附属医院神经外科(邮编450000)
△通讯作者 E-mail:mayunfu126@126.com
