姜黄素-盐酸阿霉素复方脂质体的制备及评价
2014-06-15胡海洋赵秀丽孙玉琦陈大为
曲 杨,胡海洋,赵秀丽,刘 丹,孙玉琦,陈大为*
(1.沈阳药科大学 中药学院,辽宁 沈阳 110016;2.铁岭师范高等专科学校,辽宁 铁岭 112000)
姜黄素-盐酸阿霉素复方脂质体的制备及评价
曲 杨1,胡海洋1,赵秀丽1,刘 丹2,孙玉琦1,陈大为1*
(1.沈阳药科大学 中药学院,辽宁 沈阳 110016;2.铁岭师范高等专科学校,辽宁 铁岭 112000)
目的选择姜黄素(curcumin,Cur)和盐酸阿霉素(adriamycin,ADM)能产生显著协同作用的比例制成复方脂质体(compound liposomes,Lip),并对姜黄素-盐酸阿霉素复方脂质体的制剂学和生物学性质进行评价。方法 采用MTT法测定药物体外对MCF-7/ADR细胞的抑制作用,应用金氏公式分析联合用药效果。采用薄膜分散-硫酸铵梯度法制备姜黄素-盐酸阿霉素复方脂质体。采用马尔文动态光散射粒径仪测定平均粒径和Zeta电位。通过葡聚糖凝胶(Sephadex G-50)微柱离心去除游离药物,以HPLC法测定制剂和摄取样品中药物含量。结果 姜黄素与盐酸阿霉素在质量浓度比为2∶1和1∶1时协同作用均较强且Q值无显著性差异。薄膜分散-硫酸铵梯度法制得的制剂符合2种药物质量浓度比例为2∶1、1∶1的要求。在制剂中包载的姜黄素与盐酸阿霉素质量浓度比例为2∶1时,MCF-7/ADR细胞对盐酸阿霉素的摄取量显著增加。结论 姜黄素与盐酸阿霉素质量浓度比为2∶1时,呈显著的协同效应,按此比例制备的复方脂质体与Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]相比,对于MCF-7/ADR细胞有较大的细胞毒和较多的盐酸阿霉素摄取量。
药剂学;MCF-7/ADR细胞;姜黄素;盐酸阿霉素;联合用药;姜黄素-盐酸阿霉素复方脂质体
乳腺癌是女性易患的恶性肿瘤之一,女性一生中患乳腺癌的概率为10%,全世界每年约有乳腺癌病人120万人,每年约有40万人死于该病,并且以每年2%~3%的速度递增[1]。盐酸阿霉素(adriamycin,ADM)是一种治疗乳腺癌的重要药物[2],但由于药物引起的肿瘤细胞的多药耐药(multi-drug resistance,MDR)是治疗失败的重要原因。P糖蛋白、多药耐药相关蛋白1、拓扑异构酶Ⅱ、谷胱甘肽转移酶等介导的外排作用会降低很多肿瘤细胞对ADM的敏感性[3]。长期应用ADM可发生剂量依赖性的不可逆性心肌病变,严重的心脏毒性,严重影响临床应用和治疗效果[4]。脂质体(liposomes,Lip)是一种由类脂质双分子层组成,内部为水相的闭合囊泡。将盐酸阿霉素包载进脂质体能降低心脏中盐酸阿霉素的浓度峰值,有效的增加ADM在肿瘤中的量[5]。脂质体有靶向性与改变包载药物的药物动力学的特性,有些学者利用这些特点,同时包载抗癌药与肿瘤细胞多药耐药逆转剂于脂质体中来逆转肿瘤细胞的MDR[6]。姜黄素(curcumin,Cur)可以减少细胞内P糖蛋白、多药耐药相关蛋白1、米托蒽醌耐药蛋白这3个重要的ABC药物转运体成员的表达量,有着逆转很多种肿瘤细胞耐药性的作用[7-9]。林溪等[10]的研究表明,姜黄素与盐酸阿霉素同时合用对K562及Bel 7402细胞可产生单纯相加至增强的协同杀伤效果,尤其是姜黄素与低浓度盐酸阿霉素的协同作用更为显著。以上研究提示,将姜黄素和盐酸阿霉素联合包载制成复方脂质体不但可以增强肿瘤细胞对ADM的敏感性,又能发挥协同作用降低ADM对机体的毒性,值得深入研究。
1 仪器与材料
Hitachi高效液相色谱仪(Pump L-2130,UV Detector L-2400,日本Hitachi公司),WJ-808-III 型CO2培养箱(上海新苗医疗器械制造有限公司),Varioskan Flash 全波长多功能酶标仪(配有SkanIt RE for Varioskan Flash 2.4.3运行软件,美国Thermo Scientific公司),旋转蒸发仪(上海亚荣生化仪器厂),SHZ-D(Ⅲ)循环水式真空泵(巩义市英峪华仪器厂),JY9222D 超声波细胞粉碎机(宁波新芝科器研究所),DF-101S集热式恒温加热磁力搅拌器(巩义市英峪华仪器厂制造),Nano ZS90纳米粒度仪(英国Malvin公司),ZETA电位仪(英国Malvin公司),透析袋(截留相对分子质量为7 000~12 000,上海绿鸟科技有限公司)。
姜黄素(纯度质量分数≥95%,美国Sigma-Aldrich公司),盐酸阿霉素(纯度质量分数>98%,北京华风科技有限公司),大豆卵磷脂(质量分数>96%,上海太伟有限公司),胆固醇(生化纯,天津市博迪化工股份有限公司),甲醇(色谱纯,天津康科德科技有限公司),乙腈(色谱纯,天津康科德科技有限公司),磷酸(色谱纯,天津科密欧化学试剂有限公司),二氯甲烷(分析纯,天津市富宇精细化工有限公司),葡聚糖凝胶G-50(瑞典Pharmacia公司),考马斯亮蓝G-250(coomassie brilliant blue G-250,CBBG,国药集团化学试剂有限公司),96孔细胞培养板(美国Corning 公司),RPIM1640培养基(美国GIBCO公司),四甲基偶氮唑蓝(3-(4,5)-dimethylthiahiazoy1)-3,5-diphenytetrazoliumromide,简称MTT,美国Sigma公司),人乳腺癌耐药细胞MCF-7/ADR(MDR breast cancer cell MCF-7/ADR,美国 ATCC公司,由本实验室冻存培养,MCF-7/ADR细胞培养在含质量分数为20%胎牛血清的RPIM1640培养液内,置37 ℃含体积分数为5%的CO2的细胞培养箱中培养),其他所用试剂均为市售分析纯。
所有细胞实验均在细胞处于对数生长期进行。
2 方法与结果
2.1 姜黄素联合盐酸阿霉素对MCF-7/ADR细胞的作用
2.1.1 姜黄素、盐酸阿霉素对MCF-7/ADR细胞的抑制作用
精密称取Cur、ADM,分别溶于少量二甲基亚砜(dimethyl sulfoxide,DMSO)和重蒸水后,用培养液稀释至试验所需不同浓度。取MCF-7/ADR细胞单细胞悬液以每孔200 μL接种于96 孔细胞培养板(每孔1.4×104个细胞)。培养24 h待细胞贴壁,吸尽培养液,加入不同种类不同浓度供试品溶液,并设调零组、对照组(细胞培养液),每组设5个复孔。分别培养48 h后,每孔加入5 g·L-1MTT的PBS溶液20 μL,继续培养4 h,弃去培养液,每孔加入150 μL 二甲基亚砜,震荡约10 min至沉淀完全溶解,多功能酶标仪490 nm处测定光密度值(OD值)。计算各组分对细胞MCF-7/ADR抑制率,抑制率计算公式为:抑制率=[1-(实验组OD值-调零组OD值)/(对照组OD值-调零组OD值)]×100%。实验结果见表1。
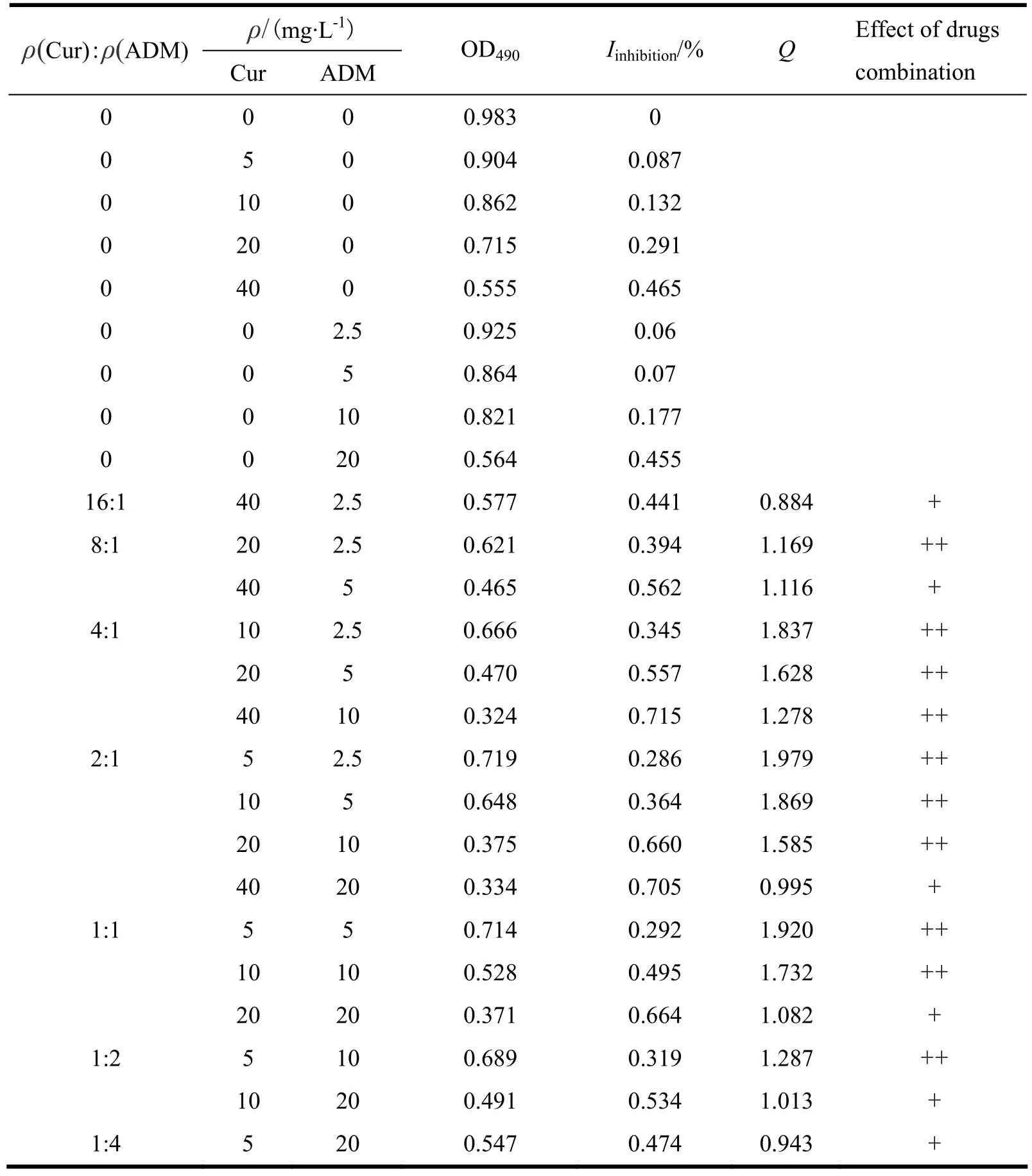
表 1 姜黄素和盐酸阿霉素同时合用对MCF-7/ADR细胞的联合作用Table 1 Synergistic antitumor effect of Cur combined with ADM on MCF-7/ADR cells at different ratios
2.1.2 姜黄素和盐酸阿霉素联合用药对MCF-7/ADR细胞的杀伤作用
取“2.1.1”条下溶于DMSO的姜黄素和溶于重蒸水的盐酸阿霉素,分别用培养液稀释至相应调整浓度,得到姜黄素质量浓度分别为80、40、20和10 mg·L-1;盐酸阿霉素质量浓度分别为40、20、10和5 mg·L-1的系列溶液。取上述溶液两两组合稀释成姜黄素和盐酸阿霉素的质量浓度比分别为16∶1、8∶1、4∶1、2∶1、1∶1、1∶2和1∶4的系列溶液。按MTT试验方法,测定各组分、各比例单独与联合作用于MCF-7/ADR细胞48 h在490 nm 处的光密度值(OD值)。评价药物合用是否有协同作用,作者参照文献[11]中金氏公式判断:其中为合并用药抑制率,Ea和Eb分别为A药和B药的抑制率。式中分子代表“实测合并效应”,分母是“期望合并效应”,Q是两者之比。Q值0.85~1.15为单纯相加(+),>1.15~2.00为增强(++),<0.85~0.55为拮抗(-),<0.55为明显拮抗(--)。结果见表1。
Cur与ADM 同时联合用药对MCF-7/ADR细胞的杀伤均呈单纯相加至增强作用。由表1可以看出当Cur和ADM质量浓度比为4∶1、2∶1、1∶1时,2种药物联合用药对MCF-7/ADR细胞均能达到较好的杀伤作用,且随着ADM浓度增高,二药的协同作用下降。将质量浓度比为4∶1、1∶1的Q值与质量浓度比为2∶1的Q值按ADM浓度配对进行配对T检验,检验结果如表2。表2的数据表明,质量浓度比为2∶1与4∶1的Q值有显著性差异;质量浓度比为2∶1与1∶1的Q值无显著性差异。
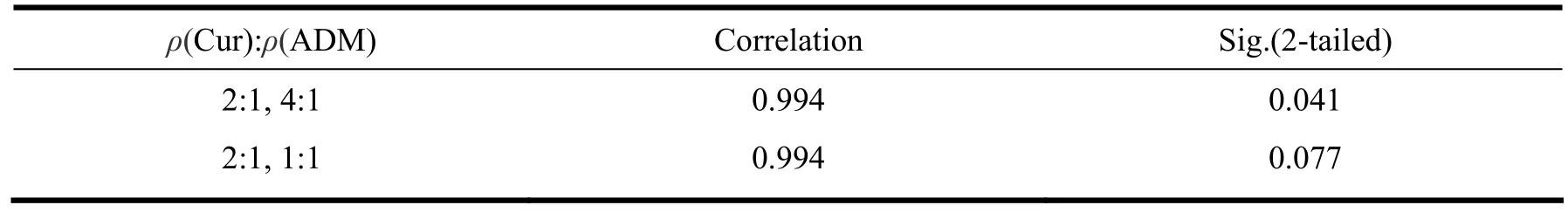
表 2 质量浓度比为2:1、4:1、1:1 Q值的配对T检验Table 2 Paired-samples T test of different ratios (2:1,4:1,1:1) of Q value
2.2 姜黄素-盐酸阿霉素复方脂质体的制备
采用薄膜分散-硫酸铵梯度法制备姜黄素-盐酸阿霉素复方脂质体。称取处方量大豆磷脂、胆固醇、姜黄素,用适量二氯甲烷超声溶解于圆底烧瓶中,28 ℃下减压抽真空旋蒸除去有机溶剂。加入硫酸铵10 mL于50 ℃下水化30 min。待磷脂水化完全后,探头超声即得姜黄素脂质体。用量筒称取上述制剂适量装入透析袋中(截留相对分子质量为7 000 wm),以水为介质透析6 h(每隔2 h更换透析介质)。将透析过的脂质体取出,并根据透析前姜黄素脂质体体积计算加入盐酸阿霉素的量。水浴温度设为50 ℃,称取计算量的盐酸阿霉素,置于小烧杯中,适量水溶解后,加入搅拌子,搅拌下逐滴加入空白脂质体混悬液,载药30 min后取出,过0.22 μm滤膜,即得姜黄素-盐酸阿霉素复方脂质体。
2.3 复方脂质体包封率及包载药物浓度的测定
采用葡聚糖凝胶( Sephadex G-50)微柱离心法测定姜黄素脂质体的包封率及包载药物浓度。制备2.5 mL葡聚糖凝胶柱,精密称复方脂质体混悬液0.1 mL,缓缓加于柱顶部,2 000 r·min-1离心3 min;由柱顶部加入0.2 mL蒸馏水,2 000 r·min-1离心3 min,收集滤过液,再于柱顶部加入同体积的水,重复以上操作。合并1-3管滤过液,置10 mL容量瓶中,甲醇破乳并定容,摇匀,高效液相测定峰面积为另取复方脂质体混悬液0.1 mL,置10 mL容量瓶中,甲醇破乳并定容,测定其峰面积为按下式计算包封率:包封率(%)=×100%。将分别代入ADM和Cur标准曲线,经计算求出制剂中ADM和Cur的浓度。
按“2.2”条方法制得的复方脂质体,Cur和ADM的包封率均达到95%以上。因为制剂对包载的2种药物浓度比例有要求,所以用高效液相法测定制剂中药物浓度。Cur-ADM-Lip[ρ(Cur)∶ρ(ADM)=1∶1]制剂中Cur和ADM的质量浓度比为0.998±0.007(见表3);Cur-ADM-Lip[ρ(Cur)∶ρ(ADM)=2∶1]制剂中Cur和ADM的质量浓度比为2.013±0.031(见表4)。
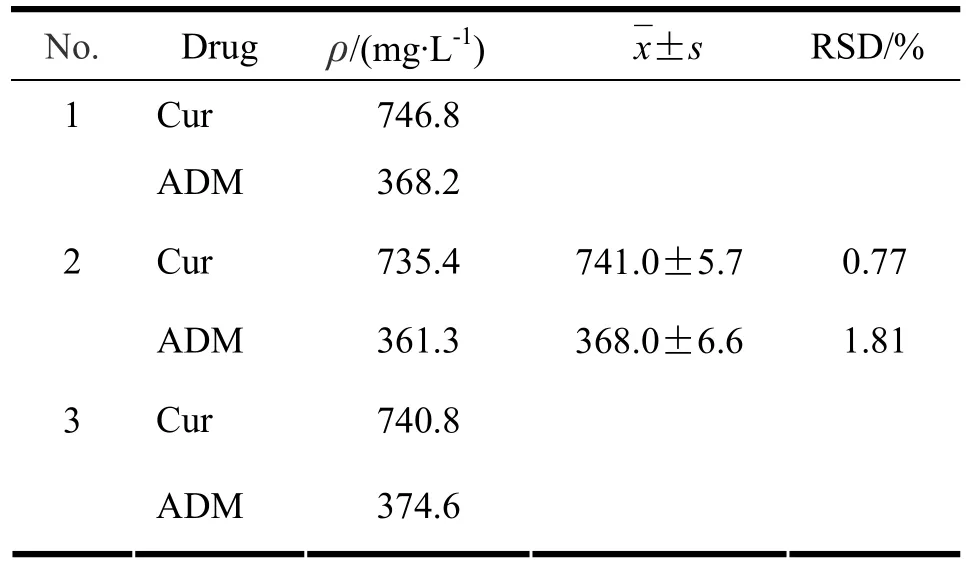
表 4 按药物质量浓度比为2:1的最优处方制备3批脂质体,包载进脂质体中的Cur、ADM的质量浓度(n=3)Table 4 The concentration of Cur and ADM encapsulated in three batches of liposomes prepared according to theoptimized formulation at Cur and ADM ratio of 2:1(n=3)
2.4 脂质体的粒径及Zeta电位测定
采用马尔文动态光散射粒径仪测定平均粒径和Zeta电位。取50 μL脂质体溶液用水稀释至10 mL,摇匀平衡3 min 后测定。
Cur-ADM-Lip[ρ(Cur)∶ρ(ADM)=2∶1]马尔文粒径为148.1 nm,Zeta电位为-7.10mV;Cur-ADMLip[ρ(Cur)∶ρ(ADM)=1∶1]马尔文粒径为154.1 nm,Zeta电位为-9.23 mV。
2.5 制剂的细胞毒
用RPIM1640培养液将Cur-Lip、ADM-Lip、Cur-ADM-Lip(包括Cur和ADM的质量浓度比为1∶1、2∶1的2种制剂)制剂稀释至试验所需适当浓度,作为供试品溶液。按“2.1.1”条下方法测定4种制剂的细胞毒,实验结果见表5。
姜黄素-盐酸阿霉素复方脂质体对细胞MCF-7/ADR的抑制率以其中盐酸阿霉素的浓度计算,所有细胞毒数据均用SPSS 16.0软件处理。
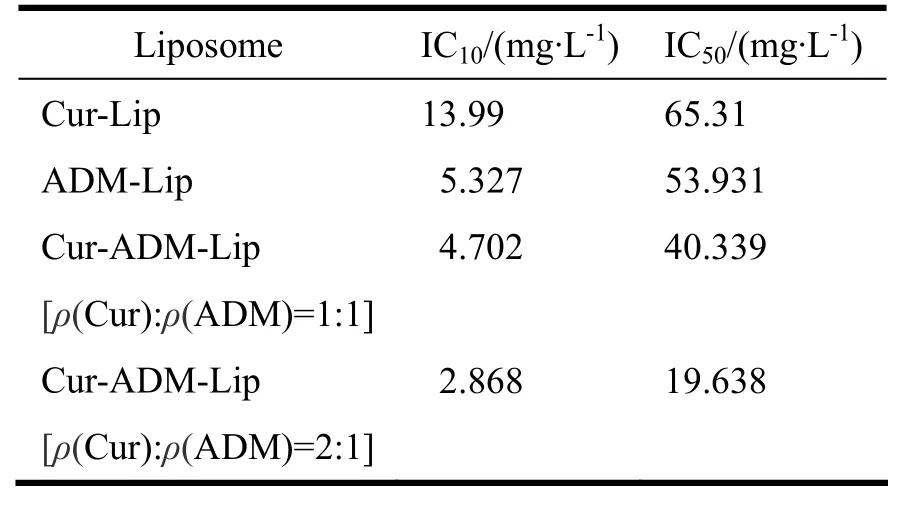
表 5 Cur-Lip、ADM-Lip、Cur-ADM-Lip(ρ(Cur):ρ(ADM)=1:1)、Cur-ADM-Lip(ρ(Cur):ρ(ADM)=2:1)对MCF-7/ADR的细胞细胞毒(48 h)Table 5 The cytotoxicity of the Cur-Lip, ADM-Lip,Cur-ADM-Lip(ρ(Cur):ρ(ADM)=1:1), Cur-ADM-Lip(ρ(Cur): ρ(ADM)=2:1) on MCF-7/ADR in vitro (48 h)
2.6 MCF-7/ADR细胞对姜黄素-盐酸阿霉素复方脂质体的摄取动力学
用RPIM164培养液稀释ADM-Lip、Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]、Cur-ADM-Lip[ρ(Cur)∶ρ(ADM)=2∶1],其中Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]和Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=2∶1]分别用来表示的制剂为复方制剂中姜黄素和盐酸阿霉素的质量浓度比为1∶1、2∶1,稀释至这3种制剂中的ADM质量浓度均为15 mg·L-1作为供试品溶液。待生长在培养瓶内的MCF-7/ADR细胞汇合度达到70%~80%,倒掉培养液,用预冷PBS洗2次后加入供试品溶液。分别培养0.5、1.0、1.5、2.0、4.0、6.0、8.0 h后倒掉含药培养液,用预冷PBS洗3次,每瓶加胰酶400 μL消化,倒掉胰酶。每瓶加2.5 mL PBS吹打下细胞,转移至EP管内,离心10 min(1 000 r·min-1)后弃去PBS,在每管细胞沉淀内加甲醇1 mL。将上述处理的样品探头超声2 min (80 W),迅速取出50 μL到对应编号的EP管内(留做测定蛋白样品),剩余样品离心10 min(13 000 r·min-1),取上清作为摄取测定样品。
MCF-7/ADR细胞对姜黄素-盐酸阿霉素复方脂质体的摄取动力学用考马斯亮蓝法测定蛋白含量,并以蛋白量对细胞摄取药物量进行校正。MCF-7/ADR细胞对ADM和Cur的摄取结果见图1和图2。摄取数据表明:MCF-7/ADR细胞对ADM-Lip的摄取2 h达到平衡(2.66 g·kg-1protein);MCF-7/ADR细胞对Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]的摄取,细胞内ADM质量浓度首先在1.5 h达到峰值(3.34 g·kg-1protein),Cur在2 h达到峰值(8.37 g·kg-1protein),随后两药的摄取量均逐渐减少,但除0.5 h时间点外其他时间点ADM摄取量均大于同时间点ADM-Lip组;MCF-7/ADR细胞对Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=2∶1]的摄取,细胞内Cur浓度4 h达到峰值(26.33 g·kg-1protein),而细胞内ADM的质量浓度一直在降低,但整个摄取过程中细胞内ADM的质量浓度大于Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]组所有时间点ADM的质量浓度。对Cur和ADM的质量浓度比为2∶1和1∶1的两种制剂的摄取数据按时间点进行配对T检验,结果表明MCF-7/ADR细胞摄取的Cur和ADM均有显著性差异。
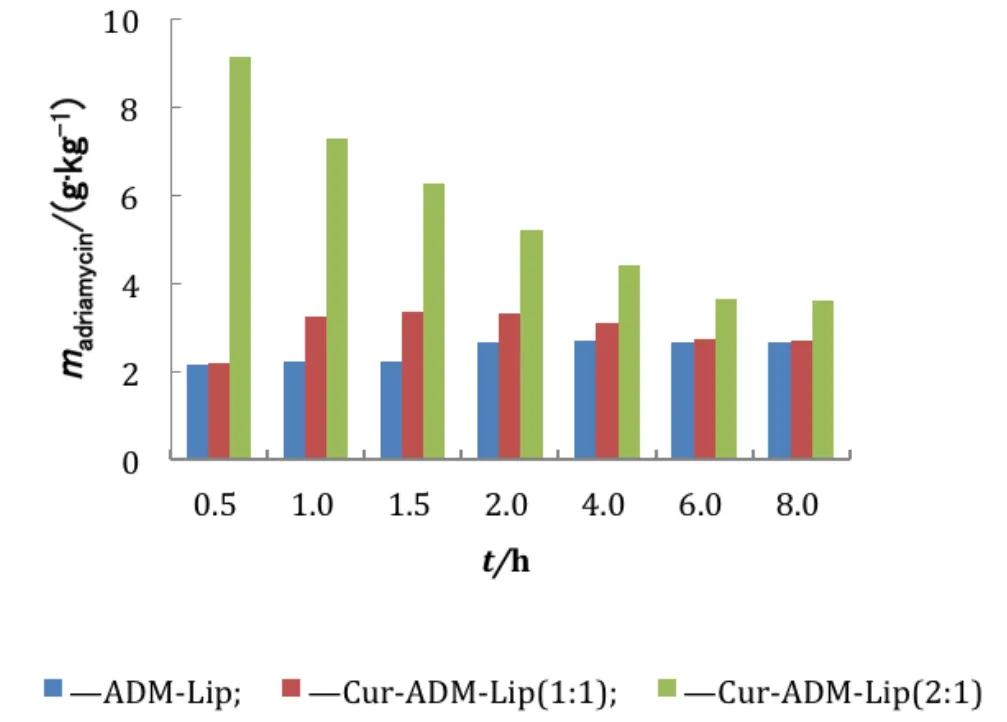
图1 MCF-7/ADR细胞对ADM-Lip、Cur-ADM-Lip [ρ(Cur):ρ(ADM)=1:1]、Cur-ADM-Lip [ρ(Cur):ρ(ADM)=2:1]制剂的摄取,细胞内盐酸阿霉素浓度Fig.1 Intracellular doxorubicin of MCF-7/ADR,after incubation with ADM-Lip,Cur-ADM-Lip [ρ(Cur):ρ(ADM)=1:1], Cur-ADM-Lip [ρ(Cur):ρ(ADM)=2:1]
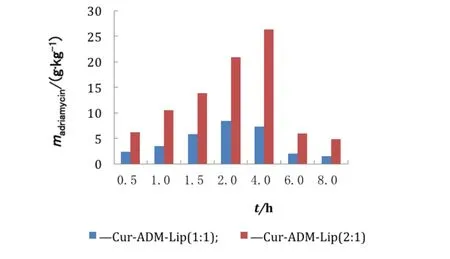
图2 MCF-7/ADR细胞对ADM-Lip、Cur-ADM-Lip [ρ(Cur):ρ(ADM)=1:1]、Cur-ADM-Lip [ρ(Cur):ρ(ADM)=2:1]制剂的摄取,细胞内Cur浓度Fig.2 Intracellular curcumin of MCF-7/ADR,after incubation with ADM-Lip,Cur-ADM-Lip [ρ(Cur):ρ(ADM)=1:1], Cur-ADM-Lip [ρ(Cur):ρ(ADM)=2:1]
3 讨论
a. MTT实验的作用时间曾选择24、48、72 h,经考察在24 h随原料药或者制剂浓度变化时,细胞抑制率没有明显趋势变化;在48 h时乳腺癌MCF-7/ADR细胞对药物作用较敏感,数据波动小;72 h由于未被杀灭的细胞重新分裂,达到同样的抑制率所需药物浓度开始增大,所以最终选择48 h数据作为试验分析对象。从原料药的细胞毒试验结果可以看出,Cur与ADM同时合用对MCF-7/ADR细胞产生单纯相加至增强的协同效果,尤其是它们质量质量浓度比为2∶1和1∶1时协同作用更为显著,两种浓度比例的Q值没有显著性差异。由表1还可看出,每种浓度比例随着ADM浓度的升高联合作用由增强降低至单纯相加。此结果提示,在临床应用时二药如同时合用,尤其是Cur与低浓度ADM同时合用效果可能最佳。
b. 由于Cur和ADM的质量浓度比为2∶1和1∶1时,细胞毒的数据分析表明它们的协同作用没有显著性差异,所以将这2种比例制成复方脂质体后进一步考察它们的性质。对于复方脂质体的制备,用正交试验筛选出姜黄素脂质体的最佳处方后,再用硫酸铵梯度主动载药法包载盐酸阿霉素。经高效液相法测定两种药物的包载率均达到95%以上。制备时可以根据姜黄素投药量、透析前制剂体积计算出盐酸阿霉素的投药量以保证制得制剂中2种药物浓度比例。
c. 制得的2种浓度比例的复方脂质体马尔文粒径和Zeta电位相差的并不大。这可能是由于姜黄素嵌入在脂质体的疏水集团中暴露在外侧,盐酸阿霉素包载在亲水封闭囊泡里。而2种浓度比例的制剂制备制剂时加入的姜黄素的量是一定的,盐酸阿霉素的包载量最多是和姜黄素等量,这样外部的疏水基团受到的影响很小,所以脂质体的一些制剂学性质没有受到包载药物量的影响。为了进一步考察两种浓度比例的复方制剂那种治疗效果更好,还需考察制剂的细胞毒和摄取情况。
d. 对姜黄素和盐酸阿霉素的荧光激发和发射光谱进行扫描,发现它们彼此在不同波长均有发射或者吸收的干扰,因此不能采用荧光分光光度法测定细胞对2种药物的摄取。本文作者采用高效液相分析摄取样品中2种药物的浓度,本实验室的试验条件有限(没有高灵敏度的荧光检测器只有紫外检测器)。因为MCF-7/ADR细胞对2种药物的摄取量很少,尤其是盐酸阿霉素,所以摄取试验用能生长更多细胞的培养瓶培养细胞并直接在瓶内进行摄取试验,姜黄素和盐酸阿霉素分别在它们有最大吸收的425 nm和233 nm紫外波长下测定。根据使用的色谱柱和参考文献[12-14]对2种药分别选取2种流动相条件,在不同的色谱条件下测定一种药物摄取浓度时另一种药没有色谱峰的出现。MCF-7/ADR细胞对制剂摄取结果表明:复方脂质体中的姜黄素能明显增加MCF-7/ADR细胞对盐酸阿霉素的摄取量,且随着姜黄素浓度的增大细胞摄取的盐酸阿霉素量显著增加;MCF-7/ADR细胞对药物摄取的总量有限,对于Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=2∶1]制剂,细胞内姜黄素浓度增大时盐酸阿霉素浓度降低,但细胞内盐酸阿霉素的浓度即使随着时间减小仍然大于Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]组细胞内盐酸阿霉素的最大浓度。
e. 综上所述,当姜黄素和盐酸阿霉素两种原料药的质量浓度比为2∶1和1∶1时,对2种比例的Q值按ADM的浓度进行配对T检验,结果Q值无显著性差异,表明2种比例的协同作用效果相当。为了进一步比较2种比例浓度的药物对MCF-7/adr细胞作用的区别,将这2种浓度比例药物制备成复方脂质体。Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=2∶1]比Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]的细胞毒大,这与表1中2种比例原料药细胞毒的结果一致,即在ADM质量浓度相同时,随着Cur的质量浓度增大,不论是原料药还是复方脂质体对MCF-7/ADR细胞的抑制作用均增大。按姜黄素和盐酸阿霉素质量浓度比为2∶1制备的复方脂质体与Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=1∶1]相比,对于MCF-7/ADR细胞具有较多的盐酸阿霉素摄取量,这可能是因为Cur-ADM-Lip [ρ(Cur)∶ρ(ADM)=2∶1]中姜黄素浓度更大,而姜黄素有着减少与细胞耐药性相关蛋白表达量的作用,这样便增加了MCF-7/adr细胞对ADM的摄取量。
参考文献:
[1] JEMAL A, SIEGEL R, XU J, et al. Cancer statistics, 2010 [J]. Cancer Journal for Clinicians, 2010, 60(5)∶277-300.
[2] ZORDOKY B N M, ANWAR-MOHAMED A, ABOUTABL M E, et al. Acute doxorubicin cardiotoxicity alters cardiac cytochrome P450 expression and arachidonic acid metabolism in rats [J]. Toxicology and Applied Pharmacology, 2010, 242(1)∶38-46.
[3] LAGE H. ABC-transporters∶ Implications on drug resistance from microorganisms to human cancers [J]. International Journal of Antimicrobial Agents, 2003, 22∶188-189.
[4] 张洪妍, 沈朋, 亲连军, 等. 一种测定MDR肿瘤细胞内阿霉素浓度的方法 [J]. 化学学报, 2004, 62(12)∶1162-1165.
[5] BATIST G, RAMAKRISHNAN G, RAO C S, et al. Reduced cardiotoxicity and preserved antitumor efficacy of liposome-encapsulated doxorubicin and cyclophosphamide compared with conventional doxorubicin and cyclophosphamide in a randomized, multicenter trial of metastatic breast cancer [J]. Journal of Clinical Oncology, 2001, 19(5)∶1444-1454.
[6] LO Y L, LIU F I, YANG J M, et al. Reversal of multidrug resistance to epirubicin by cyclosporin A in liposomes or intralipid [J]. Anticancer Research, 2001, 21∶445-450.
[7] ANGELINI A, IEZZI M, FEBBO C D, et al. Reversal of Pglycoprotein-mediated multidrug resistance in human sarcoma MES-SA/Dx-5 cells by nonsteroidal anti-inflammatory drugs [J]. Oncology Reports, 2008, 20(4)∶731-735.
[8] HOU X L, TAKAHASHI K T, TANAKA K, et al. Curcuma drugs and curcumin regulate the expression and function of P-gp in Caco-2 cells in completely opposite ways [J]. International Journal of Pharmaceutics, 2008, 358∶224-229.
[9] ANDJELKOVIC T, PESIC M, BANKOVIC J, et al. Synergistic effects of the purine analog sulfinosine and curcumin on the multidrug resistance human non-small cell lung carcinoma cell line (NCI-H460/R) [J]. Cancer Biology & Therapy, 2008, 7(7)∶1024-1032.
[10] 林溪, 许建华, 柯丹如. 姜黄素与盐酸阿霉素联合用药的体外抗肿瘤作用 [J]. 中国药理学通报, 2000, 16(5)∶522-525.
[11] 戴体俊. 合并用药的定量分析 [J]. 中国药理学通报, 1998, 14(5)∶479-480.
[12 ] 张洪妍, 沈朋, 栾连军. 一种测定MDR肿瘤细胞内外阿霉素浓度的方法[J]. 化学学报, 2004, 62(12)∶1162-1165.
[13] 贾海英, 杜守颖, 李冬学,等. 高效液相色谱法测定黄丝郁金中姜黄素的含量[J]. 时珍国医国药, 2005, 16(4)∶318-319.
[14] XIANG W, GAO A , LIANG H, et al. Reversal of P-glycoprotein-mediated multidrug resistance in vitro by milbemycin compounds in adriamycin-resistant human breast carcinoma (MCF-7/ADR) cells [J]. Toxicology in Vitro, 2010, 24(6)∶1474-1481.
Preparation and evaluation of curcumin-adriamycin compound liposomes
QU Yang1, HU Hai-yang1, ZHAO Xiu-li1, LIU Dan2, SUN Yu-qi1, CHEN Da-wei1*
(1.School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. Tieling Normal College, Tieling 112000, China)
ObjectiveThe curcumin-adriamycin compound liposomes(Cur-ADM-Lip) were prepared at the ratio of significant synergies, and the pharmaceutical and biological characteristics of the compound liposomes were evaluated. Methods MTT assay was used to test the inhibition efficiency on MCF-7/ADR cells in vitro, and the effect of drug combination was determined with Jin’s formula. Cur-ADM-Lip were prepared using the film dispersion-ammonium sulfate gradient method. The mean diameter and Zeta potential were measured by Malvern dynamic light scattering particle size analyzer. Free drugs were removed by micro-column centrifugation (Sephadex G-50), and HPLC method was established for the determination of drug loading in liposome and drug concentration in cellular uptake samples. Results The synergistic effect was strong when curcumin and adriamycin were combined at the ratio of 2∶1 and 1∶1,and no significant difference was found in their Q value. The compound liposomes prepared by the film dispersion-ammonium sulfate gradient method met the concentration ratio requirement that the proportion of curcumin and adriamycin concentration in the formulation were 2∶1 or 1∶1.The cellular uptake of adriamycin increased significantly on MCF-7/ADR cells when the proportion of curcumin and adriamycin concentration in the formulation was 2∶1. Conclusions Significant synergistic effect was produced when the proportion of curcumin and adriamycin concentration was 2∶1.The compound liposomes prepared according to that ratio exhibited higher cytotoxicity and cellular uptake against MCF-7/ADR cells when compared to the formulation Cur-ADM-Lip.
pharmaceutics; MCF-7/ADR cells; curcumin; adriamycin; drug combination; Cur-ADM-Lip
R 94
A
(2014)05–0141–10
(本篇责任编辑:吕向一)
2014–03–20
曲杨(1988-),女(汉族),辽宁铁岭人,硕士研究生,E-mail 837370002@qq.com;*通讯作者:陈大为(1959-),男(汉族),辽宁海城人,教授,博士,主要从事靶向给药系统的研究,Tel. 024-23986308,E-mail chendawei@syphu.edu.cn。
