他克莫司脂质微球注射液的制备
2014-06-15王月奇蔡翠芳
王月奇, 唐 星, 蔡翠芳
(沈阳药科大学 药学院,辽宁 沈阳 110016)
他克莫司脂质微球注射液的制备
王月奇, 唐 星, 蔡翠芳*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的制备他克莫司脂质微球注射液并进行稳定性的初步评价。方法 以外观、粒径及粒度分布、离心稳定性、ζ-电位、含量等作为主要评价指标,对他克莫司脂质微球注射液的处方及制备工艺进行了优化筛选,并进行初步稳定性的评价。结果 最终处方及制备工艺确定为:将0.1 g他克莫司分散于溶有0.03 g油酸及1.6 g磷脂的15 g注射用油中,置磁力搅拌器中加热 至75 ℃,并搅拌至全部溶解;将2.5 g甘油和0.2 g F-68分散于适量注射用水中,至磁力搅拌器中70 ℃加热搅拌使分散均匀得水相;在高速组织捣碎机搅拌下(10 000 r·min-1),将水相缓慢加入至油相中,待完全加入后,继续剪切4 min,得初乳;将初乳冷却至室温,转移至高压均质机中,以冰水浴控制均质温度在40 ℃以下,以80 000 kPa压力均质8次得终乳,以0.1 mol·L-1盐酸溶液将终乳pH值调节至6.0,用注射用水定容至全量;装瓶,封罐氮气,121 ℃高压蒸汽灭菌8 min,以冰水浴迅速降温即得。所制备的他克莫司脂质微球注射液样品的粒径和粒度分布、ζ-电位、含量、游离脂肪酸、甲氧苯胺值均符合规定标准,振摇稳定性良好,可用葡糖糖稀释,不可冷冻储存。结论 可以将他克莫司制备成脂质微球注射液,且其初步稳定性良好。
药剂学;他克莫司;脂质微球;初步稳定性评价
他克莫司是一种大环内酯类新型强效免疫抑制剂,其免疫活性是环孢素的50~100倍[1]。他克莫司难溶于水,目前国内外上市的注射剂中含有聚氧乙烯氢化蓖麻油(HCO-60)和无水乙醇,使用时常有不良反应,且制剂稀释时有药物析出的风险。
脂质微球作为载药体系,有提高难溶性药物的溶解度;提高药物稳定性并降低药物的毒性和刺激性;可耐高压蒸汽灭菌;制备工艺简单,易于进行工业化大规模生产等优点[2]。
本研究目的是以脂质微球为载药系统,开发一种稳定的他克莫司脂质微球注射液。以满足静脉给药要求。并对所制备的脂质微球注射液进行初步评价以评价其初步稳定性。
1 仪器与材料
HITACHI高效液相色谱仪(日本Hitachi公司),L-2000色谱工作站(日本Hitachi公司),ZHWY-110X30往复式水浴恒温摇床(上海智城分析仪器制造有限公司),KQ-50B型超声清洗机(昆山市超声仪器有限公司),FA1104N电子分析天平(上海民桥精密科学仪器有限公司),EYELA型旋转蒸发仪(上海爱朗仪器有限公司),80-2 型离心机(上海手术器械厂),DZF-6015型真空干燥箱(上海一恒科学仪器有限公司),ELSD 2000型高速离心机(北京雷柏尔离心机有限公司),NicompTM 380动态光散射粒度测定/ζ-电位测定仪(美国 Santa Barbara公司)。
他克莫司原料药(国药集团川抗制药有限公司,批号:100601),注射用蛋黄卵磷脂PL-100M(日本Kazuyoshi Tsukikawa公司),注射用豆磷脂Lipoid® S-100(德国Lipoid公司),注射用蛋黄卵磷脂Lipoid® E80(德国Lipoid公司),注射用甘油(浙江遂昌惠康药业有限公司),注射用油酸(德国Lipoid®公司),泊洛沙姆188(Poloxamer 188,F-68)(德国BASF公司),注射用中链脂肪酸甘油三酯(medium chain triglyceride, MCT,德国Lipoid公司), 注射用大豆油(long chain triglyceride, LCT,铁岭北亚药用油厂), 酚酞(天津市北方化工股份有限公司),氢氧化钠(天津博迪化工股份有限公司),4-甲氧基苯胺(沈阳药科大学药剂实验室), 其他试剂(分析纯,市售)。
2 方法
2.1 他克莫司脂质微球注射液的制备
将处方量的他克莫司、磷脂和油酸置磁力搅拌器中加热至75 ℃,并搅拌至全部溶解。将处方量甘油和F-68分散于适量注射用水中,至磁力搅拌器中70 ℃加热搅拌使分散均匀得水相。在高速组织捣碎机搅拌下(10 000 r·min-1),将水相缓慢加入至油相中,待完全加入后,继续剪切4 min,得初乳。将初乳冷却至室温,转移至高压均质机中,以冰水浴控制均质温度在40 ℃以下,以80 000 kPa压力均质8次得终乳,以0.1 mol·L-1盐酸溶液将终乳pH值调节至6.0,用注射用水定容至全量。装瓶,封罐氮气,121 ℃高压蒸汽灭菌8 min,以冰水浴迅速降温即得。
2.2 他克莫司脂质微球注射液评价指标及检测方法
2.2.1 外观
用肉眼观察他克莫司脂质微球,外观应为白色或类白色均匀乳状液体。
2.2.2 pH值
使用PHS-3C型酸度计测定不同处方脂质微球注射液样品的pH值。
2.2.3 粒径及ζ-电位测定
粒径测定方法:取样品适量,用纯化水(过0.22 μm的滤膜)稀释约100倍,置于样品池内,将光强度调节至300 左右,光源为HeNe激光(λ0=632.8 nm),介质水的折光率和黏度(n=1.333, η=0.933 cp),将操作参数中温度设为测定时室温,开始测定,保持测定至Time history曲线趋于直线,测定维持时间12 min。乳粒的平均粒径(以强度为权重计算)应为150~300 nm,Norm.Stnd.Dev.值小于0.4,小于60 nm的粒径累积值不得超过10%,500 nm以下粒径累积值不小于90%。
ζ-电位的测定方法:取样品适量,用过0.22 μm微孔滤膜的注射用水稀释适当倍数,放至样品池内,调节光强度(Intensity)至2 000 左右,光源为He-Ne 激光(λ0=633 nm),介质为水(n=1.333),散射角θ=18.9°,测定温度为室温,测定时间为2 min。
2.2.4 他克莫司含量测定方法
参照已知文献[3-4],选择含量测定方法。色谱柱:八烷基硅烷键合硅胶柱(4.6 mm×250 mm,5 µm),流动相:0.05 mol·L-1磷酸二氢钾溶液(用φ=10%的磷酸溶液调节pH至(3.0±0.1))-乙腈(体积比为35∶65),柱温:50 ℃,流速:1.0 mL·min-1,检测波长:210 nm,进样体积:20 μL。以异丙醇为溶剂制备质量浓度为40 g·L-1的试验溶液,室温放置6 h使其立体异构体相互转换趋于平衡后,取样测定,以他克莫司3个异构体峰面积之和进行定量计算。
2.2.5 离心稳定常数测定方法
取3 mL乳剂样品放入离心管中,以6 000 r·min-1离心15 min,取出离心管。用微量进样器吸取试管底部乳液,精密量取20 μL至10 mL量瓶中,用过0.22 μm微孔滤膜的蒸馏水稀释至刻度,摇匀,以蒸馏水为空白,用紫外-可见分光光度计在可见区500 nm测定吸光度A。同法将未离心的乳剂测定A0值,按照下式计算Ke。
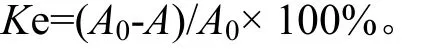
2.2.6 游离脂肪酸的测定
参照已知文献[5],用酸碱滴定法测定游离脂肪酸。精密量取样品10 mL,加乙醚-乙醇(体积比为1∶1)混合液(临用前加酚酞指示液1.0 mL,用氢氧化钠滴定液(0.1 mol·L-1)调至微显粉红色)50 mL,振摇使完全溶解(可缓慢加热回流助溶),用氢氧化钠滴定液(0.1 mol·L-1)滴定,至粉红色持续30 s不褪,记录滴定量。样品10 mL所消耗的氢氧化钠滴定液(0.1 mol·L-1)的量不得超过2.0 mL。2.2.7 甲氧苯胺值的测定
参照已知文献[6],精密量取样品10 mL,旋转蒸发除尽水分,得到透明凝胶状物。加体积分数为20 %异丙醇的异辛烷溶液溶解所得透明胶凝状物并移至25 mL量瓶中,加上述溶液稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。取供试品溶液,通过紫外-可见分光光度法,在350 nm的波长处,以体积分数为20 %异丙醇的异辛烷溶液作空白,测得的吸光度为A0。
精密量取上述供试品溶液 5 mL置具塞试管中,再精密加入2.5 g·L-14-甲氧基苯胺的冰醋酸溶液(临用新配)1 mL,加塞,振摇,避光放置 10~30 min(不超过30 min);另精密量取体积分数为20%异丙醇的异辛烷溶液5 mL 代替供试品溶液,同法操作,制成试剂空白溶液。以试剂空白溶液作空白,在350 nm 波长处测得的吸光度为 A。按下式计算,甲氧基苯胺值不得超过5.0。
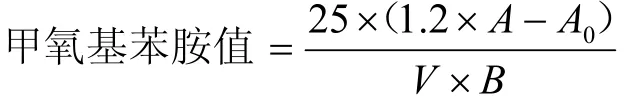
式中:V为供试品的取样量(mL);B为供试品中油相组成的标示量(g·mL-1);1.2 为加入4-甲氧基苯胺的冰醋酸溶液后的溶液稀释因子。
2.2.8 振摇稳定性
本次调研主要选择南京工业大学的8个院系,涉及化学、材料科学与工程、安全科学与工程、土木工程、法学、经济管理与工程等多个学科。目前,南京工业大学的化学、材料科学、工程学3个学科进入ESI世界排名前1%,生物学与生物化学是距离ESI全球前1%最近的学科,4个学科可以说是属于学校的“高峰”“高原”学科,其他学科则属于“一般学科”。因此,调研结果一定程度上反映了不同层次学科的资源需求。
以最终确定的处方和制备工艺制备一批样品,将一瓶样品放入25 ℃恒温水浴振荡器里,以100 r·min-1的速度振摇,分别于2、4、6、12、24、48 h取样,观察各时间点下样品的外观,且分别测定零时及各取样时间下脂质微球的粒径及粒度分布。
2.2.9 冻融循环
以最终确定的处方和制备工艺制备一批样品,在-20 ℃条件下冻结12 h,取出融化后在室温放置12 h,如此反复循环3次观察制剂外观并进行粒径测定。
2.2.10 稀释稳定性
以最终确定的处方和制备工艺制备一批样品,分别用生理食盐水和葡萄糖注射液将样品稀释5倍、50倍,分别于0、2、4、8、12、24、48 h测定他克莫司脂质微球的粒径及粒度分布。
3 结果与讨论
3.1 他克莫司脂质微球注射液制备中处方因素考察
按照经典处方拟定出初步处方,采用单因素变量法,以脂质微球注射液外观、粒径及粒度分布、离心稳定性、ζ-电位、含量等作为主要评价指标,对他克莫司脂质微球注射液进行处方及制备工艺进行了优化筛选。
3.1.1 注射用油的种类和比例
由于中链油溶解药物的能力远远大于大豆油对药物的溶解能力,且鉴于他克莫司用作免疫抑制剂时使用剂量极低,本研究中,作者采用单独使用MCT,用量定为质量浓度为150 g·L-1。
以外观、粒径及长期物理稳定性为评价指标,结果见表1。
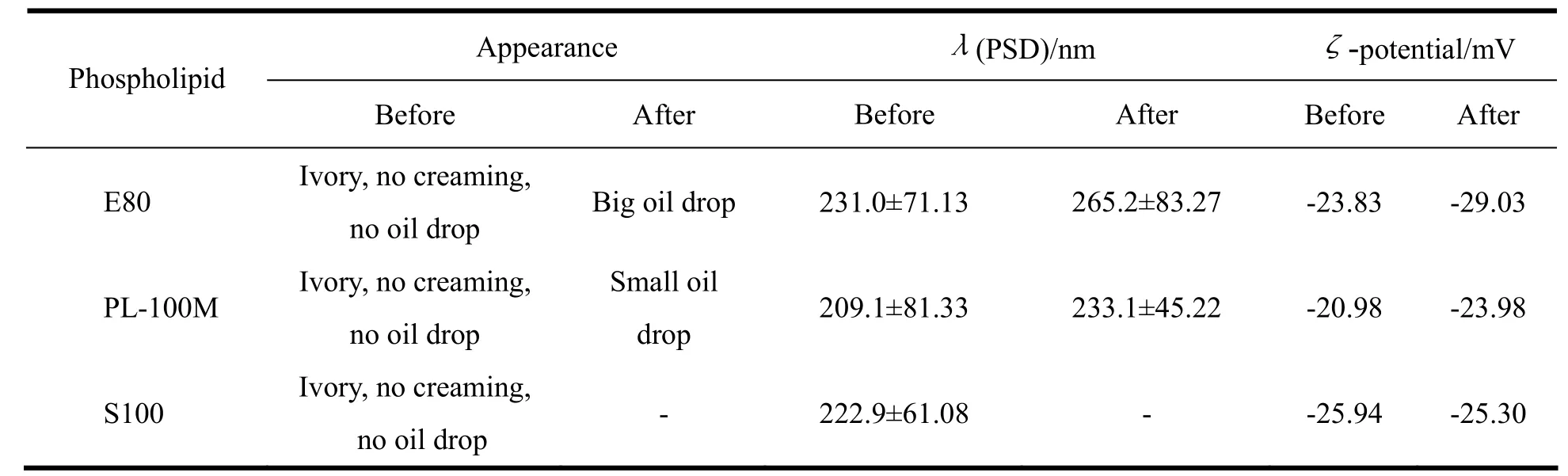
表1 磷脂种类对他克莫司脂质微球注射液物理性质的影响Table 1 The effect of th e d ifferent t ypes o f p hospholipid on th e p hysicochemical p roperties of ta crolimus lip idmicrosphere
由表可见,含有S100的处方所得制剂灭菌后破乳,使用E80的处方2个月后出现分层现象,而PL-100M的处方状态相对良好。因此,选定PL-100M磷脂。
以物理外观、粒径及粒度分布和ζ-电位及离心稳定常数作为评价指标考察磷脂的用量,结果见表2。
实验结果显示,当磷脂质量浓度为12 g·L-1时,所得乳剂可看到小油滴,当磷脂质量浓度增加到16 g·L-1或更高时,乳剂外观良好,灭菌后液面无油滴产生。将磷脂质量浓度在16 g·L-1以上的处方在室温放置,1个月时,磷脂加入量为20 g·L-1的处方有絮凝现象出现,提示乳剂不稳定。确定磷脂用量为16 g·L-1。
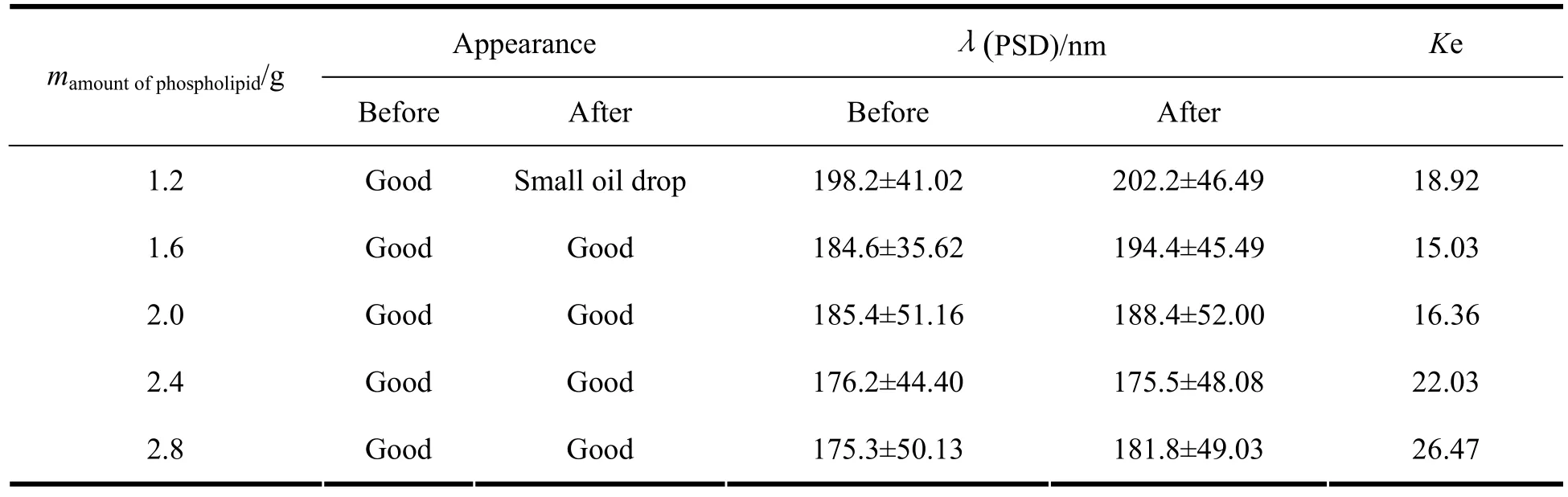
表2 磷脂用量对去他克莫司脂质微球注射液理化性质的影响Table 2 Th e effect of th e different amount of p hospholipid on the physicochemical properties of ta crolimus lipidmicrosphere
3.1.3 助乳化剂的确定
本实验中,作者采用F-68为助乳化剂,对其用量进行考察,结果见表3。

表3 F-68用量对他克莫司脂质微球注射液理化性质的影响Table 3 The effect of the different amount of F-68 on the physicochemical properties of tacrolimus lipid microsphere
由表中结果可知,随着F-68用量的增加,离心稳定常数下降,提示乳剂稳定性增强,但是粒径分布结果显示,乳剂粒径有变小的趋势,且分布明显变宽,且长期储存后有絮凝的现象。故将F-68质量浓度定为2 g·L-1。
3.1.4 稳定剂的考察
本研究中,作者选择呈弱酸性的油酸作为稳定剂。结果见表4。
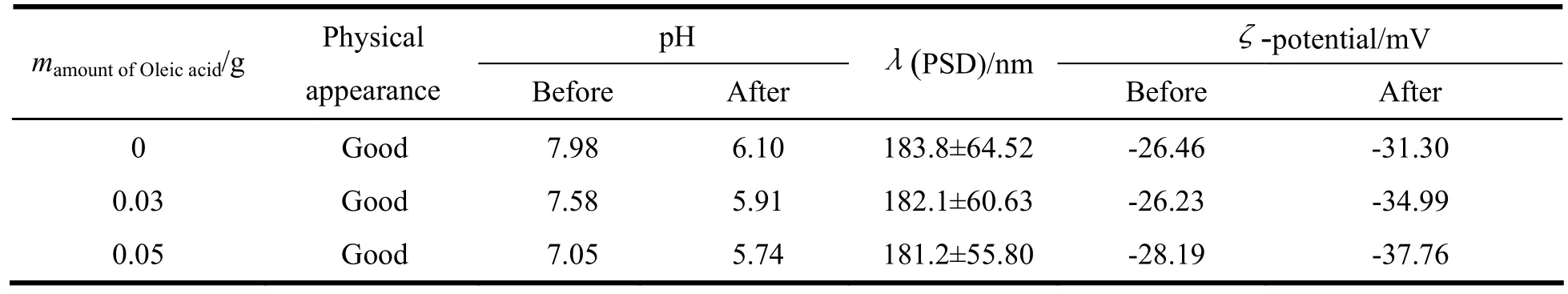
表4 油酸用量对他克莫司脂质微球注射液理化性质的影响Table 4 The effect of the different amount of oleic acid on the physicochemical properties of tacrolimus lipid microsphere
如表4所示,尽管随着油酸量增加,降低pH值效果显著增加,但由于油酸是外源性物质,有溶血作用,故最终将油酸的质量浓度定为0.3 g·L-1。
3.2 他克莫司脂质微球注射液制备中工艺因素考察
3.2.1 剪切工艺
本研究中,作者将剪切速度定为10 000 r·min-1。分别考察剪切时间为3、4、5、8 min情况下粒径的分布情况,结果如表5所示。

表5 剪切时间对初乳粒径的影响Table 5 The influence of shearing time on particle size of primary emulsion
由表中结果可知,当剪切时间为4 min时,粒径分布最均匀,将剪切时间定为4 min。
3.2.2 高压均质考察
均质考察结果见表6及表7。
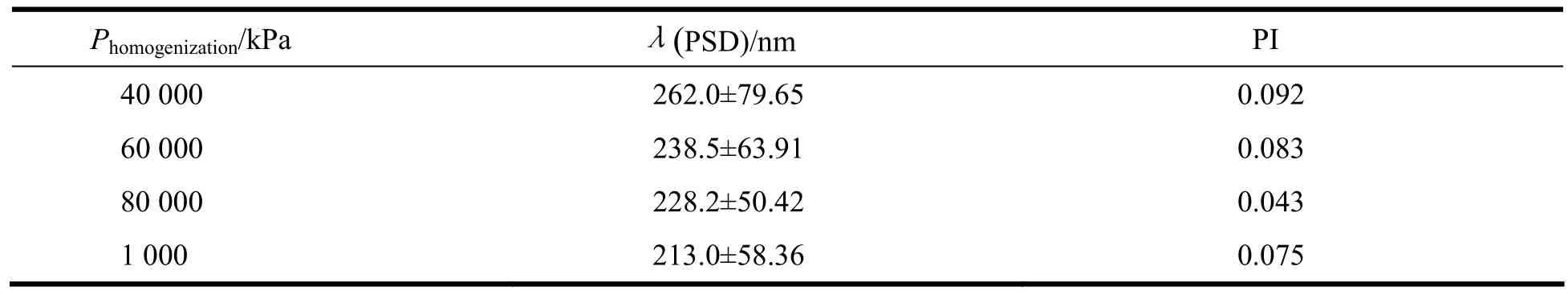
表6 高压均质压力考察结果Table 6 The influence of homogenization pressure on quality of tacrolimus lipid microsphere
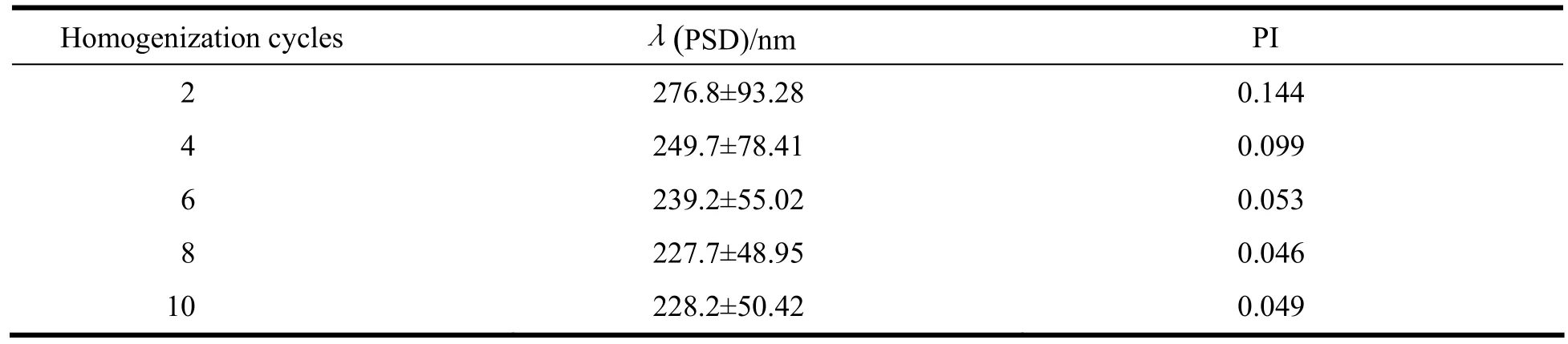
表7 高压均质次数考察结果Table 7 The influence of homogenization circles on size and size distribution of tacrolimus lipid microsphere
根据表中数据可知,均质压力为80 000 kPa,循环8次时,制备的脂质微球分布最均匀,故均质工艺定为80 000 kPa,循环8次。
3.2.3 pH值调节
临床常用的注射液的pH值多在4~9之间。由于他克莫司在碱性条件下不稳定,其最稳定的pH值为5.4。故将最终灭菌后pH值定为5.4。初步实验结果显示,灭菌过程中由于有游离脂肪酸生成,脂肪乳体系的pH值会有一定程度的降低。因此,本研究中,作者决定将灭菌前pH保持在6左右,由于PL-100M特殊的处理过程,其经过高压均质的脂质微球细乳偏碱性,pH可达到8.5~9.0,本实验过程中,作者也发现均质后pH明显升高,证明了此事实,分析pH升高的原因为:磷脂主要成分为磷脂酰胆碱(phosphatidylcholine, PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)、磷脂酰肌醇(phosphatidylinositol, PI)等。其中PE呈碱性,以质量分数计,已知Lipoid E80®含有大约80 %的PC和8 %的PE,PL-100M大约含有78 %的PC和18 %的PE。可见PL-100M较其它磷脂PE含量高,所以在均质乳滴细化过程中pH升高显著。故均质前调解pH作用不明显,因此本研究的pH调节方法为:把初乳过高压均质,用0.1 mol·L-1盐酸溶液将均质后乳剂调节至所需pH值(6.0)。
3.2.4 灭菌条件选择
灭菌是使注射剂安全用药的重要保证,常将F0值作为评论灭菌可靠性的指标,本试验中,作者先考察F0=8时的灭菌条件,即分别进行115 ℃ 30 min、121 ℃ 8 min的灭菌,以灭菌后最大杂质含量为指标,初步判定121 ℃8 min下灭菌较好,之后又考察了121 ℃ 10 min、121 ℃ 15 min条件下灭菌效果,结果见表8。
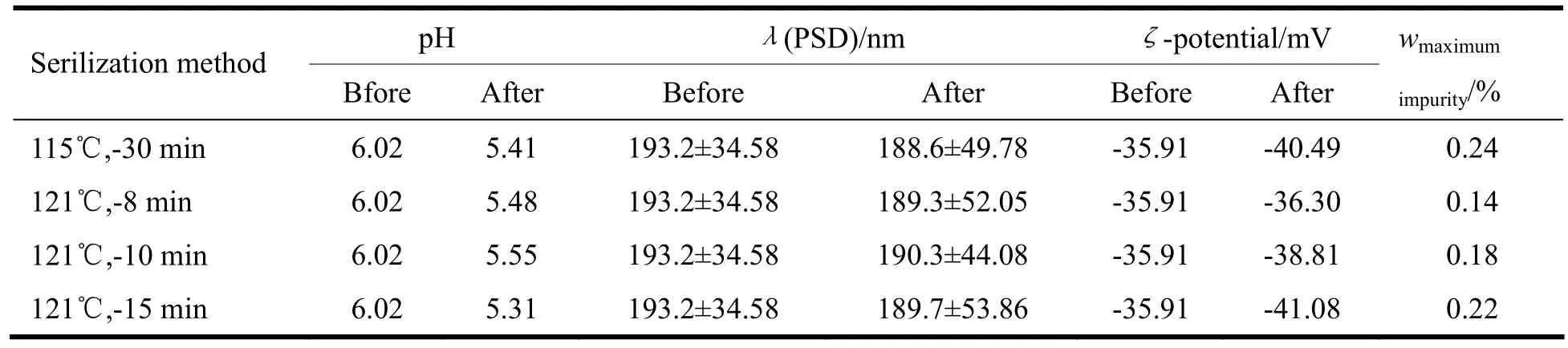
表 8 灭菌条件对他克莫司脂质微球注射液理化性质的影响Table 8 The influence of sterilization method on chemical and physical stability of tacrolimus lipid microsphere
实验结果显示,当F0=8时,121 ℃ 8 min时产生最大杂质含量最低,故最终将灭菌条件定为121 ℃8 min。
3.3 初步评价
3.3.1 性状
肉眼观察样品外观为白色均匀乳状液体。无油滴、分层,絮凝或药物结晶析出等现象,表明他克莫司脂质微球注射液稳定性良好,符合标准。
3.3.2 pH值
测得样品pH值为5.5,符合标准。
3.3.3 粒径及粒度分布的测定
测得样品平均粒径(196.5±55.4) nm,为150~300 nm,分布均匀,无大于5 μm的粒子存在,符合静脉注射用乳剂的粒径要求。
3.3.4 ζ-电位的测定
测得样品的ζ-电位值为-34.99 mV,为-20 mV ~ -40 mV,符合标准。
3.3.5 含量测定
测得样品含量质量分数为99.7 %( 90 %~110 %),符合标准。
3.3.6 游离脂肪酸
测得该批样品测定消耗滴定液的用量为0.53 mL,未超过2 mL,符合标准。
3.3.7 甲氧苯胺值
测得该批样品甲氧苯胺值在5以下,符合标准。
3.3.8 振摇稳定性
振摇稳定性结果见图1。
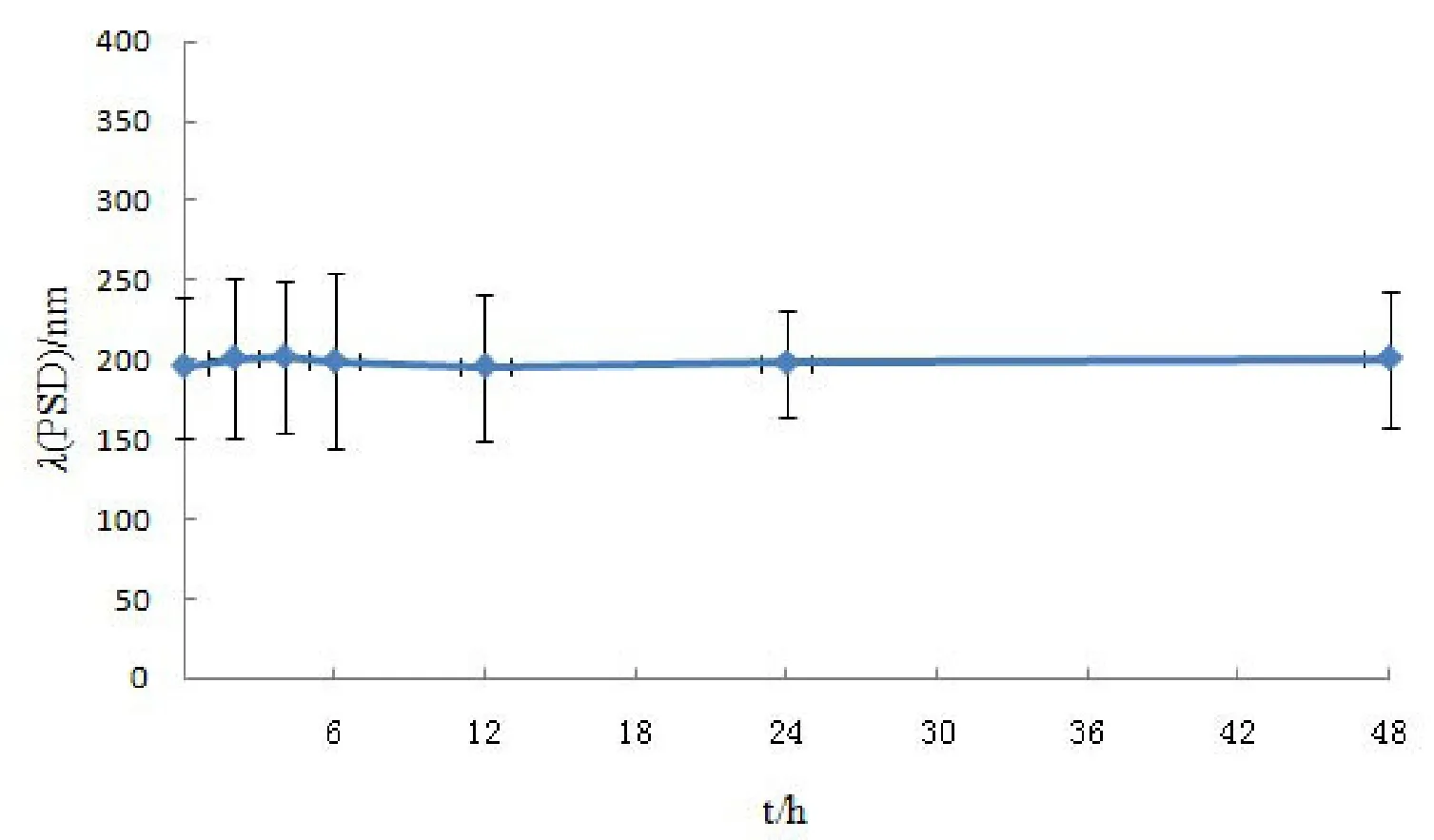
图1 他克莫司脂质微球注射液振摇稳定性结果Fig.1 Stability of tacrolimus lipid microsphere upon shaking
图1中结果可知,经48 h振摇后,他克莫司脂质微球注射液平均粒径没有显著变化。提示振摇稳定性良好,可以满足运输中的要求。
3.3.9 稀释稳定性
稀释稳定性结果见图2。
注射用药物在临床上使用时经常稀释后给药,常用的稀释介质包括氯化钠注射液(w=0.9 %)及葡萄糖注射液(w=5.4%)。故本实验中, 作者分别用生理食盐水及葡萄糖注射液将自制他克莫司脂质微球注射液稀释,考察其稀释稳定性,为以后用药提供参考。由图2可见,以葡萄糖注射液稀释的样品,静止48 h后仍无显著变化,而以生理食盐水稀释的2组样品,粒径均有逐渐增大的趋势,且实验中作者发现,分布范围也变宽。因此提示本制剂不适合用生理食盐水稀释,适于用葡萄糖注射液稀释,稀释48 h内可以使用。
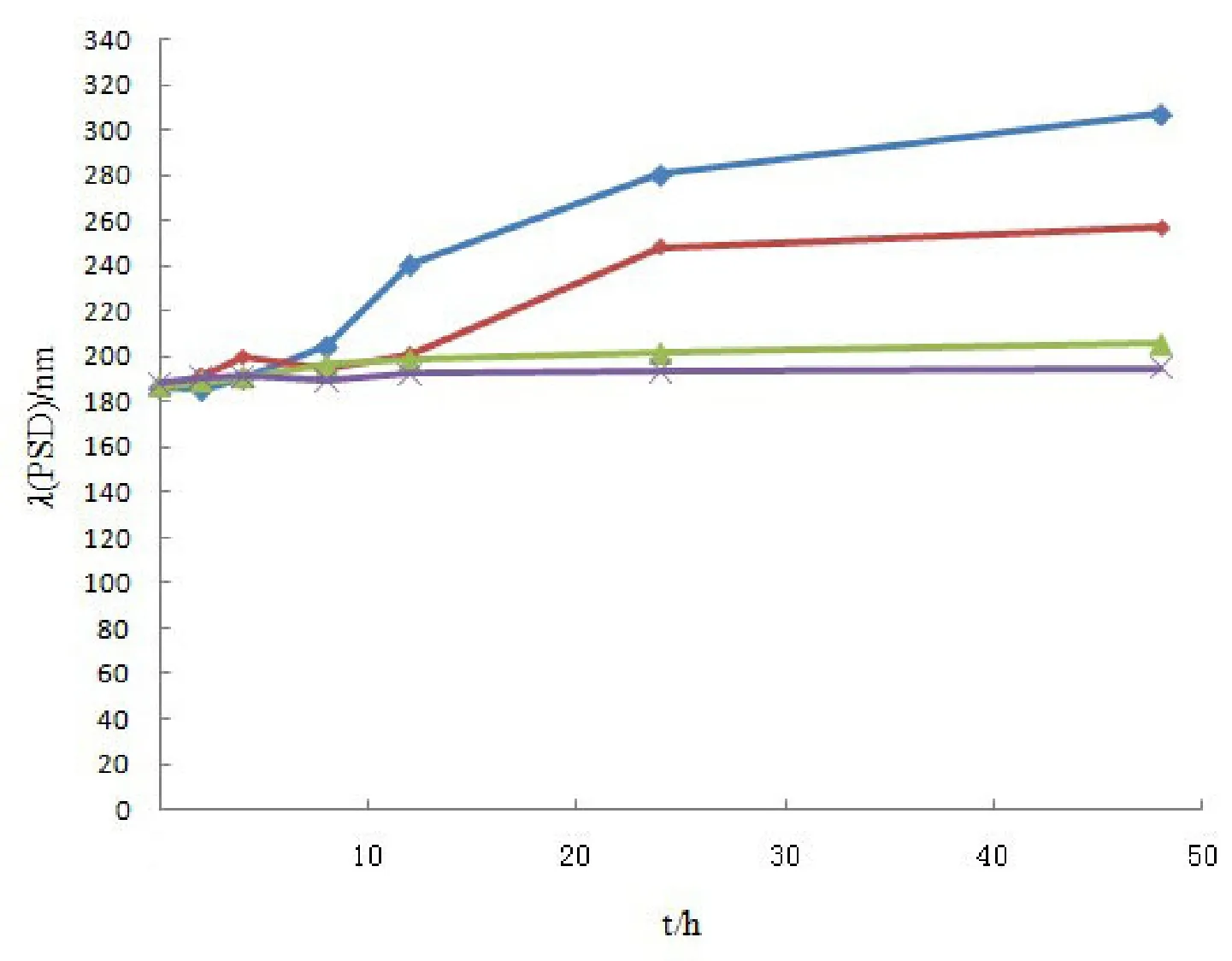
图2 他克莫司脂质微球稀释稳定性试验结果Fig.2 Stability of tacrolimus lipid microsphere upon dilution
3.3.10 冻融循环
测定结果见图3。
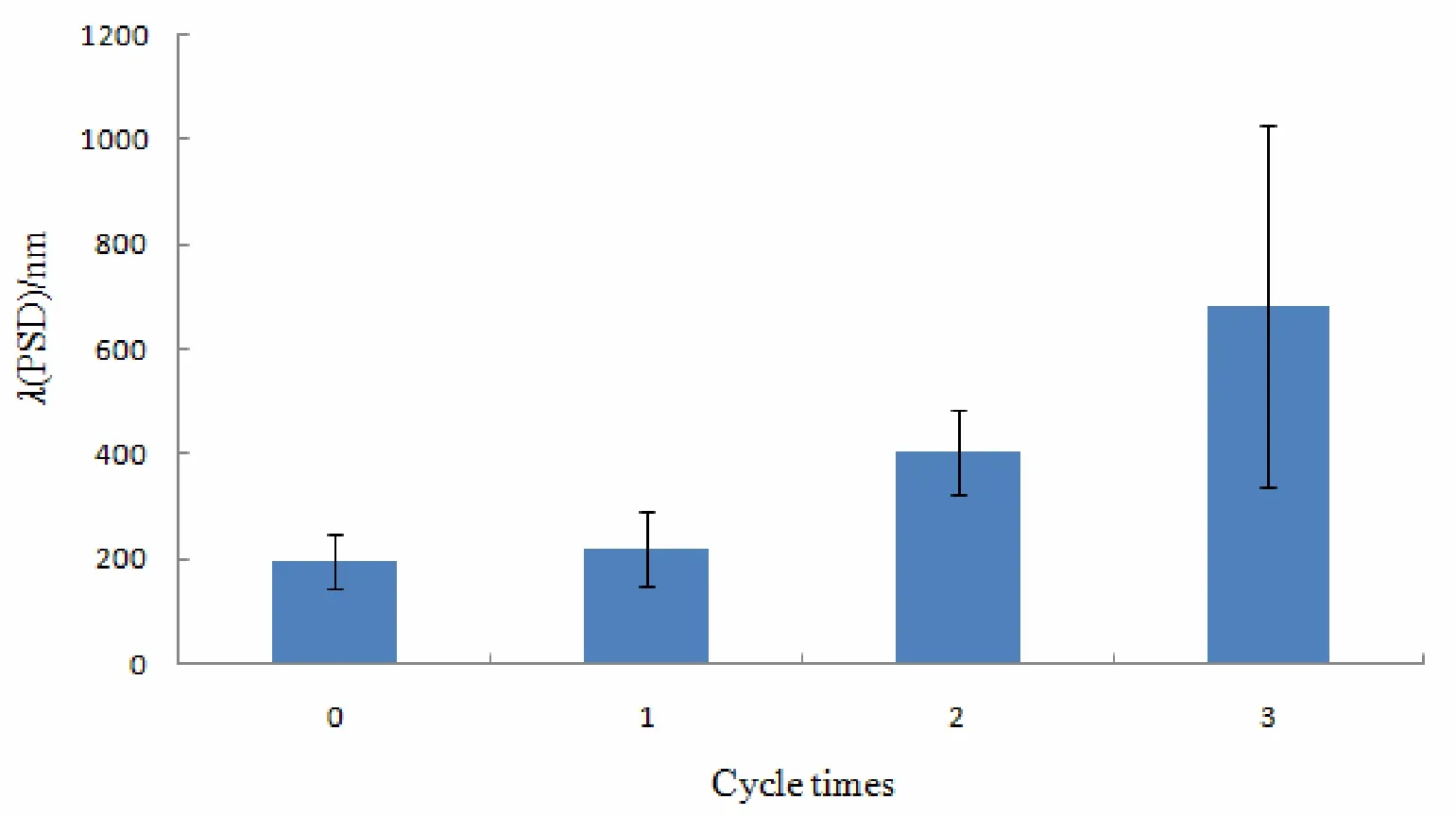
图3 他克莫司脂质微球冻融稳定性结果Fig.3 Stability of tacrolimus lipid microsphere upon freezing and thawing
由图3中可见制剂经过冻融过程,平均粒径随冻融次数增加变化显著,平均粒径由196.5 nm增加到683.4 nm。结果表明冰冻对制剂的稳定不利,故制剂不可冰冻。
4 结论
本研究中,作者成功的制备了他克莫司脂质微球注射液,优化了他克莫司脂质微球注射液制备的最佳处方及工艺。对制备的脂质微球进行了初步评价,包括粒径和粒度分布、ζ-电位、含量、游离脂肪酸、甲氧苯胺值,结果显示各项均符合规定标准。振摇稳定性良好,可用葡糖糖稀释,不可冷冻储存。结果表明,制备的他克莫司脂质微球注射液初步稳定性良好。
[1] 王意如. 免疫抑制剂研究新进展[J]. 中国新药杂志, 2002, 11(7)∶ 512-515.
[2] 陈涛, 惠民权, 傅经国, 等. 脂肪乳药物制剂的研究进展[J]. 世界最新医学信息文摘, 2004, 3(5)∶ 1295-1298.
[3] 郑国钢, 管燕, 罗金文. 反相高效液相色谱法测定他克莫司胶囊的含量[J]. 中国药业, 2007, 16(1)∶ 17-18.
[4] 陈悦. HPLC法测定他克莫司的含量及有关物质[J]. 药物分析杂志, 2008, 28(2)∶ 309-313.
[5] 国家食品药品监督管理局. 国家药品标准 WS1-(X-041)-2002[S].
[6] 国家食品药品监督管理局. 国家药品标准 JX20010342[S].
Study of tacrolimus-loaded lipidmicrosphere preparation
WANG Yue-qi, TANG Xing, CAI Cui-fang*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo prepare and characterize tacrolimus lipid microsphere. Methods Formulation and preparation process of tacrolimus lipid microsphere were investigated using appearance, particle size, ζ-potential, pH, content and related substances of formulation as the evaluation index. Results The final formulation and preparation were optimized as follows∶ as mass percentage, the oil phase was composed of 0.1% tacrolimus, 1.6% lecithin, 0.03% oleic acid, and 15 % MCT; the water phase was composed of 0.2% F-68, 2.5% glycerol, and the oil phase and water phase were heated to 75 ℃ and 70 ℃ respectively; the homogenization pressure and cycles were 800 bar and 8 times; the pH was adjusted to 6.0 and then tacrolimus lipid microsphere was sterilized by autoclaving for 8 min at 121 ℃. The appearance, particle size, ζ-potential, pH, content, free fatty acids and methoxy aniline values meet the standards. The formulation can be diluted with glucose injection and it cann’t be frozen. Conclusion Tacrolimus loaded lipid microsphere were successfully prepared with high preliminary stability.
pharmaceutics; tacrolimus; lipid microsphere; preliminary stability ditration
R 94
A
(2014)05–0167–10
(本篇责任编辑:曹 霞)
2014–06–18
王月奇(1987-),女(汉族),吉林公主岭人,硕士研究生,Tel. 024-23984395,E-mail wangyueqi1987@163.com; *通讯作者:蔡翠芳(1974-),女(汉族),山东庆云人,副教授,博士,主要从事非胃肠道给药缓控释研究,Tel. 024-23984395,E-mail caicuifang@163.com。
