辅酶Q10纳米裸晶的制备及表征
2014-06-15王春玲程晓波邓意辉
隋 月,孙 姣,王春玲,王 宇,程晓波,邓意辉*
(1.沈阳药科大学 药学院,辽宁 沈阳 110016;2. 江苏恒瑞医药股份有限公司,江苏 连云港 222000)
辅酶Q10纳米裸晶的制备及表征
隋 月1,孙 姣2,王春玲1,王 宇1,程晓波1,邓意辉1*
(1.沈阳药科大学 药学院,辽宁 沈阳 110016;2. 江苏恒瑞医药股份有限公司,江苏 连云港 222000)
目的制备不含稳定剂且稳定存在的辅酶Q10(coenzyme Q10,CoQ10)纳米裸晶。方法 分别以沉降法和逆向沉降法制备纳米裸晶,并运用激光粒度仪、zeta电位仪和透射电镜(transmission electron microscope,TEM)考察制剂的理化性质。结果 确定最终处方工艺,得到粒径范围在80~700 nm内的纳米裸晶,其中粒径为(82.6 ± 5.4)、(118.2 ± 14.5)、(388.6 ± 19.8)和(675.1 ± 53.4) nm制剂的zeta电位分别为-(34.20 ± 0.47)、-(29.23 ± 0.34)、-(17.68 ± 0.37)和-(6.54 ± 1.78) mV,透射电镜观察纳米裸晶呈圆球状。结论 成功制备了不含稳定剂的CoQ10纳米裸晶。
药剂学;纳米裸晶;沉降法;逆向沉降法;CoQ10;粒径
纳米裸晶是粒径在纳米级别、未添加任何辅料、纯药物的纳米晶体。纳米晶体由于具有大的比表面积,倾向于聚集或沉淀来减小由比表面积增大而产生的过剩自由能,故常需要添加表面活性剂或高分子聚合物等稳定剂[]1。但在研究中发现,添加剂的使用会影响粒子的行为[]2,干扰结果的判断;因此,制备不含任何稳定剂的纳米晶体显得尤为重要。迄今为止,在制药领域对纳米裸晶的报道寥寥无几[]3-6,本文在前期试验的基础上,选择药物CoQ10,制备了未添加任何稳定剂也能稳定存在的纳米晶体,并对其性质进行表征,为探讨粒径与溶解度及体内行为的关系奠定基础。
1 仪器与材料
DF-101S集热式恒温加热磁力搅拌器(巩义英峪予华仪器厂),高速分散机(德国IKA T18 ULTRA TURRAX®),Nicomp-380激光粒度测定仪(美国PSS公司),JM-1200EX透射电镜(日本电子公司)。
CoQ10原料药(云南楚雄太阳药业有限公司),无水乙醇(分析纯,天津博迪化工股份有限公司),重蒸水(实验室自制)。
2 方法与结果
2.1 CoQ10纳米裸晶的制备
2.1.1 筛选指标
2.1.1.1 外观
纳米裸晶因比表面积很大,在未添加任何稳定剂的情况下,容易出现沉淀、分层等现象,所以可通过观察纳米裸晶混悬液的外观,对制剂稳定性进行评价。
2.1.1.2 平均粒径及多分散系数
粒径及其分布可以从微观角度反映纳米裸晶混悬液内部的变化,粒径分布情况通常用平均粒径及多分散系数(polydispersity index,PI)表示,PI越小,粒子分布越均一。故选择平均粒径和PI值为处方和工艺筛选的指标。
2.1.2 沉降法
沉降法是在搅拌的条件下,将含药物的有机相迅速分散于水相中,由于巨大的溶解性差异导致药物析出,并因机械力作用快速分散成为较均一纳米晶体的方法。
2.1.2.1 基本处方工艺
在50 ℃水浴中将CoQ10(质量浓度为1 g·L-1)溶于乙醇,作为有机相,重蒸水组成水相,在一定转速搅拌下将有机相注入水相中,继续搅拌一段时间后,放冷至室温即得。
2.1.2.2 乙醇体积分数的选择
以“2.1.2.1”条的方法制备纳米裸晶,得到制剂中乙醇体积分数分别为5%、10%、15%、20%、25%、30%、35%和40%。当乙醇体积分数为5%时,出现明显的沉淀;乙醇体积分数为10%和15%时,测定制剂的粒径和PI值分别为125.2、130.6 nm和0.109、0.112,且制剂外观良好,放置10 d后仍稳定;乙醇体积分数为30%以上,所得制剂粒径大于200 nm,放置0.5 h后出现沉淀。故最终确定乙醇体积分数为10%。
2.1.2.3 药物质量浓度的选择
按照“2.1.2.1”条的方法,制备药物质量浓度分别为0.17、0.33、0.50、1.00和2.00 g·L-1的CoQ10纳米裸晶,制剂外观均良好,平均粒径和PI值见表1。由表可知,粒径随药物质量浓度的增加而增大。
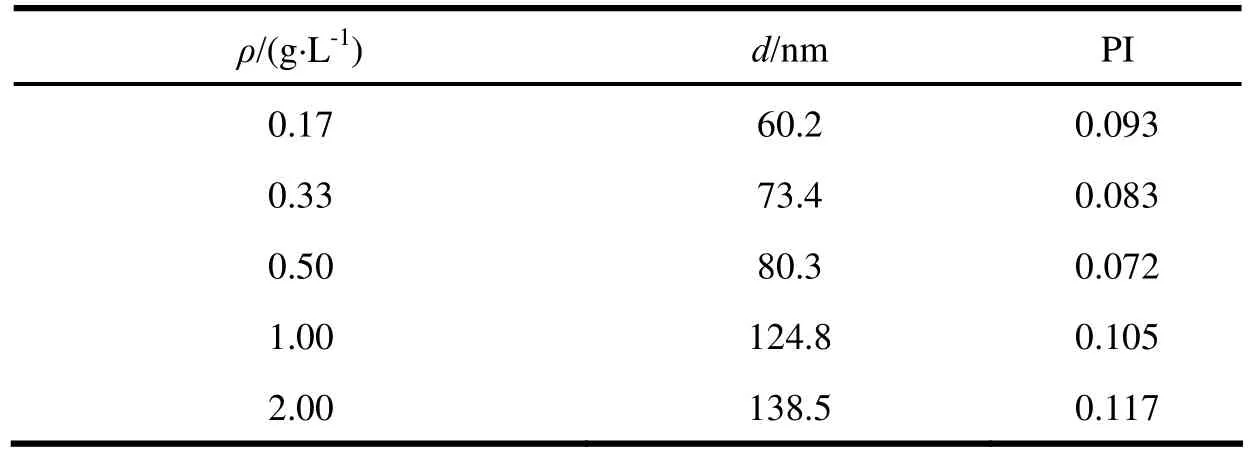
表 1 药物质量浓度对CoQ10纳米晶体粒径的影响Table 1 Effect of the concentration of CoQ10 on the particle size of CoQ10 nanocrystal
2.1.2.4 转速的选择
按照“2.1.2.1”条方法,分别将转速设为10 000、14 000、18 000和22 000 r·min-1制备CoQ10纳米裸晶。当转速为10 000 r·min-1时,发现混悬液的液面上漂浮着一些大粒子,这可能是由于转速小体系分散不完全所致;而转速大于14 000 r·min-1,得到的制剂粒径接近200 nm。综合考虑将转速确定为14 000 r·min-1。
2.1.2.5 搅拌时间的选择
按照“2.1.2.1”条方法制备纳米裸晶混悬液,搅拌时间分别选择10、15、20、30和45 s,制剂外观均良好,平均粒径和PI值见表2。由表2可知,搅拌时间大于20 s,在机械搅拌下粒子间碰撞几率增大,导致最终体系粒度分布宽;当搅拌10、15和20 s时,所得的制剂粒径较小,通过PI值间的比较,确定搅拌时间为15 s。
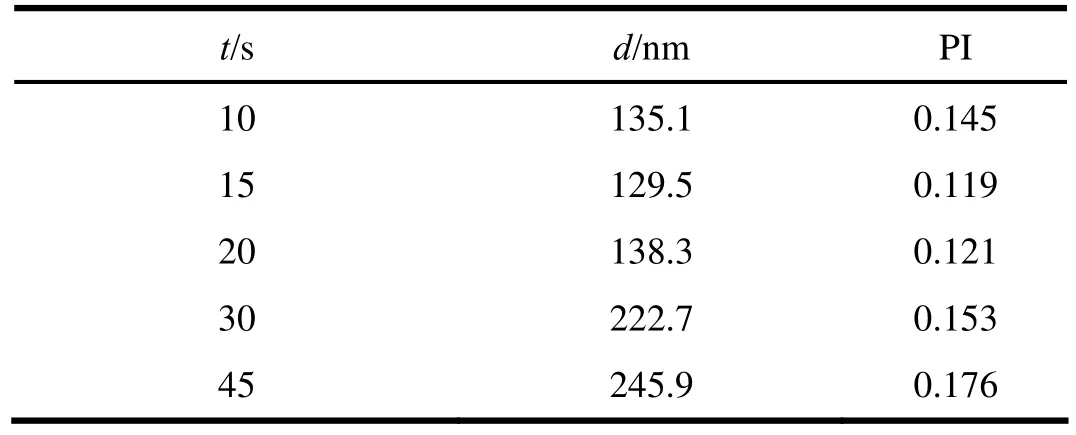
表 2 搅拌时间对CoQ10纳米晶体粒径的影响Table 2 Effect of stirring time on the particle size of CoQ10 nanocrystal
2.1.2.6 有机相温度的选择
按照“2.1.2.1”条的处方,有机相的温度分别选择为50、55、60、65和70 ℃,制剂外观均良好,平均粒径和PI值见表3。由表3可知,有机相温度范围在60~65 ℃时,得到的粒径值较小。当有机相温度达到70 ℃,温度过高,使粒子间碰撞加剧,致使粒子聚集,制剂粒径变大,故将温度确定为60 ℃。
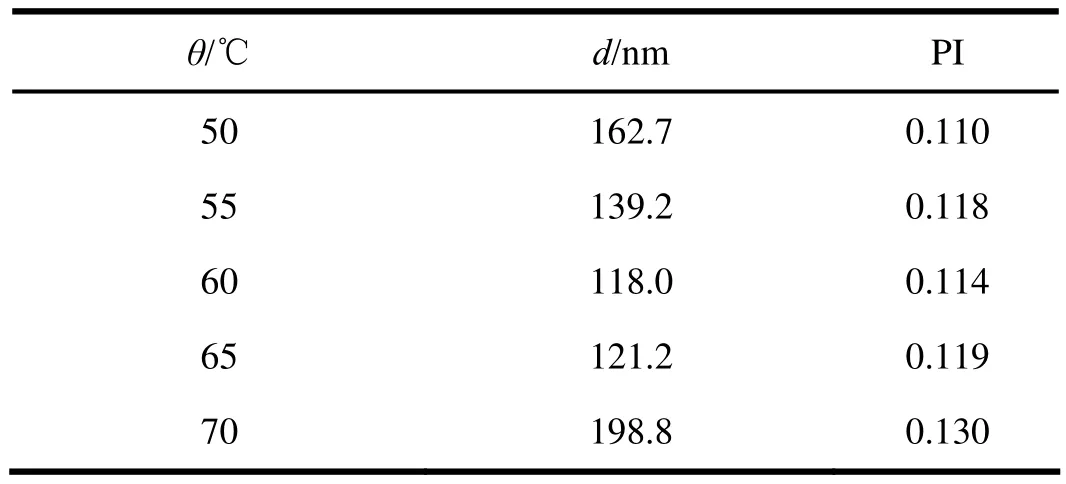
表 3 温度对CoQ10纳米晶体粒径的影响Table 3 Effect of temperature on the particle size of CoQ10 nanocrystal
2.1.3 逆向沉降法
逆向沉降法系在搅拌的条件下,将水相以一定速度滴入溶解药物的有机相中,并经机械力作用分散成均一的纳米晶体。
2.1.3.1 基本处方工艺
在50 ℃水浴中将CoQ10(质量浓度为1 g·L-1)溶于乙醇,作为有机相,重蒸水组成水相,在一定转速搅拌下,将水相注入有机相中,继续搅拌一段时间后,放冷至室温即得制剂。
2.1.3.2 注入速度的选择
按照“2.1.3.1”条方法制备纳米裸晶,其中水相的滴入速度分别为3、15、20、30和60 mL·min-1,以外观、平均粒径和PI值为指标进行筛选,结果见图1。由图1可知,随着注入速度的增加,药物是在分散良好的情况下逐渐析出,粒径增加均匀,外观均较好。另外,考虑速度控制的问题,将注入速度的最佳范围确定为15~30 mL·min-1。
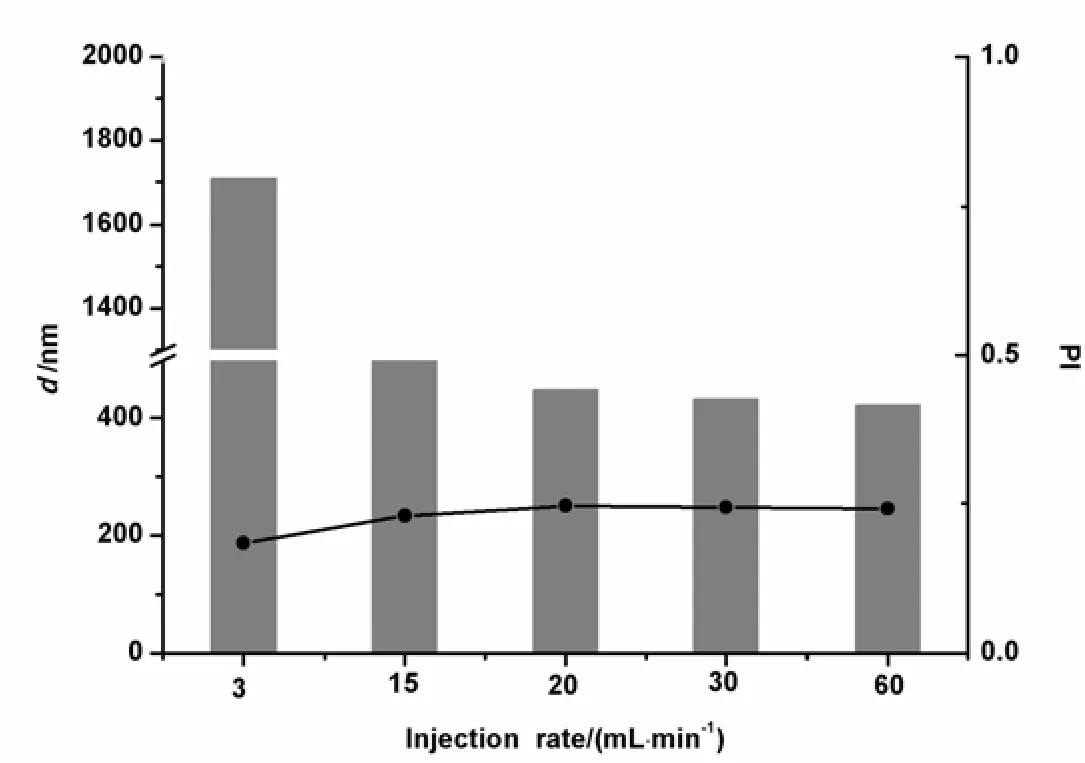
图 1 注入速度对CoQ10纳米晶体粒径的影响Fig. 1 Effect of injection speed on the particle size of CoQ10 nanocrystal
2.1.3.3 搅拌速度的选择
按照“2.1.3.1”条方法制备纳米裸晶,其中搅拌速度分别为250、500、750、1 000和1 500 r·min-1,结果见图2。当转速为1 500 r·min-1时,由于搅拌过于剧烈,制剂已经贴壁旋转,冷却至室温时,杯壁上漂浮少量油滴;而转速过慢,药物分散性差且粒径分布较宽。因此,转速的最佳范围确定为500 ~ 1 000 r·min-1。
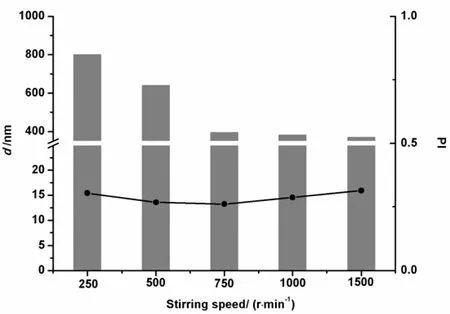
图 2 搅拌速度对CoQ10纳米晶体粒径的影响Fig. 2 Effect of stirring speed on the particle size of CoQ10 nanocrystal
2.1.3.4 搅拌时间的选择
水相加入至有机相后,搅拌时间对粒度分布的影响较大。搅拌时间短,药物溶液分散不均一,容易聚集;搅拌时间长,增加纳米晶体间的碰撞几率,粒子也易发生聚集。因此本文对搅拌时间进行了考察,搅拌时间为1或2 min,制剂表面漂油,说明搅拌不够充分,药物未分散完全导致聚集;搅拌3 min后,所得制剂外观良好,平均粒径和PI值较小;而搅拌5 min时,制剂粒径明显增大,表明有部分粒子因搅拌碰撞而聚集。故将搅拌时间确定为3 min。
2.1.4 最终处方和工艺
2.1.4.1 沉降法
制备粒径小于200 nm的纳米裸晶。80 nm①粒径制剂的制备:在60 ℃水浴中,以5 g·L-1CoQ10的无水乙醇溶液为有机相,重蒸水作为水相。在14 000 r·min-1高速分散下将有机相快速注入到水相中,分散15 s,放置至室温即得。②120 nm粒径制剂的制备:在60 ℃水浴中,以10 g·L-1CoQ10的无水乙醇溶液为有机相,重蒸水作为水相。在14 000 r·min-1高速分散下将有机相快速注入到水相中,分散15 s,放置至室温即可。
2.1.4.2 逆向沉降法
制备粒径大于200 nm的纳米裸晶。①400 nm粒径制剂的制备:在50 ℃水浴中,以10 g·L-1CoQ10的无水乙醇溶液为有机相,重蒸水作为水相。在750 r·min-1的磁力搅拌下,以30 mL·min-1的速度将水相滴入到有机相中,搅拌3 min,放置至室温即可。②700 nm粒径制剂的制备:在50 ℃水浴中,以10 g·L-1CoQ10的无水乙醇溶液为有机相,重蒸水作为水相。在500 r·min-1的磁力搅拌下,以15 mL·min-1的速度将水相滴入到有机相中,搅拌3 min,放置至室温即可。
2.2 辅酶Q10纳米裸晶的表征
2.2.1 外观
CoQ10纳米裸晶混悬液外观见图3。不同粒径的制剂外观有很大不同,随着粒径的增加,外观由半透明逐渐向不透明转变。

图 3 不同粒径CoQ10纳米晶体在室温贮存24 h后的外观Fig. 3 Suspensions of CoQ10 nanocrystals with different sizes after storage for 24 h at room temperature
2.2.2 粒度分布及zeta电位
粒度大小以动态光散射法测定,用平均粒径和PI值表示。Zeta电位可评价制剂表面的荷电情况,影响其体内药物动力学及组织分布。本研究采用PSS-NICOMP380 ZLS测定各制剂的zeta电位。各制剂的平均粒径、PI及zeta电位值见表4,所有制剂均荷负电,电位值随粒径变化而改变。

表 4 Co Q10纳米晶体的粒径大小、PI值和zeta电位值Table 4 Particle size, PI and zeta potential of CoQ10 nanocrystal (n=4)
2.2.3 形态
采用负染法观察CoQ10纳米裸晶。将样品稀释适当的倍数,取适量滴于以火棉胶作为支持膜的铜网上,用滤纸吸去多余液体,铜网浸泡于20 g·L-1磷钨酸溶液中染色3~5 min,而后自然晾干,用透射电镜观察纳米裸晶的形态。不同粒径的CoQ10纳米裸晶透射电镜照片见图4,粒子呈圆球形。
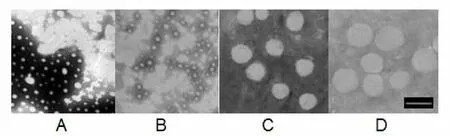
图 4 不同粒径CoQ10 纳米晶体的透射电镜图,其中A为80 nm;B为120 nm;C为400 nm;D为700 nm (bar =500 nm)Fig. 4 TEM micrographs of CoQ10 nanocrystal with particle size of 80 nm (A), 120 nm (B), 400 nm (C) and 700 nm (D) (bar=500 nm)
3 讨论
3.1 制备方法的选择
纳米混悬剂的制备方法有很多种,但总体来讲可分为“Bottom up”、“Top down”及二者的联用[-]78。“Top down”法是大粒子在机械力的作用下碎裂变成小粒子,包括研磨法和高压匀质法等,但这类方法存在一些问题,例如,球磨法在粉碎过程中会对样品造成污染,产品溶液黏着在球珠表面或球磨腔内表面;高压均质过程中的高温、高压、高能对于温度敏感型药物不适用。“Bottom up”法也称沉降法,其原理是基于药物在不同溶剂中的溶解性差异,使药物过饱和析出,并通过控制晶核形成和生长而得到纳米尺寸的药物晶体。该法操作简单、易控且重现性好,制备过程中未引入高温、高压,从而避免了药物降解及对仪器的污染。因此,本文选择沉降法和逆向沉降法制备纳米裸晶。
3.2 纳米裸晶制备的影响因素
纳米混悬液的形成分为2个阶段:晶核形成和晶体的生长,二者共同决定晶体的质量[]9。过饱和度是晶核形成的推动力,搅拌能加速晶核生成和晶体生长,温度可促进表面化学反应速度的提高,增加结晶速度,因此实验中分别对溶剂和反溶剂的比例、药物质量浓度、有机相温度、注入速度及搅拌速度进行考察。
对于药物质量浓度与形成晶体大小的关系,研究者们持有不同的观点。Mersmann等[]10认为药物质量浓度大,过饱和度高,成核快且成核率高,则形成晶体粒径较小;而Rodriguez等[]11研究表明药物质量浓度小,体系黏度低,在两相界面上形成的晶核少,对溶剂向反溶剂的扩散影响小,所得粒径小。本文实验结论与后者相似,作者认为这可能是药物性质、溶剂黏度和药物质量浓度综合作用的结果。
3.3 PI值的作用
近年来,文献中多采用PI值评价制剂粒径的均一程度。当PI<0.1时,系统为单分散体系或近单分散体系;PI在0.1~0.25内,粒径分布较窄;当PI>0.7时,体系的尺寸分布非常宽,很可能不适合光散射的方法分析[]12。本实验中制备的制剂PI均小于0.3,可认为是均匀体系。但在制剂评价中,也要注意大粒子浮于制剂表面或沉于底部时,测定的PI值可能很小。因此,在判定制剂中粒子分布时,除以PI值为指标外,还要结合制剂的外观综合进行判断。
[1] RABINOW B E. Nanosuspensions in drug delivery[J]. Nat Rev Drug Discov, 2004, 3(9): 785-796.
[2] GHOSH I, BOSE S, VIPPAGUNTA R, et al. Nanosuspension for improving the bioavailability of a poorly soluble drug and screening of stabilizing agents to inhibit crystal growth[J]. International Journal of Pharmaceutics, 2011, 409(1/2): 260-268.
[3] ZHANG Ji-yao, SHEN Zhi-gang, ZHONG Jie, et al. Preparation of amorphous cefuroxime axetil nanoparticles by controlled nanoprecipitation method without surfactants[J]. International Journal of Pharmaceutics, 2006, 323(1/2): 153-160.
[4] ZHANG X, XIA Q, GU N. Preparation of All-Trans Retinoic Acid Nanosuspensions Using a Modified Precipitation Method[J]. Drug Development and Industrial Pharmacy, 2006, 32(7): 857-863.
[5] BABA K, PUDAVAR H E, ROY I, et al. New Method for Delivering a Hydrophobic Drug for Photodynamic Therapy Using Pure Nanocrystal Form of the Drug[J]. Molecular Pharmaceutics, 2007, 4(2): 289-297.
[6] 王范, 孙姣, 邓意辉. 辅酶Q10纳米混悬剂的粒径和溶解度之间的关系[J]. 沈阳药科大学学报, 2010, 27(12): 933-939.
[7] MLLER R H, JACOBS C, KAYSER O. Nanosuspensions as particulate drug formulations in therapy: Rationale for development and what we can expect for the future[J]. Advanced Drug Delivery Reviews, 2001, 47(1): 3-19.
[8] ZHANG Hai-xia, WANG Jie-xin, ZHANG Zhi-bing, et al. Micronization of atorvastatin calcium by antisolvent precipitation process[J]. International Journal of Pharmaceutics, 2009, 374(1/2): 106-113.
[9] 艾萍, 金义光, 王林. 药物传送中的纳米混悬液[J]. 国外医学药学分册, 2005, 32(1): 61-63.
[10] MERSMANN A, L FFELMANN M. Crystallization and precipitation: the optimal supersaturation[J]. Chemical engineering & technology, 2000, 23(1): 11-15.
[11] GALINDO-RODRIGUEZ S, ALL MANN E, FESSI H, et al. Physicochemical parameters associated with nanoparticle formation in the salting-out, emulsification-diffusion, and nanoprecipitation methods[J]. Pharmaceutical Research, 2004, 21(8): 1428-1439.
[12] 陈莉, 汤忞, 陆伟根. 纳米混悬剂粒径稳定性及其控制策略[J]. 世界临床药物, 2010, 31(4): 245-249.
Preparation and characterization of Coenzyme Q10naked nanocrystal
SUI Yue1, SUN Jiao2, WANG Chun-ling1, WANG Yu1, CHENG Xiao-bo1, DENG Yi-hui1*
(1. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China;2. Hengrui Medicine Corporation, Jiangsu 222000,China)
ObjectiveTo prepare stable CoQ10naked nanocrystal without any surfactant or polymer. Methods CoQ10naked nanocrystals were prepared by precipitation method and anti-precipitation method. The laser light scattering technique, zeta potential analyzer and TEM were employed to study the physicochemical properties of naked nanocrystal. Results Naked nanocrystals with different sizes ranging from 80 nm to 700 nm were prepared. The zeta potential of nanocrystals with the size of (82.6 ± 5.4)、(118.2 ± 14.5)、(388.6 ± 19.8) and (675.1 ± 53.4) nm were -(34.20 ± 0.47)、-(29.23 ± 0.34)、-(17.68 ± 0.37) and - (6.54 ± 1.78) mV, respectively. TEM images show that nanocrystals were spherical. Conclusions Through optimizing the formulations and preparation conditions, CoQ10naked nanocrystals were successfully prepared without stabilizer.
pharmaceutics; naked nanocrystal; precipitation method; anti-precipitation method; coenzyme Q10; size
R 94
A
(2014)03–0073–08
(本篇责任编辑:马丽丽)
2014–03–12
隋月(1989-),女(汉族),吉林农安人,硕士研究生,E-mail suiyue629@163.com;*通讯作者:邓意辉(1964-),男(汉族),湖南花垣人,教授,博士,主要从事靶向制剂的研究,Tel. 024-23986316,E-mail dds-666@163.com。
