光照对螺旋藻生长速率的影响*
2014-06-14李永强陈清香师文庆熊正烨李思东李高荣凌旭炜
李永强,陈清香,师文庆*,熊正烨,李思东,李高荣,凌旭炜
(1.广东海洋大学 a.理学院;b.海洋与气象学院,广东 湛江 524088;2.广州市格棱生物科技开发有限公司吴川生物养殖基地,广东 吴川 524000)
螺旋藻(Spirulina)是一种具有重要开发应用价值的自养原核生物。它具有光合效率高、生长繁殖快和对环境适应性强等特点,是少数能大规模培养的微藻之一[1]。国内外研究表明,螺旋藻具有抗疲劳、抗辐射、抗病毒、抑肿瘤、增强免疫力等多种功能,这使螺旋藻及其活性成分在功能性食品的研究与开发方面有广阔的应用前景[2-4]。
在螺旋藻的形态、繁殖习性、氮素营养、藻种保存、生产条件及分类等方面,已有许多研究报导[5-8],而关于光照对螺旋藻生长影响的研究大多数集中在光照时间和光照强度,光照波长对螺旋藻生长影响方面少见报道。本文研究在LED灯照射下,光照波长对螺旋藻生长速率的影响,为螺旋藻养殖业提供参考。
1 材料与方法
1.1 材料
1.1.1 藻种 藻种为钝顶螺旋藻,采自广州市格棱生物科技开发有限公司吴川生物养殖基地。
1.1.2 培养液 采用Zarrouk培养液作为基本培养液,再加少量微量元素溶液A5和B6,三者的比例(v/v):1000∶1∶1。Zarrouk 培养液的组成(g/L)[9]:NaHCO3,16.80;NaNO3,2.50;NaCl,1.00;KH2PO4,0.41;K2SO4,1.00;MgSO4·7H2O,0.20;CaCl2·2H2O,0.04;FeSO4·7H2O,0.01;EDTA,0.08。微量元素溶液A5的组成 (g/L):H3BO3,2.86;MnCl2·4H2O,1.80;MoO3,0.01;ZnSO4·7H2O,0.22;CuSO4·5H2O,0.08。微量元素溶液 B6 的组成(mg/L):NH4VO3,22.90;NiSO3·7H2O,47.80;NaWO4,17.90;Ti2(SO4)3,40.00;Co(NO3)2 ·6H2O,4.40。
1.2 方法
1.2.1 实验藻体原液的培养 将藻种和培养液按体积比1∶20置于大小为100 cm×50 cm×50 cm的玻璃培养缸中,在上方以两根30 W的日光灯照射培养,光照周期 L∶D=12 h∶12 h,用12 W 的涡轮搅拌器搅拌,搅拌周期为10 min/h。将藻液培养至该实验条件下的最大浓度,作为实验的藻体原液。
1.2.2 螺旋藻的形态观察 吸取藻体原液少许滴在载玻片上,置于显微镜下,放大100倍观察螺旋藻的形态。
1.2.3 标准曲线制作 取100.00 mL的藻体原液,经已知干重的滤纸过滤,对滤得的藻泥用蒸馏水冲洗数次,以洗去藻体表面吸附的盐分,沥干后放入烘箱80℃真空干燥至恒重,计算得到藻体原液的螺旋藻干物质含量为1.240 g/L。
分别吸取 10.00 mL、25.00 mL、40.00 mL、55.00 mL、70.00 mL、85.00 mL、100.00 mL 藻体原液于相应编号的100 mL容量瓶中,加培养液至刻度线,摇匀。在560 nm波长下测定光密度(Optical Density,简称OD),结果见表1。
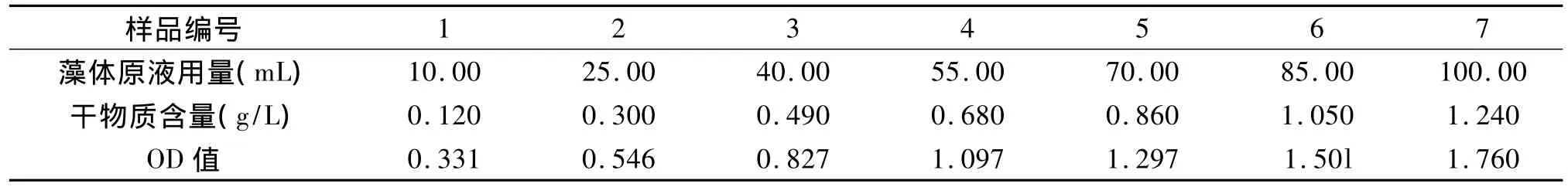
表1 OD值与螺旋藻干物质含量的关系Tab.1 The relationship of optical density and dry matter content of spirulina
1.2.4 螺旋藻生长曲线试验 在1000 mL锥形瓶中加入500 mL用培养液稀释了20倍的藻液,在培养箱中日光灯照射培养,光照强度6000 lx,光照周期 L∶D=12 h∶12 h,轻微搅拌培养 12 d。每天10∶00用分光光度计在560 nm处测定OD值。
1.2.5 不同波长光照对螺旋藻生长的影响试验
(1)在编号为 A、B、C、D 的四个 1000 mL锥形瓶,分别加入500 mL稀释了20倍的藻液,置于光照培养箱中培养,光照强度6000 lx,光照周期L∶D=12 h∶12 h,轻微搅拌培养 12 d。
(2)每天在 18∶00-20∶00 时 A、B、C、D 四个样品采用不同波长 LED灯光照,对A作红色(650-675 nm)照射处理,对B作绿色(520-545 nm)照射处理,对C作蓝色(450-475 nm)照射处理,对D不作任何处理。
(3)每天10∶00用分光光度计在560 nm处测定OD值,比较四个锥形瓶中螺旋藻的生长情况。
2 结果与讨论
2.1 螺旋藻的形态
图1是螺旋藻的显微镜图。由图可见,螺旋藻呈蓝绿色,为丝状体藻丝螺旋状,藻丝长500-650 μm,藻丝直径约29 μm,顶端钝圆或略尖细,末端细胞宽圆形。

图1 螺旋藻的显微镜图(放大100倍)Fig.1 The microscope figure of spirulina( ×100)
螺旋藻螺旋结构的形态受光照强度及养殖温度的调控。较强光照和较高温度均能引起螺旋藻的螺旋结构变紧,螺间距减小;强度较小的光照和较低的温度则使螺旋藻的螺旋结构变松,螺间距增大[10]。本实验主要是在实验室内进行,光照强度较小,温度为25℃(螺旋藻生长的最适温度为25-35℃),因此螺旋藻的螺旋结构均较疏松,螺间距较大。
2.2 光密度(OD)与螺旋藻干物质含量(C)的关系
按表1数据,以螺旋藻的干物质含量C为横坐标,OD值为纵坐标,得图2标准曲线,回归方程为OD=1.280C+0.1831,相关系数 R2=0.9973。
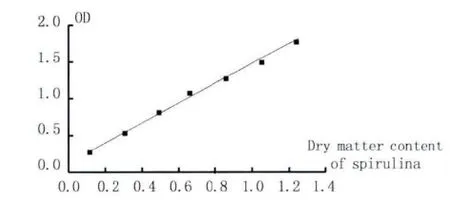
图2 标准曲线Fig.2 Standard curve
从图2的标准曲线可以看出,螺旋藻液的干物质含量与其OD值在C=0.1-1.3 g/L时呈良好的线性关系,故可用OD值作为衡量螺旋藻生物量的标准,通过藻液的OD值直观地反映出螺旋藻的生长情况。
2.3 螺旋藻生长曲线
图3是用日光灯照射培养螺旋藻的生长曲线,随着养殖时间增加,螺旋藻干物质含量呈上升趋势;在2 d~5 d生长速率较慢,为缓慢增长期;在5 d~11 d生长速率较快,呈对数增长,为快速增长期;在11 d达到了生长的最大浓度,干物质含量为0.742 g/L,是初始含量的7倍。
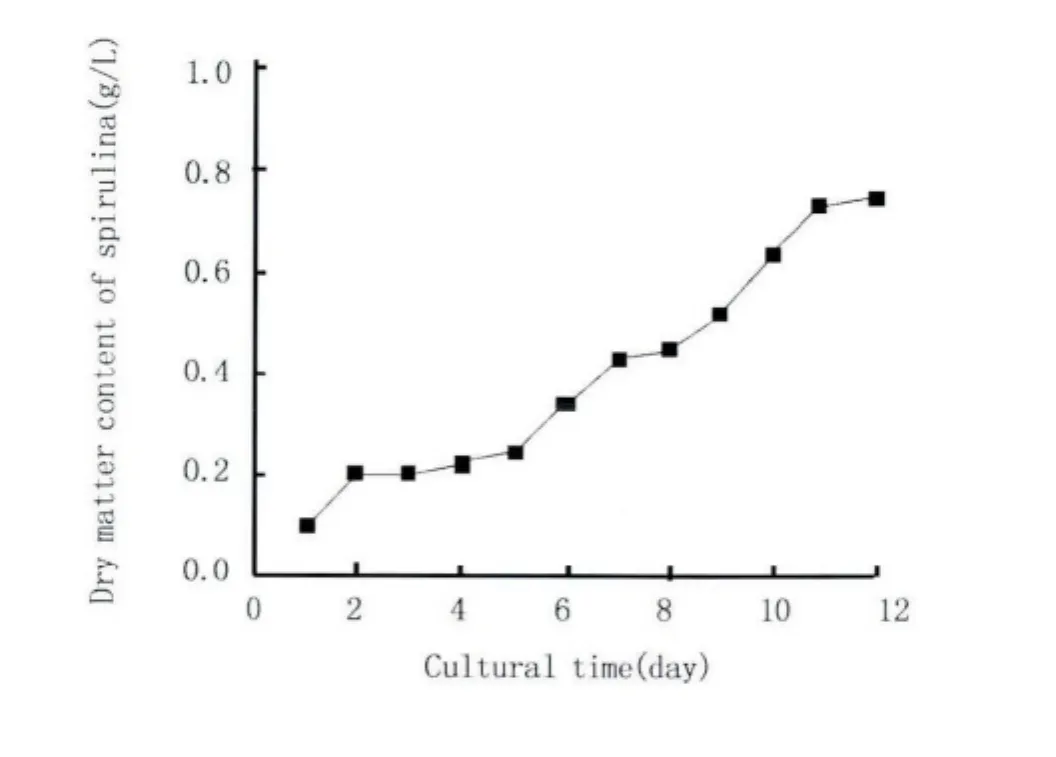
图3 螺旋藻生长曲线Fig.3 Spirulina growth curve
2.4 光照波长对螺旋藻生长的影响
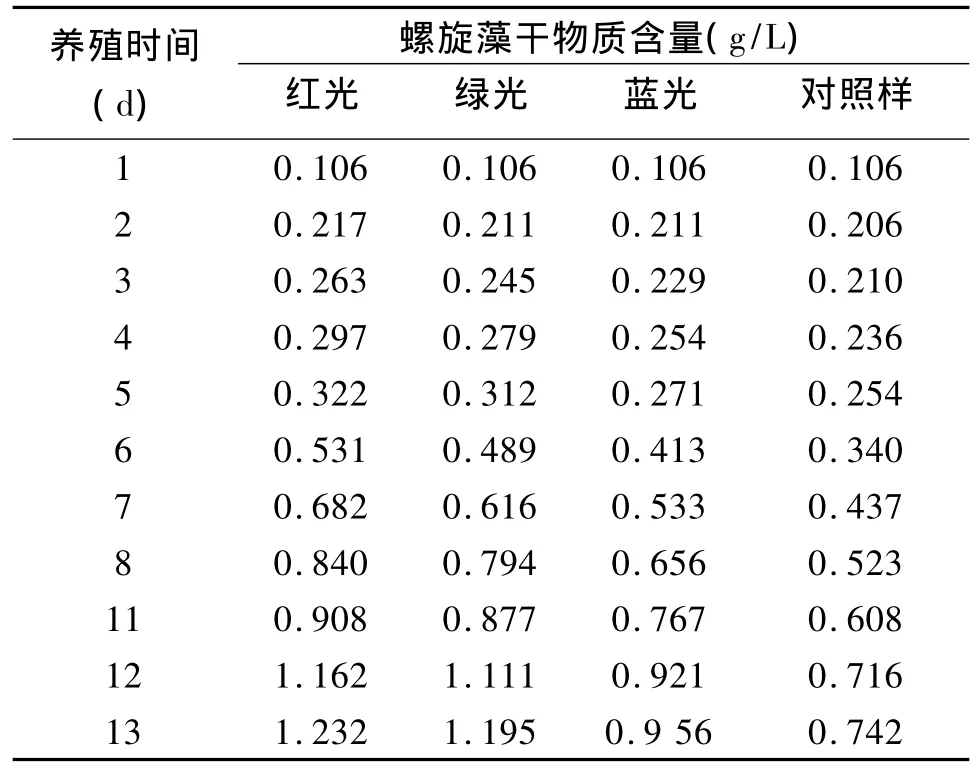
表2 光照波长对螺旋藻生长的影响Tab.2 Effect of light wavelength on the growth of spirulina
由表2数据画图得图4,对照样采用日光灯照射。从表和图可以看出,采用红绿蓝光处理过的螺旋藻生长量明显高于对照样。经过13 d养殖,螺旋藻干物质含量到达最大,红光处理的为1.232 g/L,绿色处理的为1.195 g/L,蓝色处理的为0.956 g/L,对照样的为0.742 g/L。红光处理过的螺旋藻干物质含量最大,比对照样增加了66.04%。
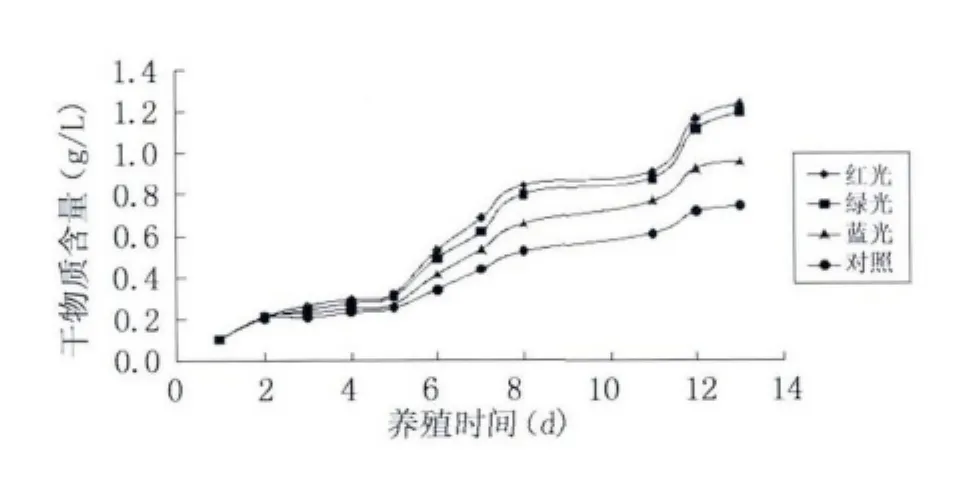
图4 不同光照处理螺旋藻的生长曲线Fig.4 Growth curves of different light treatment of spirulina platensis
从波长考虑,红光(650-675 nm)波长最大,绿光(522-532 nm)第二,蓝光(465-475 nm)第三,较长波长的光有利于螺旋藻的生长,在红光下生长的螺旋藻光合效率最高,干物质积累最多,这与鱼腥藻的研究结果一致[11]。
3 结论
(1)螺旋藻呈蓝绿色,为丝状体,藻丝螺旋状,螺旋直径为 29 μm,长度为 500-650 μm。
(2)螺旋藻的光密度标准曲线是:OD=1.280C+0.1831。
(3)螺旋藻生长速度较快,在经过一个12 d的生长周期后,浓度达到最初浓度的7倍。
(4)经红绿蓝光处理的螺旋藻生长量明显高于对照样,红光最好,生长量比对照样增加了66.04%。
[1]SANTILIAN C.Mass production of Spirulina[J].Experimentia,1982,38(1):40-43.
[2]张文,吴清平,吴军林.螺旋藻营养保健价值及开发应用进展[J].食品与发酵科技,2013,(3):89-93.ZHANG Wen,WU Qingping,WU Junlin.The nutrition health value and research progress of spirulina[J].Food and Fermentation Technology,2013,49(3):89-93.
[3]王继平,任景文,武爱民.螺旋藻营养和保健功效概述[J].包头医学,2012,36(3):145-147.WANG Jiping,REN Jingwen,WU Aimin.A summary on nutrition and healthcare function of spirulina[J].Journal of Baotou Medicine,2012,36(3):145-147.
[4]吴文龙,杨志娟.螺旋藻保健食品的功能因子与研究开发进展[J].食品研究与开发,2006,27(2):129-131.WU Wenlong,YANG Zhijuan.The material base and present situation of research and development in Spirulina platensis functional foods[J].Food Research and Development,2006,27(2):129-131.
[5]陈新美,梅兴国,房伟,等.用CO2饱冲氢氧化钠替代碳酸氢钠培养螺旋藻的研究[J].中国食品添加剂,2013,(3):84-89.CHEN Xinmei,MEI Xinguo,FANG Wei,et al.CO2substitutes NaHCO3in NaOH solution for culturing spirulina[J].China Food Additives,2013,(3):84-89.
[6]巩东辉,乔辰.温度对螺旋藻呼吸作用的影响[J].内蒙古科技大学学报,2010,29(1):73-75.GONG Donghui,QIAO Chen.Effects of temperature on the respiratory of spirulina[J].Journal of Inner Mongolia University of Science and Technology,2010,29(1):73-75.
[7]陈必链,江贤章,王娟,等.光生物反应器中螺旋藻培养条件的优化[J].植物资源与环境学报,2005,14(2):19-22.CHEN Bilian,JIANG Xianzhang,WANG Juan,et al.Optimization of cultural conditions of spirulina platensis in stirred photobioreactor[J].Journal of Plant Resources and Environment,2005,14(2):19-22.
[8]刘娟妮,王雪青,庞广昌.温度和光照对极大螺旋藻多糖含量和SOD酶活力的影响[J].食品工业科技,2008,(9):132-134.LIU Juanni,WANG Xueqing,PANG Guangchang.Effects of temperature and light on content of polysaccharides and activity of SOD in spirulina maxima[J].Science and Technology of Food Industry,2008,(9):132-134.
[9]ZARROUK.Contribution a Letude D’une Cyanophycee.Influence de divers factours physiques.et chimiques sur la croissance et la phytosynthese do spirulina maxima[D].French:University of Paris,1966.
[10]WU H,GAO K,MA Z.Effects of solar ultraviolet radiation on biomass production and pigment contents of Spirulina platensis in commercial operations under sunny and cloudy weather conditions[J].Fisheries Science,2005,71(2):454-456.
[11]宋云,唐崇钦,匡廷云,等.不同光质下生长的满江红叶绿体和共生者满江红鱼腥藻的吸收光谱和荧光光谱的研究[J].植物生理学报,1983,(1):69-76.SONG Yun,TANG Chongqin,KUANG Tingyun,et al.The effects of light quality on absorption spectra and flourescence spectra of Anabaena azollae and chloroplasts of azolla imbricate roxb nakai[J].Acta Phytophysiologia Sinica,1983,(1):69-76.
