正常和癌变胃粘膜组织的共焦拉曼光谱初探*
2014-06-14代剑华周学谦刘云杰彭贵勇
陈 瑶,代剑华,张 华,周学谦,刘云杰,彭贵勇*
(1.第三军医大学西南医院全军消化病研究所,重庆 400038;2.中国科学院重庆绿色智能技术研究院跨尺度制造技术重点实验室,重庆 400714)
0 引言
胃癌是人类最常见的癌症之一,在癌症相关死亡率中位居第二。而胃癌的早期发现和预后密切相关。早期胃癌的5年存活率大于90%,而一旦有深层胃壁浸润或有局部淋巴结累及,5年生存率降至20-30%[1-3〛。因此早期发现在提高胃癌的存活率中具有重大意义。
胃癌的检测主要依靠影像学及内窥镜,诊断的金标准则是病理活检。我们已知,影像学检测大多都是在组织形态发生异常改变后才可以探测到,PET-CT(正电子发射计算机断层显像)虽然可以检测组织细胞的代谢改变,但分辨率也只有4-7 mm,且假阳性较高,费用昂贵。内窥镜下活检部位的选择依靠内镜医师的主观判断,且活检有出血、转移的风险。拉曼光谱可以对生物样品进行实时、快速检测,不受水的干扰,适用于体内活体诊断。不但对结构改变敏感,可以反映物质内部分子生化改变,且光谱图简单,谱峰锐利,利于分析。之前对乳腺癌、皮肤癌、喉癌等组织的拉曼光谱相关研究显示,正常和癌变组织的拉曼光谱存在明显差别[4-7〛。本研究对正常和癌变粘膜组织的拉曼光谱进行分析研究,为拉曼光谱用于临床检测研究奠定基础。
1 实验材料和方法
1.1 拉曼光谱设备
激光共聚焦显微拉曼光谱仪(RENISHAW):二极管激光器,激发波长785 nm,分辨率1-2 cm-1,最大激发光功率约300 mW,最大波谱范围100-3200 cm cm-1,光栅:1200、1800、2400,并配置有高性能 Leica显微镜,XYZ三维样品台等。
1.2 标本收集

图1 激光共聚焦显微拉曼光谱仪(RENISHAW)Fig.1 Laser confocal microscope raman spectrometer
标本均来自2012-2013年于西南医院行胃镜检查的患者。检查前均取得患者知情同意并签署相关知情同意书。本研究已通过伦理委员会的审查。共收集19例正常胃粘膜组织和12例胃癌粘膜组织。包括17男14女、平均年龄55.55±14.73岁,标本采集后立即置入1.8 mL冻存管封装后置入冰块中保存,带至拉曼光谱实验室检测(标本检测时离体时间约1 h)。各标本均经病理确诊。
1.3 拉曼光谱测定
显微共焦拉曼光谱仪参数设置:曝光时间20 s,累积次数2次,激发光功率30 mW,光栅1200,波普采集范围800-1800 cm-1。测量前用硅片校准仪器。仪器校准后,将标本从冻存管中取出,平铺于载玻片上,对每例标本随机选取1个点进行采集,共获得31个拉曼光谱图(包括12个胃癌和19例正常)。激光共焦显微拉曼光谱仪如图1。
1.4 根据拉曼光谱原理及参考文献总结人体组织拉曼光谱谱峰归属
当入射光与样品分子发生能量交换(非弹性碰撞)则会产生频率发生改变的散射光,即拉曼散射。入射光的频率(v0)与散射光的频率(vib)之差即拉曼位移(△v,△v=v0-vib)。对于同一物质,拉曼位移只和样品分子的振动有关,与入射光的频率无关(拉曼位移即波数=1 cm/v0-vib)[8]。拉曼位移频率等于分子官能团的振动频率。组成分子的各种官能团如 C=O、C-N、C=C、C-H、苯环等都有其各自特定的拉曼位移峰,分子其他部分对该峰的位置影响很小,这种有特定峰形或较高强度的峰,代表某种特定官能团存在,称作官能团特征振动峰,峰所在的位置称特征振动波数。参考文献[9-18],总结人体组织拉曼光谱谱峰归属。
1.5 数据处理及分析
所获原始光谱数据均予以强度标准化、减掉基线背景等处理。并采用 spss、excell、NGS-Labspec等软件分析处理。寻找胃正常和癌变粘膜组织的拉曼特征峰,计算特征峰平均位移、相对峰强比等。比较分析相对峰强,结合两独立样本t检验,绘制ROC曲线等。
2 实验结果
2.1 人体组织拉曼光谱谱峰归属
具体归属见表1。

表1 人体组织的拉曼光谱谱峰归属Tab.1 Raman peaks assignment of human tissues
2.2 正常和癌变胃粘膜组织的拉曼特征峰分析
本次研究所测得正常和癌变胃粘膜组织的全部光谱分别如图2和3所示,平均光谱如图4和5所示。由平均光谱分析可见,癌变胃粘膜的拉曼光谱发生了明显改变。正常和癌组织中853 cm-1、939 cm-1、1004 cm-1、1128 cm-1处谱峰位置固定,表明测量前仪器校正准确,癌变组织的拉曼特征峰位移有意义。检测所获具体特征峰分布如下表2所示。由表可以看出,拉曼特征峰主要分布于800-1300 cm-1之间。除 1660 cm-1、1241 cm-1、1207 cm-1、1156 cm-1之外,正常胃粘膜组织特征峰相对强度大于胃癌。和正常相比,癌变胃粘膜中特征峰平均位移2.57 ±1.28 cm-1。除 829 cm-1、1800 cm-1发生了蓝移(向低波数移动)之外,癌组织特征峰主要发生了红移(与蓝移相反)。而我们已知红移主要是基团的活化、扭曲、吸附等,导致振动的能量减少;而蓝移则表示振动的能量增加,可能是引入了新的基团或化学键,或是由于周边的基团的活化,是其振动更加稳定。与正常组织相比,胃癌增加了特征峰1263 cm-1、1586 cm-1,同时减少了特征峰 956 cm-1、1172 cm-1。我们已知,这几个特征峰均表征蛋白质,提示癌组织内部蛋白质组成发生了改变。
2.3 相对峰强比区分正常和癌变胃粘膜组织
所有光谱的I1087cm-1/I1207cm-1如下表3所示。采用两独立样本的t检验,分析发现胃癌和正常胃粘膜相对强度比I1087cm-1/I1207cm-1在胃癌和正常胃粘膜组织中存在明显差别(P<0.05),胃癌中 I1087cm-1/I1207cm-1≥1.87(平均值 1.05 ± 0.30),而胃正常粘膜组织中 I1087cm-1/I1207cm-1<1.87(平均值 0.39±0.09)。I1087cm-1/I1207cm-1区分胃癌和正常胃粘膜组织的准确率、灵敏度和特异度分别为87.1%、83.3%、89.5%,如图6ROC曲线所示。

图2 胃癌的拉曼光谱(n=12)Fig.2 Raman spectrums of gastric cancer(n=12)
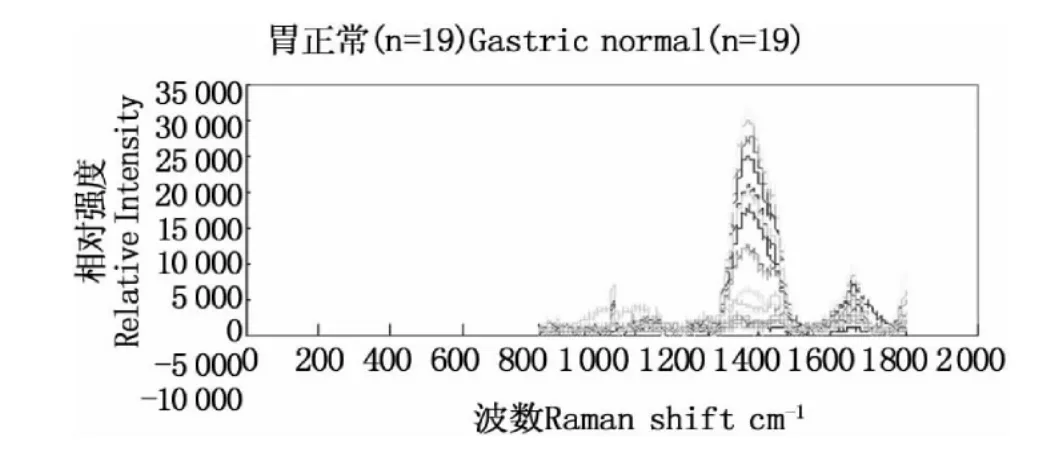
图3 胃正常粘膜组织的拉曼光谱(n=19)Fig.3 Raman spectrums of gastric normal tissues(n=19)

图4 胃癌和胃正常粘膜组织的平均拉曼光谱Fig.4 Average Raman spectrum of malignant and normal gastric tissues

表2 正常和癌变胃粘膜的拉曼特征峰Tab.2 Characteristic raman peaks of normal and malignant gastric tissues

图5 拉曼光谱(胃正常-胃癌,平均)Fig.5 Raman spectrum(gastric normal-cancer,average)
3 讨论
胃癌的发生伴随一系列生理生化代谢改变,如DNA解聚并大量复制、相关酶的合成等,其组分如蛋白质、脂质、核酸等大分子比例组成、内部化学键及分子之间官能团相互作用也随之改变,从而引起拉曼光谱呈现出相应特征性改变。不仅可以通过癌变特征光谱区分正常和癌变,而且可以探索发现癌变的分子起源。目前胃粘膜癌变的拉曼光谱检测分析逐渐引起研究者们的关注。代剑华等[19]提取正常胃粘膜、肠化胃粘膜、胃腺癌细胞基因组DNA进行拉曼光谱分析,推测三种细胞DNA的磷酸骨架链由稳定、不稳定发展到断裂。Z Huang等[20]研究发现正常胃粘膜和异型增生胃粘膜的拉曼光谱有特征性差别,如特征峰1450 cm-1及1305 cm-1的相对峰强在异型增生的胃粘膜中明显增加,I875cm-1/I1450cm-1作为诊断法则,鉴别异型增生和正常组织的灵敏度及特异度分别达到85.7%和80.0%。而我们已知胃粘膜癌变大都由异型增生发展而来。因此,我们对正常和癌变胃粘膜的拉曼光谱进行了初步分析研究。

表3 相对峰强比(I1087 cm-1/I1207 cm-1)Tab.3 Ratio of relative peak intensity(I1087 cm-1/I1207 cm-1)

图6 ROC曲线来自于两独立样本的t检验,曲线下面积为0.908,充分说明了I1087/I1207鉴别胃正常和癌变粘膜组织的有效性Fig.6 The receiver operating characteristic(ROC)curve generated from the two independent T-test,the integration area under curve(AUC)is 0.908,inllustrating the efficacy of I1087 cm-1/I1207 cm-1in differentiating malignant from normal gastric tissues
由此次研究中正常和癌变胃粘膜的拉曼光谱对比分析可以发现,在相同检测条件下,胃癌的总体拉曼峰强度小于正常胃粘膜组织。我们已知胃癌组织血供丰富,而红细胞富含卟啉,卟啉为强荧光物质,可能因此掩盖了部分拉曼信号。
与正常胃粘膜组织相比,胃粘膜癌变后特征峰主要向高波数移动,即发生了红移,振动能量降低。可能癌组织中分子内部化学键、官能团等有更多的振动模式,一致性降低,振动能量降低。提示组织细胞癌变中,不仅宏观形态如组织形态、细胞排列、细胞核结构等发生了异常,其微观组成如分子内部化学键、基团之间的相互作用等也发生了相应改变。进一步证实了拉曼光谱可以在分子生化水平跟踪监测癌变。
特征峰1263 cm-1、1586 cm-1仅在胃癌组织中出现,而正常组织中不明显。已知1263 cm-1来自于N-H的弯曲振动和C-H的伸缩振动[21],表明某种蛋白质的构型构象发生了改变,导致某些氨基酸侧链的暴露活化,出现了新的振动频移位点;也可能是由于癌组织细胞活跃的增殖过程中合成了某种新的蛋白质。相反,特征峰1172 cm-1、955 cm-1仅在正常胃组织中出现,而在胃癌中这两个特征峰不明显。已知1172 cm-1主要是来自芳香族氨基酸的C-H面内弯曲振动[15],提示胃癌组织中芳香族氨基酸与邻近分子相互作用增强;也可能是胃癌组织中芳香族氨基酸含量减少。我们已知组织细胞内部蛋白质的含量及种类非常丰富,我们的研究结果提示癌组织中蛋白质的组成比例、种类、构型等发生了改变。表明拉曼光谱在探索分析癌变组织细胞内部如蛋白质、DNA等大分子物质的相对含量、结构特征、存在状态中具有独特的优势。
由表3可见,与正常胃粘膜组织相比,I1087cm-1/I1207cm-1在胃癌中明显大于正常组织。而我们已知,1087 cm-1表征核酸,1207 cm-1表征蛋白质,提示相对于蛋白质,核酸相对含量增加更明显。反映了癌细胞有丝分裂活跃,核酸的含量明显增加。在随后深入的研究中,我们会增加样本量,进一步证实这个结论。
本研究通过对比分析胃正常和癌变粘膜组织的拉曼光谱差异,结合统计学分析,区分胃正常和癌变粘膜组织,并初步探索癌变相关的分子生化改变,主要结果如下:1.和正常相比,胃癌组织的拉曼特征峰主要向高波数发生位移,提示胃癌组织内部分子化学键或官能团的振动模式多样化。2.特征峰1263 cm-1和1586 cm-1仅在胃癌中出现,正常组织中不明显;与此相反,955 cm-1仅在正常组织中出现,而胃癌中不明显。提示胃癌组织内部大分子物质如蛋白质等的相对含量、构型构象、存在状态等发生了改变。3.相对峰强比I1087cm-1/I1207cm-1在胃癌和正常胃粘膜组织中存在明显差别(P<0.05),胃癌中 I1087cm-1/I1207cm-1≥1.87,其鉴别胃癌和正常胃粘膜组织的准确率、灵敏度和特异度分别高达87.1%、83.3%、89.5% 。
因此,拉曼光谱检测胃癌和正常胃粘膜组织,不仅可通过相对峰强比等鉴别癌变,还可通过光谱探索癌变组织细胞内部的分子生化改变。提示拉曼光谱在胃癌的跟踪监测、临床诊断和基础研究中具有良好应用前景。
[1]VIUDEZ-BERRAL A,MIRANDA-MURUA C,ARIAS-DE-LAVEGA F,et al.Current management of gastric cancer[J].Rev Esp Enferm Dig,2012,104(3):134-141.
[2]HU Y,FANG J Y,XIAO S D.Can the incidence of gastric cancer be reduced in the new century?[J].J Dig Dis,2013,14(1):11-15.
[3]HAGLUND U H,WALLNER B.Current management of gastric cancer[J].Journal of Gastrointestinal Surgery,2004,8(7):907-914.
[4]CHOWDARY M V,KUMAR K K,KURIEN J,et al.Discrimination of normal,benign,and malignant breast tissues by Raman spectroscopy[J].Biopolymers,2006,83(5):556-569.
[5]HAKA A S,SHAFER-PELTIER K E,FITZMAUR-ICE M,et al.Identifying microcal-cifications in benign and malignant breast lesions by probing differre-nces in their chemical composition using Raman spectroscopy[J].Cancer Res,2002,62(18):5375-5380.
[6]LUI H,ZHAO J,MCLEAN D,et al.Real-time Raman spectroscopy for in vivo skin cancer diagnosis[J].Cancer Res,2012,72(10):2491-2500.
[7]LI S X,CHEN Q Y,ZHANG Y J,et al.Detection of nasopharyngeal cancer using confocal Raman spectroscopy and genetic algorithm technique[J].J Biomed Opt,2012,17(12):125003.
[8]方容川.固体光谱学[M].北京:中国科学技术大学出版社,2001.FANG Rongchuan.Solid State Spectroscopy[M].Beijing:University of Science and Technology of China Press,2001.
[9]SURMACKI J,MUSIAL J,KORDEK R,et al.Raman imaging at biological interfaces:applications in breast cancer diagnosis[J].Mol Cancer,2013,12(1):48.
[10]ZHOU Y,LIU C H,SUN Y,et al.Human brain cancer studied by resonance Raman spectroscopy[J].J Biomed Opt,2012,17(11):116021.
[11]LESLIE D G,KAST R E,POULIK J M,et al.Identification of pediatric brain neoplasms using Raman spectroscopy[J].Pediatr Neurosurg,2012,48(2):109-117.
[12]OLIVEIRA A F,SANTOS I D,CARTAXO S B,et al.Differential diagnosis in primary and metastatic cutaneous melanoma by FT-Raman spectroscopy[J].Acta Cir Bras,2010,25(5):434-9.
[13]COUAPEL J P,SENHADJI L,RIOUX-LEC-LERCQ N,et al.Optical spectroscopy techniques can accurately distinguish benign and malignant renal tumours[J].BJU Int,2013,111(6):865-871.
[14]OLSZTYŃSKA-JANUS S,GąSIOR-GłOGOWSKA M,SZYMBORSKA-MAłEK K,et al.Spectroscopic techniques in the study of human tissues and their components.Part II:Raman spectroscopy[M].Acta Bioeng Biomech,2012,14(4):121-133.
[15]STONE N,STAVROULAKI P,KENDALL C,et al.Raman spectroscopy for early detection of laryngeal malignancy:preliminary results[J].Laryngoscope,2000,110(10 Pt 1):1756-1763.
[16]YANG J P,GUO J Y,WU L P,et al.Raman spectroscopic identification of normal and malignant human stomach cells[J].Chinese Optics Leters,2005,3(12):705-707.
[17]GELDER J D,GUSSEM K D,VANDENABEELE P,et al.Reference database of Raman spectra of biological molecules[J]. Journal of Raman Spectroscopy,2007,38(9):1133-1147.
[18]唐伟跃,刘婉华,孙雷明,等.肺癌切片的拉曼光谱分析[J].激光杂志,2007,28(3):91-93.TANG Weiyue,LIU Wanhua,SUN Leiming,et al.Analysis of cofocus laser raman spectrums of lung cancer[J].Laser Journal,2007,28(3):91-93.
[19]代剑华,彭贵勇,冉曾令,等.胃粘膜正常和癌变细胞基因组DNA的表面增强拉曼光谱研究[J].激光生物学报,2011,20(3):299-303.DAI Jianhua,PENG Guiyong,RAN Zengling,et al.A study of normal mucosa and gastric carcinoma cell genome DNA using surface enhanced raman spectroscopy[J].Acta Laser Biology Sinica,2011,20(3):299-303.
[20]TEH S K,ZHENG W,HO K Y,et al.Diagnostic potential of near-infrared Raman spectroscopy in the stomach:differentiating dysplasia from normal tissue[J].Br J Cancer,2008,98(2):457-465.
[21]NIJSSEN A,BAKKER SCHUT T C,HEULE F,et al.Discriminating basal cell carcinoma from its surrounding tissue by Raman spectroscopy[J].J Invest Dermatol,2002,119(1):64-69.
