大豆超高产育种研究进展的讨论
2014-06-12,
,
(1.黑龙江省农业科学院 大豆研究所,黑龙江 哈尔滨 150086;2.国家大豆改良中心 牡丹江试验站,黑龙江 牡丹江157041;3.南京农业大学大豆研究所/国家大豆改良中心/农业部大豆生物学与遗传育种重点实验室(综合)/作物遗传与种质创新国家重点实验室,江苏 南京 210095)
0 引 言
20世纪80年代,日本提出超高产水稻育种计划,用15 a时间育成相对产量比对照品种增产50%的超高产品种[1-2]。1989年国际水稻研究所(IRRI)也正式启动了“新株型”(NPT)水稻育种计划[3]。中国水稻超高产育种即超级稻研究始于20世纪80年代中期,被正式纳入国家“七五”和“八五”期间重点科技攻关计划[4]。在超级稻育种启迪下,盖钧镒主持的“八五”国家大豆育种攻关开展了大豆超高产育种研究,并制定了育种目标。即国内大豆主产区高产指标分别为,西北灌区5.63 t·hm-2、东北4.88 t·hm-2、黄淮海4.50 t·hm-2、南方3.75 t·hm-2,由此拉开了我国大豆超高产育种的序幕。经15 a的努力各地区均实现了各自的超高产目标,但重演的不多,大豆超高产育种取得阶段性成果,见表1。
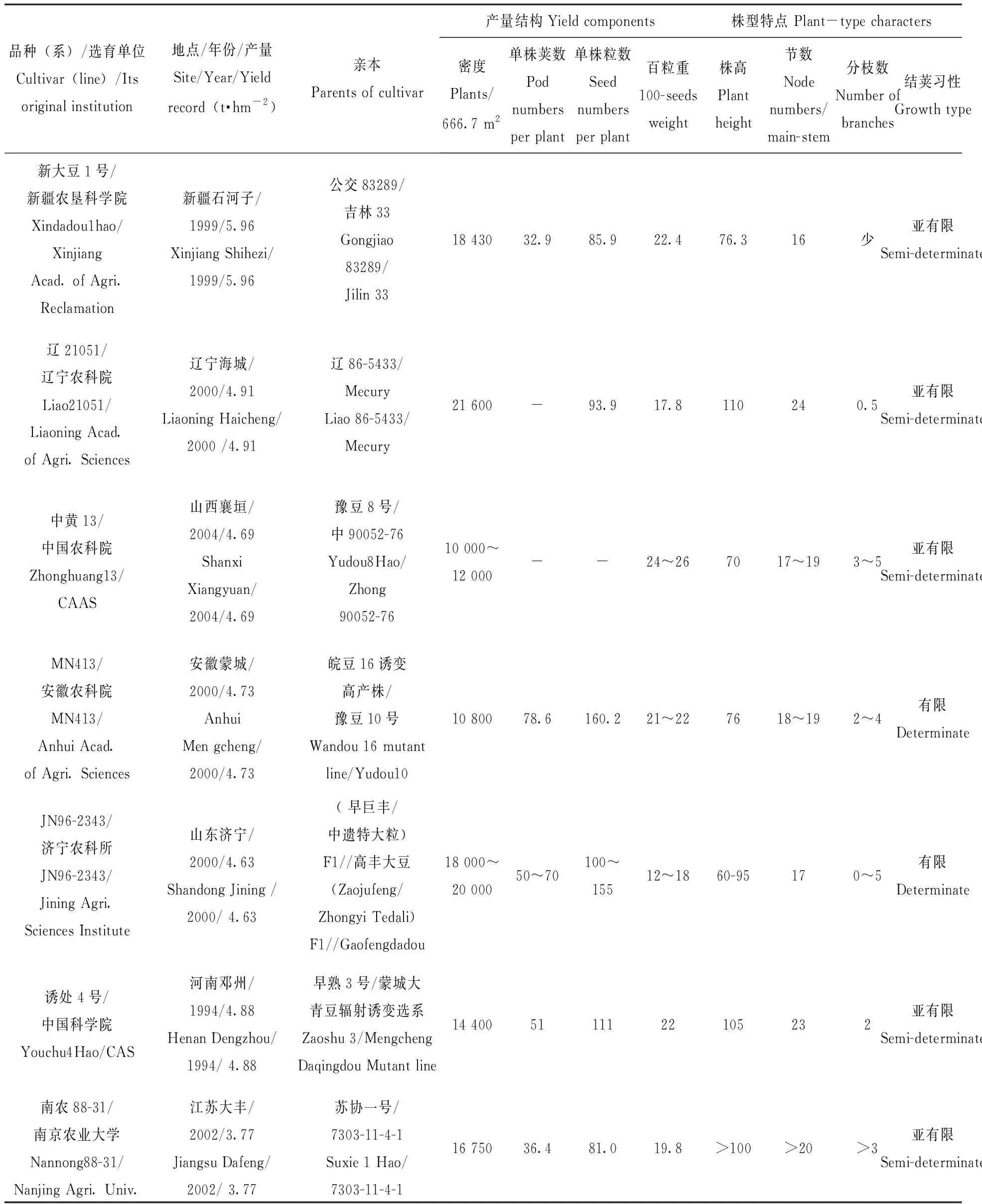
表1 中国不同地区获超高产记录的大豆品种及其特性Tab.1 The cultivars with super high-yield record in China and their major performances
1 大豆产量相对上限与超高产育种目标
1.1 大豆产量相对上限
人们较普遍认同的是从能量利用率的角度推测作物产量界限。杜维广等[5]以能量论观点推算大豆最高产量相对上限理论光能利用率的最高值为1.5%~2.4%,即最高产量约为6.00 t·hm-2~9.59 t·hm-2,该产量是现阶段在大豆水分以及无机养分充分供应,病虫害、杂草等得到控制的条件下才可能达到。
大豆产量界限是伴随着作物产量理论研究深入、生产水平和土壤耕作条件的不断改善而变化的。目前我国大豆生产水平光能利用率仅为0.45%~1%。可见我国大豆品种产量潜力空间很大。
1.2 大豆超高产育种目标
2005年,盖钧镒主持国家大豆改良中心召集全国大豆改良分中心一起商讨我国大豆超级豆培育事宜,提出我国大豆超高产育种目标。第一阶段(2006年-2010年)西北灌区、东北春大豆区、黄淮海春夏大豆区、南方多播季大豆区“大豆超级种”要求产量分别达到6.15 t·hm-2、4.95 t·hm-2、4.65 t·hm-2和3.90 t·hm-2。品质指标达大豆二级(行业标准),抗当地主要大豆病(虫)害,耐当地主要逆境。第二阶段再选育出比第一阶段高产品种增产15%以上的新品种。绝对指标是在较大面积(0.667 hm2)达到西北6.75 t·hm-2、东北5.70 t·hm-2、黄淮海5.40 t·hm-2、南方4.50 t·hm-2的高产指标[6]。2009年在辽宁,中黄35产量达到4.50 t·hm-2的产量指标。
2 大豆品种超高产有关的生物量、表观收获指数、生育期及花荚脱落性状
生物量、表观收获指数、生育期和花荚脱落性状是产量的重要相关性状。提高大豆品种产量人们容易从提高某种产量构成因素(单株荚数、粒数、百粒重)为切入点来实现提高大豆产量目标。这在某种程度上走进“发育研究法”的误区[7],实践证明这种选择结果,产量并没有明显改良,而只是形态结构发生改变。从生理、生态学观点看,产量形成受遗传控制的3个主要生理组分所支配:① 净干物量的积累;② 收获指数;③ 达到收获期的生育时间[8]。众所周知,较大的总干物量、较高的收获指数和较长的生育期;源(光合)- 流(光合产物运转)- 库(籽粒)协调是超高产形成的基础。大豆花荚脱落普遍存在于大豆生殖生长过程中,是影响产量提高的重要因素之一。大豆花荚脱落率可达30%~80%[9],实验和实践证明,通过降低花荚脱落率,提高大豆籽粒生产的潜力很大[10]。
2.1 生物量、表观收获指数和生育期性状研究
杜维广等[11]研究了大豆转化系数及产量间的相关,研究结果显示可以通过表观收获指数的选择,获得经济系数、实际收获指数、粒茎比和产量增益,它可作为高光效育种衡量产量的指标,见表2。
黄中文等[12]利用亲本间生物量、收获指数和产量有较大差异的南农1138-2和科丰1号杂交衍生的大豆重组自交系(NJR1KY),研究始花期(R1)、始荚期(R3)、始粒期(R5)、收获期生物量以及表观收获指数和产量的相关,结果表明:生物量与产量呈显著曲线相关,相关程度从R1、R3、R5期到收获期逐渐增加;表观收获指数与产量以0.42为转折,表现为先正变后负变关系(仅限于本实验)。晁毛妮等[13]研究指出,大豆鼓粒期的生物量与百粒重和单株籽粒产量存在极显著的正相关及共同的遗传基础。
生物量是植物基因型C、N积累能力、栽培措施、环境因素的综合结果[14],与后期籽粒产量有紧密的相关关系[15]。近年来,大豆育种家已经鉴定出许多与产量有关的QTL或SNP,主要关于成熟期、株高、百粒重和生长习性等与产量相关的性状[16-21]。但是,关于生育期内大豆生物量积累、收获指数和生育期构成产量形成的主要生理组分的研究却很少。
黄中文等[12]利用NJR1KY检测到产量、表观收获指数、收获期生物量有关的QTL分别为9个、10个、10个,其中两年稳定的QTL分别有2个、3个、3个。在9个产量QTL中的6个标记区间同时还检测到生物量积累、收获期生物量和表观收获指数的QTL,产量和生物量、表观收获指数具有部分共同的遗传基础。晁毛妮等[13]利用自然群体中的1142 SNP,在2年环境下通过全基因组关联分析检测大豆基因组中与生物量及产量组分显著关联的SNP。结果检测到41个、56个和29个SNP分别与生物量、百粒重和单株籽粒产量显著关联,其中仅有6个、19个和1个SNP在2个环境中都被检测到。共检测到15 SNP同时控制2个或2个以上性状,其中位于第19染色体上的BARC-029051-06057位点被检测到同时与生物量、百粒重和单株籽粒产量3个性状显著关联,表明共同的遗传基础,同时也解释了性状间相关的遗传原因。
大豆的生育期是大豆的生理特性在一定条件下的表现,是大豆重要的生态性状。经典遗传学研究发现了9个与开花期相关的基因[22-29],除与“长童期”相关的J位点[30]外,其余习惯称为E系列(E1至E8)基因;特别是E1、E3、E4与E7位点均与大豆光周期敏感性相关联[23-24,31-33]。夏正俊等[34-36]、刘宝辉等[37-38]及孔凡江等[39]与日本科学家原田久也及阿部纯领导的研究小组进行了长期合作,成功克隆了与大豆光周期反应相关E1、E2、E3、E4及GmFTs等生育期基因,并深入系统地研究了这些基因之间关系。
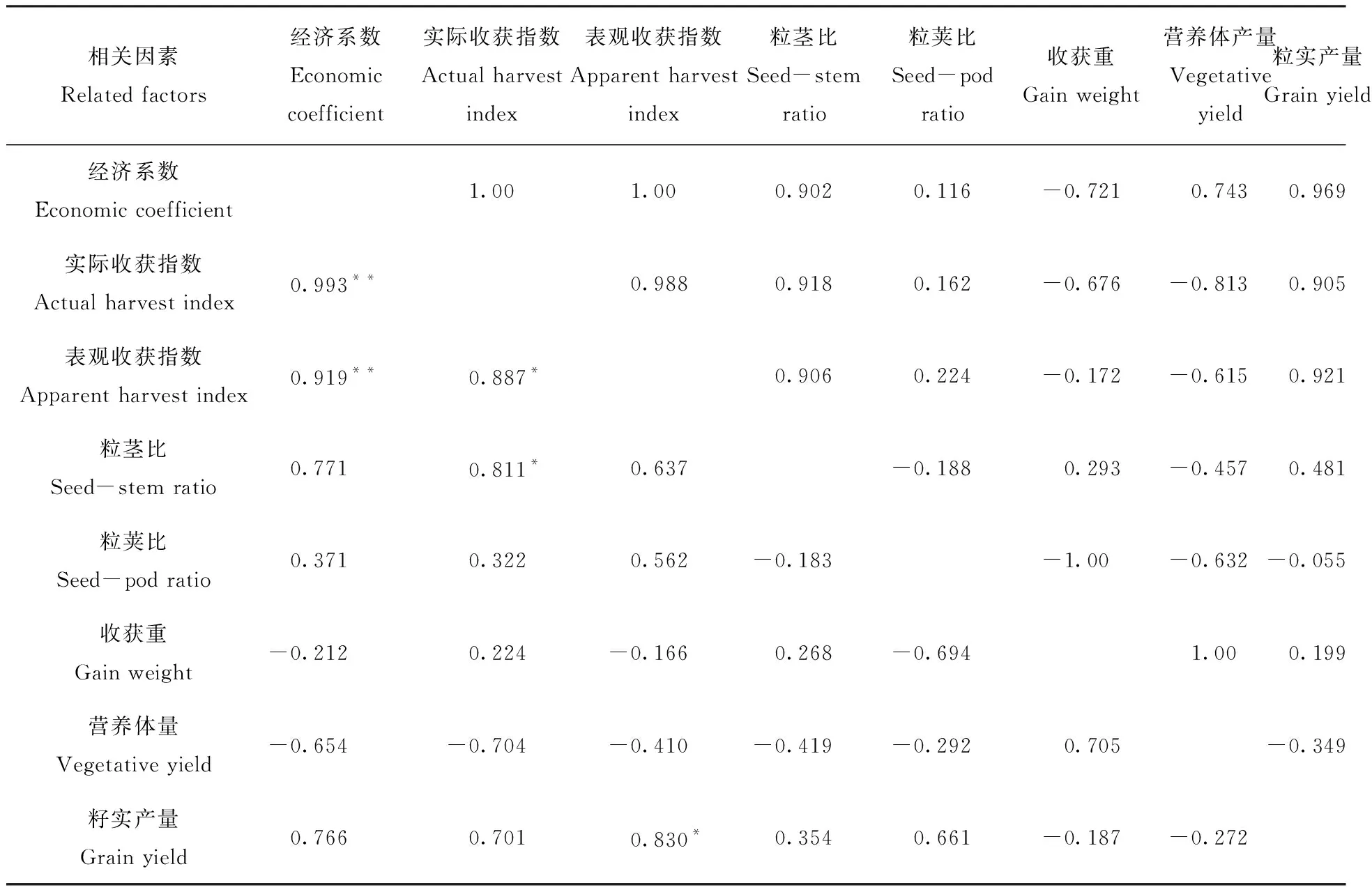
表2 大豆各转化系数及产量间的相关系数Tab.2 The correlation coefficient between conversion factor and yield of soybean
注:左下角为表观型相关系数,右上角为遗传相关系数。*表示5%显著水准,**表示1%显著水准。
2.2 花荚脱落性状与SSR标记关联分析
在拟南芥中,已鉴定出多个与离层发育和器官脱落相关基因,如影响花器的离层发育的KMAT/BP基因[40]和引发花器官脱落的IDA和HAESE基因[41]。并且解析了由AS1、AS2、JAG、KNAT/BP和FIL等组成的拟南芥果荚离层发育调控网络[42-44]。在水稻中,落粒性的分子机制研究已成功克隆了落粒性基因SH4、SHA1、qSH1和OsSH1[45-48]。大豆花数和荚数相关QTL定位方面取得了较大进展[49-50],但在花荚脱落基因定位方面研究尚少。王欢等[51]分别以2011年种植的104个和2012年种植的314个东北春大豆品种组成的两个自然群体为材料,选用分布于20个连锁群的205对SSR引物对供试材料进行基因型分析。结果共发现33个与大豆落花落荚相关的QTL,不同年际和不同种植密度间与花荚脱落性状关联的QTL不同。其中有4个QTL(Satt534、Satt452、Satt244和Satt478)在两年中都与大豆花荚脱落率相关,是较为可靠的QTL。并且已有报道称Satt452与大豆裂荚性状相关,也可能是影响大豆花荚脱落重要的QTL,可以进一步分析利用。
综上所述,因为大豆品种生物量、表观收获指数和生育期及花荚脱落性状是表型不易判断的与产量密切相关的生态性状,所以有必要对其深入发掘出对育种有价值超高产分子模块,应用于超高产育种。
3 超高产理想株型育种
3.1 超高产理想株型育种生理基础
盖钧镒[5]指出光能是地球上食物能源的终极来源。随着人口的大量增长,可用耕地面积的大量缩减,只有靠提高单位面积产量来增加总产,因而提出了超高产育种和超高产栽培的要求。实现超高产有赖于单位面积上光能利用效率的提高,包括光能截取的提高和光合效率的提高。因此,作物科学家提出了株型和群体结构的最优化问题。20世纪的绿色革命便是围绕株型带动光能利用效率而展开的。
关于中国大豆超高产株型育种研究概况分为三个阶段[6]。第一阶段,早期单一株型性状的研究:早期对大豆理想型的研究是估计产量和一系列形态、生理性状之间的相关,包括结荚习性、小而窄的小叶、直立叶、单位叶面积的光合速率等,这些性状被认为与光合作用及其最终产物(种子)产量有关,但并未发现它们有明显的相关[52]。第二阶段,盖钧镒在国内根据当时的品种研究性状间的相关去推论未来的“高产理想”的思路来探讨高产理想型的群体生理基础。通过7 a 8次试验比较不同产量水平大豆品种,结果表明高产类型的叶面积、光合速率、干物重、荚干重、粒干重在动态过程中比中、低产类型均较大,成熟时表现生物量及收获指数均较高;其营养生长期相对较短而生殖生长期相对较长,两者的重叠期也相对较短,其产量在空间的分布垂直方向为均匀型,水平方向为主茎型或主茎分枝并重型。由此对高产理想型的形态、生理组成做出推论。苗以农[53]从大豆产量构成因素、田间产量空间分布、产量形成和光合作用、花荚脱落率与营养生长和生殖生长的竞争等方面归纳大豆产量形成生理特点,提出高产特异株型。杜维广、郝廼斌、满为群在大豆高光效育种研究基础上,从大豆光能吸收、传递和转化、光合速率和RuBP羧化酶及C4途径酶系活性、光合产物运输和分配、光合作用时间等方面研究了超高产理想株型,并提出理想光合生态型构想。第三阶段:从超高产实践探索超高产理想株型。“八五”国家育种攻关计划提出创造高产基因型,从实现的高产结果来追溯验证理想株型的形态、生理及产量构成,并获得成功实例,见表1。
实现超高产的品种以有限、亚有限结荚为主,新大豆一号、中黄13、MN413、JN96-2343等品种表现半矮秆(株高70 cm~80 cm),而辽20051、诱处4号、南农88-31等品种则植株高大繁茂(株高>100 cm),品种株型紧凑,杆强抗倒,适宜密植,见表1。王岚等[54]研究了超高产大豆品种的产量构成:黄淮海及辽宁地区超4.50 t·hm-2的大豆产量构成:密度18.7 株·m-2~35.0株·m-2,株高73.6 cm~97.0 cm,节数16.6个~17.0个,单株荚数30.1个~56.2个,单株粒数71.2个~115.1个,单株粒重21.5 g~24.4 g,百粒重24.8 g~24.9 g,见表3。

表3 黄淮海及辽宁地区超4.50 t·hm-2的大豆产量构成Tab.3 Yield composition of soybeans over 4.50 t·hm-2 in Huanghuaihai and Liaoning
新疆地区超6.10 t·hm-2的大豆产量构成:密度28.3株·m-2~29.9株·m-2,株高52.4 cm~114.5 cm,节数11.8~16.8,单株荚数36.4个~47.5个,单株粒数94.3个~102.1个,百粒重20.0 g~22.1g。
张性坦等[55-56]对创造高产纪录的大豆品种诱处4号研究发现,该品种具有高光能生理特点,光合和抗光抑制能力强,株型紧凑,具有良好的受光态势。苗以农[57]从国内外几例大豆产量4.50 t·hm-2以上的高产品种特征概括提出超高产大豆群体生理生化特征。魏建军[58]在新疆灌区对中黄35超高产大豆群体的生理参数进行了研究,结果表明:中黄35和对照新大豆1号的最大叶面积指数(LAImax)分别为4.31和3.64,LAI大于3的天数分别持续50 d和36 d,全生期总光合势(LAD)分别为2 766 375 m2·d-1和2 385 645 m2·d-1;中黄35生育前期(出苗后第15 d ~ 58 d)群体的光合生产率为3.3 g·m-2·d-1~ 5.2 g·m-2·d-1,而后期(出苗后第72 d ~ 114 d)则为2.52 g·m-2·d-1~ 5.0 g·m-2·d-1;对照分别为3.8 g·m-2·d-1~ 6.0 g·m-2·d-1和0.6 g·m-2·d-1和3.5 g·m-2·d-1;中黄35的生物产量、籽粒产量和经济系数为13 943.2 kg·hm-2、5 521.5 kg·hm-2和0.396,对照则为13 108.1 kg·hm-2、4 666.5 kg·hm-2和0.356 3。与对照相比,中黄35最大叶面积指数持续时间长,全生育期的总光合势高,后期群体的光合生产率大,经济指数高是实现超高产目标的基础。
3.2 超高产理想型设计与实践
盖钧镒等[59]根据从当时品种研究性状间的相关去推论未来的“高产理想型”的思路来探讨高产理想型的群体生理基础,并由此在国内首先对高产理想型的形态、生理性状组成模式作出推论:① 成熟时的静态株型:高生物产量和收获指数、有限或亚有限生长习性、主茎上下结荚均匀,主茎型或主茎分支并重的空间产量分布。② 生育期过程中的动态生理模型:营养生长与生殖生长重叠期短;叶面积前期扩展快,达峰值时间短,后期下降缓慢,鼓粒期中上叶位功能期长,叶片光合速率高。并据此选育出大豆新品种南农88-31,其高产株型结构为亚有限结荚习性,分枝能力强,似塔式株型,结荚节数多,荚粒数多,呈主茎分枝并重的空间产量分布。2002年实现了3.75 t·hm-2南方夏大豆高产纪录。
杜维广在大豆高光效育种研究基础上,结合多年育种实践,依据目前大豆生产上群体结构概括为小群体(15 株·m-2~ 18株·m-2)、中群体(28株·m-2~ 35株·m-2)、大群体(40株·m-2左右),提出如下黑龙江省春大豆理想光合生态型模式,这仍有待实践验证。
小群体:中(半矮)杆,多分枝,节间短,有效节数多,塔型(复叶下披上半挺),杆强。Pn、PSII综合活力高、RuBPC、PEPC、PPDK活性高、叶片衰老迟、R6-R8时间长、花荚脱落率低、高收获指数、均匀主茎型或曲茎分枝并重型;根系活力高。并据此选育出半矮杆曲茎多分枝并重型新品系。
中群体:中高杆,节间短,有效分枝多,每节座荚多,塔型(复叶下披上挺),杆强。Pn、PSII综合活力高、RuBPC、PEPC、PPDK活性高、叶片衰老迟、R6-R8时期长、花荚脱落率低、高收获指数、均匀主茎型或曲茎分枝并重型;根系活力高。并据此选育出高光效高产品种黑农39、40、41等新品种。
大群体:半矮杆,节间短,有效节数多,每节座荚多、塔形(复叶下披上挺),杆强。Pn、PSII综合活力高、RuBPC、PEPC、PPDK活性高、叶片衰老迟、R6-R8时期长、花荚脱落率低、高收获指数、均匀主茎型或曲茎分枝并重型;根系活力高。并据此从黑农35突变体中选育出半矮杆新品系。
应该指出的是,以上模式应跟据不同的生态条件,因地制宜设计品种理想光合生态型模式,同时它和群体结构相互适应。
随着信息技术和精准农业的不断进步,近二三十a发展起来的虚拟植物研究应用于作物高光效株型育种的株型数字化设计。苏中滨等[60]提出通过计算机分析影响株型形态因素与植株形态的相关性,总结功能-结构-环境三者相关规律,构建能合理变化的可视化定量模型,并对给定条件以高光效为目标进行设计,将株型设计模式由定性化转变为定量化,并提出株型数字化设计方法。但是该方法部分流程处于理论设计阶段。大豆群体冠层生长是群体生理组成部分,对其产量有较大影响。吴琼等[61]进行高光谱遥感估测大豆冠层生长和籽粒产量的探讨,结果表明高光谱遥感对大豆冠层生长检测和产量估测有相对可行性,可望在大规模育种计划中用于早期产量估测。育种者期待着上述两项研究的进展。
应该指出,20世纪60年代后期,提倡“理想型”(ideotype)的育种概念,并未像株型育种那样立即收到广泛的认可和应用。大豆超高产株型研究仍处于探索阶段,因此应利用各种特异株型性状的搭配以创造新的株型,在此基础上才能研究高产的田间群体组成,不同时期的形态生理生化特点、动态的产量发展过程等,从而建立高产理想型的形态生理生化模型,进一步揭示高产的遗传组成。这项研究需组织育种、栽培、生理生化、生物技术等多方面人员协同攻关[62]。
4 高光效育种
4.1 高光效育种总体思路
作物遗传改良的实质是提高作物的产量。大豆产量的90%来自光合作用,因此提高光能吸收、传导、转化的效率是提高单产的根本。
大豆高光效育种初期,将大豆高光效育种划分为两个阶段:第一阶段是以提高大豆光合活性和经济系数为主要目标,用此阶段程序和方法选育出高光效种质哈79-9440、哈82-7851;第二阶段是以提高光合活性和固氮活性,调节“源与库”的平衡为主要目标。在高光效基础上,选育出具有高固氮的共生体系,而这种体系对光温反应不很敏感[63]。20世纪80年代以后作物高光效育种走上作物遗传育种和植物生理生化紧密结合的轨道。此时,大豆高光效育种总体思路是:早在1984年我们开始研究C3植物的C4途径酶,提出在C3作物小麦和大豆叶片中,虽然不是具有C4植物的Kranz解剖结构,但可能是具有一个完整的C4途径循环系统[64]。根据C4途径酶在C3植物细胞内的定位和CO2浓缩位点,提出设想图,见图1。

图1 C3植物类似C4途径微循环的设想示意图Fig.1 Imaginative diagram for microcirculation of C3 plants similar to C4 pathway注:①CA②PEPCase③NADP-MDH④NADP-ME⑤PPDK
在匡廷云指导下,根据植物生理学原理、生物遗传育种学和光合作用理论,用还原论和整体论相结合思路,研究C3作物大豆的C4途径,进行C3作物大豆遗传改良,在某一地区生态类型基础上,启动和改良C3作物大豆自身的C4途径酶系基因来提高光合速率,并将多项高光效高产优质抗逆基因聚合,与常规育种相结合。这是杜维广等提出的大豆高光效育种总体思路[5]。
4.2 高光效的光合生理基础
杜维广等[5]从高光效大豆叶片光合特性、叶绿体的光能吸收、传导和转化、光合碳同化特点等方面详细阐述了大豆高光效育种的生理生化基础。这里仅简述大豆高光效的光合生理基础。
4.2.1光合作用光反应得到改善。采用荧光发射光谱技术及荧光动力学,研究了高光效高产大豆品种黑农40、黑农41和高产大豆品种黑农37叶片PSII反应中心的综合活力。表明反应PSII反应中心活力的Fv/Fo、Fv/Fm、qp、qn及фPSII等荧光参数在不同品种间有着明显的差异,且黑农40、黑农41优于黑农37,见表4。此外,叶片叶绿体DCIP光还原活性和光系统电子传递率也是黑农40优于黑农37[5]。
4.2.2光合作用暗反应中CO2同化效率得到改善。李卫华等以高光效高产品种黑农40和高产品种黑农37为试验材料,研究了苗期、开花期、初荚期和鼓粒期等不同发育时期的叶片中PEPcase、NADP-MDH、NADP-ME、PPDK等C4途径的主要酶和RuBPcase活性变化。结果表明两种大豆叶片均含有上述4种酶,尤以初荚期活性最大。大豆体内可能构成一个完整的C4循环(PEPcase羧化-C4酸脱羧-PEP再生)。从而发挥高效的碳同化作用。同时黑农40叶片4种C4途径酶活性明显高于黑农37,而且从PEPcase/RuBPcase的比值看,C4酶在黑农40叶片中表达较高[65]。

表4 不同大豆品种的荧光动力学特征Tab.4 The chlorophyII fluorescence characteristics of different soybean cultivar
综上所述,大豆高光效的光合生理基础是其光反应和暗反应过程都有明显地改善。光反应主要表现在光化学反应能力利用的增加和非光化学反应能量耗散的减少。在暗反应方面则是C4途径酶活性的大幅度提高,羧化中C4酸初产物的明显增加。
4.3 大豆高光效高产(超高产)品种选育
作物高光效育种途径和方法,经历了在C3植物中导入筛选C4途径;利用单叶光合速率高的材料与综合性状好的亲本进行杂交,通过传统系谱法选育;和作物遗传育种和生理生化相结合,探索作物高光效育种新途径共3个主要时期。采用大豆高光效高产育种体系,杜维广研究团队先后育成高光效高产品种黑农39、黑农40、黑农41、黑农51;高油高光效高产品种黑农44、黑农64、黑农68;高蛋白高光效高产品种黑农48、黑农54等。
实现大豆超高产有赖于提高作物光能利用率,因此,深入研究C3作物的类似C4途径调控机制,找出C4酶表达的限制因子,采用遗传学和生物学等手段进行修饰和改造,这是作物高光效育种新突破点之一。另外,利用转基因技术将C4植物的C4途径酶系基因导入C3植物中,期望在C3作物中建立类似的C4植物的C4循环系统以提高C3作物光合效率,这是作物高光效育种的另一个新突破点。1976年以来,在杜维广主持下,黑龙江省农业科学院大豆研究所和中国科学植物研究所合作组成的课题组,在国内率先展开大豆高光效育种研究,实现大豆遗传育种和植物生理生化学科紧密结合,当时国内外尚无成功的先例,也无技术路线可循,课题组成员不断探索,历经30年的辛勤耕耘,取得了“大豆光合特性研究和高光效种质哈79-9440的发现”、“大豆高光效育种的生理遗传基础及其种质遗传改进”和“高光效大豆品种选育及高光效的光合生理基础”等原始创新成果[5]。
杜维广等课题组试图通过启动和改造C3作物大豆自身的C4酶系基因和多种C4酶基因共转化或单基因分步聚合转化等方式,将C4途径中若干主要光合酶基因导入高光效高产大豆品种中,期望培育出高光效高产大豆新品种,实现大幅度提高C3作物大豆单产水平的目标。并认为这两种途径所获得高光效和高产等优良性状具有异曲同工、殊途同归的效果。
5 超高产育种关键科学问题探讨
盖钧镒曾指出,用理论育种家和实践育种家相结合思路进行作物遗传改良。这里仅从实践育种家角度对中国大豆超高产育种关键科学问题进行探讨。
5.1 超高产基因/分子模块发掘与种质创制
作物育种的突破和进展,主要依赖于优异资源的发掘和利用。一个优良品种的育成,一般应有一半归功于优异种质资源。应用新技术发掘现有种质的价值,发掘新的基因源,并探明其遗传基础,加强种质创制研究是超高产育种研究的重要科学课题之一。育成品种积聚了多方面的优异种质,是现时品种改良最核心的遗传资源。文自翔等研究表明:育成品种与野生大豆和地方品种相比,虽然分别丢失了77.7%和70.9%的等位变异,但同时也分别增了54.7%和45.9%的新变异[66]。所以育成品种既是重要的受体亲本又是珍贵的供体亲本,因此首要针对育成品种进行解析。野生大豆品种含有丰富遗传资源,Concibido等[67]对HS-1 PI407305的回交自交系群体进行产量QTL分析,结果发现来自PI407305的产量位点可增产8%~9.4%。所以也要关注野生大豆品种遗传构成解析,大豆超高产育种要重视从新育成品种和野生大豆品种中发掘超高产分子模块,同时创制新种质。应该指出,对育种利用而言,只有那些在多数环境和多数遗传材料中都稳定表达的QTL才有应用价值[68]。Wu等[69]认为产量性状是一类复杂性状,受主效和微效基因控制,也受互作基因网络和环境因素影响,在这个基因网络中,每个基因的效应很小。实践育种家跟据育种宝贵经验(是不可摸拟的)、表型分析和系谱追朔其来源和形成过程等来发掘优异亲本,并提出限制超高产育种瓶颈的主要生态性状。首先发掘超高产育种受体亲本,在解析育成品种、各生态区新育成并有很好配合力的主栽品种遗传基础的基础上,发掘受体亲本(底盘品种),包括超高产分子在内的优异分子模块。其次发掘供体亲本的超高产和特(优)异分子模块,注重选择产量和产量的主要相关生态性状:产量性状、理想株型性状、高光效性状、花荚脱落性状、每节多荚性状、主茎短分枝性状、中杆曲茎短分枝性状、成熟期干物重、收获指数、R6-R8时期、生育期、高异交率及抗病虫、耐旱等生态性状。对于上述生态性状,至少可在7个层次(水平)上分析特性的表现和遗传基础:即由底层到高层次分为基因水平、酶水平、生物化学水平、生理水平、解剖水平、形态水平和农学水平。各层次(水平)都是互相衔接,互不排斥的。
理论育种家用还原论分析方法解析和发掘上述各生态性状分子模块、功能验证、作用机理及互作效应,获得能为育种应用的分子模块,并开发鉴定超高产分子模块等位变异基因的特异分子标记。实践育种家用还原论和整体论相结合的思路,将分子模块导入受体亲本,并通过育种技术培育超高产品种。在发掘现有种质资源超高分子模块的同时,更重要是加强种质创制研究,探索创新途径和方法,创制新种质并明确其遗传基础,不断地提供超高产育种的供体亲本。就目前黑龙江大豆主产区因受玉米和水稻的影响,由第二积温带(有效活动积温2 500 ℃~ 2 700 ℃)转移到第三、四和五积温带(1 900 ℃~ 2 500℃)的现状,所以要重点解决早熟和高产,高产和优质的矛盾。要重点发掘早熟高产和优质分子模块,夏正俊、刘宝辉、孔凡江等已鉴定出早熟分子模块E1、E3、E4[34-39],并开发鉴定E1、E3、和E4等位变异基因的特异分子标计,故应把重点放在每节多荚性状、花荚脱落性状、成熟期干物重性状的高产模块解析和发掘。
采用春夏大豆杂交、新育成主栽品种和地方品种(含上述生态性状分子模块)杂交、新育成主栽品种和国外品种杂交、新育成主栽品种和野生(半野生)品种杂交,用不孕系构建含东北春大豆、黄淮海春夏大豆、南方多季作大豆和国外大豆品种(系)的育种群体等,通过高光效育种、分子设计育种和常规育种相结合技术路线,创造育种中间材料(新种质),目前诱变育种、基因聚合、基因渗入和转基因育种等也是创制新种质有效途径和方法。
5.2 超高产育种技术体系
回顾作物育种历史,不难看出每一次育种理论、途径、方法改进和种质资源创新,对提高作物产量所做的贡献。作物育种从开始的农家品种整理、系统育种、到有性杂交育种和诱变育种,每一阶段都使作物产量有了显著的提高。随着分子生物学的发展,标志着现代育种技术作物DNA标记辅助育种、转基因育种、分子设计育种悄然崛起,虽然在这方面尚未建成—套完整的体系,但进展还是较快的。在基因组学时代,实践育种家如何在超高产育种发挥作用是值得探讨的课题。
5.2.1关于超高产育种亲本形成的遗传基础和选择。超高产育种亲本遗传基础、亲本选择、合理组配及后代预测和选择是制约超高产育种成败之瓶颈。用理论育种家和实践育种家相结合思路来解析超高产育种亲本遗传基础,为合理选择亲本提供理论依据。实践育种家依据第2阶段超高产育种目标,设计超高产育种方案。首先选择已明确的已含有在解析育成品种、各生态区新育成并有很好配合力的主栽品种遗传基础的基础上,发掘出的受体亲本(底盘品种),包括含有超高分子模块在内的优异分子模块的优良主栽品做受体亲本。选择包括上述生态性状并已发掘的超高产和特(优)异分子模块品种、种质和育种中间材料做供体亲本,它不但要弥补受体亲本中欠缺的分子模块,还要考率携带有利的产量、适应性、抗逆性基因等,确定最佳基因型组合。
5.2.2关于超高产育种亲本合理组配与后代预测和选择。一个常规育种项目一般每年要配置数百甚至上千杂交组合,然而最终只有1%~2%的组合可以选育出符合育种目标的品种,大量的组合在不同世代的选择过程中被淘汰,传统育种在很大程度上仍然依赖表型选择和育种家的经验,提高育种过程的可预见性和效率是育种家很久以来的梦想[70-71],可通过理想株型育种、高光效育种(高光效高产育种体系)和分子设计育种及常规育种相的结合育种技术路线实现。
匡廷云为首席专家的“973”项目“光合作用高效转能机理及其在农业中应用”向育种家们提出了“外在光能转化效率(合理株型)加内在光能转化效率(高光效)加杂种优势”的超高产育种的技术路线[5],这—建议的本质是把光合效率作为超高产育种的重要生理基础并补充到已有的育种路线中。采用受体亲本(底盘品种)和供体亲本杂交,用底盘品种为轮回亲本进行1-3次回交转育再自交的回交转育种技术路线;修饰回交和多基因聚合育种技术路线及轮回选择进行亲本组配及后代预测和选择是近期较为应用的技术路线。将分子设计育种应用于超高产育种,进行亲本组配和后代预测和选择是超高产育种亲本合理组配与后代预测和选择的新突破点,但目前分子设计育种仍是新兴研究领域,其核心是建立以分子设计为目标的育种理论和技术体系的研究。作物育种的目标性状大多存在基因和环境间的互作,表型鉴定是研究基因和环境间互作的基础,随着生物技术的发展,基因型的鉴定不再是遗传研究的限制性因素,对各类育种性状大规模、准确的表型鉴定成为最大挑战[72-73],亟待开展各种重要农作物的表型组学研究。这也是超高产育种技术体系内容之一。杂种优势利用是实现超高产育种重要途径之一,但目前仍要解决高优势(异交率)组合的亲本选择和组配及制种技术等主要问题。高光效理想型和杂优结合可能是新的方向之一。
对后代选择杜维广等提倡经常田间观察,跟踪各组合世代依据生态性状遗传规律和分子模块,对目标基因和遗传背景分别进行前景和背景选择;用常规育种(表型值选择、育种经验)和分子设计育种(分子模块选择)有机结合方法选择。这里应该强调建立高通量、高效、便捷、低成本的检测平台;育种模式工具研发和应用;遗传分析新方法的研究及先进仪器的研制也至关重要。
5.3 超高产育种栽培技术体系
要想使超高产育种培育出的“超级豆”产量潜力充分表达,必须研制相适应的超高产栽培技术体系。杜维广曾依据大豆高光效育种实践,提出高光效超高产品种、最大限度截获光能的群体结构及满足品种和群体结构充分发挥潜力的土壤条件,构成超高产栽培技术体系三要素[5],但是它们之间似乎存在如肥料三要素那样的受“木桶原理”(最小养分律)的支配,这个设想仍有待进一步实践证明。要以超高产品种为核心技术,配以相适应超高产栽培技术,建立超高产育种栽培技术体系。超高产栽培技术体系主要是通过超高产生理研究和栽培技术研究来实现。
5.4 超高产育种顶层设计
综上所述,着眼未来中国大豆发展的战略,建议以学科间协作方式开展新一轮大豆超高产育种计划。依托国家大豆生物学和遗传育种重点实验室,在西北灌区、东北、黄淮海、南方四大主产区开展大豆产量突破关键技术及其理论基础研究的超高产育计划:① 大豆高产典型的创造、解析和重演:针对西北灌区春大豆、东北春大豆区、黄淮海春夏大豆区、南方大豆单作区、南方间套作实际,研究突破高产瓶颈因素的技术措施,创造超高产典型。研究大豆产量突破的个体与群体生物学特点及其与生产环境互作用规律;优化集成后形成适合当地条件的高产高效现代大豆生产技术体系。② 大豆种质资源精准鉴定和超高产育种材料的创新及育种技术体系的改进:对大豆种质资源进行表型和分子模块鉴定,通过常规育种和分子设计育种,创造超高产纯系品种和材料,改进大豆突破性高产育种选择技术体系,改进大豆转基因育种技术并合理利用。③ 提高异交结实率,选育强优势杂交大豆品种:创制新型大豆质核互作雄性不育三系种质,育成强优势、高种子产量的杂交大豆组合,提高异交结实,实现杂交制种技术的突破;优化大豆优势亲本/基因资源高效鉴定与组配技术。④ 大豆高光能利用效率育种新途径的探索和高光效品种培育:研究大豆高产(超高产)品种光能吸收、传导和转化的机理,大豆自身的C4途径的调控和改造;研究大豆高产(超高产)理想株型、群体结构、群体生理及其调控技术,大豆花荚脱落性状分子机制的解析与育种利用,培高光效品种。⑤ 大豆广适应性育种技术及其基础研究:大豆生育期基因调控网络和新基因及其分子元件的发掘与利用;大豆根系发育、高产(超高产)土壤理化性状、微生物区系及其调控技术研究;大豆耐逆机制及高产耐旱优异大豆种质资源的创制;分析不同产量水平下实现产量突破的技术途径。⑥ 大豆产量生物学与遗传育种。⑦ 大豆遗传资源学与种质创新。⑧ 大豆营养高效、耐逆生物学与遗传育种。⑨ 大豆超高产育种理论与方法。⑩ 大豆应用基因组学和表型组学研究。我国各生态区合理耕层构建体系研究。
重新启动和实施新一轮大豆超高产育种计划项目可大幅度提高我国大豆单产水平,增加总产量。对缓解我国大豆严重依赖进口的局面,振兴我国大豆产业具有重大和深远意义。
参考文献:
[1] 东正昭. 水稻の超多收品种育种の现状と今后の课题[J]. 农业および园艺,1988,63(7): 793-799.
[2] 徐正进,陈温福,张龙步,等. 日本水稻育种的现状与展望[J]. 水稻文摘,1990,9(5): 1-6.
[3] 陈温福,徐正进,张龙步,等. 水稻新株型创造与优势利用相结合[J]. 沈阳农业大学学报,1987,22(3): 295-304.
[4] 陈温福,徐正进,张文忠,等. 北方超级粳稻育种研究进展与前景[J]. 北方水稻,2007(1): 1-6.
[5] 杜维广,郝廼斌,满为群. 大豆高光效育种[M]. 北京: 中国农业出版社,2007.
[6] 赵团结,盖钧镒,李海旺,等. 大豆育种研究的进展与讨论[J]. 中国农业科学,2006,39(1): 29-37.
[7] 户苅义次. 作物的光合作用与物质生产[M]. 北京: 科学出版社,1979.
[8] 崔继林. 光合作用与生产力[M]. 南京: 江苏科学技术出版社,2000.
[9] Heitholt J J,Egli D B,Leggett J E,et al. Role of assimilate and carbon-14 photosynthate partitioning in soybean reproductive abortion[J]. Crop Science,1986,26(5): 999-1004.
[10] 汪宝卿,慈敦伟,张礼凤,等.同化物供应和内源激素信号对大豆花荚发育的调控[J]. 大豆科学,2010,29(5): 878-882.
[11] 杜维广,张桂茹,栾晓燕,等. 大豆转化系数的研究Ⅰ.转化系数及产量间的相关分析[J]. 中国油料,1989(1): 25-28.
[12] 黄中文,赵团结,喻德跃,等. 大豆生物量积累收获指数及产量间的相关与QTL分析[J]. 作物学报,2008,34(6): 944-951.
[13] 晁毛妮,郝德荣,印志同,等. 大豆生物量与产量组分间的相关及关联分析[J]. 作物学报,2014,40(1): 7-16.
[14] 黄中文,赵团结,盖钧镒. 大豆不同产量水分生物量积累与分配的动态分析[J]. 作物学报,2009,35(8): 1483-1490.
[15] Board J E,Modali H. Dry matter accumulation predictors for optimal yield in soybean[J]. Crop Science,2005,45(5): 1790-1799.
[16] Orf J H,Chase K,Adler F R,et al. Genetics of soybean agronomic traits: II. Interactions between yield quantitative trait loci in soybean[J].Crop Science,1999,39(6): 1652-1657.
[17] Yuan J,Njiti V N,Meksem K,et al. Quantitative trait loci in two soybean recombinant inbred line populations segregating for yield and disease resistance[J]. Crop Science,2002,42(1): 271-277.
[18] Kabelka E A,Diers B W,Fehr W R,et al . Putative alleles for increased yield from soybean plant introductions[J]. Crop Science,2004,44(3): 784-791.
[19] Guzman P S,Diers B W,Neece D J,et al. QTL associated with yield in three backcross-derived populations of soybean[J]. Crop Science,2007,47(1): 111-122.
[20] Palomeque L,Li-Jun L,Li W B,et al. QTL in mega-environments: I. Universal and specific seed yield QTL detected in a population derived from a cross of high-yielding adapted × high-yielding exotic soybean lines[J]. Theoretical and Applied Genetics,2009,119(3): 417-427.
[21] Hao D,Cheng H,Yin Z,et al. Identification of single nucleotide polymorphisms and haplotypes associated with yield and yield components in soybean (Glycine max) landraces across multiple environments[J]. Theoretical and Applied Genetics,2012,124(3): 447-458.
[22] Bernard R L. Two Major Genes for Time of Flowering and Maturity in Soybeans[J]. Crop Science,1971,11(2): 242-244.
[23] Buzzell R I. Inheritance of a soybean flowering response to fluorescent-daylength conditions[J]. Canadian journal of genetics and cytology,1971,13(4): 703-707.
[24] Buzzell R I,Voldeng H D. Inheritance of insensitivity to long day length[J]. Soybean Genet Newsl,1980(7): 26-29.
[25] McBlain B A,Bernard R L,Cremeens C R,et al. A procedure to identify genes affecting maturity using soybean isoline testers[J]. Crop Science,1987,27(6): 1127-1132.
[26] Ray J D,Hinson K,Mankono J E B,et al. Genetic control of a long-juvenile trait in soybean[J]. Crop Science,1995,35(4):1001-1006.
[27] Bonato E R,Vello N A. E6,a dominant gene conditioning early flowering and maturity in soybeans[J]. Genetics and Molecular Biology,1999,22(2): 229-232.
[28] Cober E R,Voldeng H D. A New Soybean Maturity and Photoperiod-Sensitivity Locus Linked toE1and T[J]. Crop Science,2001,41(3): 698-701.
[29] Cober E R,Molnar S J,Charette M,et al. A new locus for early maturity in soybean[J]. Crop Science,2010,50(2): 524-527.
[30] Ray J D,Hinson K,Mankono J,et al. Genetic control of a long-juvenile trait in soybean[J]. Crop science,1995,35(4): 1001-1006.
[31] Cober E R,Tanner J W,Voldeng H D. Genetic control of photoperiod response in early-maturing,near-isogenic soybean lines[J]. Crop science,1996,36(3): 601-605.
[32] Cober E R,Tanner J W,Voldeng H D. Soybean photoperiod-sensitivity loci respond differentially to light quality[J]. Crop science,1996,36(3): 606-610.
[33] Abe J,Xu D,Miyano A,et al. Photoperiod-insensitive Japanese soybean landraces differ at two maturity loci[J]. Crop Science,2003,43(4): 1300-1304.
[34] Xia Z J,Watanabe S,Yamada T,et al. Positional cloning and characterization reveal the molecular basis for soybean maturity locusE1 that regulates photoperiodic flowering[J]. Proc Natl Acad Sci USA,2012,109(32): E2155- E2164.
[35] Watanabe S,Hideshima R,Xia Z J,et al. Map-based cloning of the gene associated with the soybean maturity locusE3[J]. Genetics,2009,182(4): 1251-1262.
[36] Watanabe S,Xia Z J,Hideshima R,et al. A map-based cloning strategy employing a residual heterozygous line reveals that the GIGANTEA gene is involved in soybean maturity and flowering[J]. Genetics,2011,188(2): 395-407.
[37] Liu B H,Kanazawa A,Matsumura H,et al. Genetic redundancy in soybean photoresponses associated with duplication of the phytochrome A gene[J]. Genetics,2008,180(2): 995-1007.
[38] Liu B H,Watanabe S,Uchiyama T,et al. The soybean stem growth habit gene Dt1 is an ortholog of Arabidopsis TERMINAL FLOWER1[J].Plant physiology,2010,153(1): 198-210.
[39] Kong F J,Liu B H,Xia Z J,et al. Two coordinately regulated homologs ofFLOWERING LOCUS T are involved in the control of photoperiodic flowering in soybean[J]. Plant physiology,2010,154(3): 1220-1231.
[40] Wang X Q,XU W H,Ma L G,et al. Requirement ofKNAT1/BP for the development of abscission zones in Arabidopsis thaliana[J]. Journal of Integrative Plant Biology,2006,48(1): 15-26.
[41] Butenko M A,Patterson S E,Grini P E,et al.INFLORESCENCEDEFICIENTINABSCISSIONcontrols floral organ abscission in Arabidopsis and identifies a novel family of putative ligands in plants[J]. The Plant Cell,2003,15(10): 2296-2307.
[42] Xu B,Li Z Y,Zhu Y,et al. Arabidopsis genesAS1,AS2,andJAGnegatively regulate boundary-specifying genes to promote sepal and petal development[J]. Plant physiology,2008,146(2):566-575.
[43] Shi C L,Stenvik G E,Vie A K,et al.Arabidopsisclass I KNOTTED-like homeobox proteins act downstream in the IDA-HAE/HSL2floral abscission signaling pathway[J]. The Plant Cell,2011,23(7): 2553-2567.
[44] Bonaccorso O,Lee J E,Puah L,et al. FILAMENTOUS FLOWER controls lateral organ development by acting as both an activator and a repressor[J]. BMC Plant Biology,2012(1):176.
[45] Li C B,Zhou A L,Sang T,et al.Rice domestication by reducing shattering[J]. Science,2006,311(5679): 1936-1939.
[46] Lin Z W,Griffith M E,Li X R,et al.Origin of seed shattering in rice (OryzasativaL.)[J]. Planta,2007,226(1):11-20.
[47] Konishi S,Izawa T,Lin S Y,et al. An SNP caused loss of seed shattering during rice domestication[J]. Science,2006,312(5778): 1392-1396.
[48] Lin Z W,Li X R,Shannon L M,et al. Parallel domestication of the Shattering1 genes in cereals[J]. Nature Genetics,2012,44(6): 720-724.
[49] Zhang D,Cheng H,Wang H,et al. Identification of genomic regions determining flower and pod numbers development in soybean (GlycinemaxL.)[J]. Journal of Genetics and Genomics,2010,37(8): 545-556.
[50] Zhang D,Lin C,Cheng H,et al.Quantitative trait loci associated with soybean tolerance to low phosphorus stress based on flower and pod abscission[J]. Plant Breeding,2010,129(3): 243-249.
[51] 王 欢,孙 霞,岳岩磊,等. 东北春大豆花荚脱落性状与 SSR 标记的关联分析[J]. 土壤与作物,2014,3(1): 32-40.
[52] 盖钧镒. 美国大豆育种的进展和动向[J]. 大豆科学,1984,3(1): 70-80.
[53] 苗以农,朱长甫,石连旋,等. 从大豆产量形成生理特点探索特异高产株型的创新[J]. 大豆科学,1999,18(4): 342-346.
[54] 王 岚,孙君明,赵荣娟,等. 大豆超高产品种选育研究进展[J]. 大豆科学,2013,32(5): 687-693.
[55] 张性坦,赵 存,柏惠侠,等. 夏大豆诱处4号公顷产4500kg生理指标研究[J]. 中国农业科学,1996,29(6): 46-54.
[56] 张性坦,赵 存,陈建南,等. 超高产大豆(诱处4号)的某些特性研究[J]. 作物学报,1997,23(3): 296-300.
[57] 苗以农,朱长甫,石连旋,等.从大豆株型结构和生理生化特点看选育超高产品种的趋势[J]. 大豆科学,1997,16(4): 334-338.
[58] 魏建军,罗赓彤,张 力,等. 中黄35超高产大豆群体的生理参数[J]. 作物学报,2009,35(3): 506-511.
[59] 盖钧镒,游敏感,邱家驯,等. 大豆高产理想型群体生理基础的探讨[M].南京: 江苏科学出版社,1990.
[60] 苏中滨,张继成,郑 萍,等. 作物高光效株型数字化设计的方法研究[J]. 计算机应用与软件,2008,25(5): 269-270,282.
[61] 吴 琼,齐 波,赵团结,等. 高光谱遥感估测大豆冠层生长和籽粒产量的探讨[J]. 作物学报,2013,39(2): 309-313.
[62] 盖钧镒. 发展我国大豆遗传改良事业解决国内大豆供给问题[J]. 中国工程科学,2003,5(5): 1-6.
[63] 许忠手,张贤泽. 大豆生理与生理育种[M]. 哈尔滨: 黑龙江科学技术出版社,1989.
[64] 郝迺斌,谭克辉,那松青,等. C3植物绿色器官PEP羧化酶活性的比较研究[J]. 植物学报,1991,33(9): 692-697.
[65] 李卫华,卢庆陶,郝乃斌,等. 大豆叶片C4循环途径酶[J]. 植物学报,2001,43(8): 805-808.
[66] 文自翔,赵团结,丁艳来,等. 中国栽培及野生大豆的遗传多样性、地理分化和演化关系研究[J]. 科学通报,2009,54(21): 3301-3310.
[67] ConcibidoC V,La Valle B,Mclaird P,et al. Introgression of a quantitative trait locus for yield from Glycine Saja into commercial soybean cultivars[J]. Theorecical and Applied Genetics,2003,106:575-582.
[68] 印志同,宋海娜,孟凡凡,等. 大豆光合气体交换参数的QTL分析[J]. 作物学报,2010,36(1): 92-100.
[69] Wu R L,Lin M. Functional mapping-how to map and study the genetic architecture of dynamic complex traits[J]. Nature Reviews Genetics,2006,7: 229-237.
[70] Zhai H Q,Wang J K. Applied Quantitative Genetics[M]. Beijing: China Agricultural Science and Technology Press,2007.
[71] Wang J K,Pfeiffer W H. Principle of simulation modeling with applications in plant breeding[J]. Sci Agric Sin,2007,40(1):1-12 .
[72] Cooper M,Podlich D W,Smith O S. Gene-to-phenotype models and complex trait genetics[J].Australian Journal of Agricultural Research,2005,56(9): 895-918.
[73] Houle D,Govindaraju D R,Omholt S. Phenomics: the next challenge[J].Nature Reviews Genetics,2010,11: 855-866.
