玉米和大豆秸秆还田对黑土微生物量及呼吸的影响
2014-06-12,,,,,,,
,,,,,,,
(1.中国科学院 东北地理与农业生态研究所,吉林 长春 130102;2. 中国科学院大学,北京 100049)
0 引 言
秸秆还田是增加土壤有机碳含量,减缓温室气体排放,培肥土壤的重要措施[1]。秸秆在土壤中的分解是土壤中碳循环的关键过程,直接关系到秸秆还田的碳固存效果[2]。而微生物是土壤中秸秆的主要分解者,在秸秆的分解转化过程中起着至关重要的作用[3]。许多研究发现不同秸秆还田量、不同秸秆还田方式下的土壤微生物学特性存在差异[4-6],秸秆在不同分解阶段的土壤微生物生物量、种群结构、活性也存在差异[7-8]。秸秆性质(比如秸秆的碳氮含量)也对土壤中秸秆的分解矿化、微生物量、种群结构等均有重要的影响[9-10]。一般来说含氮量高,C/N低的秸秆在土壤中更容易分解,并释放较多的矿质态氮,并提高微生物生物量[9,11]。然而也有研究认为秸秆的木质素等难分解物质的含量、土壤的性质等也是秸秆分解过程中的微生物物特性改变的重要影响因素[12]。
黑土是东北主要的耕作土壤,近百年来的耕垦活动使黑土严重退化,土壤有机质含量迅速下降[13]。在东北黑土区实施秸秆还田不仅可以阻止土壤进一步退化,还可以增加土壤有机碳含量,减少CO2的排放[14]。土壤的微生物生物量和呼吸是土壤中微生物数量和活性的重要表征[15],对还田秸秆的碳固存意义重大。目前,有关玉米和大豆两种作物不同部位的秸秆还田对土壤微生物生物量和呼吸影响的研究鲜有报道;在黑土区还田秸秆的C、N含量与土壤微生物间的关系尚不明确。因此文章通过玉米、大豆不同植株部位秸秆还田的培养实验,研究了不同类型秸秆还田对黑土微生物数量和活性的影响,为探明秸秆的C、N含量与微生物的关系及如何提高秸秆还田的碳固存效果提供理论依据。
1 材料和方法
1.1 土壤与秸秆
培养实验的土壤采自于吉林省德惠市米沙子乡(中心位置为44°12′N,125°33′E)中国科学院东北地理与农业生态研究所黑土农业生态试验示范基地的玉米连作地表层(0~10 cm)。该土壤类型为典型中层黑土,壤质黏土[16]。采集土壤风干后使用电位法(土水比1∶4)测得土壤pH为5.40;样品过100目筛用FlashEATM1112元素分析仪测得土壤全碳含量为17.6 g·kg-1,全氮含量为1.7 g·kg-1。鲜土过2.5 mm筛,在4℃保鲜冰箱中保存,后与秸秆混合进行培养实验。
玉米和大豆秸秆均于2013年10月采自中国科学院东北地理与农业生态研究所长春综合农业试验站。玉米品种为先玉335(Zea mays),大豆品种是吉育47(Glycine max),采样时玉米和大豆均已经完全成熟。将采集的玉米秸秆分成根、茎下部(3节以下)、茎中间部分、茎顶部(7节以上)、叶5部分,其中茎中间部分未进行培养实验。采集的大豆秸秆分成根、茎、叶3部分。将上述秸秆装入牛皮纸袋中在60℃条件下烘干至恒重,然后用粉碎机粉碎。利用FlashEATM1112元素分析仪测定的各类型秸秆的全碳、全氮含量。秸秆的全碳、全氮含量及碳氮比见表1。
1.2 培养实验设计
培养实验采用单因素实验设计,每个处理设置4个重复。分别称取烘干粉碎后的玉米根、茎下部、茎顶部、叶,大豆根、茎、叶1.5 g与相当于烘干土150 g的鲜土进行充分混合,然后置于500 ml广口瓶中进行调节土壤含水量至60%的孔隙含水率,然后用保鲜膜将广口瓶瓶口封住,并用注射器针头扎若干细孔保证土壤含水量和培养瓶中的氧气浓度。将处理好的广口瓶置于25℃的恒温培养箱中进行培养,每2 d进行称重补水。在培养的61 d对培养土壤的微生物呼吸速率进行测定,然后破坏性取样测定土壤的微生物量碳、氮和矿质态氮浓度。
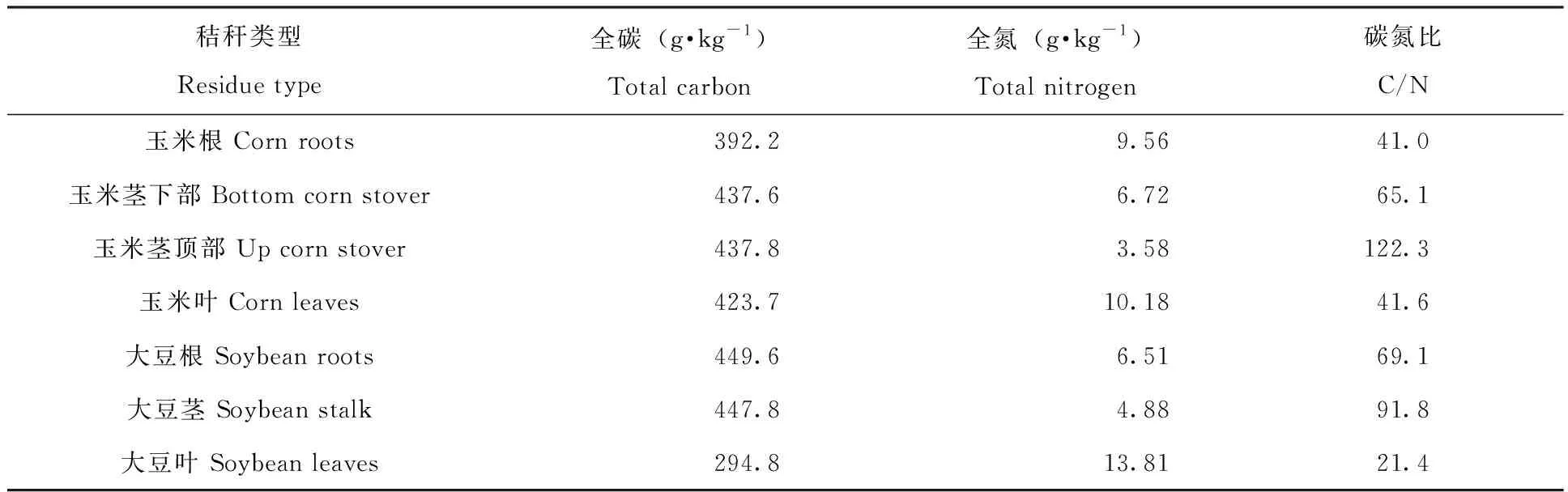
表1 玉米、大豆不同部位全碳、全氮含量及碳氮比Tab.1 Total carbon,total nitrogen and C/N in different part of corn and soybean residues
1.3 测定项目与方法
1.3.1土壤微生物量碳(MBC)、氮(MBN)测定。采用氯仿熏蒸-K2SO4浸提法,岛津TOC-VCPH分析仪测定提取液中的碳、氮含量[17]。根据熏蒸和未熏蒸处理的提取液中有机碳之差除以转换系数0.38为MBC[18],根据熏蒸和未熏蒸处理的提取液中全氮之差除以转换系数0.45为MBN[19]。
1.3.2土壤微生物呼吸速率的测定与计算。利用LI-820 CO2红外气体分析仪,根据封闭动态箱原理对土壤CO2排放速率进行测定计算[20]。将广口瓶、LI-820构建成封闭动态体系,并对封闭动态体系内的CO2浓度进行实时动态测定。将测定的CO2浓度与测定时间进行线性回归,计算出封闭动态体系内CO2浓度的增加速率a。CO2排放速率根据公式(1)进行计算
(1)
式中:F——培养物质的CO2产生速率,单位是mol·(g·s)-1;Vm——CO2摩尔体积;M——培养物质的质量;V——封闭动态系统内的体积。实验采用室内培养法测定土壤呼吸速率,所测定的土壤CO2排放速率,主要来自于土壤微生物呼吸。
土壤微生物呼吸熵:
qCO2=CO2-C/MBC
式中:CO2-C——单位时间内土壤微生物呼吸释放的碳量[21]。
1.3.3土壤矿质态氮浓度测定。土壤中的矿质态氮使用0.5 M的K2SO4(土壤、溶液的比值为1∶4)浸提,用岛津TOC-VCPH分析仪测定浸提液中的总氮含量。由于浸提液中的氮素主要是无机氮形态,有机氮的含量较少。因此,测定的结果可以基本反映出土壤中矿质态氮总体含量的高低。
1.4 统计分析
使用Excel 2013进行平均值及标准差进行计算,使用SAS 9.3 PROC组块的GLM过程对不同处理的进行单因素方差分析,不同变量间采用Pearson相关性分析,使用SigmaPlot 10.0进行绘图。
2 结果与分析
2.1 不同秸秆添加下的土壤微生物生物量和矿质态氮含量
在进行恒温培养60 d后,添加秸秆对土壤的微生物生物量和矿质态氮浓度产生了显著影响,且不同类型秸秆的影响效果不一致,见表2。添加秸秆的土壤MBC是空白处理的1.76倍~2.63倍,并存在显著性差异(p<0.05)。不同秸秆添加处理中,B3的土壤MBC最小,其数值比B1、A2、B2、A4、A3、A1分别小33.1%、28.6%、25.3%、23.3%、17.4%、14.34%。不同类型秸秆添加下的土壤MBC含量差别明显。和MBC类似,添加秸秆使土壤微生物量氮显著增加,其数值是空白处理的1.48倍~ 3.99倍。不同秸秆添加处理中,B3的微生物量氮最小,其数值分别比A2、A4、B1、A1、A3、B2小62.8%、62.2%、59.9%、50.4%、48.1%、41.7%。不同类型秸秆添加的土壤MBN含量差别明显。除大豆叶和大豆茎外,不同类型秸秆添加的MBC/MBN差异不明显。大豆叶的MBC/MBN显著大于空白处理,而大豆茎的MBC/MBN则比空白小10%(p>0.05)。其它秸秆添加处理的土壤MBC/MBN范围是6.3 ~ 8,显著小于空白处理的土壤。
与土壤微生物生物量不同的是,秸秆添加处理使土壤中的矿质态氮含量显著下降,见表2。除大豆叶的矿质态氮含量比空白高15.4%外,其它类型秸秆的矿质态氮含量均显著小于空白土壤。玉米茎顶部、大豆根、大豆茎的矿质态氮含量均在8.4 mg·kg-1左右,而玉米根、玉米叶、玉米茎下部则分别比它们高109.5%、84.3%、29.8%,并存在显著性差异(p<0.05)。

表2 不同秸秆添加的土壤微生物量和矿质态氮含量(均值±标准差)Tab.2 The concentration of soil microbial biomass and mineral N in soil the soil amended with different crop residue samples(mean ± SD)
2.2 不同秸秆添加下的土壤微生物呼吸速率和呼吸熵
在进行恒温培养60 d后,不同秸秆添加下的微生物呼吸速率和呼吸熵的大小表现基本一致,见图1。添加秸秆的土壤微生物呼吸速率和呼吸熵分别是空白处理的2.34倍~12.88倍、1.3倍~5.51倍,均显著大于空白处理的土壤(p<0.05)。不同秸秆添加处理中,B2的呼吸速率和呼吸熵是最大的。B1、B2的呼吸速率和呼吸熵均显著大于其它类型的秸秆添加处理(p<0.05)。A2、A3、A4的微生物呼吸速率和呼吸熵的大小基本一致,呼吸速率分别比B1、B2小38%、57%左右,呼吸熵分别比B1、B2小30%、60%左右。A1、B3的呼吸速率和呼吸熵大小基本一致,呼吸速率比A2、A3、A4小45%左右,呼吸熵比A2、A3、A4小28%左右,并且存在显著性差异(p<0.05)。

图1 不同秸秆添加下的土壤微生物呼吸速率和呼吸熵Fig.1 Microbial respiration and metabolic quotient in soil the soil amended with different crop residue samples注:CK,A1,A2,A3,A4,B1,B2,B3分别代表空白、玉米根、玉米茎下部、玉米茎顶部、玉米叶,大豆根、大豆茎、大豆叶
2.3 秸秆碳氮含量、土壤矿质态氮含量与微生物之间的相关关系
土壤的矿质态氮含量与秸秆C/N、MBN、微生物呼吸速率有显著的负相关关系,与秸秆含氮量、MBC/MBN有显著的正相关关系,见表3。秸秆含碳量与MBC、MBN、MBC/MBN、微生物呼吸速率、呼吸熵之间均有显著的相关关系,秸秆含碳量与土壤矿质氮含量之间有极显著的负相关关系。秸秆含氮量与土壤的微生物呼吸速率之间有显著的负相关关系,与MBC之间也有较为明显负相关关系。微生物的呼吸速率、呼吸熵与MBC、MBN之间的相关性不明显。但是微生物呼吸速率与呼吸熵之间有极为显著的相关性。
表3秸秆碳氮含量、土壤矿质态氮含量与微生物之间的相关系数
Tab.3 The correlation coefficient between the C and N concentration of residues and the mineral N concentration,microbial of soil amended with different crop residue samples
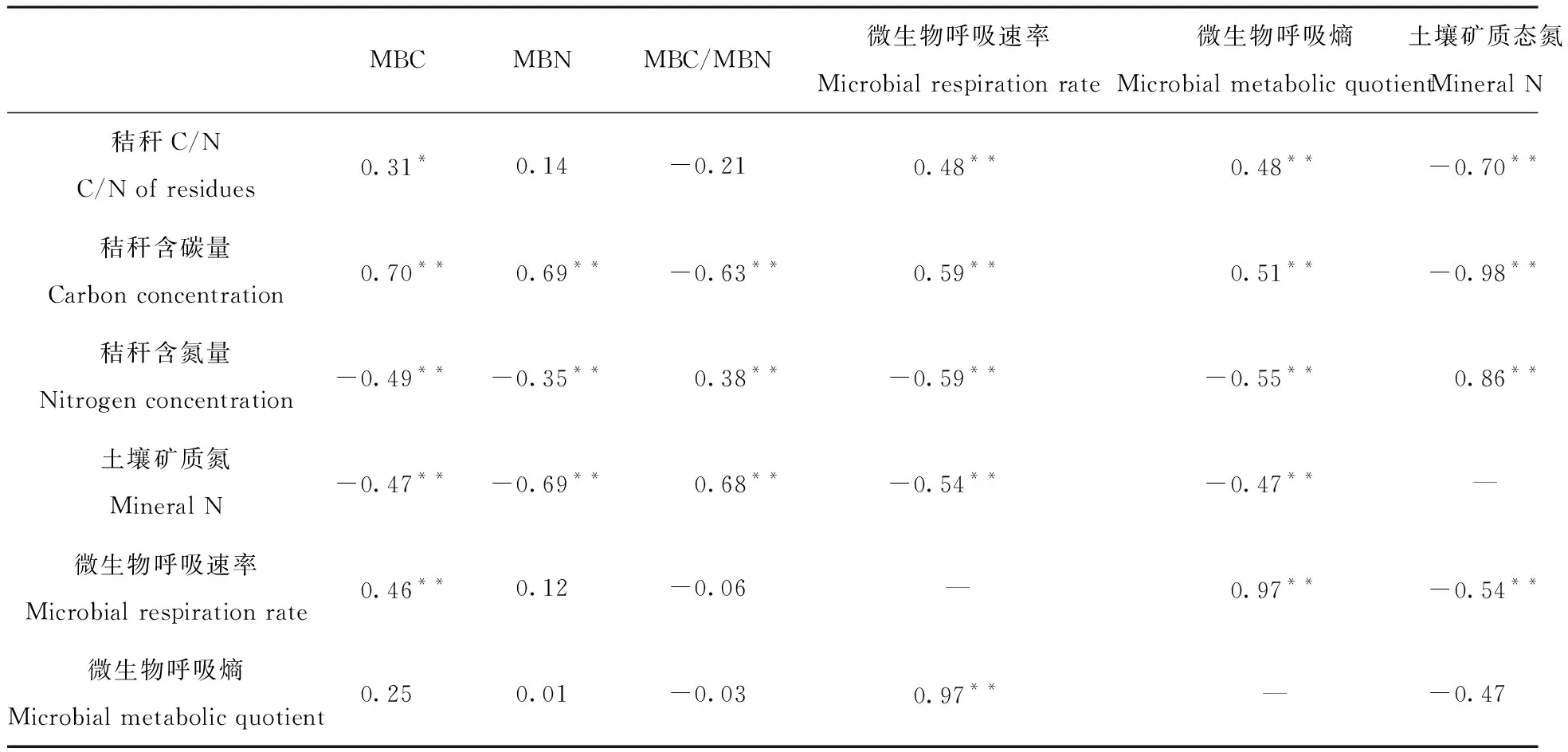
MBCMBNMBC/MBN微生物呼吸速率Microbial respiration rate微生物呼吸熵Microbial metabolic quotient土壤矿质态氮Mineral N秸秆C/NC/N of residues0.31*0.14-0.210.48**0.48**-0.70**秸秆含碳量Carbon concentration0.70**0.69**-0.63**0.59**0.51**-0.98**秸秆含氮量Nitrogen concentration-0.49**-0.35**0.38**-0.59**-0.55**0.86**土壤矿质氮Mineral N-0.47**-0.69**0.68**-0.54**-0.47**—微生物呼吸速率Microbial respiration rate0.46**0.12-0.06—0.97**-0.54**微生物呼吸熵Microbial metabolic quotient0.250.01-0.030.97**—-0.47
注:*和**分别表示相关性达0.05和0.01显著水平。
3 讨 论
研究结果显示,不同类型秸秆还田对黑土的微生物生物量和矿质态氮含量产生明显影响。所有秸秆添加处理的土壤MBC、MBN均显著大于CK;除B3外,其它处理的土壤矿质态氮含量则显著小于CK;不同类型秸秆添加下的土壤微生物量和矿质态氮浓度差异明显。这可能和秸秆的C、N含量密切相关。相关性分析显示,秸秆含碳量与土壤矿质态氮含量呈极显著的负相关关系,与MBC、MBN有显著的正相关关系;秸秆含氮量与土壤MBC之间有明显的负相关关系,与土壤矿质态氮含量存在显著的正相关关系;土壤矿质态氮含量与土壤MBN之间存在显著的负相关关系。因为添加秸秆给土壤中微生物提供了物质和能源,促进了微生物的生长繁殖[22]。氮素是微生物生长繁殖的必须元素,当秸秆中的氮素不能满足微生物的生长繁殖和分解植物残体的需要时,微生物就会从土壤中吸收矿质态氮,从而使土壤中的矿质态氮含量下降[23]。秸秆含氮量与MBC之间关系和Gul等的研究结果不一致[24]。这可能是因为,含氮量高、C/N低的秸秆在还田早期会有更利于土壤中微生物的生长繁殖,并加快秸秆的分解[25],在还田分解后期秸秆中的有机物质减少,不利于保持较高的微生物生物量[26]。另一方面,土壤中的矿质态氮的含量受到土壤中微生物的同化固定和秸秆的矿化作用的共同影响[27]。不同类型秸秆的含氮量、C/N存在差异。因此它们还田后土壤微生物对氮素的同化固定作用和矿化作用也不同,从而导致土壤中的矿质态氮含量存在差异。而B3的矿质态氮含量增加是因为大豆叶的C/N较小,秸秆中的氮素能够满足微生物的生长繁殖和分解秸秆需要,并矿化释放进入土壤。
一般情况下细菌碳氮比在5∶1左右,放线菌在6∶1左右,而真菌在10∶1左右[28-29],因此,土壤微生物量碳氮比(MBC/MBN)可反映微生物的种群结构信息[28]。除大豆叶外,添加秸秆的土壤MBC/MBN显著小于空白土壤。这说明秸秆还田主要是促进了土壤中的C/N较低的细菌、放线菌的繁殖,真菌的繁殖相对缓慢。而大豆叶、大豆茎的土壤MBC/MBN较大,可能是因为它们在还田培养的60多d的时间内有比较大的分解率(数据未发表)。在秸秆分解的后期,由于秸秆中的易分解物质减少,难分解的化合物不断堆积,C/N改变,容易被微生物利用的营养物质减少[26],从而使分解秸秆的土壤微生物的种群结构发生改变,土壤中的真菌比例开始增加[30]。但是土壤微生物的MBC/MBN,只能大致反映土壤中微生物种群结构的变化,需要磷脂脂肪酸法等更为先进的方法才可以准确判断出土壤中微生物种群结构特征的变化。
秸秆添加使土壤的微生物呼吸速率和呼吸熵显著提高,是因为秸秆进入土壤后促进土壤中微生物生长繁殖的同时,也提高了微生物的活性,使土壤中有机质的分解速率加快[31]。不同类型秸秆添加下的土壤微生物呼吸速率、呼吸熵的差异显著,并与秸秆含氮量有显著的负相关关系。这是因为含氮量较多的秸秆在前期已经有了较高的分解率(数据未发表),在后期秸秆中易分解的有机物质较少,从而使微生物分解有机物质的难度增加,微生物的呼吸速率、呼吸熵降低。不同类型秸秆添加下土壤的微生物呼吸速率和微生物呼吸熵的大小表现基本一致,且两者之间呈极显著的正相关关系,但是微生物呼吸与土壤MBC、MBN之间的相关关系不显著。这说明秸秆还田主要是通过影响黑土微生物的活性来影响微生物的呼吸速率和秸秆分解矿化的,微生物生物量差异对秸秆分解、微生物呼吸速率的影响较小。
由于微生物是保护土壤有机碳的一种形式[32],而秸秆中的碳素主要是通过微生物呼吸的形式从土壤中释放出来[33],因此微生物生物量大,呼吸熵小的土壤更有利于秸秆还田的碳固存。研究发现不同类型秸秆添加下的土壤微生物生物量的差别不大,但是大豆根、大豆茎在前期有更大的CO2累积排放量(数据未发表),且它们的土壤微生物呼吸速率、呼吸熵是玉米秸秆的2倍左右。这说明玉米秸秆还田的碳固存效果比大豆秸秆好,实施玉米秸秆还田可能更有利于黑土有机碳储量的增加。但是实施玉米秸秆还田是否真的有利于黑土有机碳储量的增加,则需要进一步的野外实验进行验证。
4 结 论
不同类型秸秆还田对黑土微生物生物量、呼吸熵有显著影响。含氮量高的秸秆不利于还田后期微生物生物量、微生物呼吸速率及活性的保持。秸秆还田促进了细菌、放线菌等C/N较低的微生物生长繁殖,使土壤的MBC/MBN显著降低。黑土微生物的活性对微生物的呼吸速率和秸秆分解矿化有很大影响,而微生物生物量对秸秆分解、微生物呼吸速率的影响很小。
参考文献:
[1] Triberti L,Nastri A,Giordani G,et al. Can mineral and organic fertilization help sequestrate carbon dioxide in cropland?[J]. European Journal of Agronomy,2008,29(1): 13-20.
[2] Randlett D L,Zak D R,Pregitzer K S,et al. Elevated atmospheric carbon dioxide and leaf litter chemistry: influences on microbial respiration and net nitrogen mineralization[J]. Soil Science Society of America Journal,1996,60(5):1571-1577.
[3] Van Veen J A,Kuikman P J. Soil structural aspects of decomposition of organic matter by micro-organisms[J]. Biogeochemistry,1990,11(3):213-233.
[4] 强学彩,袁红莉,高旺盛. 秸秆还田量对土壤CO2释放和土壤微生物量的影响[J]. 应用生态学报,2004,15(3): 469-472.
[5] 陈冬林,易镇邪,周文新,等. 不同土壤耕作方式下秸秆还田量对晚稻土壤养分与微生物的影响[J]. 环境科学学报,2010,30(8):1722-1728.
[6] 丁永亮. 不同秸秆还田方式对土壤生物学特征的影响[D]. 杨凌: 西北农林科技大学,2013.
[7] Wilkinson S C,Anderson J M,Scardelis S P,et al. PLFA profiles of microbial communities in decomposing conifer litters subject to moisture stress[J]. Soil Biology and Biochemistry,2002,34(2): 189-200.
[8] Poll C,Marhan S,Ingwersen J,et al. Dynamics of litter carbon turnover and microbial abundance in a rye detritusphere[J]. Soil Biology and Biochemistry,2008,40(6),1306-1321.
[9] Thormann M N,Currah R S,Bayley S E. Succession of microfungal assemblages in decomposing peatland plants[J]. Plant and Soil,2003,250(2): 323-333.
[10] Eskelinen A,Stark S,Männistö M. Links between plant community composition,soil organic matter quality and microbial communities in contrasting tundra habitats[J]. Oecologia,2009,161(1): 113-123.
[11] Nicolardot B,Recous S,Mary B. Simulation of C and N mineralisation during crop residue decomposition: A simple dynamic model based on the C:N ratio of the residues[J]. Plant and Soil,2001,228(1): 83-103.
[12] Gul S,Whalen J. Plant life history and residue chemistry influences emissions of CO2and N2O from soil perspectives for genetically modified cell wall mutants[J]. Critical Reviews in Plant Sciences,2013,32(5): 344-368.
[13] 于君宝,刘景双,王金达,等. 不同开垦年限黑土有机碳变化规律[J]. 水土保持学报,2004,18(1):27-30.
[14] 方华军,杨学明,张晓平. 东北黑土有机碳储量及其对大气CO2的贡献[J]. 水土保持学报,2003,17(3): 9-12,20.
[15] Baumann K,Marschner P,Smernik R J,et al. Residue chemistry and microbial community structure during decomposition of eucalypt,wheat and vetch residues[J]. Soil Biology and Biochemistry,2009,41(9): 1966-1975.
[16] 梁爱珍,杨学明,张晓平,等. 免耕对东北黑土水稳性团聚体中有机碳分配的短期效应[J]. 中国农业科学,2009,42(8): 2801-2808.
[17] 鲁如坤. 土壤农化分析[M]. 北京: 中国农业科技出版社,2000.
[18] Vance E D,Brookes P C,Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry,1987,19(6): 703-707.
[19] Jenkinson D S.Determination of microbial biomass carbon and nitrogen in soil[J]. In: Advances in Nitrogen Cycling in Agricultural Ecosystems,C.A.B International,Wallingford,1988: 368-386.
[20] 刘四义,张晓平,贾淑霞,等. 一种室内培养条件下采用封闭动态系统测定培养物质CO2排放速率的方法: 中国,201410035448.7[P],2014-5-7.
[21] Anderson T H,Domsch K H. Application of eco-physiological quotients(qCO2andqD) on microbial biomass from soils of different cropping histories[J]. Soil Biology and Biochemistry,1990,22(2): 251 -255.
[22] Matsuyama T,Nakajima Y,Matsuya K et al. Bacterial community in plant residues in a Japanese paddy field estimated by RFLP and DGGE analyses[J]. Soil Biology and Biochemistry,2007,39(2): 463-472.
[23] Ros G H,Hoffland E,Temminghoff E J M. Dynamics of dissolved and extractable organic nitrogen upon soil amendment with crop residues[J].Soil Biology and Biochemistry,2010,42(12): 2094-2101.
[24] Gul S,Whalen J K,Ellis B E,et al. Plant residue chemistry impacts soil processes and microbial community structure: A study with Arabidopsis thaliana cell wall mutants[J]. Applied Soil Ecology,2012,60:84-91.
[25] Stubbs T L,Kennedy A C,Reisenauer P E,et al. Chemical composition of residue from cereal crops and cultivars in dryland ecosystems[J].Agronomy Journal,2009,101(3): 538-545.
[26] Rui J P,Peng J J,Lu Y H. Succession of bacterial populations during plant residue decomposition in rice field soil[J]. Applied and environmental microbiology,2009,75(14): 4879-4886.
[27] Chen B,Liu E K,Tian Q,et al. Soil nitrogen dynamics and crop residues. A review[J]. Agronomy for Sustainable Development,2014,34(2): 429-442.
[28] 李 娟,赵秉强,李秀英,等. 长期有机无机肥料配施对土壤微生物学特性及土壤肥力的影响[J]. 中国农业科学,2008,41(1):144-152.
[29] 黄昌勇,徐建明. 土壤学(第三版)[M]. 北京: 中国农业出版社,2010.
[30] Wilkinson S C,Anderson J M,Scardelis S P,et al. PLFA profiles of microbial communities in decomposing conifer litters subject to moisture stress[J]. Soil Biology and Biochemistry,2002,34(2): 189-200.
[31] 王晓玥,孙 波. 植物残体分解过程中微生物群落变化影响因素研究进展[J]. 土壤,2012,44(3): 353-359.
[32] 孙冰洁,张晓平,贾淑霞. 农田土壤理化性质对土壤微生物群落的影响[J]. 土壤与作物,2013,2(3): 138-144.
[33] Fang M,Motavalli P P,Kremer R J,et al. Assessing changes in soil microbial communities and carbon mineralization in Bt and non-Bt corn residue-amended soils[J]. Applied Soil Ecology,2007,37(1-2): 150-160.
