PEI-质粒纳米粒子对体外培养新生C57BL/6J小鼠耳蜗基底膜转染效果观察*
2014-06-12刘永泽周函钱晓云朱光洁罗熠李奇峰陈杰马登滨高下
刘永泽 周函△ 钱晓云 朱光洁 罗熠 李奇峰 陈杰 马登滨 高下
基因治疗所用载体分为病毒载体和非病毒载体两类,目前重组病毒是最有效的基因转染载体,但存在诸多问题,比如免疫原性不能重复给予、染色体整合或重组、潜在致癌效应、毒性、对所载DNA大小有限制以及制造困难等,限制了其进一步应用,特别是病毒载体临床试验期间的致癌及致死事件,引起了广泛注意,这些风险使得其在临床应用成为一大难题[1]。聚合物载体的一些优势(安全性高、易生产、可载较大基因、容易修饰等)使得其成为可能的替代物,聚乙烯亚胺(polyethylenimine, PEI) 作为阳离子多聚物的一种,已被证明是一种体内外均有效的非病毒载体,其转染效率比其它阳离子聚合物高,新合成的阳离子聚合物的转染效率大多需要参考PEI作比较。本研究以25 kDa线性PEI(linear PEI,L-PEI)或分枝PEI(brcmched PEI,B-PEI)与质粒pEGFP-C1在0.1 M PBS溶液或者5%葡萄糖溶液中形成纳米粒子,通过293T细胞转染实验选用最合适的转染条件再用于转染体外培养的新生小鼠耳蜗基底膜,观察其转染效果。
1 材料与方法
1.1实验动物 48只出生后4天(P4)的C57BL/6J小鼠(南京大学模式动物研究所)为实验动物,动物饲养按照南京大学及鼓楼医院的规定执行。
1.2主要材料 pEGFP-C1质粒(Clontech), 25 kDa B-PEI (Sigma-Aldrich),25 kDa L-PEI (Polysciences),MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅盐,噻唑蓝] (Sigma),DMSO(二甲基亚砜)(Sunshine),293T细胞(本实验室冻存),高糖DMEM (Hyclone),FBS (兰州民海),100×谷氨酰胺 (Gibco),0.1 M PBS、5%葡萄糖(上海生工),酶标仪 (BioTek Instruments),透射电镜 (JEM-200CX,JEOL),荧光显微镜 (Nikon),流式仪 (FACS Calibur),解剖显微镜 (Zoom645,COIC),尖镊、精细剪刀 (上海医疗仪器),眼科镊、眼科剪 (苏州医疗仪器)。
1.3实验方法
1.3.1纳米粒子的制备及透射电镜观察 根据Boussif的经典方法制备pEGFP-C1 - B/L-PEI纳米粒子[2],分别预配制1 μg/μl L-PEI、1 μg/μl B-PEI;将2 μg质粒加入一预加50 μl 1×PBS的1.5 ml EP管,再将14 μg L-PEI加入另一1.5 ml EP管;将装有PEI的EP管内液体吸出,缓慢逐滴加入质粒管,然后立即涡旋30秒形成纳米复合物后静置20~30 min,滴加一滴于铜网上,负染并干燥10~15 min,装入透射电镜观察。
1.3.2凝胶阻滞实验 纳米粒子的制备同上实验,质粒用量均为2 μg,PEI用量范围为0~4 μg,并行1%琼脂糖凝胶电泳。
1.3.3MTT毒性实验 按照ATCC的方法进行293T细胞培养。0.25%胰酶消化,计数后以每孔约10 000个细胞种入已预加无血清培养液180 μl的96孔板,培养22~26 h。分别用B/L-PEI、pEGFP-C1 - B/L-PEI纳米粒加入每孔。B-PEI每孔用量0,0.5,1,1.5,2,3,5,7,10 μl/孔,PBS补足20 μl,每个浓度组设4个复孔。L-PEI各组同样设定。对于pEGFP-C1-B-PEI,先以B-PEI每管用量0,2.5,5,7.5,10,15,25,35,50 μl补以PBS制备纳米复合物,然后每孔加20 μl,每个浓度设4个复孔。pEGFP-C1-L-PEI各组同样设定。4小时后换180 μl 培养液,然后加入20 μl 5 mg/ml MTT[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide],4小时后用枪吸尽每孔中的溶液,加入150 μl DMSO,振摇15 min。以570 nm为测量波长,610 nm为参考波长测定吸光值。细胞活力计算公式为(试验孔-调零孔)/(空白孔-调零孔)×100%。
1.3.4pEGFP-C1-L-PEI纳米粒转染293T细胞 常规培养293T细胞于培养瓶内,培养长到70%~80%时,胰酶消化,5×104个细胞/孔种于24孔板。再次长到75%左右时,换400 μl无血清培养液。按照之前的方法制备100 μl 纳米复合物,加入每孔,孵箱中放置5 h,再换为含血清培养液。在转染前30分钟、转染后24小时及48小时用荧光镜观察或收集细胞,调整细胞浓度后行流式上机检测。
1.3.5纳米粒转染体外培养的小鼠基底膜 本实验共重复4次,每次使用12只小鼠。每次实验将12只P4小鼠冰上麻醉后,皮肤消毒,在超净台内断头后剪开顶骨并清除脑组织以充分暴露颅底,用细镊于内耳道处分离暴露耳蜗底回。取出整个耳蜗,在Hanks平衡液中用游丝镊打开耳蜗壳,暴露膜迷路,去掉蜗轴及螺旋韧带、血管纹等其他结构,在放大25~40倍的解剖显微镜下用游丝镊分离取出全耳蜗基底膜。将基底膜移入预装有培养液的培养皿内,然后将样品在胶原凝胶滴的表面铺放平整,培养皿中预先滴入20 μl新鲜配制的鼠尾胶(鼠尾胶的配制是在临用前将9 份含有0.02 M乙酸和50×Collagen溶液,1份10×Basal Medium Eagle溶液,和1份2%碳酸钠溶液按比例混合制成),在室温下放置30分钟直至鼠尾胶凝胶[3]。然后在每个培养皿中加入500 μl培养液。将培养皿移入37℃、5%二氧化碳培养箱内培养36 h。吸净培养液,加入新鲜配制的纳米复合物粒子转染5 h,之后再换回原培养液。转染前30分钟及转染后培养24 h、48 h分别进行免疫荧光观察。
1.3.6转染后小鼠耳蜗基底膜免疫荧光染色 终止实验时向培养皿中加入4%多聚甲醛并在4℃冰箱中固定。0.1 M PBST漂洗后浸入含0.25% TritonX-100溶液破膜,再用0.1 M PBST漂洗后5%BSA封闭,1:200稀释抗小鼠神经丝蛋白抗体NF200,4℃湿盒孵育过夜。第二天以相应二抗及Topro共孵育,湿盒避光,室温两小时。0.1 M PBST漂洗后封片,Leica激光共聚焦显微镜观察。
1.3.7统计学方法 使用统计软件SAS 9.2,各实验组行单项方差分析后,再行SNK-Q检验。
2 结果
2.1pEGFP-C1-PEI纳米粒子的透射电镜观察结果 在0.1 M PBS中制备的pEGFP-C1-PEI纳米粒子多为类球形,pEGFP-C1-L-PEI纳米粒直径约30~100 nm,pEGFP-C1-B-PEI纳米粒直径约70~100 nm(图1)。
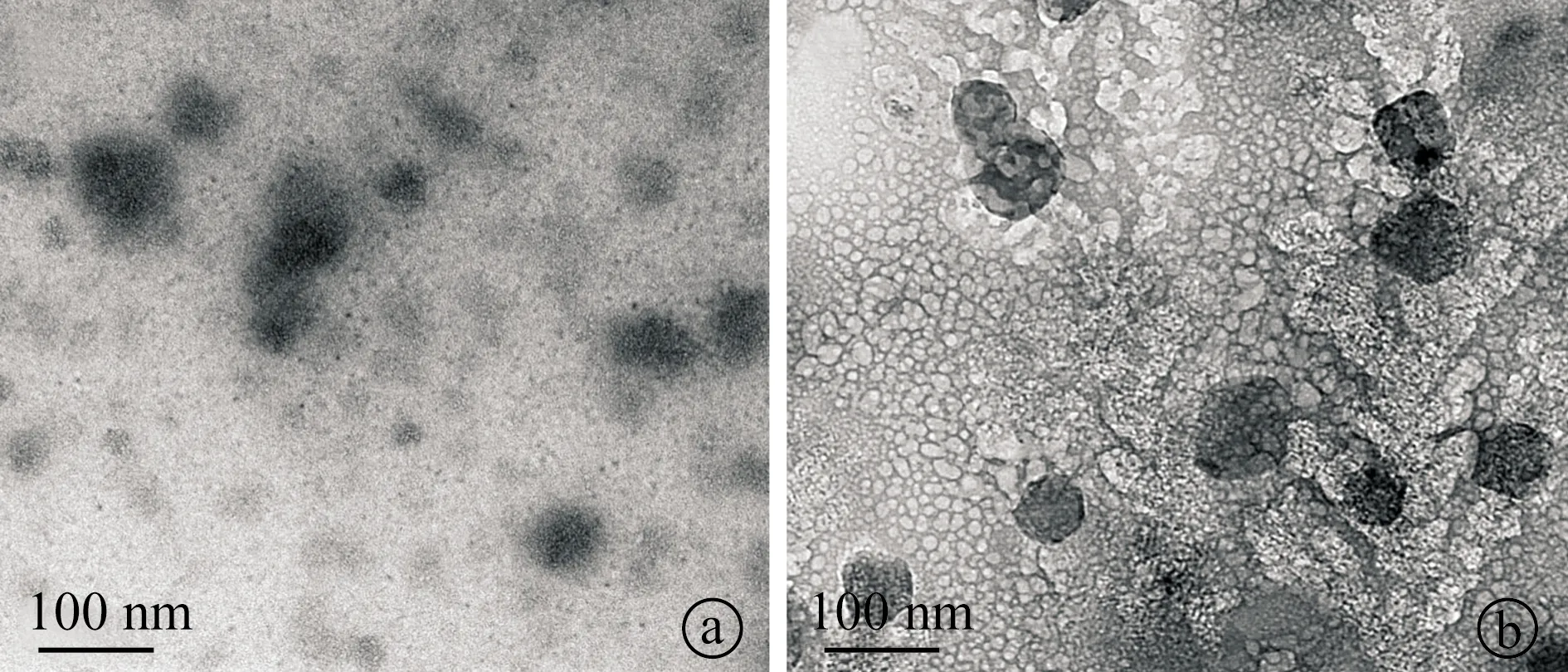
图1 pEGFP-C1-PEI纳米粒子透射电镜观察
2.2凝胶阻滞结果 无论在0.1 M PBS还是5%葡萄糖溶液中,B-PEI在用量达0.5 μg时就可与2 μg质粒有相当强的结合,L-PEI在PBS中也能产生较强的阻滞效应;但在5%葡萄糖中制备时,用量需达1.5 μg才能有一定的阻滞作用,即便如此,使用更高量时,仍不能完全阻滞。B-PEI在使用较高量时,会与DNA结合相当牢固,溴化乙锭(ethidium bromide,EB)无法插入,因此孔内看不到荧光(图2)。

图2 L-PEI在PBS中对pEGFP-C1质粒的阻滞效应
2.3MTT毒性实验结果 ①载体L-PEI在PBS中对293T细胞无明显毒性(P>0.05),而载体B-PEI在PBS中对293T有细胞毒性,且呈剂量依赖性,在很高浓度B-PEI,细胞活性明显下降(P<0.05)。②载体L-PEI在5%葡萄糖中对293T细胞存在毒性,且呈剂量依赖性(P<0.05),但在最高测试浓度毒性反而不明显,细胞活性与对照组相反(P>0.05),载体B-PEI在5%葡萄糖中对293T细胞不仅存在毒性,而且细胞毒性提升很快(P<0.05)(图3a)。③pEGFP-C1-L-PEI纳米粒子在PBS中制备时,随着L-PEI用量的增加,细胞活性无明显下降(P>0.05);而pEGFP-C1-B-PEI纳米粒子在PBS中制备时,形成的纳米粒子降低了B-PEI本身的毒性,在用量增加时,细胞活性下降(P<0.05)。④pEGFP-C1-L-PEI纳米粒子在5%葡萄糖溶液中制备时,随着L-PEI用量增加,毒性还是很明显(P<0.05)。pEGFP-C1-B-PEI纳米粒子在5%葡萄糖中制备后对293T细胞存在细胞毒性,而且细胞毒性的提升比只加载体时缓慢许多,在高B-PEI用量时,活性显著下降(P<0.05)(图3b)。因此,无论是L-PEI载体本身,还是其与质粒pEGFP-C1形成的纳米粒子,在PBS中对293T细胞的细胞毒性均为四种中最低。
2.4pEGFP-C1-L-PEI纳米粒转染293T细胞荧光观察及流式分析 依据MTT实验结果,在PBS中制备pEGFP-C1-L-PEI纳米粒子。pDNA用量为2 μg,L-PEI用量范围为2~14 μg,在L-PEI用量达7 μg时,流式测定转染效率已达81.54%±2.32%,继续增加用量不能显著提高转染效率(图4)。
2.5pEGFP-C1 - L-PEI纳米粒子转染体外培养的小鼠基底膜荧光观察 当L-PEI用量达4 μg后,开始出现转染,主要转染部位位于螺旋缘的纤维细胞,螺旋缘的纤维细胞表达绿色荧光的时间可长达一周。在L-PEI用量达5~14 μg的条件下,支持细胞所在部位出现绿色荧光,表达时间较短,多不超过72小时。螺旋神经元出现绿色荧光的样品多为L-PEI用量达10 μg及以上,表达时间亦短于72小时(图5)。
2.6转染后小鼠耳蜗基底膜组织不同部位免疫荧光染色结果 体外培养三天的新生小鼠耳蜗基底膜仍能维持较好的形态(图6a)。转染后48小时,行免疫荧光染色后,可以明确螺旋缘中的纤维细胞、螺旋神经元、支持细胞被转染。根据被转染的支持细胞的形态和位置推测,Hensen细胞最有可能被转染(图6b~d)。另外,前庭膜上的多边形上皮细胞也有少许被转染。
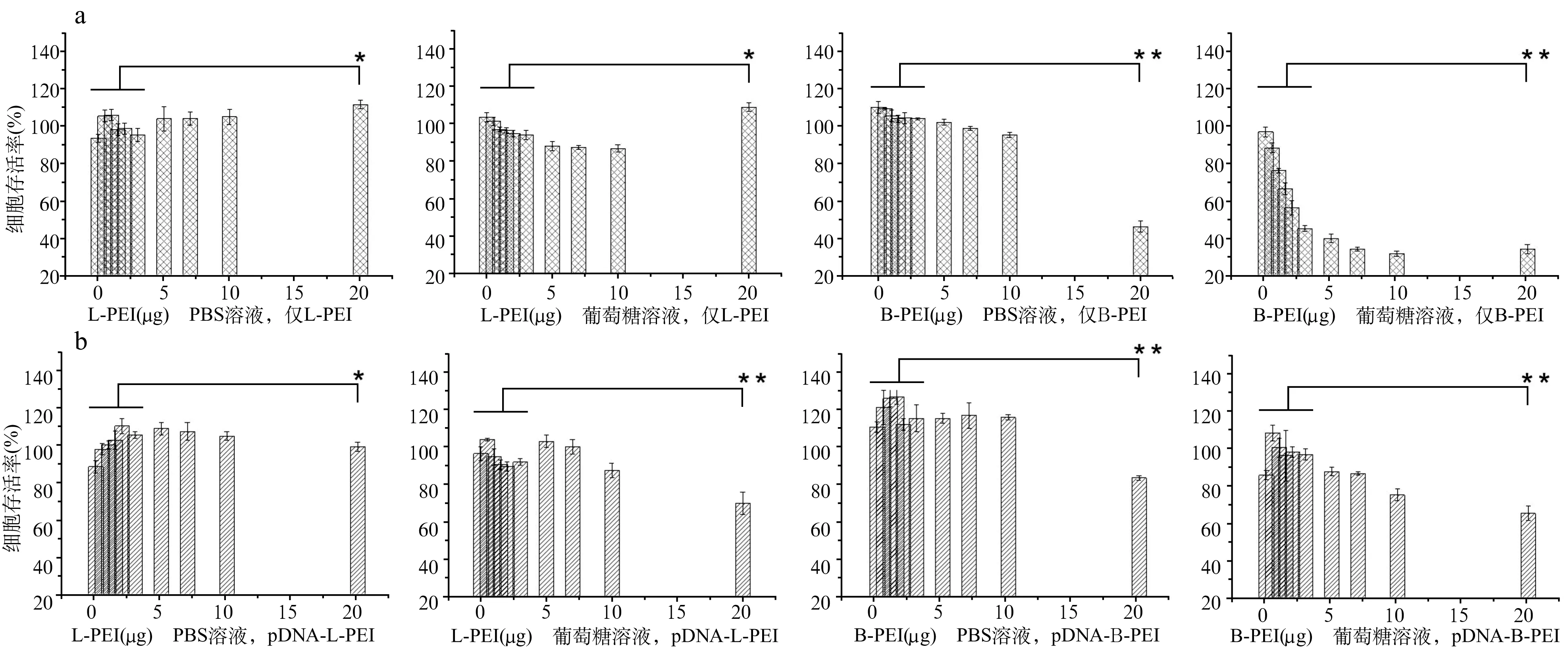
图3 PEI载体和pEGFP-C1-PEI纳米粒子对293T细胞的毒性测试
a:不同浓度的PEI载体对293T细胞的毒性;b不同比例复合形成的pEGFP-C1-PEI纳米粒子对293T细胞的毒性(*P>0.05;**P<0.05)
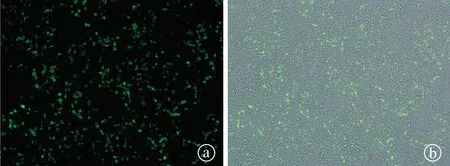
图4 pEGFP-C1-L-PEI纳米粒转染293T细胞(5 μg L-PEI: 2 μg pEGFP-C1)
3 讨论
PEI可作为非病毒基因载体介导DNA[2]、RNA[4,5]、寡核苷酸转染[2,6],由于其转染效率比之前研究的DEAE-dextran、polylysine、polyberene、Ca3(PO4)2等要高出很多,很大程度上推动了非病毒载体的发展。PEI是一种带有很高正电荷的聚阳离子,一、二、三级胺基基团的比例为1:2:1,每三个原子就是一个可以质子化的氮原子,而在生理pH条件下仅15%~20%氮原子发生质子化[7]。在较广的范围内(例如低于生理pH时),PEI能改变其离子化状态来实现缓冲,结合DNA后,每2~3个氨基氮有一个发生质子化。PEI所带的正电荷可与DNA磷酸基团的负电荷发生相互作用,DNA被压缩,两者变为结构紧凑的纳米复合物粒子,呈环形或球形结构[8]。傅里叶变幻红外光谱证明复合后DNA保留B型构象[9]。
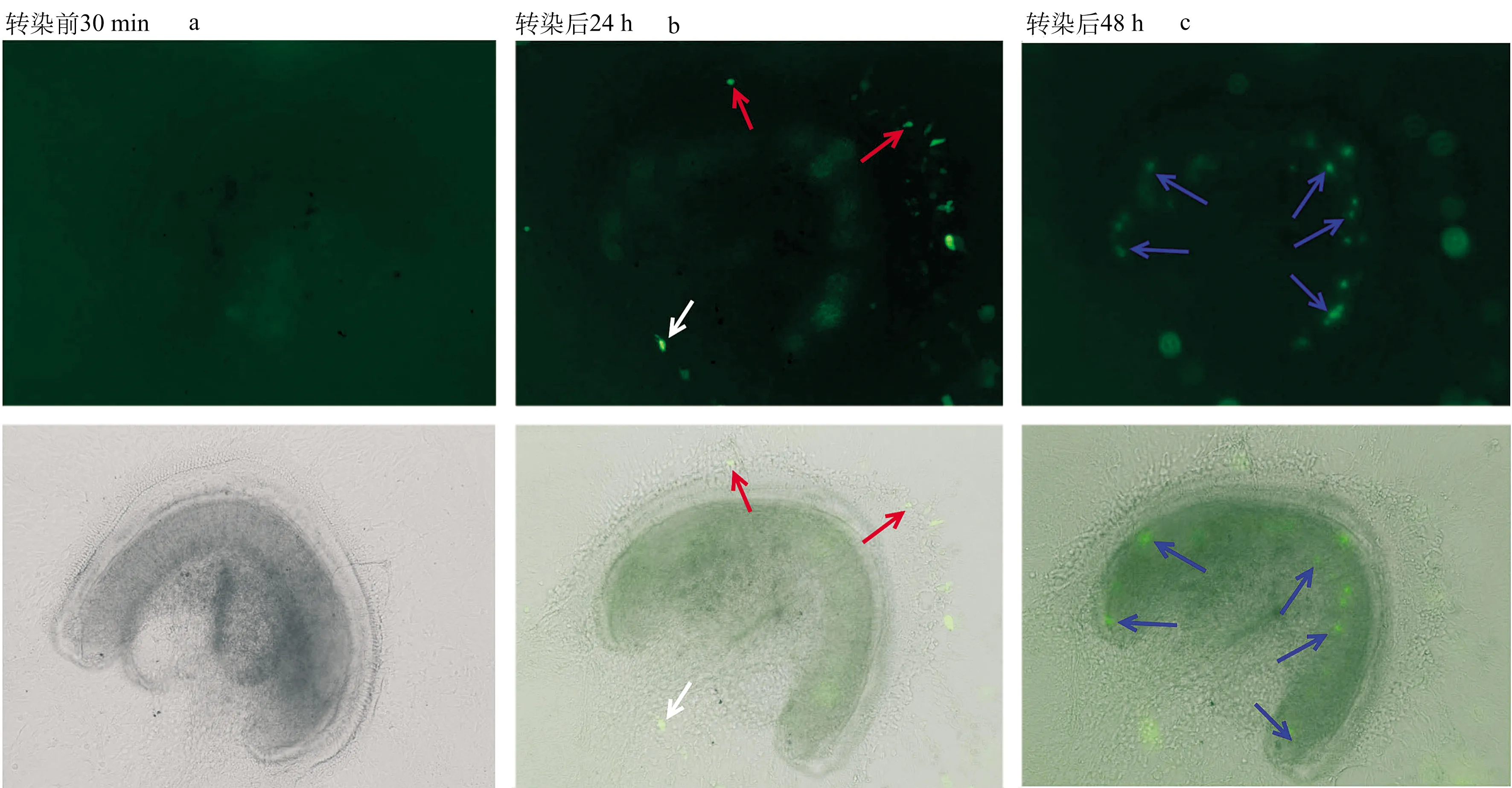
图5 pEGFP-C1 - L-PEI纳米粒转染体外培养的小鼠基底膜荧光观察
a:正常培养36小时的基底膜组织(底回),转染前30分钟,形态良好,无任何绿色荧光;b:转染后24小时,可见支持细胞区域出现绿色荧光(红色箭头),极少数神经元也被转染(白色箭头)。c:转染后48小时,可见主要转染部位位于螺旋缘的纤维细胞(蓝色箭头)。a、b、c中上三张图示绿色激发光下所见,下三张图示光镜下所见。上下两张图代表同一视野
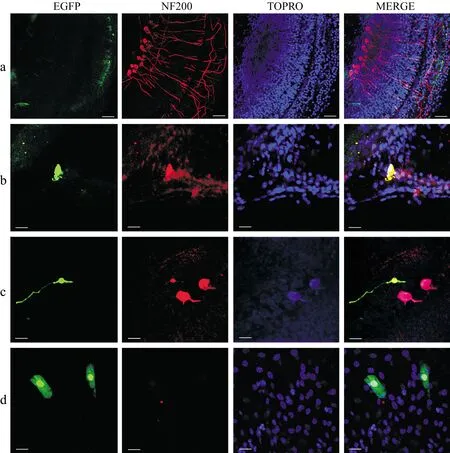
图6 转染前后小鼠耳蜗基底膜免疫荧光染色结果
a:转染前体外培养三天小鼠耳蜗基底膜;b:转染后48 h螺旋缘内的纤维细胞;c:转染后48 h螺旋神经元,胞体较小的2型神经元被转染;d:转染后48 h支持细胞,扁平条状,类似Hensen细胞的表面形态。 (标尺:a:40 μm;b~d:20 μm)
在细胞外基质内,硫酸化氨基葡聚糖可与纳米复合物作用,使后者入胞,但也可使DNA被释放,仅空载体入胞[10]。PEI-pDNA形成的纳米复合物主要通过胞吞或胞饮方式进入早期继而晚期内含体,然后进入溶酶体。PEI具有“质子海绵效应”,在内含体-溶酶体内,通过结合大量质子,引起氯离子内流,渗透压上升导致水进入,最终引起内含体-溶酶体破裂,纳米复合物和游离的PEI释放进入胞质[11],从而PEI不需破膜剂来帮助其与质粒等形成的纳米粒从内含体-溶酶体中逃逸。胞质内存在的蛋白、微管、细胞器阻碍粒子的运动,裸质粒在胞质中移动非常缓慢[12],带正电的纳米粒可以沿带负电的微管或马达蛋白移动,或依赖自然情况下的内含体-溶酶体沿微管的移动而移动,减数分裂时也能被重分布[13]。纳米复合物接近核膜后,由于缺乏类似病毒的入核机制,转染分裂期细胞比刚开始细胞周期的细胞更容易。
Boussif等[2]一开始研究的是分子量为750 kDa的分枝PEI,体内应用时毒性较大已被淘汰,之后发展出许多新的低分子量或不同结构的PEI,以25 kDa分枝PEI、25 kDa线性PEI为代表[14]。制备纳米复合物的溶剂多选用5%葡萄糖或者150 mM NaCl。本研究中利用0.1 M PBS和5%葡萄糖溶液分别和不同浓度的PEI制备纳米粒子行凝胶阻滞,结果B-PEI在使用较高量时EB无法插入,孔内看不到荧光,而L-PEI在PBS中对pEGFP-C1质粒的阻滞效果较为理想,这与其他研究的结果类似[15,16],但这些研究大多测定的是在某一种介质如150 mM NaCl中制备的样品且多仅提供某一种PEI的阻滞结果。以5%葡萄糖为溶剂时,无论B-PEI还是L-PEI,均可制备出粒径较小且较为均一的纳米粒子,粒径随所用PEI的种类和分子量以及DNA与PEI的用量比有关[17];无盐溶液中制备的纳米粒,在加入盐溶液后会发生聚集作用[18]。本研究采用实验室常规使用的缓冲溶液1×PBS,是为了模拟外淋巴液中较复杂的离子成分和溶液中的离子强度[19],并且已有用Tris缓冲液作为溶剂来制备纳米复合物的报道[20]。
本研究首次证明非病毒载体L-PEI既可以转染支持细胞或毛细胞,又可以转染螺旋神经节细胞,虽然转染不同细胞所用的最优L-PEI用量与质粒的用量比可能不一致,仍将推进非病毒载体在耳科的研究,因为,不仅该方向的研究极少,而且之前在葡萄糖系统中制备的22 kDa L-PEI并未成功转染支持细胞和/或毛细胞及两者的前体细胞、螺旋神经节细胞(这些是耳科基因治疗的靶细胞),这可能与Tan等[21]选择的氮磷比(N/P)比较低有关。
本研究证明,相对于B-PEI,L-PEI提供了更好的转染效果,在缓冲系统例如PBS中制备L-PEI-pDNA纳米粒不仅比150 mM NaCl优越,而且比5%葡萄糖溶液制备的也要优越,以适宜比例范围的质粒及L-PEI用量可以转染新生小鼠耳蜗基底膜的细胞。后续实验将以人工外淋巴液或内淋巴液为溶剂制备纳米复合物,观察其作为介质是否会对转染产生影响及在人工外淋巴液中制备后再转入内淋巴液环境时纳米复合物性质是否会有所改变。借助电镜,还将进一步追踪纳米粒及L-PEI在体外培养小鼠内耳基底膜的组织细胞定位。
分枝和线性PEI-pDNA复合物转染细胞的能力不同,线性PEI更高的效率可能是由于组织对25 kDa L-PEI的耐受力强于B-PEI以及盐条件下不稳定的内在动能。了解如何充分利用此机理,可以以更大的灵活性和体内转染效率来帮助设计未来的载体[14];聚合物非病毒载体领域在耳科的应用才刚起始,并且值得深入研究;高通量合成及筛选法为更快寻找更好的非病毒载体提供了可能[22]。
4 参考文献
1 Endo T, Nakagawa T, Kita T, et al. Novel strategy for treatment of inner ears using a biodegradable gel[J]. Laryngoscope,2005,115:2 016.
2 Boussif O, Lezoualch F, Zanta MA, et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in-vivo-polyethylenimine[J]. Proc Natl Acad Sci USA,1995,92:7 297.
3 付勇,丁大连,Richard Salvi. 大鼠耳蜗器官培养及其组织学检查技术[J]. 中华耳鼻咽喉头颈外科,2009,11: 604.
4 Urban-Klein B, Werth S, Abuharbeid S, et al. RNAi-mediated genetargeting through systemic application of polyethylenimine (PEI)-complexed siRNA in vivo[J]. Gene Ther,2005,12:461.
5 Thomas M, Lu JJ, Ge Q, et al. Full deacylation of polyethylenimine dramatically boosts its gene delivery efficiency and specificity to mouse lung[J]. Proc Natl Acad Sci USA,2005,102:5 679.
6 Dheur S, Dias N, Van A, et al. Polyethylenimine but not cationic lipid improves antisense activity of 3'-capped phosphodiester oligonucleolides[J]. Antisense Nucleic Acid Drug Dev,1999,9: 515.
7 Liu MA.DNA vaccines: a review[J]. J Intern Med,2003,253:402.
8 Kichler A. Gene transfer with modified polyethylenimines[J]. J Gene Med,2004,6: 3.
9 Choosakoonkriang S, Lobo BA, Koe GS, et al. Biophysical characterization of PEI/DNA complexes[J]. J Pharm Sci,2003,92:1 710.
10 Ruponen M, Honkakoski P, Tammi M, et al. Cell-surface glycosaminoglycans inhibit cation-mediated gene transfer[J]. J Gene Med,2004,6:405.
11 Akinc A, Thomas M, Klibanov MA, et al. Exploring polyethylenimine- mediated DNA transfection and the proton sponge hypothesis[J]. J Gene Med,2005,7:657.
12 Liu G, Li D, Pasumarthy MK, et al. Nanoparticles of compacted DNA transfect postmitotic cells[J].J Biol Chem,2003,278:32 578.
13 Lechardaeur D, Sohn KJ,Haardt M, et al. Metabolic instability of plasmid DNA in the cytosol: a potential barrier to gene transfer[J]. Gene Ther,1999,6:482.
14 Wightman L, Kircheis R, Rössler V, et al. Different behavior of branched and linear polyethylenimine for gene delivery in vitro and in vivo[J]. J Gene Med,2001,3:362.
15 Ikonen M, Murtomäki L, Kontturi K, et al. Controlled complexation of plasmid DNA with cationic polymers:effect of surfactant on the complexation and stability of the complexes[J]. Colloids and Surfaces B,2008 ,66:77.
16 Shim MS, Kwon YJ. Controlled cytoplasmic and nuclear localization of plasmid DNA and siRNA by differentially tailored polyethylenimine[J]. J Control Release,2009,133:206.
17 Goula D, Benoist C, Mantero S, et al. Polyethylenimine- based intravenous delivery of transgenes to mouse lung[J]. Gene Ther,1998,5:1 291.
18 Ikonen M, Murtomaki L, Kontturi K. Controlled complexation of plasmid DNA with cationic polymers: Effect of surfactant on the complexation and stability of the complexes[J]. Colloids Surf B,2008,66:77.
19 Sterkers O, Ferrary E, Amiel C. Production of inner ear fluids[J]. Physiol Rev,1988,68: 1 083.
20 Choosakoonkriang S, Lobo BA,Koe GS, et al. Biophysical characterization of PEI/DNA complexes[J]. J Pharm Sci,2003,92:1 710.
21 Tan BT, Foong KH, Lee MM, et al. Polyethylenimine-mediated cochlear gene transfer in guinea pigs[J]. Arch Otolaryngol Head Neck Surg,2008,134:884.
22 Kircheis R, Wightman L, Wagner E, Design and gene delivery activity of modified polyethylenimines[J]. Adv Drug Deliv Rev,2001, 53: 341.
