炎症对声带间充质干细胞生物学行为的影响*
2014-06-12杨润琴梁媛媛邓志宏
杨润琴 梁媛媛 邓志宏
成体干细胞的增殖及定向分化能力是组织器官再生修复的基础[1]。已有研究表明炎症能够影响成体干细胞的增殖和分化,如抑制骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)和牙周膜干细胞(periodontal ligament stem cells,PDLSCs)的多向分化,促进脂肪间充质干细胞(adipose tissue-derived stromal cells,ADSCs)和神经元祖细胞(neural progenitor cells,NPCs)的增殖[2~6]。因此炎症对成体干细胞在组织再生修复中的应用效果有极大影响,其对成体干细胞增殖和分化的影响将致其修复组织再生的能力发生改变。声带间充质干细胞(vocal fold mesenchymal stem cells, VF-MSCs)是分离声带黏膜组织获得的成体干细胞,是分泌声带固有层细胞外基质(extracellular matrix, ECM)成分的主要细胞[7~9]。声带固有层ECM有序化排列是声带振动的基础,而声带炎性疾病可致ECM的排列紊乱,引起瘢痕挛缩[10~12]。声带息肉、任克水肿和接触性肉芽肿等疾病具有炎性病变的特征[13],故本实验选取声带息肉(水肿型)并伴声带炎性病变的手术标本作为炎性声带组织,研究炎症对VF-MSCs生物学行为影响,以期为炎症损伤声带的修复提供一定的理论依据。
1 资料与方法
1.1组织来源 实验所用的组织均来源于第四军医大学西京医院耳鼻咽喉头颈外科手术标本,正常组织来源于下咽癌行喉全切除术后的正常声带组织,炎症组织来源于声带息肉(水肿型)患者切除的标本,所取组织大小约1 mm×1 mm,每种组织3例,均为男性,年龄均为35~55岁,供体无任何传染病及内分泌疾病,术前征得患者本人同意签字并报医院伦理委员会批准。
1.2实验方法
1.2.1组织学行为检测 HE染色:所取组织经清水反复清洗后,4%多聚甲醛固定过夜,梯度乙醇脱水,二甲苯透明,石蜡包埋并连续切片,厚度约5 μm,分别用苏木精染色5 min和0.5%伊红染色1 min后中性树胶固定封片。
声带组织切片经Masson三色染色后,胶原纤维可着蓝色,细胞核呈蓝黑色,红细胞呈红色。参照Weigert铁苏木素试剂盒(贝索)使用说明书,A液和B液等比例混合,滴染切片10 min,流水稍洗,1%盐酸酒精分化1 s,丽春红酸性品红染液染5 min,流水稍冲洗,磷钼酸溶液处理约5 min,不用水洗直接用苯胺蓝染液复染5 min,1%冰醋酸处理1 min,酒精脱水并用二甲苯透明后,中性树胶封固。
Elastin Van Gieson(EVG)染色:EVG染色后可使声带组织固有层中弹性纤维及细胞核着蓝黑色,胶原纤维红染。参照EVG染色试剂盒(贝索),将脱蜡水化后的切片用70%乙醇稍冲洗后,浸入Victoria Blue’B染色液(0.5g Victoria Blue’B溶于100ml 70%乙醇)15 min,95%乙醇分化后蒸馏水洗2次,用Ponceau染色液(0.5%丽春红水溶液10 ml混于苦味酸饱和水溶液85 ml)滴染5 min,无水乙醇分化脱水、二甲苯透明后中性树胶封片。
1.2.2细胞分离培养和免疫荧光染色 细胞分离培养:参照文献[7,8],将声带黏膜组织用PBS清洗干净后,除去血液肌肉组织,用眼科剪将组织剪碎,置于离心管中离心后加入Dipase酶(Gibco BRL),在含5% CO2、37 ℃及饱和湿度的孵箱中消化30 min,体式显微镜下撕脱消化下来的上皮细胞,将余下的组织剪成后乳糜状并加入I型胶原酶(Gibco BRL)消化30 min,加入含有α-MEM(Gibco BRL)的大瓶中,置于含5% CO2、37 ℃及饱和湿度的孵箱,每3 d换液一次,细胞长至90%时用胰蛋白酶消化传代,本实验所用细胞均为第3代细胞。
细胞免疫荧光染色:检测所培养细胞是否表达间充质干细胞表面标志物Stro-1,制备细胞爬片,待细胞贴壁生长后4%多聚甲醛固定,0.25%的triton孵育15min,PBS洗3次,3% H2O2浸泡15 min,羊血清孵育30 min,加入一抗(小鼠抗人Stro-1,1:100,Biolegend) ,37 ℃孵育2 h,避光加入荧光二抗,37 ℃孵育1 h,PBS清洗3次,吸干残液,Hochest衬染核2 min,甘油封片后在荧光显微镜下照相。
1.2.3细胞增殖能力检测 平板克隆形成实验:将1 000个处于对数生长期的细胞接种至100 mm培养皿中,连续培养14 d,弃去培养液,PBS洗3遍后,多聚甲醛固定10 min,甲苯胺兰染色30 min,PBS洗3遍后显微镜下观察并拍照,含50个细胞以上的细胞集落作为一个克隆计数,计算克隆形成率。
细胞生长曲线绘制:取对数生长期细胞制成单细胞悬液 (1×105个/m1),200 μl细胞悬液加入96孔板,分别于接种1~7 d后每孔加入20 μl MTT溶液, 孵育4 h后弃上清,每孔加入150 μl二甲基亚砜,振荡5 min后酶标仪测490 nm吸光度值,绘制细胞生长曲线。
1.2.4细胞分化能力检测 成脂分化实验:将细胞制成单细胞悬液,按每孔2×105个细胞接种于6孔板,待细胞贴壁并长满90%时,分别加入2 ml成脂诱导液,10%胎牛血清,2 μM 吲哚美辛,0.5 mM 3-异丁基-1-甲基黄嘌呤,10 nM地塞米松(均购自Sigma),每3 d 换液一次。成脂诱导分化14 d 后,0.3% 油红O染色30 min,PBS洗3次,拍照后每孔中加入1 ml Tris-HCl,室温放置15 min,将150 μl混合溶液移入96孔板,酶联免疫检测仪检测520 nm处吸光值。
成骨分化实验:将细胞制成单细胞悬液,按每孔2×105个细胞接种于6孔板,待细胞贴壁并长满90%时,加入成骨诱导液,10%胎牛血清,5 mM β-磷酸甘油钠,100 nM 地塞米松,50 μg/ml 维生素C(均购自Sigma),每3 d 换液一次。成骨诱导分化21 d 后,弃去诱导液,PBS洗3次后4%多聚甲醛固定10 min,0.1% 茜素红染色30 min,PBS洗3次,倒置显微镜下观察并拍照后每孔中加入十六烷基吡啶孵育15 min,酶联免疫检测仪检测560 nm处吸光值。
1.3统计学方法 分别取经Masson三色和EVG染色的切片,炎症组和正常组各取3张,每张切片分别取3个视野,显微镜200倍视野观察固有层胶原纤维和弹力纤维分布情况并拍照,通过Image Pro Plus 5.0(IPP) 软件分析计算胶原纤维和弹力纤维的累积光密度值(IOD),各成分含量由其颜色的深浅、所占面积的大小决定,颜色越浅、面积越小,IOD越小。采用SPSS 17.0软件对数据(均数±标准差)进行单因素方差分析,两两比较用SNK检验。
2 结果
2.1组织学行为观察 声带石蜡切片HE染色可见声带组织结构由浅至深为上皮层,固有层和肌层。其中,正常声带组织结构清楚,细胞排列整齐。炎性声带组织较正常声带组织上皮层增厚,鳞状上皮细胞呈覆层生长,上皮下固有层局部有炎性细胞浸润,成纤维细胞增生(图1)。
Masson三色染色结果显示,正常声带组织固有层中胶原纤维无明显增粗且排列整齐,炎性声带组织固有层中胶原纤维增粗且排列紊乱,IPP软件定量分析结果显示炎症组胶原纤维含量(1.15±0.13)较正常组(0.53±0.02)增高,差异有统计学意义(P<0.05)(图2)。
EVG染色结果显示,炎症声带组织固有层中弹性纤维较正常变细,分布减少,也可见胶原纤维较正常增粗,分布较多且排列紊乱。IPP软件定量分析结果显示炎症组弹性纤维含量(0.64±0.03)较正常组(1.47±0.23)减少,差异有统计学意义(P<0.05)(图3)。
2.2VF-MSCs细胞形态学观察及免疫荧光染色 慢性炎性组织来源的声带间充质干细胞(inflammatory vocal fold mesenchymal stem cells,I-VF-MSCs)和正常声带组织来源的间充质干细胞(normal vocal fold mesenchymal stem cells,N-VF-MSCs)均可贴壁生长,细胞形态均呈长梭样,胞核较大,呈椭圆形。对细胞进行间充质干细胞表面标志物Stro-1免疫荧光染色后,可见Stro-1在I-VF-MSCs和N-VF-MSCs均有表达(图4)。
2.3细胞增殖能力的比较 细胞克隆形成实验结果可见,I-VF-MSCs和N-VF-MSCs均具有细胞克隆形成能力,且I-VF-MSCs克隆形成能力高于N-VF-MSCs,差异有统计学意义(P<0.05)(图5a)。细胞生长曲线显示,I-VF-MSCs和N-VF-MSCs均具有增殖能力,3 d时细胞均处于快速生长期,6 d后细胞增殖速率变慢,进入平台期,且I-VF-MSCs生长曲线高于N-VF-MSCs,差异有统计学意义(P<0.05)(图5b)。
2.4细胞分化能力的比较 细胞中加入成脂诱导液后,细胞形态变长,有部分细胞死亡,N-VF-MSCs和I-VF-MSCs分别于诱导7 d和10 d后有少量空泡样脂滴生成,诱导14 d后脂滴数量增加,呈串珠样,行油红O染色,可见N-VF-MSCs中着红染的串珠样脂滴多于I-VF-MSCs,进行定量示N-VF-MSCs组吸光度值(0.62±0.04)高于I-VF-MSCs组(0.13±0.01)(P<0.05)(图6a、b)。
细胞中加入成骨诱导液后,细胞有少量死亡,诱导10 d后细胞呈旋涡状大量密集,细胞形态变细变长,N-VF-MSCs和I-VF-MSCs分别于诱导14 d和18 d后有少量矿化结节生成,后逐渐增多,至21 d时加入茜素红染色,矿化结节着红色,镜下可见N-VF-MSCs中着红色的矿化结节多于I-VF-MSCs,该脂滴在结节检测吸光度值,N-VF-MSCs组吸光度值(0.57±0.04)高于I-VF-MSCs组(0.21±0.02)(P<0.05)(图6c、d)。
3 讨论
分离培养声带黏膜组织可获得VF-MSCs,其与声带组织的再生修复密切相关,可分泌胶原纤维,弹力纤维等固有层内ECM成分。其中,胶原纤维为组织提供结构和力量,受力时可承受压力、抵抗变形,弹性纤维赋予组织弹性,与声带变形和回复等声带特性相关[6,14]。炎症是体内影响成体干细胞功能的重要因素,其可影响成体干细胞的增殖和分化能力[2~6,15]。研究炎症对VF-MSCs增殖和分化能力的影响,可为炎性声带损伤修复奠定一定的理论基础。
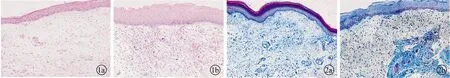
图1 声带组织切片HE染色图片(a为正常组,b为炎症组)(×200)图2 声带组织切片Masson三色染色图片(a为正常组,b为炎症组)(×200)
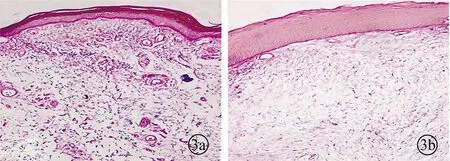
图3 声带组织切片EVG染色图片(a为正常组,b为炎症组)(×200)
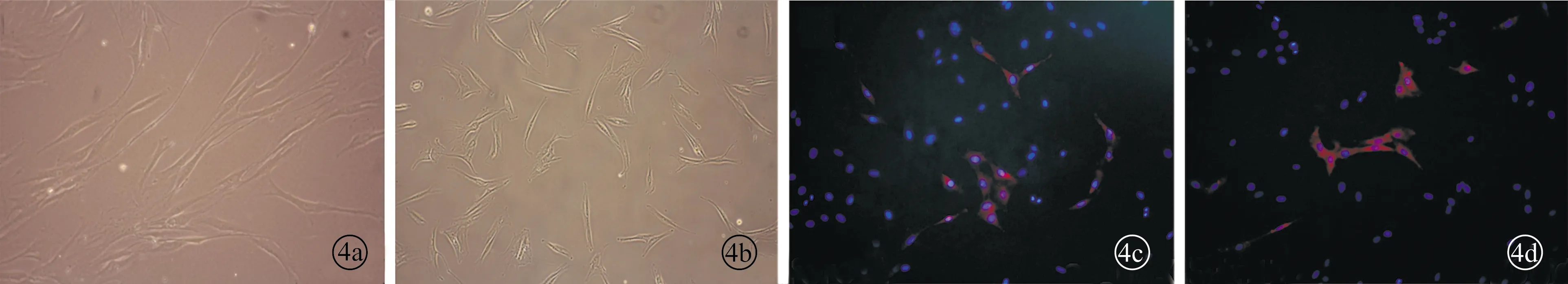
图4 VF-MSCs细胞形态学观察胶原染色图片 a、b为VF-MSCs原代培养(×100),c、d为Stro-1免疫荧光染色(×200)

图5 VF-MSCs克隆形成率(a)和MTT细胞生长曲线(b)
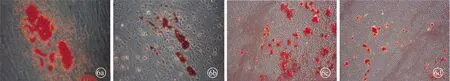
图6 VF-MSCs成脂诱导分化油红O染色(a、b)和成骨诱导分化茜素红染色(c、d)(×100)
本研究对炎性和正常声带组织行HE、Masson三色及EVG染色,以观察炎性声带组织固有层内ECM的改变情况,结果显示,炎性声带组织上皮层较正常组增厚,固有层局部有炎性细胞浸润,炎性声带组织中弹性纤维较正常组变细,胶原纤维排列紊乱且含量增多,表明炎症引起声带固有层ECM的弹性纤维含量减少和胶原纤维含量增加、排列紊乱,损害ECM的成分和有序化排列改变,致炎性声带组织较正常声带组织弹性减弱,抗压力增强,引起声带振动功能减弱[15~17]。
有研究认为炎性细胞的过度增殖既是慢性炎症的病理特征,又是其发病机制的始动因素[18]。在正常情况下,干细胞增殖处于相对静止的状态,当炎性因素刺激时,干细胞会进入瞬时扩增状态。本研究用消化法分离培养炎症和正常声带黏膜组织获得VF-MSCs,见原代细胞均可贴壁生长,呈长梭形,胞核较大;用间充质干细胞表面分子标志物Stro-1对细胞行免疫荧光染色,可见N-VF-MSCs和I-VF-MSCs 均可表达Stro-1;用平板克隆形成实验和MTT细胞生长曲线实验结果显示,I-VF-MSCs细胞增殖能力较N-VF-MSCs增强,表明炎症促进VF-MSCs增殖。
有研究证实炎症微环境中炎性因子如肿瘤坏死因子(tumor necrosis factor α, TNF-α)激活Wnt通路而引起间充质干细胞分化能力的下降,而抑制Wnt通路可调节炎症对成骨和成脂分化能力的影响[19,20]。本研究将细胞定向向成脂、成骨细胞方向分化,以比较炎症对VF-MSCs多向分化能力的影响,结果显示,N-VF-MSCs中着红染的脂滴较I-VF-MSCs多,I-VF-MSCs中着红色的矿化结节较N-VF-MSCs少,表明炎症抑制VF-MSCs向成脂、成骨细胞方向分化。
本实验为炎症损伤声带后固有层内ECM的变化及炎症对VF-MSCs增殖及分化能力的影响提供了一定的依据,为今后逆转炎性损伤声带组织奠定了一定的基础。关于如何逆转炎性疾病损伤声带固有层内ECM及对VF-MSCs的影响,将是我们今后研究工作的一个重点。
4 参考文献
1 da Sliva ML, Chagastelles PC, Nardi NB. Mesenchymal stem cells reside in virtually all post-natal organs and tissue[J]. Cell Sci, 2006,119:2 204.
2 Laceyy DC,Simmonsz PJ,Gravesy SE,et al.Pro-inflammatory cytokines inhibit osteogenic differentiation from stem cells: implications for bone repair during inflammation[J]. Osteoarthritis and Cartilage,2009,17:735.
3 Wehling N, Palmer GD,Pilapil C, et al. Interleukin-1 and tumor necrosis factor-α inhibit chondrogenesis by human mesenchymal stem cells through NF-κB dependent pathways[J]. Arthritis Rheum,2009,60: 801.
4 Kong X, Liu Y,Ye R, et al. GSK3β is a checkpoint for TNF-α-mediated impaired osteogenic differentiation of mesenchymal stem cells in inflammatory microenvironments[J]. Biochimica et Biophysica Acta,2013,1 830:5 119.
5 Przybyt E, Krenning G,Brinker MG. Adipose stromal cells primed with hypoxia and inflammation enhance cardiomyocyte proliferation rate in vitro through STAT3 and Erk1/2[J]. Transl Med,2013,11;39.
6 Bachstetter AD,Jernberg J,Schlunk A. Spirulina promotes stem cell genesis and protects against LPS induced declines in neural stem cell proliferation[J]. Plos One,2010,55:10 496.
7 刘阳,韩鹏,梁媛媛,等.不同部位喉粘膜间充质干细胞的分离培养[J].现代生物医学进展,2011,8:1 440.
8 刘阳,梁强,梁媛媛,等.喉粘膜间充质干细胞的分离培养及鉴定[J].中华耳鼻咽喉头颈外科杂志,2011,46:408.
9 潘叶挺,邹坚定,龚梁,等. 喉外伤后声带瘢痕形成机制的实验研究[J].调查与实验研究,2012,50:29.
10 徐文,韩德民,胡蓉,等. 声带损伤后自身修复特点研究[J]. 首都医科大学学报,2011,32:729.
11 Lee BJ, Wang SG, Lee JC, et al. The prevention of vocal fold scarring using autologous adipose tissue-derived stromal cells[J]. Cells Tissues Organs,2006,184:198.
12 Ohno S, Hirano S, Kanemaru S. Role of circulating MSCs in vocal fold wound healing[J]. The American Laryngological, Rhinological and Otological Society,2012,122:2 503.
13 Bless DM, Welham NV. Characterization of vocal fold scar formation, prophylaxis and treatment using animal models[J]. Curr Opin Otolaryngol Head Neck Surg,2010,18: 481.
14 牛玉光,黄冬雁,王荣光. 声带固有层组织工程学再生研究[J]. 国际耳鼻咽喉头颈外科杂志,2010,34:253.
15 Ohlstein B, Kai T, Decotto E, et al. A The stem cell niche: theme and variations[J]. Curr Opin Cell Biol,2004,16:693.
16 Kutty JK,Webb K. Tissue engineering therapies for the vocal fold lamina propria[J]. Tissue Engineering: Part B Rev,2009,15:249.
17 江志超,田道法,何迎春,等. NF—K B抑制剂对慢性鼻咽炎豚鼠鼻咽黏膜炎症细胞增殖与凋亡活性的影响[J].中国中西医结合耳鼻咽喉科杂志,2010,18:22.
18 Liu W, Konermann A, Guo T, et al. CanonicalWnt signaling differently modulates osteogenic differentiation of mesenchymal stem cells derived from bone marrow and from periodontal ligament under inflammatory conditions[J]. Biochim Biophys Acta,2014,1840:1 125.
19 Boland GM,Perkins G,Hall DJ,et al. Wnt 3a promotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells[J].Cell Biochem, 2004,93:1 210.
20 Liu G,Vijayakumar S,Grumolato L, et al. Canonical Wnts function as potent regulators of osteogenesis by humanmesenchymal stem cells[J]. Cell Biol, 2009,185:67.
