NHC-Pd配合物的合成及其催化Suzuki-Miyaura偶联反应的研究
2014-06-10于宏伟施继成
于宏伟,施继成
(1.石家庄学院化工学院,石家庄 050035;2.广东石油化工学院,广东 茂名 525000)
过渡金属(Pd,Ni,Cu等)催化卤代芳烃与芳基硼酸的偶联反应被称为Suzuki-Miyaura偶联反应。由于芳基硼酸具有易合成、稳定性好等优点,使得 Suzuki-Miyaura偶联反应成为构建C—C 键 的 重 要方 法[1-4]。传统 的 Suzuki -Miyaura偶联反应中通常以大空间位阻、富电子的三价膦化合物作为催化剂配体[1-2],膦配体具有很高的反应活性,但对水和空气比较敏感,且合成工艺复杂,影响了其在Suzuki-Miyaura偶联反应中的广泛应用。N-杂环卡宾(NHC)配体和膦配体类似,具有大的空间位阻及很强的给电子能力,且合成更为简单,被广泛应用于催化化学的各个领域。笔者参考相关文献[5-11],以2-氨基联苯等为原料制备出 NHC-Pd配合物,并对其催化氯苯与苯硼酸的 Suzuki-Miyaura偶联反应进行了研究。
1 实验部分
1.1 试剂与仪器
2-氨基联苯、叔丁醇钠、醋酸钯、正癸烷,Alfa Aesar试剂公司;其他试剂均为国产市售分析纯试剂。Suzuki-Miyaura偶联反应中所用试剂均按照 Schlenk技术经过严格的脱水及脱氧处理。
Varian 400 MHz核磁共振波谱仪(CDCl3,TMS为内标),美国Varian公司;GC 7890F气相色谱仪,上海天美科学仪器有限公司。
1.2 NHC-Pd配合物的合成
NHC-Pd配合物的合成路线如下:
1.2.1 N,N -二甲基-2 -氨基联苯(Ⅱ)的制备[12]
室温下向250 mL三口瓶中依次加入5.1 g 2-氨基联苯(Ⅰ)和含有9.0 g氢氧化钠的 100 mL水溶液,在0.5 h内分3批加入38 g硫酸二甲酯,加热回流反应,TLC(薄层色谱)跟踪反应进程。反应结束后加入浓度为1 mol/L的氢氧化钠水溶液至pH为12,用乙醚萃取水相(50 mL×3),用饱和食盐水洗涤(50 mL ×3),合并有机相,用无水硫酸钠干燥12 h,过滤浓缩,采用柱层析(硅胶100~200目,展开剂为石油醚)分离提纯,得到淡红色液体,收率为 50%。1H NMR(CDCl3,400 MHz,TMS)δ:7.580 ~ 6.997(m,9H),2.527(s,6H)。
1.2.2 二聚钯配合物(Ⅲ)的制备[13]
高纯氮气保护下,向许林克瓶中依次加入1.77 g氯化钯、0.85 g 氯化锂、50 mL 无水甲醇及2.96 g N,N-二甲基-2-氨基联苯,室温下搅拌反应24 h,得到土黄色沉淀,过滤,室温下真空干燥,得到2.94 g二聚钯配合物,产率为85%。
1.2.3 NHC -Pd 配合物(Ⅴ)的制备[14]
高纯氮气保护下,向许林克瓶中依次加入5.0 mL干燥脱气的 THF、405 mg 咪唑盐(Ⅳ)[15]、311 mg二聚钯配合物及91 mg叔丁醇钠,室温下搅拌反应 2 h后过滤浓缩,柱层析(硅胶 100~200 目,展开剂组成 V石油醚∶V乙酸乙酯=1∶10)分离提纯,得到393 mg黄色固体,产率为60%。1H NMR(CDCl3,400 MHz,TMS)δ:7.433(t,J=8.0 Hz,1H),7.307(d,J=7.6 Hz,1H),7.240(d,J=8.0 Hz,1H),7.189(s,2H),7.109(t,J=7.6 Hz,1H),7.041(t,J=7.8 Hz,1H),6.992(d,J=3.6 Hz,1H),6.941(t,J=6.2 Hz,1H),6.894(d,J=8.0 Hz,1H),6.851 ~6.732(m,6H),6.676 ~ 6.654(dd,J=1.6,1.2 Hz,1H),3.791 ~ 3.755(m,1H),3.629 ~ 3.601(m,1H),2.858(s,3H),2.564 ~2.529(m,1H),2.111 ~2.081(m,1H),1.994(s,3H),1.638(d,J=6.8 Hz,3H),1.414(d,J=6.4 Hz,3H),1.235(d,J=6.8 Hz,3H),1.070(d,J=6.8 Hz,3H),0.917(d,J=6.4 Hz,3H),0.788(d,J=6.4 Hz,3H),0.659(d,J=6.8 Hz,3H),0.419(d,J=6.4 Hz,3H)。
1.3 Suzuki-Miyaura偶联反应
高纯氮气保护下,向干燥的许林克瓶中依次加入14.6 mg NHC-Pd配合物、115 mg叔丁醇钠、171 mg苯硼酸及1.5 mL脱气干燥的异丙醇,室温下搅拌反应15 min,然后依次加入1.0 mmol脱气干燥的氯苯及1.0 mmol内标正癸烷,室温下反应75 min,气相色谱仪跟踪反应。反应结束后加入20 mL去离子水,用乙醚萃取水相(5 mL×3),合并有机相,用无水硫酸钠干燥,过滤浓缩,柱层析分离提纯(硅胶100~200目,展开剂组成V乙酸乙酯∶V石油醚=1∶10),得到产物联苯。1H NMR(CDCl3,400 MHz,TMS)δ:7.596 ~ 7.312(m,10H)。
2 结果与讨论
2.1 结构表征
2.1.1 中间体Ⅱ的结构表征
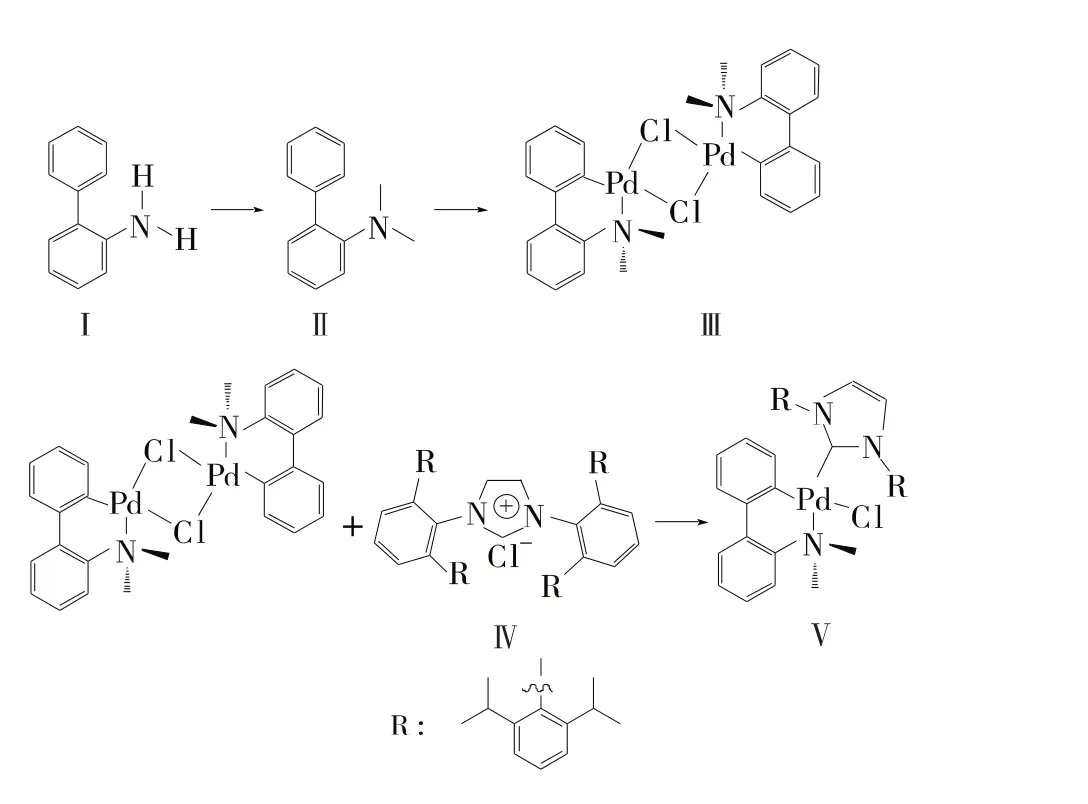
通过1H NMR对中间体Ⅱ的结构进行表征,结果如图1所示。δ 7.580~6.997归属于联苯环1,2,4,5,6,8,9,10,11 位上 9 个氢原子的化学位移;δ 2.527则归属于14,15位上甲基的6个氢原子 的 化 学 位 移。 积 分 面 积 S(1,2,4,5,6,8,9,10,11)位∶S(14,15位)=3∶2,和理论值一致。分析结果表明产品为目标产物N,N-二甲基-2-氨基联苯。
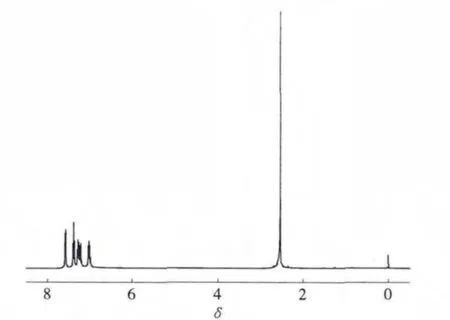
图1 中间体Ⅱ的1H NMR谱图
2.1.2 配合物Ⅴ的结构表征
通过1H NMR对配合物Ⅴ的结构进行表征,结果如图2所示。δ 7.450~6.654归属于芳环和杂环上 16 个氢原子的化学位移;δ 3.772,3.616,2.546和2.081分别归属于异丙基上4个叔碳上氢原子的化学位移;δ 2.858和1.994分别归属于N上2个甲基氢原子的化学位移;δ 1.638,1.414,1.235,1.070,0.917,0.788,0.659 和 0.419 则分别归属于异丙基上的8个甲基氢原子的化学位移。通过谱图分析并结合文献报道[14],确认合成化合物为目标产物。
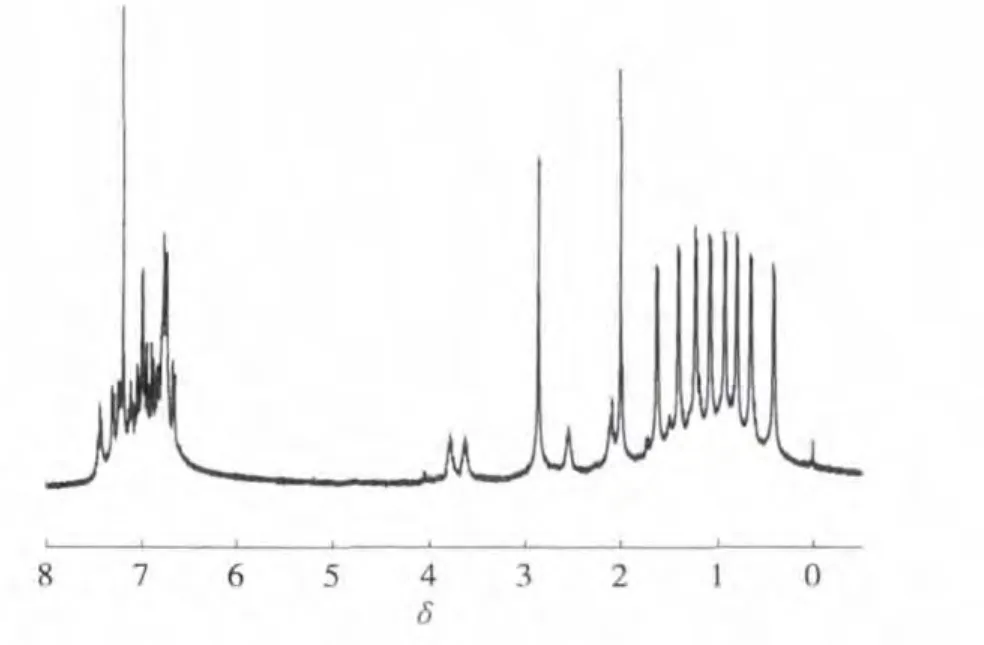
图2 配合物Ⅴ的1H NMR谱图
2.1.3 偶联产物的结构表征
通过1H NMR对偶联产物的结构进行表征,结果如图3所示。δ 7.596~7.575归属于联苯环1,5,8,12 位上4 个氢原子的化学位移;δ 7.445 ~7.407归属于联苯环 2,4,9,11位上 4 个氢原子的化学位移;δ 7.351~7.312则归属于联苯环 3,10位上2个氢原子的化学位移。积分面积S(1,5,8,12位)∶S(2,4,9,11位)∶S(3,10位)=2∶2∶1,和理论值一致。实验结果表明偶联产物为目标产物联苯。
图3 偶联产物的1H NMR谱图
2.2 催化反应机理
2.2.1 NHC -Pd 配合物的解离
NHC-Pd配合物中的 Pd没有空轨道,不能直接参与 Suzuki-Miyaura偶联反应。Nolan等[14]系统研究了配合物Ⅴ的解离原理,结果如图4所示。
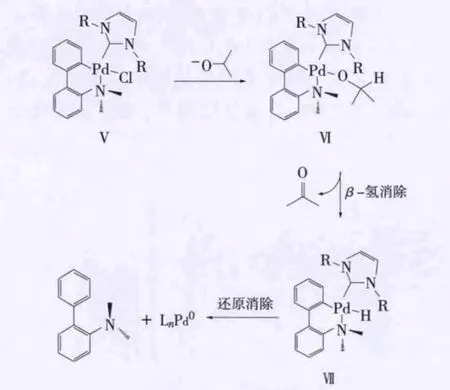
图4 配合物Ⅴ解离原理
在强碱叔丁醇钠作用下,异丙醇脱去氢质子后进攻配合物中的钯金属,发生类似亲核取代反应,生成配合物Ⅵ;然后经过β-氢消除生成丙酮及配合物Ⅶ;最后配合物Ⅶ经过还原消除生成具有催化活性的 LnPd0及N,N-二甲基-2-氨基联苯。LnPd0可直接参与Suzuki-Miyaura偶联反应的催化循环圈。
2.2.2 LnPd0催化 Suzuki-Miyaura 偶联反应
LnPd0作为催化剂直接催化Suzuki-Miyaura偶联反应。Suzuki-Miyaura偶联反应主要包括氧化加成、金属转移和还原消除3个步骤,反应机理如图5所示[16]。LnPd0具有非常好的催化活性,可以高活性地催化氯苯与苯硼酸的Suzuki-Miyaura偶联反应,室温下反应75 min收率达到93%,而常见的催化体系Pd(OAc)2/PPh3在相同的反应条件下收率几乎为0。
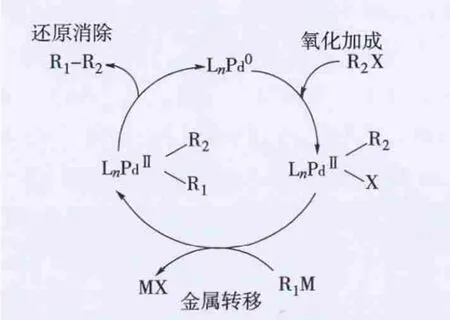
图5 Suzuki-Miyaura偶联反应机理
LnPd0具有空的配位点,有利于底物氯苯的氧化加成。此外LnPd0分子中的卡宾配体具有很强的给电子能力,与过渡金属钯的d轨道形成化学键,电子从卡宾流向钯。在氧化加成过程中,底物的反键轨道中填充来自钯的d轨道富裕电子,进一步减少底物分子键能,有利于氧化加成。在金属转移步骤中碱的选择很重要。对于本催化体系叔丁醇钠有双重作用,一方面作为碱可以中和卤素,另一方面可以促进配合物Ⅴ解离生成LnPd0。在还原消除步骤中,配体的空间位阻起主要作用。LnPd0配体中的异丙基苯具有很大的空间位阻,有利于还原消除。但并非具有大空间位阻和富电子的配体的催化活性一定高,它们之间存在微妙的平衡关系[16]。
3 结论
以2-氨基联苯等为原料制备了高催化活性的NHC-Pd配合物,并以该配合物为催化剂催化氯苯和苯硼酸的Suzuki-Miyaura偶联反应。NHC-Pd配合物的催化活性远高于传统的偶联反应催化剂。
[1]Littke A F,Dai C Y,Fu G C.Versatile catalysts for the Suzuki cross-coupling of arylboronic acids with aryl and vinyl halides and triflates under mild conditions[J].J Am Chem Soc,2000,122(17):4020 -4028.
[2]Wolfe J P,Buchwald S L.A highly active catalyst for the room-temperature amination and Suzuki coupling of aryl chlorides[J].Angew Chem Int Ed,1999,38(16):2413 -2416.
[3]Arduengo III A J,Harlow R L,Kline M.A stable crystalline carbene[J].J Am Chem Soc,1991,113(1):361 - 363.
[4]Altenhoff G,Goddard R,Lehmann C W,et al.An N-heterocyclic carbene ligand with flexible steric bulk allows Suzuki cross-coupling of sterically hindered aryl chlorides[J].Angew Chem Int Ed,2003,42(31):3690-3693.
[5]Hadei N,Kantchev E A,Obrien C J,et al.Room -temperature negishi cross-coupling of unactivated alkyl bromides with alkyl organozinc reagents utilizing a Pd/N-heterocyclic carbene catalyst[J].J Org Chem,2005,70(21):8503-8507.
[6]Grasa G A,Viciu M S,Huang J,et al.Suzuki- Miyaura cross-coupling reactions mediated by palladium/imidazolium salt systems[J].Organometallics,2002,21(14):2866 -2873.
[7]Grasa G A,Nolan S P.Palladium/imidazolium salt catalyzed coupling of aryl halides with hypervalent organostannates[J].Organic Letters,2001,3(1):119-122.
[8]Lee H M,Nolan S P.Efficient cross-coupling reactions of aryl chlorides and bromides with phenyl or vinyltrimethoxysilane mediated by a palladium/imidazolium chloride system[J].Organic Letters,2000,2(14):2053 -2055.
[9]Marion N,Ecarnot E C,Navarro O,et al.(IPr)Pd(acac)Cl:an easily synthesized,efficient,and versatile precatalyst for C-N and C-C bond formation[J].J Org Chem,2006,71(10):3816-3821.
[10]Grasa G A,Viciu M S,Huang J,et al.Amination reactions of aryl halides with nitrogen-containing reagents mediated by palladium/imidazolium salt systems[J].J Org Chem,2001,66(23):7729-7737.
[11]Delaude L,Szypa M,Demonceau A,et al.New in situ generated ruthenium catalysts bearing N-heterocyclic carbene ligands for the ring-opening metathesis polymerization of cyclooctene[J].Adv Synth Catal,2002,344(6/7):749 -756.
[12]Lepley A R,Giumanini A G,Giumanini A B,et al.Benzyne addition to dialkylanilines[J].J Org Chem,1966,31(7):2051-2055.
[13] Beletskaya,Cheprakov A V.The heck reaction as a sharpening stone of palladium catalysis[J].Chem Rev,2000,100(8):3009-3066.
[14]Nararro O,Kelly R A,Nolan S P.A general method for the Suzuki-Miyaura cross-coupling of sterically hindered aryl chlorides:synthesis of di- and tri-ortho-substituted biaryls in isopropanol at room temperature[J].J Am Chem Soc,2003,125(52):16194-16195.
[15]Arduenngo Ⅲ A J,Krafczyk R,Schmutzler R.Imidazolylidenes imidazolinylidenes and imidazolidines[J].Tetrahedron,1999,55(51):14523-14534.
[16]Yu H W,Shi J C,Zhang H,et al.Unsymmetric-1,3-disubstituted imidazolium salt for palladium-catalyzed Suzuki-Miyaura cross- coupling reactions of aryl bromides[J].Journal of Molecular Catalysis A:Chemical,2006,250(1/2):15-19.
