残留复发性肝肿瘤射频消融治疗
——超声造影的应用价值
2014-06-09严昆陈敏华李荣杰吴薇张仲一王延杰杨薇
严昆,陈敏华,李荣杰,吴薇,张仲一,王延杰,杨薇
·非血管介入Non-vascular intervention·
残留复发性肝肿瘤射频消融治疗
——超声造影的应用价值
严昆,陈敏华,李荣杰,吴薇,张仲一,王延杰,杨薇
目的探讨对比增强超声(CEUS)在肝脏残留复发性恶性肿瘤进行射频消融(RFA)治疗的临床应用。方法517例原发性肝癌(HCC)、肝转移癌患者经各种治疗后残留或局部复发拟行RFA治疗,共619个病灶为研究对象。复发HCC 281例290灶,病灶大小平均(3.4±1.5)cm,其中CEUS引导治疗组150例154灶,常规超声引导组131例136灶。另复发肝转移癌236例329灶,病灶大小平均(3.1± 1.3)cm,其中CEUS引导治疗组152例198灶,常规超声引导组84例131灶。结果复发HCC CEUS组与常规组治疗结果比较:1个月肿瘤灭活率分别为96.1%和89.7%(P=0.032);肿瘤局部复发率各为9.7%和17.6%(P=0.049);两组间差异均有统计学意义。复发肝转移癌CEUS组与常规组治疗结果比较:1个月肿瘤灭活率88.4%和87.0%(P=0.712);肿瘤局部复发率16.7%和23.7%(P=0.117),两组间差异均无统计学意义。结论CEUS指导RFA治疗复发HCC,可有效提高早期灭活率,降低局部复发。
超声检查;造影剂;肝肿瘤;射频消融术
射频消融(RFA)治疗肝癌是一项安全有效的局部微创疗法,已被临床广泛应用。超声作为理想的引导治疗手段具有定位准确、实时监控等优点,但在肝脏肿瘤治疗后残留活性部分及复发癌的定性、引导定位方面常常遇到困难。对比增强超声(contrast enhanced ultrasonogra-phy,CEUS)可以确定肿瘤活性区域,与增强CT有良好一致性[1-3],本文探讨CEUS指导RFA治疗肝脏残留复发恶性肿瘤的临床应用。
1 材料与方法
1.1 材料
1.1.1 一般临床资料2004年—2012年,517例肝脏恶性肿瘤患者经各种治疗后残留活性或局部复发者(以下简称残留复发癌),共619个病灶为研究对象,分为原发性肝癌(HCC)、肝转移癌两类。
HCC 281例290灶,病灶大小1.1~8.0 cm,平均(3.4±1.5)cm。残留复发癌来源于:手术切除后146例,介入治疗后95例,RFA后10例,乙醇消融治疗后9例,肝移植后9例,伽马刀治疗后4例,微波消融治疗后3例,其他治疗后5例。其中,手术后、介入治疗后复发HCC占85.8%。复发HCC行RFA治疗中,CEUS引导治疗组150例154灶,常规超声引导为对照组131例136灶,两组病灶大小差异无统计学意义。
肝转移癌236例329灶,病灶大小0.8~7.0 cm,平均(3.1±1.3)cm。残留复发癌来源于:化疗后173例,介入治疗后28例,手术切除后9例,放疗后8例,靶向治疗后4例,RFA后3例,乙醇消融治疗后1例,其他治疗后10例。其中,化疗及介入治疗后占85.2%。复发肝转移癌行RFA治疗中,CEUS引导治疗组152例198灶,常规超声引导为对照组84例131灶。
1.1.2 RFA治疗器材常规超声、CEUS及引导治疗使用超声诊断仪为GE Logiq E9、PHILIPS IU22、Alokaα-10型,探头频率为2.0~5.0 MHz。RFA治疗使用美国RITA RFA系统1500型、美国Cool-tip RFA系统CTRF220型和德国Celon RFA系统,射频发生器频率为460~480 kHz,最大功率200~250W,电极针14~16 G。
1.2 方法
所有肝肿瘤患者均行经皮RFA治疗,由具有多年超声引导及肝肿瘤RFA治疗经验的医师完成。设计消融区尽量覆盖肿瘤病灶并超出其周围0.5~1.0 cm,转移癌有条件者需≥1 cm。应用Celon射频治疗仪器,使用2、3支射频针为一组针同时进行治疗,2针的针间距最大1.5 cm,3针的针间距最大2.0 cm,肿瘤较大时采取一组治疗后,再布针的多组重叠消融模式。应用RITA或Cool-tip射频治疗仪器,使用1支可扩展的多极伞针或直针,一次消融最大径约5 cm,肿瘤较大时采用多个消融灶重叠消融模式[4]。所有患者均采用静脉注射2.5~5 mg咪达唑仑及50~100μg芬太尼诱导的镇静麻醉下进行治疗。详细记录RFA治疗参数。
1.2.1 CEUS组治疗方法RFA治疗前行CEUS检查。采用超声对比剂为SonoVue冻干粉制剂。注入5m l 0.9%氯化钠溶液与冻干粉末振荡溶解制成悬浊液备用。先用基波超声扫查确定病灶可能的位置,然后选择最佳切面进入造影状态,调节声输出功率、焦距、增益,根据不同仪器调节机械指数,使其范围为0.08~0.10。20 G套管针穿刺患者肘静脉后快速团注1.2~2.4ml对比剂悬浊液,迅速用5ml 0.9%氯化钠溶液冲洗套管针,开始注射对比剂的同时启动超声仪内置计时器。CEUS观察肝肿瘤部位、大小、边界,动脉期至实质期动态变化,并详细记录。根据CEUS肿瘤动脉期大小,制订消融方案。
RFA治疗时,应用超声引导装置将射频针迅速插入CEUS显示的肝肿瘤部位进行RFA治疗。对小病灶或超声不能清晰显示的微小灶,采用双幅图像显示模式,其中基波图像可清晰显示穿刺针位置,CEUS图像可确定肿瘤位置和范围,这样可以明确小肿瘤位置进行准确引导治疗;大病灶依CEUS显示肿瘤大小设计多个消融灶多点布针;多血供肿瘤在CEUS肝动脉增强期可进行定位、进针治疗,少血供肿瘤常在肝实质期对比剂廓清时引导进针。当肿瘤在实质期出现对比剂廓清时,引导进针有更充裕的时间。
1.2.2 常规超声引导作为对照组RFA治疗时仅根据常规超声显示的病灶范围,选择不同针型进行一次或多点重叠消融。1.2.3疗效评价及随访RFA治疗后1个月行增强CT或MRI和实验室检查;其后每3个月随访1次。增强CT或MRI显示RFA治疗后消融灶动脉期无增强,为边界清晰的低密度区,可确定为肿瘤病灶灭活;治疗后病灶内外出现动脉期增强区,确定肿瘤为局部残存或复发。HCC患者常规定期行血清甲胎蛋白检测,肝转移癌进行CEA、CA19-9等检测。以RFA治疗后1个月增强CT或MRI判断肿瘤早期灭活率;根据随访结果,原治疗灶周围有活性区判断为肿瘤局部复发。
1.3 统计学处理
2 结果
HCC CEUS组中,90处病灶(58.4%)造影后病变范围较常规超声增大,35处病灶(22.7%)范围较常规超声减小,16处(10.4%)范围与常规超声相等,13处(8.4%)常规超声显示不清而CEUS得以显示(图1)。复发性HCC的CEUS引导组与常规超声引导组治疗结果见表1,肿瘤1个月灭活率及局部复发率两组间差异有统计学意义。
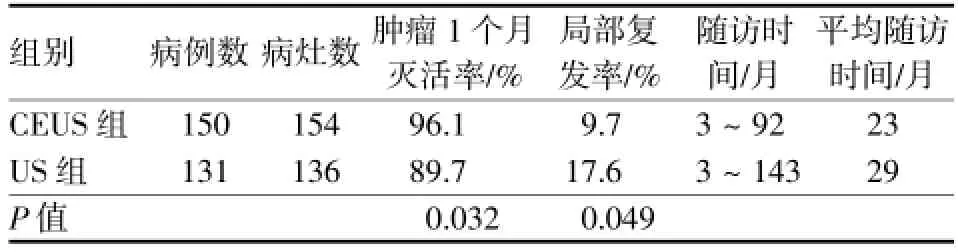
表1 复发HCC的RFA治疗效果
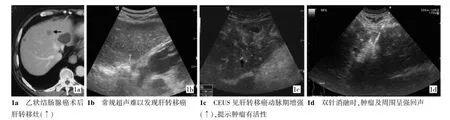
图1 CEUS检出常规超声不为发现的转移灶
肝转移癌CEUS组中,77处(38.9%)造影后病变范围较常规超声增大,50处(25.3%)较常规超声减小,57处(28.8%)与常规超声相等,14处(7.1%)常规超声显示不清而CEUS得以显示。残存活性的肝转移癌CEUS引导组与超声组治疗结果见表2,两组间比较差异无统计学意义。
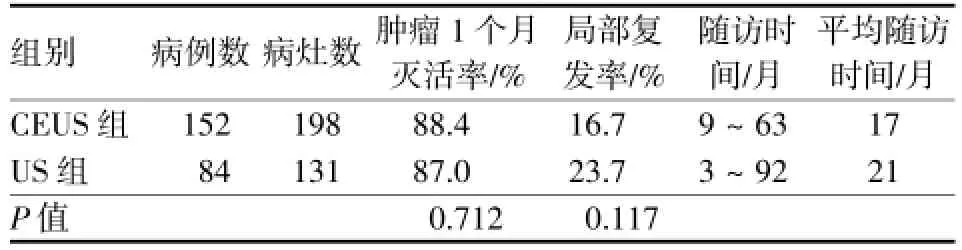
表2 残存活性的肝转移癌RFA治疗效果
应用CEUS或常规超声引导治疗时,HCC与肝转移癌患者,肿瘤1个月灭活率、局部复发率见表3。
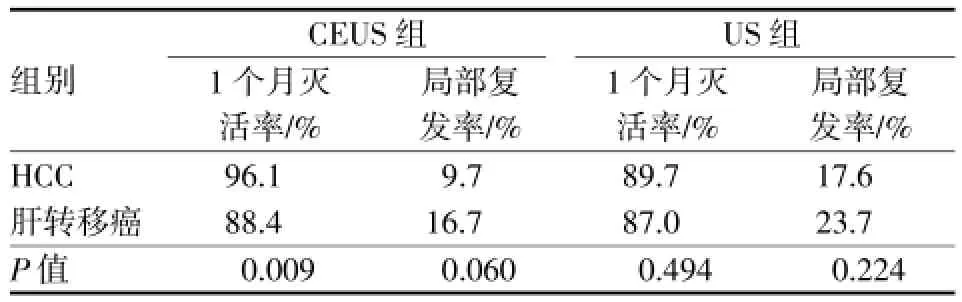
表3 复发性HCC与残留活性肝转移癌RFA治疗效果比较
应用CEUS引导RFA治疗复发性HCC与肝转移癌,肿瘤1个月灭活率两组间差异有统计学意义,HCC 1个月灭活率优于肝转移癌。
3 讨论
超声引导RFA具有实时、操作灵活简便等优点,已成为肝癌局部微创治疗的主要影像引导手段。但当肿瘤显示不清、不能准确判断肿瘤的位置及边界,可造成消融目标偏差;对肿瘤浸润范围判断不足,使RFA治疗安全范围不够,治疗后残留活性或出现局部复发。经过各种治疗后仍然残留活性或复发的肝脏恶性病灶,常不易被常规超声准确识别。
肝脏恶性肿瘤中约98%HCC及88%肝转移癌具有动脉期和(或)门脉期增强的CEUS特点[5],使CEUS能够明确肿瘤性质并可实现准确定位。CEUS对肝细胞癌的检出率较常规超声明显增高,约90%常规超声显示不清的肝细胞癌经CEUS可以检出,其中包括局部治疗残存活性病灶及新生病灶。CEUS对肝转移癌的检出率比常规超声明显提高,且与增强CT相近[6-7]。本研究CEUS组共27灶常规超声图像不能清晰显示肿瘤,而CEUS可显示病灶并可在实时CEUS引导下实施准确的消融治疗。对这类患者的准确治疗,得益于CEUS引导技术。
以往研究显示,CEUS后增强范围较常规超声显示的肿瘤范围增大,反映肿瘤周边大量新生血管形成,此区域肿瘤新生血管与浸润生长癌组织互为因果,使肿瘤不断增大、向周围侵袭[8]。CEUS可反映癌组织旁肿瘤新生血管状况,间接提示瘤旁可能已出现肿瘤浸润。按照CEUS后显示的肿瘤范围进行治疗,对复发性HCC而言,肿瘤1个月灭活率较常规超声引导组有显著提高,同时局部复发率有明显减低,这也说明依照CEUS显示的肿瘤范围进行治疗,可获得更好的局部疗效。
Nakazawa等[9]研究显示,消融区域边缘的安全距离小于0.5 cm是肿瘤进展的独立危险因子。本研究则证实常规超声引导RFA治疗,即使达到0.5 cm安全范围,仍可能低估病灶大小,导致安全范围不足,可能导致未灭活肿瘤1个月内局部复发。因此,对于原发性肝癌,应用CEUS引导,可以更准确有效地完全灭活肿瘤。
一些乏血供肝转移癌在CEUS动脉期仅显示肿瘤周边增强,而实质期及延迟期呈廓清表现,甚至其中一些病灶在常规超声不能显示[7],这些肿瘤需在CEUS实质期进行引导定位治疗。肝转移癌化疗后,CEUS显示肿瘤活性常发生在局部或周边,应用CEUS指导治疗可更有针对性,虽然治疗结果与常规超声引导差异无显著统计学意义,但CEUS引导可对局部复发率有小幅减少。根据CEUS结果扩大消融范围,有望提高肝转移癌消融疗效。但肝转移癌的复发与病程及机体状况等相关,RFA仅为灭活肿瘤的一种局部治疗手段,提高总体疗效需更深入研究并探讨综合治疗。
关于进针时机,与肿瘤增强时相有关。动脉期增强明显的富血供肿瘤,可以在动脉期进针,但动脉期短暂,需要提前做好各项准备。部分残留活性或复发肝癌仅在动脉期增强、实质期无明显廓清,故只能利用短暂的动脉期进针,才能准确插入适当位置,获得完全消融。肝肿瘤CEUS动脉期增强且实质期廓清,或动脉期增强不明显但实质期廓清者,可选择实质期进针。多数肝转移癌实质期病灶显示更清晰且持续时间长约6 min,完全可以满足引导、定位、布针等操作。
CEUS存在局限性,当残留活性病灶位置不佳,例如肿瘤与体表距离过深、位于膈下等超声扫查盲区,应用超声或CEUS引导进行消融治疗较困难,可选择超声与CT或MR融合导航技术进行定位引导,或选择CT等引导进行治疗[10-12]。
[1]葛勇胜,许戈良,李建生,等.增强CT和超声造影检查在肝癌射频消融中的应用价值[J].肿瘤,2012,32:462-465.
[2]丁红,王文平,魏瑞雪,等.实时灰阶超声造影和螺旋CT诊断肝肿瘤的比较研究[J].中国医学影像技术,2004,20:728-730.
[3]严昆,陈敏华,杨薇,等.超声造影评价肝恶性肿瘤射频治疗疗效—与常规超声及增强CT比较[J].中华超声影像学杂志,2005,14:655-658.
[4]Chen MH,YangW,Yan K,et al.Large liver tumors:protocol for radiofrequency ablation and its clinical app lication in 110 patients—mathematic model,overlapping mode,and electrode placement process[J].Radiology,2004,232:260-271.
[5]Dai Y,Chen MH,Yin SS,et al.Focal liver lesions:can SonoVue-enhanced ultrasound be used to differentiatemalignant from benign lesions?[J].Invest Radiol,2007,42:596-603.
[6]Frieser M,Kiesel J,Lindner A,et al.Efficacy of contrastenhanced US versus CT or MRI for the therapeutic control of percutaneous radiofrequency ablation in the case of hepatic malignancies[J].UltraschallMed,2011,32:148-153.
[7]Wu J,Yang W,Yin S,et al.Role of contrast-enhanced ultrasonography in percutaneous radiofrequency ablation of liver metastases and efficacy evaluation[J].Chin J Cancer Res,2013,25:143-154.
[8]曾燕荣,陈敏华,严昆,等.超声造影界定肝癌浸润范围的应用价值[J].中华医学杂志,2006,86:3294-3298.
[9]Nakazawa T,Kokubu S,Shibuya A,et al.Radiofrequency ablation of hepatocellular carcinoma:correlation between local tumor progression after ablation and ablative margin[J].AJR,2007,188:480-488.
[10]Rennert J,Georgieva M,Schreyer AG,et al.Image fusion of contrastenhanced ultrasound(CEUS)with computed tomography(CT)or magnetic resonance imaging(MRI)using volume navigation for detection,characterization and planning of therapeutic interventions of liver tumors[J].Ultraschall Med,2011,49:67-81.
[11]李凯,许尔蛟,郑荣琴,等.融合成像超声造影术中即时评估肝癌射频消融疗效[J].中华超声影像学杂志,2013,22:587-590.
[12]Koh YH,Choi JI,Kim HB,etal.Computed tomographic-guided radiofrequency ablation of recurrent or residual hepatocellular carcinomas around retained iodized oil after transarterial chemoembolization[J].Korean JRadiol,2013,14:733-742.
The clinical application of contrast enhanced ultrasonography in radiofrequency ablation therapy for residual and recurrent hepatic neoplasm s
YAN Kun,CHEN Min-hua,LEE Jung-chieh,WU Wei, ZHANG Zhong-yi,WANG Yan-jie,YANG Wei.Key laboratory of Carcinogenesis and Translational Research(Ministry of Education),Department of Ultrasound,Peking University Cancer Hospital&Institute,Beijing 100142,China
CHEN Min-hua,E-mail:minhuachen@vip.sina.com
ObjectiveTo discuss the clinical app lication of contrast enhanced ultrasonography(CEUS)in radiofrequency ablation(RFA)treatment for residual and recurrenthepatic neoplasms.MethodsA total of 517 cases of primary hepatocellular carcinoma(HCC)or hepatic metastases with residual or recurrent hepatic neoplasms after different kinds of treatment were treated with RFA.A total of 619 lesions were used as study subjects.The average size of the 290 lesions detected in 281 patientswith recurrent HCC was(3.4±1.5)cm.CEUS-guided RFA group included 150 cases(154 lesions in total),while conventional US-guided RFA group included 131 cases(136 lesions in total).A total of 329 lesionswere detected in 236 cases with recurrent hepatic metastases,and the mean size of the lesions was(3.1±1.3)cm,of which CEUS-guided RFA group included 152 cases(198 lesions in total)and conventional US-guided RFA group included 84 cases(131 lesions in total).ResultsIn recurrent HCC,the one-month tumor necrosis rate of CEUS group and conventional US group was 96.1%and 89.7%respectively(P=0.032),and the local recurrence rate was 9.7%and 17.6%respectively(P=0.049).The differences between the two groups were statistically significant.In recurrent hepatic metastases,the one-month tumor necrosis rate of CEUS group and conventional US group was 88.4%and 87.0%respectively(P=0.712),and the local recurrence rate was 16.7%and 23.7% respectively(P=0.117).No significant differences existed between the two groups. Conclusion For the treatment of recurrent HCC,CEUS-guided radiofrequency ablationcan effectively improve the early necrosis rate and decrease local recurrence rate.(J Intervent Radiol,2014,23:496-499)
ultrasonography;contrastagent;hepatic neoplasm;radiofrequency ablation
R735.7
A
1008-794X(2014)-06-0496-04
2014-02-17)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.06.009
北京市科技计划“首都市民健康项目”培育项目(Z111107067311026);北京市卫生系统高层次卫生技术人才培养计划(2013-3-086);国家自然科学青年基金(81101745)
100142北京大学肿瘤医院暨北京市肿瘤防治研究所超声科,恶性肿瘤发病机制及转化研究教育部重点实验室
陈敏华Email:minhuachen@vip.sina.com