2种灌木柳叶片细胞膜相稳定性及抗氧化酶活性对NaCl胁迫的响应
2014-06-09方炎明王保松
周 鹏,方炎明,孙 婷,王保松,张 敏*
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.江苏省林业科学研究院,江苏 南京 211153)
2种灌木柳叶片细胞膜相稳定性及抗氧化酶活性对NaCl胁迫的响应
周 鹏1,方炎明1,孙 婷1,王保松2,张 敏2*
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.江苏省林业科学研究院,江苏 南京 211153)
以2个灌木柳无性系(耐盐型JW2345,盐敏感型SW2367)为试验材料,水培法培养幼苗,盐胁迫(NaCl浓度分别为0,50,100和200 mmol/L)处理幼苗12 d,研究盐胁迫对柳树生长、叶片细胞膜相稳定性及抗氧化酶活性的影响。结果显示:NaCl胁迫抑制了灌木柳幼苗的生长,JW2345受抑制程度明显小于JW2367;在100 mmol/L NaCl处理下,随着NaCl胁迫时间的延长,其细胞膜相稳定性下降,MDA含量增加,但无性系不同,变化幅度不同。叶片CAT活性均先升高后下降,SOD和POD活性变化规律显著不同,JW2345中SOD和POD均显著高于对照,且随处理时间的延长呈升高趋势;短期胁迫对JW2367的SOD活性无影响,长期胁迫诱导其显著上升,而POD活性先增加后降低。研究认为:NaCl胁迫抑制灌木柳幼苗的生长,破坏膜相稳定性。耐盐性较强的JW2345受破坏程度较低,这可能与其维持抗氧化系统平衡密切相关,其中SOD、POD起关键作用。
灌木柳;细胞膜稳定性;丙二醛;抗氧化酶系统
细胞膜是外界盐离子进入细胞的第一道屏障,膜系统的完整性与植物耐盐性呈正相关。当植物受到NaCl胁迫时,细胞膜相的结构和功能受到伤害,膜稳定性降低,植物的正常代谢受到影响[1]。盐胁迫下,植物细胞膜系统的变化包括盐分对膜相的破坏和植物对膜系统的保护2个方面。研究表明,由活性氧(ROS)引起的膜脂过氧化是引起膜伤害的重要原因,膜系统的保护则与植物活性氧代谢平衡密切相关[2-4]。
柳树属杨柳科柳属(Salix L.),种类多,抗性强[5],其中一些品种具有较强的耐盐性[6-7]。目前,有关柳树抗盐性研究已有初步报道[8],而作为盐胁迫原初伤害之一的膜损伤机制研究尚未见到相关报道。本试验采用水培方法,以2个不同耐盐性灌木柳无性系为材料,比较NaCl胁迫下叶片细胞膜相稳定性及抗氧化保护酶的变化规律,探讨盐胁迫下膜稳定性和抗氧化保护酶活性与耐盐性的关系,以期为灌木柳耐盐机理研究及选育耐盐品种提供理论依据。
1 材料与方法
1.1 材料
供试材料为2个灌木柳杂交种无性系:盐耐受型JW2345(Salix suchowensis×S.integra)和盐敏感型JW2367(S.viminalis×S.argyracea)。
1.2 方法
1.2.1 组织培养生根苗 选取灌木柳枝条水培后新长出的嫩茎作为外植体,建立组织培养无性系。增殖培养基为WPM+0.6 mg/L 6-BA+0.05 mg/L NAA+500 mg/L酸水解酪蛋白+1 g/L活性炭,pH 5.8,温度(26±2)℃,光强2 000 lx,光周期16/8 h,继代周期25 d。获得足够数量生长稳定的健壮生根苗。
1.2.2 盐胁迫处理 NaCl处理参照张敏等[9]的方法,选取株高一致、根系发达、生长健壮的组培生根苗,移入塑料套盆中,用NaCl溶液处理,每盆50株。NaCl溶液用1/2 MS液体培养基配制,用量为每盆500 mL,每2 d更换1次培养液。NaCl溶液浓度为0(CK),50,100和200 mmol/L,每个处理重复3次,处理6 d和12 d后取样备测。
1.2.3 生长指标测定 处理12 d后,每个处理组随机取35株幼苗测定植株生物量,每处理重复3次。用蒸馏水冲洗根系,并用吸水纸吸干植株表面水分,放入烘箱,105℃杀青15 min,75℃烘干至恒重,称重。
1.2.4 细胞膜稳定指数测定 分别于NaCl处理6,12 d后,取叶片用去离子水冲洗,然后将表面水吸干,称取相同质量叶片,置于盛有25 mL去离子水的具塞试管中,40℃静置30 min后,测定电导率(L1);然后将试管置于100℃水浴30 min,冷却至室温后测定电导率(L2)。参照Bhutta[2]的方法,计算细胞膜稳定指数(MSI):MSI=(1-L1/L2)× 100%。每个处理重复3个。
1.2.5 MDA含量测定 MDA含量测定参考Agrawal等[10]的方法,略有改动。称取0.5 g叶片,加入5 mL 0.1%的三氯乙酸(TCA),匀浆后15 000×g离心5 min,上清液即为样品提取液。取1 mL上清液,加入4 mL 0.5%的TBA。混合液95℃水浴30 min后,立刻冰浴冷却,10 000×g离心10 min。上清液分别于532 nm和600 nm波长下测定吸光度。
1.2.6 抗氧化酶活性测定
(1)粗酶液制备。称取1 g植物叶片置于研钵中,加入5 mL 50 mmol/L PBS(含1 mmol/L EDTA和1%PVPP,pH 7.0),冰浴下匀浆,13 000×g,4℃离心20 min。上清液即酶液,-20℃保存备测。
(2)酶活性和可溶性蛋白含量测定。抗氧化酶活性和可溶性蛋白含量测定采用南京建成生物工程研究所生产的试剂盒进行。
1.3 统计分析方法
采用Excel 2003及SPSS 13.0对试验数据进行统计分析。
2 结果与分析
2.1 不同浓度NaCl胁迫对灌木柳生物量的影响
结果见图1。由图1可知,处理12 d后,低浓度盐胁迫(50 mmol/L NaCl)下,灌木柳水培苗干质量与对照无显著差异(P>0.05);100 mmol/L NaCl处理后,2个无性系干质量相对于对照均出现显著性差异,且JW2367下降幅度显著大于JW2345(P<0.05);200 mmol/L NaCl胁迫下,JW2345干质量降低幅度进一步增大,而JW2367植株几乎全部萎蔫,此浓度已为JW2367的致死浓度。可见,盐胁迫显著抑制了灌木柳幼苗的生长,且对JW2367生长的抑制作用明显大于JW2345。据此,在下面进行的灌木柳耐盐机理研究中选择NaCl处理浓度为100 mmol/L。
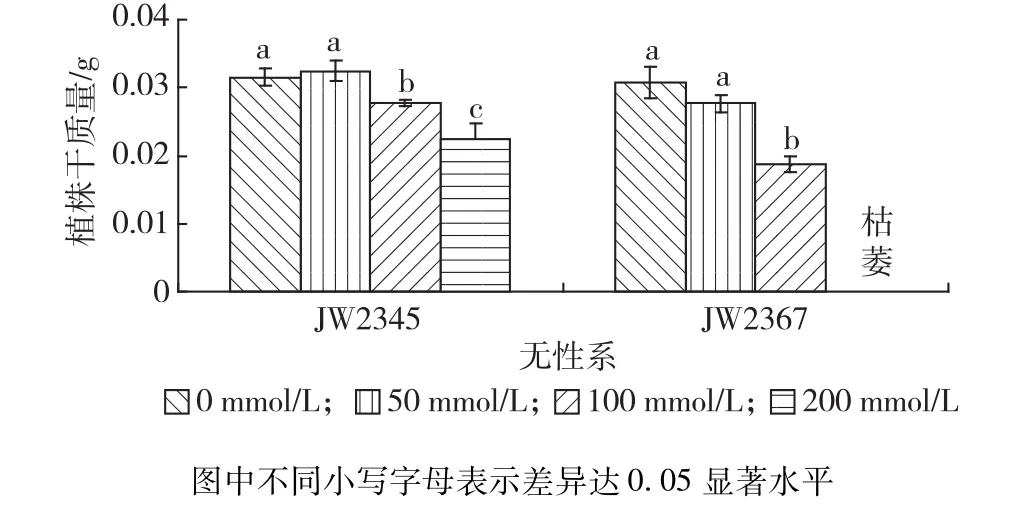
图1 不同浓度盐胁迫对灌木柳无性系植株干质量的影响
2.2 NaCl胁迫对灌木柳叶片质膜稳定性的影响
植物细胞膜稳定性可通过细胞膜稳定指数(MSI)来表示。如图2,在100 mmol/L NaCl胁迫下,2个无性系MSI随胁迫时间延长的变化存在显著差异。短期盐胁迫(6 d)对JW2345幼苗MSI值无显著影响(P>0.05),NaCl处理12 d时MSI值开始显著低于对照,为对照的93.96%。盐胁迫下,JW2367幼苗MSI值显著低于对照,且降低幅度随胁迫时间的延长而增大,12 d时比对照降低15.38%。在相同处理浓度和胁迫时间下,JW2345 MSI均显著高于JW2367。
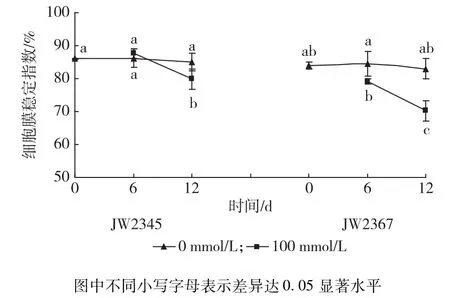
图2 不同浓度盐胁迫对灌木柳无性系叶片MSI的影响
2.3 NaCl胁迫对灌木柳叶片膜脂过氧化作用的影响
MDA是膜脂过氧化的最终产物,是衡量膜系统伤害程度的重要指标之一[11]。从图3可以看出,JW2345叶片MDA含量变化趋势基本与MSI值的变化趋势相反,且相同处理浓度和胁迫时间下,JW2345 MDA含量均低于JW2367。盐胁迫6 d时,JW2345叶片MDA含量与对照差异不显著(P>0.05),12 d时显著高于对照,为对照的1.34倍。NaCl胁迫显著提高JW2367 MDA含量,6,12 d时 MDA含量分别为对照的1.43倍和1.49倍,但12 d时与6 d时无显著差异(P>0.05)。
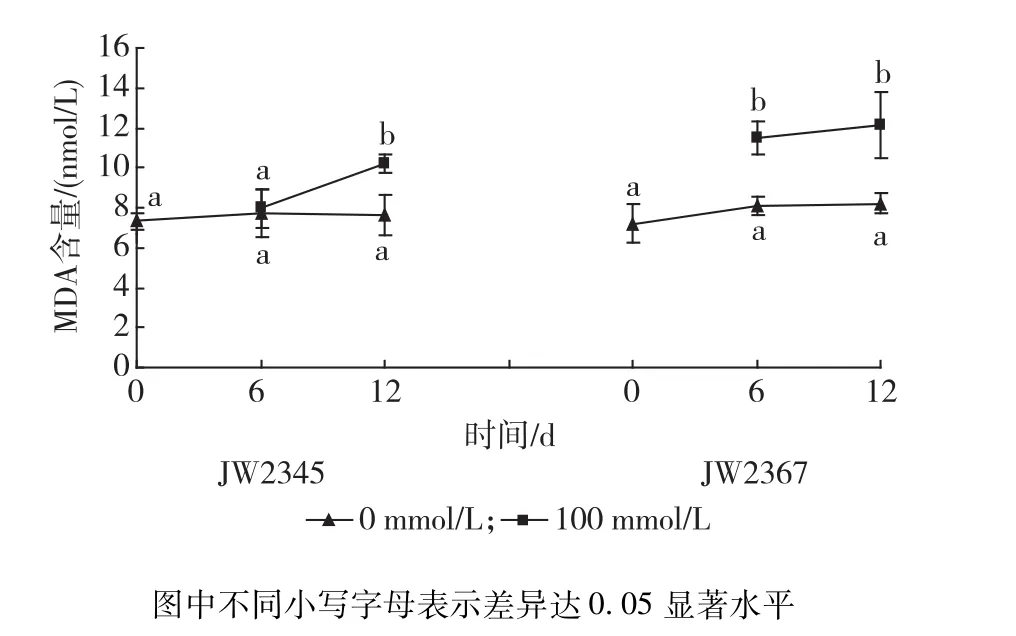
图3 不同浓度盐胁迫对灌木柳无性系叶片MDA含量的影响
2.4 NaCl胁迫对灌木柳叶片抗氧化酶活性的影响
2.4.1 NaCl胁迫对灌木柳SOD活性的影响 由图4可见,在100 mmol/L NaCl胁迫下,JW2345叶片中SOD活性随着盐胁迫时间的延长,呈上升趋势,在盐胁迫6,12 d时分别比对照升高24.29%,54.47%,且差异显著;盐胁迫6 d时,JW2367叶片中SOD活性与对照无显著变化(P>0.05),胁迫12 d时,显著高于对照,为对照的1.29倍。
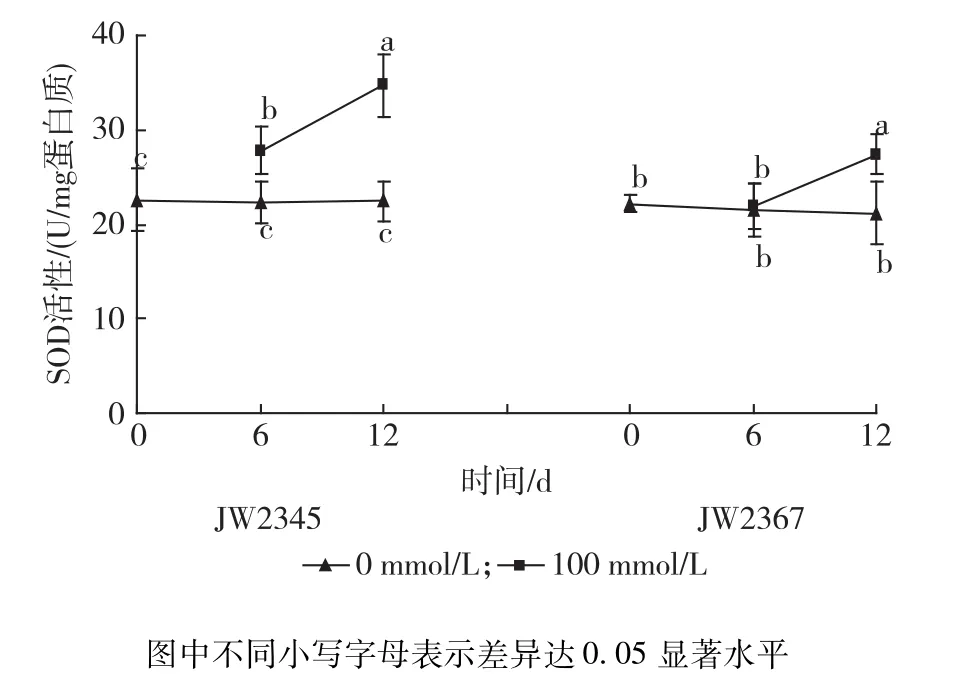
图4 不同浓度盐胁迫对灌木柳无性系叶片SOD活性的影响
2.4.2 NaCl胁迫对灌木柳POD活性的影响 100 mmol/L NaCl浓度下,2个无性系POD活性均显著高于对照(见图5)。其中,JW2345叶片中POD活性随着盐胁迫时间的延长,呈上升趋势,在盐胁迫6 d和12 d时分别比对照升高24.66%和34.70%(P<0.05);JW2367叶片中POD活性随盐处理时间延长,先上升后下降,其在胁迫6 d和12 d时的活性分别为对照的1.21倍和1.14倍。
2.4.3 NaCl胁迫对灌木柳CAT活性的影响 从图6可以看出,在100 mmol/L NaCl浓度下,随着盐胁迫时间的延长,灌木柳幼苗CAT活性变化基本一致,胁迫前期CAT活性显著高于对照(P<0.05),之后又迅速下降,12 d时JW2345仍高于对照,而JW2367已低于对照水平,但与对照的差异均不显著(P>0.05)。
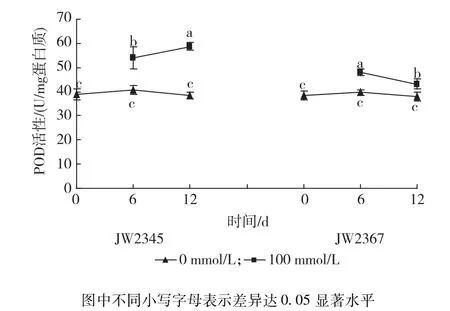
图5 不同浓度盐胁迫对灌木柳无性系叶片POD活性的影响

图6 不同浓度盐胁迫对灌木柳无性系叶片CAT活性的影响
3 结论与讨论
生物量是植物对盐胁迫反应的综合体现,也是评价植物耐盐性的重要指标[12-13]。本试验中,低盐胁迫(50 mmol/L NaCl)对灌木柳幼苗生长没有明显影响;中、高盐胁迫(100~200 mmol/L NaCl)则抑制了2个无性系幼苗的生长,且JW2367生长受抑制程度明显大于JW2345。说明2个无性系的耐盐性存在明显差异,JW2345植株的耐盐性较强。
本试验中,盐耐受型灌木柳JW2345叶片MSI值始终高于盐敏感型JW2367,且线性相关分析显示,干质量与MSI存在极显著的正相关关系(r=0.997,P<0.01)。说明耐盐型JW2345能维持较高的质膜稳定性水平,可能是其对盐胁迫耐受性较盐敏感型JW2367强的原因之一[14]。根据自由基理论[15],植物逆境伤害是由于活性氧代谢平衡失调所致。本研究结果表明,MDA含量与MSI值呈极显著负相关(r=-0.865,P<0.01),盐敏感型JW2367叶片MDA含量显著高于耐盐型JW2345。此外,胁迫后期JW2367 MSI值显著降低,而MDA含量变化不大,这可能是由于质膜严重破坏,细胞内物质流失导致。以上结果说明,盐胁迫下盐敏感型JW2367叶片中由于活性氧代谢平衡失调,膜脂发生过氧化,导致膜稳定性下降[16]。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)是参与活性氧代谢的重要酶类,SOD通过歧化反应催化O·2生成H2O2,H2O2必须进一步被CAT和各种过氧化物酶所清除,3者协同作用,在维持植物体内活性氧的动态平衡方面起着极其重要的作用[17-18]。在100 mmol/L NaCl处理下,胁迫前期JW2345通过诱导提高自身各类保护酶活性,维持活性氧代谢平衡;胁迫后期,SOD、POD活性显著上升,CAT活性有所下降。研究表明,POD对H2O2清除亲和性显著高于CAT[3,19],此时植物可能通过进一步提高POD等过氧化物酶的活性,补偿自身清除H2O2的能力,调节抗氧化系统内部平衡,减轻膜脂过氧化。盐胁迫下JW2367叶片中抗氧化保护酶内部间平衡严重失调,胁迫前期POD、CAT显著高于对照,SOD与对照差异不显著,细胞内大量积累O·2;后期SOD上升,POD和CAT下降,此时H2O2积累,可能转变为破坏性最强的·OH[20],导致质膜稳定性丧失。因此,在一定的盐胁迫下,抗氧化系统平衡情况可作为耐盐性鉴定的指标,在维持膜系统稳定性方面POD可能比SOD占更重要的地位,而CAT在盐胁迫中的抗氧化作用不明显,这与Sergio等[21]研究菊苣(Cichorium intybus L.)耐盐性时所得结论一致。
植物耐盐性与盐逆境下的质膜稳定性显著相关,质膜稳定性又与盐胁迫下植物体内抗氧化系统平衡情况紧密相关。SOD和POD在维持灌木柳活性氧代谢平衡,保证细胞膜稳定性过程中起着关键作用,但抗氧化酶种类较多,尤其是POD,究竟哪类保护酶在维持细胞膜稳定性上起主要作用以及保护酶之间的相互作用如何,还有待进一步研究。
[1] Hajlaoui H,Denden M,El Ayeb N.Changes in fatty acids composition,hydrogen peroxide generation and lipid peroxidation of salt-stressed corn(Zea maysL.)roots[J].Acta Physiologiae Plantarum,2009,31(4):787-796.
[2] Bhutta W M.Antioxidant activity of enzymatic system of two different wheat(Triticum aestivumL.)cultivars growing under salt stress[J].Plant,Soil and Environment,2011,57(3):101-107.
[3] Bor M,Ozdemir F,Turkan I.The effect of salt stress on lipid peroxidation and antioxidants in leaves of sugar beetBeta vulgarisL. and wild beetBeta maritimaL.[J].Plant Science.2003,164(1):77-84.
[4] Duan J J,Li J,Guo S R,et al.Exogenous spermidine affects polyamine metabolism in salinity-stressedCucumis sativusroots and enhances short-term salinity tolerance[J].Journal of Plant Physiology,2008,165(15):1620-1635.
[5] 汪有良,王宝松,施士争.灌木型柳树镉吸收积累性状的研究[J].西北林学院学报,2011,26(2):105-110.
[6] Hangs R D,Schoenau J J,Van Rees K C J,et al.Examining the salt tolerance of willow(Salixspp.)bioenergy species for use on salt-affected agricultural lands[J].Canadian Journal of Plant Science,2011,91(3):509-517.
[7] Zhou J,Liu M Y,Jiang J,et al.Expression profile of miRNAs inPopulus cathayanaL.andSalix matsudanaKoidz under salt stress[J].Molecular Biology Reports,2012,39(9):8645-8654.
[8] 施士争,隋德宗,王红玲,等.灌木柳速生无性系的耐盐性选择研究[J].西北林学院学报,2010,25(4):72-77.
[9] 张 敏,李荣锦,黄利斌,等.NaCl胁迫下构树幼苗液泡膜生理生化响应[J].林业科学,2009,45(8):50-55.
[10]Agrawal R,Gupta S,Gupta N K,et al.Effect of sodium chloride on gas exchange,antioxidative defense mechanism and ion accumulation in different cultivars of Indian jujube(Ziziphus mauritianaL.)[J].Photosynthetica,2013,51(1):95-101.
[11]Koca H,Bor M,Ozdemir F,et al.The effect of salt stress on lipid peroxidation,antioxidative enzymes and proline content of sesame cultivars[J].Environmental and Experimental Botany,2007, 60(3):344-351.
[12]Wani A S,Ahmad A,Hayat S,et al.Salt-induced modulation in growth,photosynthesis and antioxidant system in two varieties ofBrassica juncea[J].Saudi Journal of Biological Sciences,2013,20(2):183-193.
[13]Bavei V,Shiran B,Arzani A.Evaluation of salinity tolerance in sorghum(Sorghum bicolorL.)using ion accumulation,proline and peroxidase criteria[J].Plant Growth Regulation,2011,64(3):275-285.
[14]Sairam R K,Srivastava G C,Agarwal S,et al.Differences in antioxidant activity in response to salinity stress in tolerant and susceptible wheat genotypes[J].Biologia Plantarum,2005,49(1):85-91.
[15]Karihtala P,Soini Y.Reactive oxygen species and antioxidant mechanisms in human tissues and their relation to malignancies[J].APMIS,2007,115(2):81-103.
[16]Demiral T,Turkan I.Comparative lipid peroxidation,antioxidant defense systems and proline content in roots of two rice cultivars differing in salt tolerance[J].Environmental and Experimental Botany,2005,53(3):247-257.
[17]Dolatabadian A,Sanavy S,Chashmi N A.The effects of foliar application of ascorbic acid(Vitamin C)on antioxidant enzymes activities,lipid peroxidation and proline accumulation of canola(Brassica napusL.)under conditions of salt stress[J].Journal of Agronomy and Crop Science,2008,194(3):206-213.
[18]Rasool S,Ahmad A,Siddiqi T O,et al.Changes in growth,lipid peroxidation and some key antioxidant enzymes in chickpea genotypes under salt stress[J].Acta Physiologiae Plantarum,2013,35(4):1039-1050.
[19]Nawaz K,Ashraf M.Exogenous application of glycinebetaine modulates activities of antioxidants in maize plants subjected to salt stress[J].Journal of Agronomy and Crop Science,2010,196(1):28-37.
[20]班兆军,关军锋,李 莉,等.非生物胁迫下植物体内活性氧产生和抗氧化机制的研究概述[J].中国果菜,2012(5):40-47.
[21]Sergio L,De Paola A,Cantore V,et al.Effect of salt stress on growth parameters,enzymatic antioxidant system,and lipid peroxidation in wild chicory(Cichorium intybusL.)[J].Acta Physiologiae Plantarum,2012,34(6):2349-2358.
Membrane stability and antioxidant enzyme activity in the leaves of two clones of shrub willow in response to salinity stress
ZHOU Peng1,FANG Yan-ming1,SUN Ting1,WANG Bao-song2,ZHANG Min2*
(1.College of Forest Resources and Environment,Nanjing Forestry University,Nanjing 210037,China;2.Jiangsu Academy of Forestry,Nanjing 211153,China)
Differential response of two clones of shrub willow,namely,salt-tolerant clone JW2345 and salt-sensitive clone JW2367,to salinity stress in relation to membrane stability and antioxidant enzyme activity were evaluated.The plantlets were treated with NaCl solution at 0,50,100,or 200 mmol/L for 12 days.The results showed that the growth of shrub willow plantlets was inhibited,and the extent of inhibition for Clone JW2345 was less than that for Clone JW2367.Under 100 mmol/L NaCl stress,the membrane stability decreased with the stress time duration while the contents of MDA increased. Moreover,the degree of variation in different clones was different.CAT activities increased at the sixth day and decreased at the twelfth day in both clones.In the leaves of Clone JW2345,NaCl treatment elevated the activities of SOD and POD,and the enzymatic activities increased with the treatment time duration.In contrast,there was no obvious alteration in SOD activities in Clone JW2367 at the sixth day,however,the activities increased dramatically at the twelfth day.POD activities increased sharply at the sixth day,and then the activities declined after the treatment with NaCl for 12 days.Altogether,these results suggested that the growth of shrub willow was inhibited by salinity stress,and the membrane stability was destroyed.Furthermore,the membrane stability of the salt-tolerant clone JW2345
less attack,which might be attributed to the maintenance of the balance of antioxidant system,among which SOD and POD played a critic role.
Shrub willow;Membrane stability;MDA;Antioxidant enzymes
S792.12
A
10.3969/j.issn.1001-7380.2014.02.001
1001-7380(2014)02-0001-05
2014-03-10;
2014-03-14
国家自然科学基金“NaCl胁迫下一氧化氮调控灌木柳液泡膜H+-ATPase的分子机制”(31300515);江苏省自然科学基金“柳树H+-ATPase响应NaCl胁迫的分子机制”(BK2011872)
周 鹏(1989-),男,硕士研究生,主要从事植物生理生化研究。
*通信作者:张 敏(1980-),女,内蒙古人,副研究员,博士,主要从事植物抗逆生理及林木花卉良种繁育研究。
