活体猪肢体长骨多极射频消融灶影像与病理改变对照研究
2014-06-09陈锦州赵卫黄建强胡继红钱忠义
陈锦州,赵卫,黄建强,胡继红,钱忠义
·实验研究Experimental research·
活体猪肢体长骨多极射频消融灶影像与病理改变对照研究
陈锦州,赵卫,黄建强,胡继红,钱忠义
目的通过对活体猪胫骨行经皮多极射频消融(radiofrequency ablation,RFA),观察骨端及骨干多极RFA灶的病理及影像改变,探讨与影像改变对应的病理组织学变化。方法麻醉状态下,于8只实验活体猪胫骨骨端、骨干的相同位置行多极RFA,于术后按实验设定时间处死实验动物,获取骨端、骨干标本,并在此过程中进行活体动物RFA部位X线、CT检查,肉眼观察标本及测量后行骨切片、HE染色,镜下观察。结果X线及CT检查示骨端多极RFA灶早期无明显影像学改变;随后边缘出现低密度带,为肉芽组织吸收坏死骨质至骨密度减低所致,并向中部逐渐扩展;随后在低密度区外缘见骨质硬化带,为肉芽组织成熟形成的纤维组织内新骨形成所致,并向内缓慢填充。骨干多极RFA灶影像及病理改变大致与骨端相同,但易合并骨干病理性骨折及死骨形成。结论多极RFA灶X线及CT影像改变能反映其病理组织学变化,可作为骨肿瘤RFA灶的有效随访手段。
肢体长骨;多极射频消融;活体动物;影像学;病理学
【Key words】long bone of limb;multi-polar radiofrequency ablation;living animal;imaging;pathology
射频消融(radiofreqency ablation,RFA)已用于治疗多种骨肿瘤[1-4],目前临床多关注RFA是否能损毁骨肿瘤,基础研究多关注骨质内的消融范围及热场分布规律,而对RFA灶在RFA后的影像学改变与组织学改变的对照研究,目前报道甚少。
1 材料与方法
1.1 实验动物
采用云南小耳活猪8头,日龄(91±5.6)d,体重(53±7.4)kg,由昆明医科大学动物科提供。
1.2 实验方法
8头猪中取1只作为对照。其余7只在麻醉状态下,于右侧胫骨骨端、骨干的相同位置行RFA(RFA-I型多极射频肿瘤消融系统),术后部分动物继续饲养观察,为预防感染,给予庆大霉素肌内注射8万u每天3次,共5 d。按实验方案,麻醉下7只动物分别行X线和CT检查,获取RFA后0、3、10、24 d和5、8、12周X线及CT检查图像。影像检查后立即深度麻醉处死动物,获取对应RFA后0、3、10、24 d和5、8、12周及空白对照动物骨端、骨干标本共16个。获取的标本立即用4%甲醛固定,沿RFA针道纵向剖开RFA灶,力求获得RFA灶最大剖面,并保留邻近软组织结构,肉眼观察及测量后送病理室行骨切片,HE染色,镜下观察。RFA条件:中心温度90℃,持续时间15min。
2 结果
2.1 骨端影像学和病理学对比
X线及CT检查见多极RFA后0、3 d,除钉状低密度针道外,骨端RFA灶未见明确异常改变;RFA灶中部有椭圆形灰白色区域光,镜下见组织结构形态基本保存,周围灰褐色环状出血带,组织内多发灶性出血。RFA后10 d,RFA灶边缘见椭圆形窄带状低密度区,该区域在大体标本上即为原出血带,其灰褐色基本消失,部分略呈白色,光镜下可见炎性细胞浸润、肉芽组织形成,呈现典型的凝固性坏死改变,该区内部分肉芽组织外侧可见纤维组织带形成,外侧及内侧骨质均未见影像学改变,但内侧骨组织大体标本呈灰白色,镜下结构形态基本保存完整,外侧骨组织大体标本及镜下结构形态均正常(图1)。RFA后24 d和5、8及12周,边缘低密度区向内逐步增宽并扩展至中心,低密度带外缘见环状骨质增生硬化,并逐渐向内缓慢填充,该区域大体标本呈白色,镜下主要为纤维组织,在纤维组织内见多量成纤维细胞及其产生的尚未成熟骨质;在该低密度带内侧缘可见肉芽组织及典型的凝固性坏死(图2),其内部尚未被吸收的骨质组织结构尚基本保存。
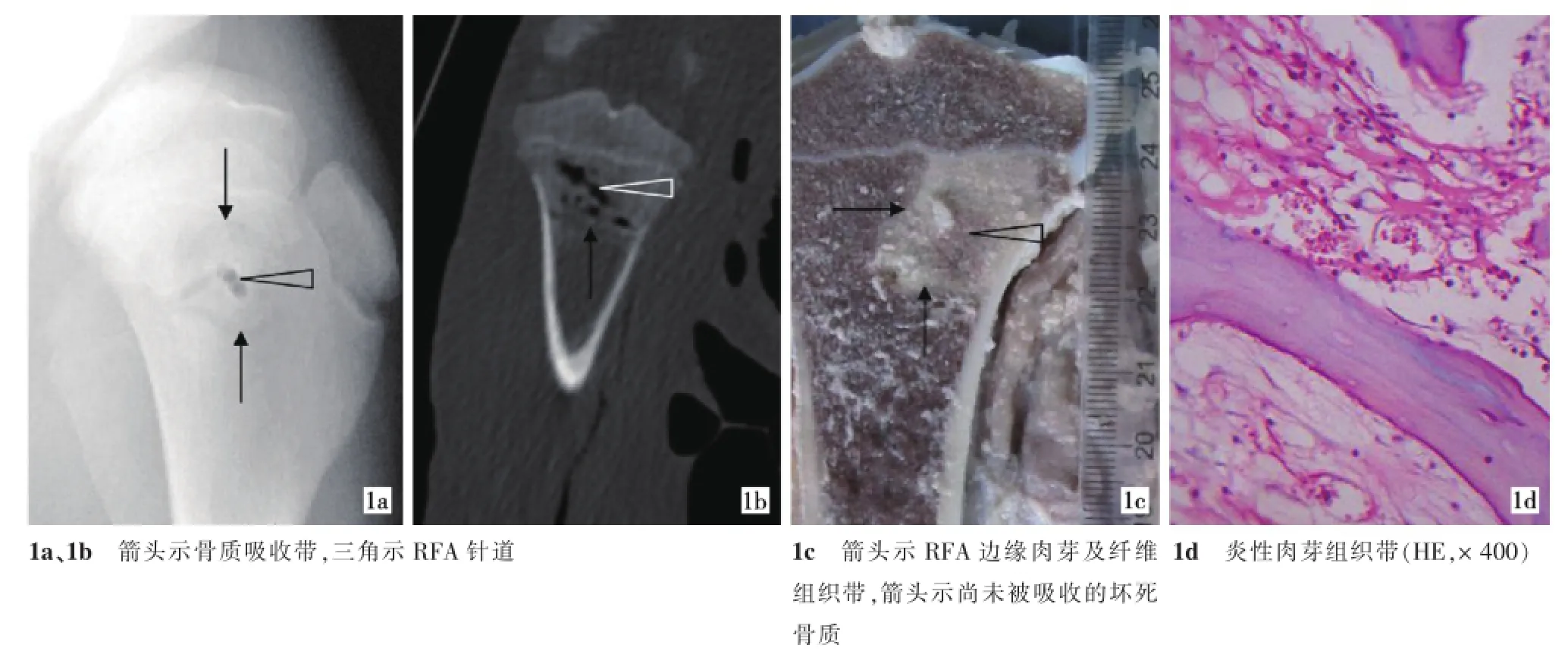
图1 RFA后10 d骨端标本的影像学和病理学所见
2.2 骨干影像学和病理学对比

图2 RFA后5周骨端标本的影像学和病理学所见
多极RFA后0、3 d,骨干X线及CT检查除骨皮质内钉状低密度针道外,骨髓组织及外缘骨皮质均未见明显改变;大体标本RFA灶中部椭圆形灰白区域及周围环状灰褐色带光镜下大部分脱落,而周围骨皮质及骨膜镜下未见明显改变。RFA后10、 24 d,RFA灶内骨髓密度减低,呈长椭圆形;大体标本中部的椭圆形灰白区域及周围环状灰褐色带,镜下亦大部分脱落,周围骨皮质正常(图3)。RFA后5、8周,RFA区域出现骨干死骨形成,继发病理性骨折,死骨长约4 cm;在大体标本上死骨呈灰黑色,并可见脓液、闻及恶臭,骨皮质外围多量环状骨痂形成,特别是断端靠近骨端侧,光镜下可见纤维组织内大量纤维母细胞及其产生的尚未成熟骨质(图4)。RFA后12周,髓腔内外大量骨痂形成,骨质硬化、致密,髓腔缩小、狭窄,镜下均见大量新生的尚未完全成熟的骨质。

图3 RFA后10 d骨干标本的影像学和病理学所见
3 讨论
既往基础研究显示,RFA能有效的损毁松质骨及骨髓组织[5],RFA灶呈以消融针为长轴的椭圆形,在骨皮质的产生直径约1 cm、50°以上的高温区,而在骨髓为1.7 cm,且能破坏RFA灶周围直径小于3 mm的血管,RFA灶的损毁范围与射频消融仪功率、射频消融电极的长度及子针的空间分布、组织血供是否丰富等有关[6]。
本实验显示RFA对活体猪松质骨及骨髓有明确的损毁作用,其坏死区符合凝固性坏死改变,与软组织内RFA灶的坏死类型相同[6]。故RFA损毁骨肿瘤及其边缘肿瘤组织与正常骨组织交织存在的区域,提高肿瘤组织完全坏死率,减低残存率,提高患者的生存期。
X线及CT检查可用于临床评估RFA范围是否满足治疗需求,是否需补充治疗,也可用于RFA后的随访评估。本实验显示骨RFA灶的影像改变能反映其病理组织学改变,X线及CT检查所示RFA边缘的低密度骨质吸收区对应于光镜下RFA灶的坏死区边缘,提示可根据RFA后骨质吸收形成的低密度带确定骨质RFA灶实际坏死边缘及范围,这对临床确定RFA的范围有重要意义。

图4 RFA后5周骨干标本的影像学和病理学所见
本实验中,RFA后0、3、24 d,骨干RFA灶边缘骨皮质并未出现坏死的影像学改变,而5周或8周后出现死骨形成及病理性骨折,结合既往研究提示热量对密质骨损伤作用有限[7],推测死骨形成可能与RFA破坏骨干骨皮质髓腔侧2/3血液供应和实验猪无法有效制动有关,而与RFA热量直接损伤所致可能性不大。这也提示骨干RFA时消融范围不能过大、过多的损毁皮质血供,否则可能会引起死骨形成及病理骨折。
RFA后,RFA灶周围正常骨质的修复过程与骨折的愈合过程相似,均在纤维组织内的成纤维细胞作用下,先形成细胞外基质,继而钙盐沉积形成骨质,与既往研究结果相同[8-9]。
由于骨组织在不同种属动物间存在高度同源性[10],因此本实验获得的结果可以为临床骨肿瘤RFA治疗提供参考。
本实验探讨了多极RFA后活体动物长骨的X线及CT影像学改变,为临床开展骨肿瘤的RFA治疗提供了有价值的参考信息。
[1]Palussière J,Pellerin-Guignard A,Descat E,et al. Radiofrequency ablation of bone tumours[J].Diagn Interv Imaging,2012,93:660-664.
[2]Cantwell CP,O’Byrne J,Eustace S.Radiofrequency ablation of osteoid osteoma with cooled probes and impedance-control energy delivery[J].Am JRoentgenol,2006,186(5 suppl):S244-S248.
[3]Corby RR,Stacy GS,Peabody TD,et al.Radiofrequency ablation of solitary eosinophilic granuloma of bone[J].Am J Roentgenol,2008,190:1492-1494.
[4]Om lor G,Merle C,Lehner B,et al.CT-guided percutaneous radiofrequency ablation in osteoid osteoma:re-assessments of results with optimized technique and possible pain patterns in mid-term follow-up[J].Rofo,2012,184:333-339.
[5]王会,赵卫,胡继红,等.射频消融对活体动物肢体长骨的损毁情况[J].介入放射学,2013,22:219-222.
[6]汝鸣,蔡郑东,郑龙坡,等.Paiban骨组织单电极射频消融的范围及热场分部[J].中国组织工程研与临床康复,2008,12:5865-5868.
[7]Bitsch RG,Rupp R,Bernd L,et al.Osteoid osteoma in an ex vivo animal model:temperature changes in surrounding soft tissue during CT-guided radiofrequency ablation[J].Radiology,2006,238:107-112.
[8]Widmann RF,Amaral TD,Yildiz C,et al.Percutaneous radiofrequency epiphysiodesis in a rabbit model:a pilot study.[J].Clin Orthop Relat Res,2010,468:1943-1948.
[9]胡继红,王会,赵卫,等.射频消融对活体动物肢体长骨损毁后的修复过程[J].介入放射学杂志,2013,22:670-673.
[10]戴景兴,杨林林,曲戎梅,等.猪源性骨支架材料的制备及性能研究[J].中国临床解剖学杂志,2007,25:439-442.
M ulti-polar radiofrequency ablation of pig’s long bones in vivo:comparison study between imaging
and pathology
CHEN Jin-zhou,ZHAO Wei,HUANG Jian-qiang,HU Ji-hong,QIAN Zhong-yi.
Department of Interventional Radiology,General Hospital,Medical Group of Pingdingshan Coal and Shenma Association,Pingdingshan,Henan Province 467000,China
ZHAOWei,E-mail:Kmyxy4117@163.com
ObjectiveTo observe the pathologic and imaging changes of pig’s diaphysis and epiphysis caused bymulti-polar radiofrequency ablation(RFA),and to discuss the relationship between the imaging findings and pathologic changes.MethodsUnder general anesthesia,RFA was carried out on the upper epiphysis and diaphysis of experimental pig’s tibias.Different operation time was used for RFA according to the experiment scheme,and then the pigswere executed by over anesthesia in order to gain the specimen of the upper epiphysis and diaphysis of the experimental pigs’tibias.X-ray and CT examination were performed before the experimental pigs were sacrificed.The specimens thus collected were sent for pathological exam ination,both macroscopically and m icroscopically.HE dyeing was used.ResultsX-ray and CT scanning showed thatat early stage therewas no obvious imaging changes in RFA lesions.Then,lowdensity zone appeared at the edge of the lesions,which was due to the absorption of the necrotic bone by granulation tissue.Shortly after that,a zone of bone sclerosis emerged around the low-density area,which was due to the new bone formation within the fibrous tissue that was produced by the mature granulation tissue,and the bone tissue slowly filled the lesion.The pathologic and imaging changes of ablated diaphysis were quite the same as those of the epiphysis,but the pathological fracture of epiphysis and the formation of necrotic bone occurred more easily.ConclusionX-ray and CT scanning can reflect the pathologic changes of the ablated lesions created by multipolar radiofrequency.Therefore,imaging examination can be used as an effective follow-up means for checking the RFA lesions of bone tumor.(J Intervent Radiol,2014,23:325-328)
R454.5,R812
B
1008-794X(2014)-04-0325-04
2013-02-10)
(本文编辑:侯虹鲁)
10.3969/j.issn.1008-794X.2014.04.013
467000河南平顶山平煤神马医疗集团总医院介入放射科(陈锦州);昆明医科大学第一临床医学院影像中心介入放射科(赵卫、黄建强、胡继红);昆明医学院病理教研室(钱忠义)
赵卫E-mail:Kmyxy4117@163.com
