射频消融治疗心房颤动前后肺静脉形态结构的变化
2014-06-09林明宽梁柳丹刘浩唐梅艳赵秋燕周祥群杨大英杜永才
林明宽,梁柳丹,刘浩,唐梅艳,赵秋燕,周祥群,杨大英,杜永才
·心脏介入Cardiac intervention·
射频消融治疗心房颤动前后肺静脉形态结构的变化
林明宽,梁柳丹,刘浩,唐梅艳,赵秋燕,周祥群,杨大英,杜永才
目的利用CT三维成像技术研究心房颤动(房颤)患者行环肺静脉电隔离术前后肺静脉形态学的变化。方法2008年5月至—2011年7月对24例房颤患者行房颤环肺静脉电隔离术,用64排螺旋CT行心脏扫描。研究随访射频消融(RFA)术后3~6个月患者肺静脉的形态改变特点,并与术前进行对比。结果与术前相比,术后左上肺静脉口最大径、右下肺静脉口最小径、左上肺静脉口截面积差异无统计学意义(P>0.05),但其他肺静脉口参数最大径、最小径和截面积差异有统计学意义(P<0.05)。与术前相比,术后右下肺静脉圆度差异有统计学意义(P<0.05),而其他肺静脉口参数、肺静脉指数及圆度差异无统计学意义(P>0.05)。男女性别间肺静脉口参数差异无统计学意义(P>0.05)。24例患者中,右肺静脉开口3支变异达21%,左肺静脉开口3支变异达4%,右肺静脉多支变异达4%。结论房颤患者的肺静脉和左心房一样具有解剖重构,RFA后可逆转其重构。肺静脉开口变异中,右肺静脉开口变异较大。
心房颤动;肺静脉;射频消融术;影像学
心房颤动(房颤)是临床上最常见的一种快速性心律失常。近十年来,射频消融已得到迅速发展,肺静脉消融隔离的可行性已得到公认。导管射频治疗无疑是最有可能使房颤得以彻底攻克的治疗措施。
如何改善肺静脉的消融隔离术是治疗房颤的重要环节,已成为目前医学界研究的热门话题。本文报道对房颤患者消融前后肺静脉形态结构的CT成像,从而为减少房颤射频消融术(RFA)并发症及对手术方法的改进等提供有价值的信息。
1 材料与方法
1.1 临床资料
2008年5月—2011年7月对24例因药物疗效欠佳或不愿接受长期口服抗心律失常药治疗的房颤患者行房颤RFA,其中男12例,女12例,年龄为34~76岁,平均(59±11)岁;阵发性房颤17例,持续性房颤7例(永久性房颤患者也归入持续性房颤)。术前常规行左心房及肺静脉64排螺旋CT三维重建成像,并用华法林抗凝3个月,保持凝血酶原时间(PT)国际正常化比值(INR)在2~3。所有患者均经食管超声心动图检查,排除左房血栓。如有心房血栓证据,必须给予正规抗凝治疗1个月后进行复查,在证实血栓消失后再行电隔离手术。所有患者均签署知情同意书。剔除胸廓畸形、纵隔肿瘤、化疗引起的肺纤维化、肺实变、肺膨胀不全、心包积液、胸腔积液、先天性心脏病及心功能不全等会影响或改变肺静脉直径及外形的患者。
1.2 术后用药与随访
术后皮下注射低分子肝素5 d,第3天加用华法林口服并维持1个月。所有病例口服胺碘酮抗心律失常3个月。术后1 d复查体表心电图、经胸超声心动图。采用门诊电话随访,若有复发随时报告。术后3~6个月复查64排螺旋CT。收集患者术前和术后的CT影像学资料进行对比分析。
1.3 影像学分析
1.3.1 肺静脉口测量经线三维重建仿真内镜腔内面、垂直于各肺静脉开口最大平面下分别测量左上肺静脉口最大径、左上肺静脉口最小径、左下肺静脉口最大径、左下肺静脉口最小径、右上肺静脉口最大径、右上肺静脉口最小径、右下肺静脉口最大径、右下肺静脉口最小径。肺静脉开口呈椭圆形,形状多不规则(图1、2)。

图1 右肺静脉口最大径及最小径的测量

图2 左肺静脉口最大径,最小径的测量
1.3.2 肺静脉口测量面积采用肺静脉分析软件,沿长轴重组出肺静脉二维图像,静脉的血管腔内成像及垂直于静脉长轴的最佳斜面,由此得到截面积,如左上肺静脉口截面积、左下肺静脉口截面积、右上肺静脉口截面积、右下肺静脉口截面积,见图3、4。如果4条肺静脉横截面都非完全圆形,我们可用圆度评估。通过用公式截面积除以最大直径获得的截面积估计圆度,如果截面为正方形,圆度为π/2,如果截面为圆形,圆度为1。

图3 在冠状面测量肺静脉口面积
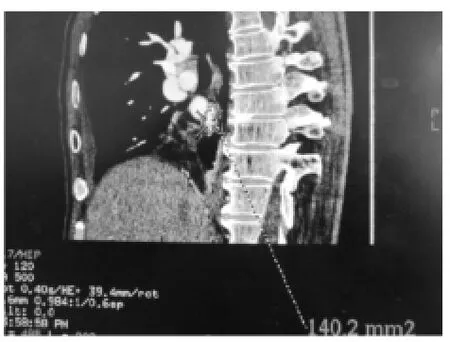
图4 在矢状面测量肺静脉口面积
1.3.3 左房需测量的径线左房横径、左房上下径和左房前后径。在冠状面上测量左房的最大横径(LA1),见图5;矢状面上测其最大上下径(LA2)和最大前后径(LA3),见图6。通过公式V=4/3π(LA1/2)(LA2/2)(LA3/2)计算左房容积。
1.4 统计学分析
应用SSPS13.0软件进行统计分析,所有计量资料以均数±标准差表示。两组计量资料的比较采用两独立样本T检验分析及配对T检验分析,两组计数资料比较采用卡方检验,P<0.05为差异有统计学意义。

图5 在冠状面测量左房横径(直线)

图6 在矢状面测量左房上下径、前后径(长线=下径,短线=后径)
2 结果
2.1 肺静脉变异分析
正常肺静脉开口有4个,即左上、左下、右上和右下肺静脉口。本研究发现具标准肺静脉4支者18例,右肺静脉3支者4例,右肺静脉4支者1例,左肺静脉3支者1例,表明肺静脉开口异常多见于右肺静脉。见表1。

表1 不同性别患者的肺静脉变异分析
2.2 肺静脉口参数与性别分析
从表2可见,男性组肺静脉口的最大径、最小径、指数、截面积、圆度与女性组差异无统计学意义(P>0.05)。
2.3 RFA治疗前后肺静脉口参数比较
从表3可见,与术前相比,术后除了左上肺静脉口的最大径、右下肺静脉口的最小径和左上肺静脉口截面积差异无统计学意义(P>0.05)外,其他肺静脉口参数最大径、最小径及截面积差异有统计学意义(P<0.05)。与术前相比,术后右下肺静脉圆度差异亦有统计学意义(P<0.05),而其他肺静脉口参数指数及圆度则差异无统计学意义(P>0.05)。
3 讨论
肺静脉口是指肺静脉进入左心房与左心房相交界的解剖部位,由于两者在胚胎组织上起源不同,使此部位具有心房和肺静脉双重组织学特性,肌束排列紊乱,从而导致此部位的传导常存在明显延缓和多向传导阻滞,从而易产生折返性激动[1]。Schwartzman等[2]通过多排螺旋CT发现房颤患者肺静脉直径比正常人大;持续性房颤患者比阵发性房颤患者大,从而得出房颤会引起肺静脉发生结构重构的结论。Rostock等[3]研究发现房颤本身导致肺静脉重构,而这种重构反过来又会增加房颤的易感性从而产生恶性循环。
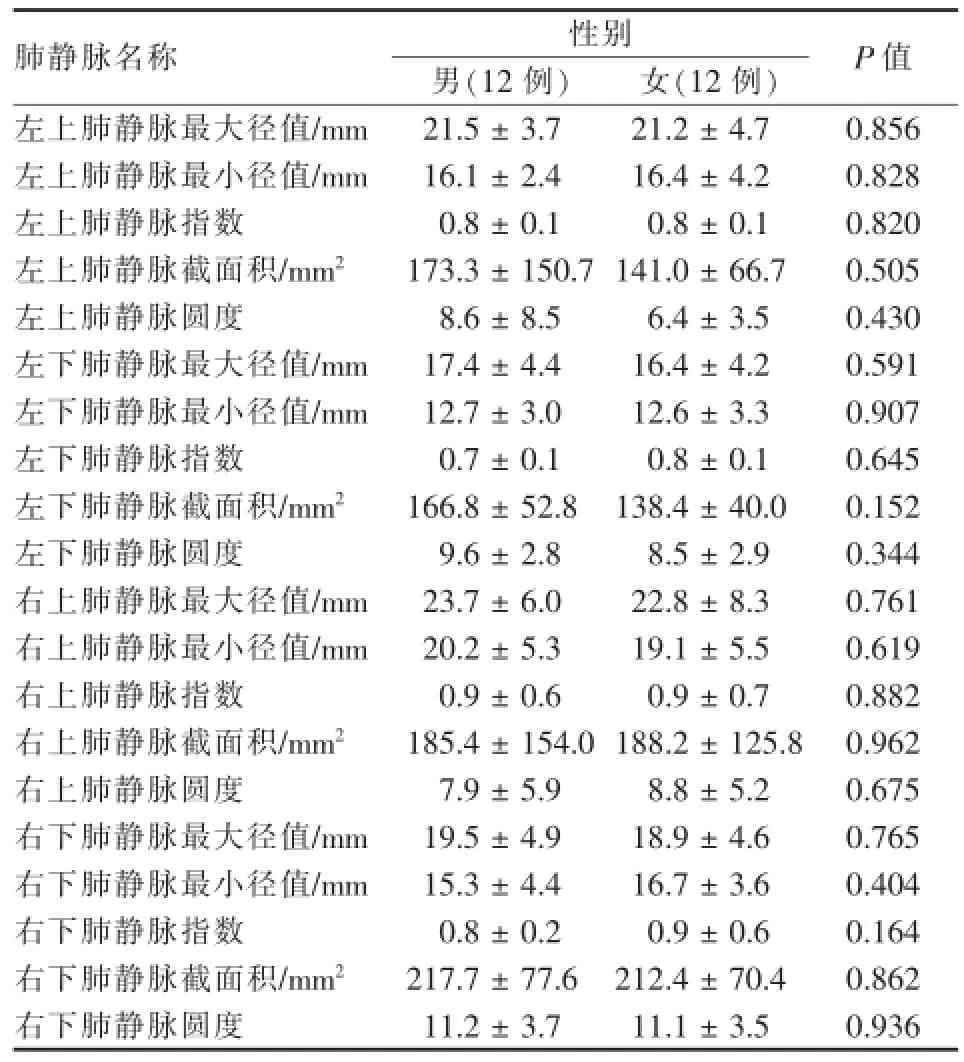
表2 术前4条肺静脉口参数的性别比较

表3 24例患者RFA治疗前后肺静脉口大小的比较
本研究显示右肺静脉开口3支变异达16.6%,左肺静脉开口3支变异达4.2%,右肺静脉开口多支变异达4.2%,从而说明在肺静脉开口变异中,右肺静脉开口变异比例较高。Thorning等[4]研究176支肺静脉断层摄影术发现,右侧肺静脉开口变异较大,有2个开口者占82%,3个开口者占17%,4个开口者占0.5%,有共干者占0.5%;左侧肺静脉开口2个者占91%,共同开口者占8.5%,3个开口者占0.5%。
本研究发现房颤患者男女肺静脉口差异无统计学意义。我们认为有以下因素:①样本量小,不足以产生统计学差异。②正常情况下,男性肺静脉口比女性大,这也许与男性肺静脉血流量多于女性有关,但是随着房颤的进展,肺静脉口不断发生结构重构及电重构,导致房颤男女患者肺静脉口产生的差异很小。
我们的研究显示左上肺静脉口的最大径、右下肺静脉口的最小径和左上肺静脉口截面积消融术前后差异无统计学意义,而其他肺静脉口参数的最大径、最小径及截面积差异均有统计学意义。我们认为,环肺静脉电隔离术(CPVA)后房颤患者多数肺静脉口直径、截面积及左房容积缩小的主要原因如下:①De Greef等[5]研究肺静脉隔离术后肺静脉狭窄的患病率、特征和预测,在部分患者观察到肺静脉狭窄,可能是左房容积减少和随后并发肺静脉缩小。国内研究表明肺静脉孔大小与左房体积有一定正相关性,相关系数为0.330~0.619,而肺静脉孔指数与左房体积无明显相关性[6]。如果肺静脉孔大小与左房体积有一定正相关性,逆转左房重构后,肺静脉口也会缩小。另有研究显示,房颤RFA后左房容积和肺静脉直径较术前明显减少,左房容积减少15.7%[从(102±42)cm3减少至(84±30)cm3],而肺静脉口直径减少11%[从(18.3±0.8)mm减少至(16.7±1.0)mm],这些证据证实RFA能逆转左房和肺静脉重构[7]。②RFA能量过大或消融电极置入过深,易导致瘢痕组织过度增生从而引起肺静脉狭窄。von Bary等[8]通过使用一种新型环状标测和导管消融评价肺静脉隔离术后肺静脉狭窄发现,可检测到的肺静脉狭窄占7%,大多数肺静脉狭窄是无意义或轻度的;只发现1例中度肺静脉狭窄;没有患者出现严重的肺静脉狭窄。Choi等[9]通过多排螺旋CT研究发现,在射频消融术后平均随访4个月的58例房颤患者共192支肺静脉中,肺静脉口直径减少(1.5±3.2)mm,有6支肺静脉狭窄,包括2支左上肺静脉和4支左下肺静脉,狭窄程度为28%~ 61%。因此,房颤RFA后6~12个月时常规行多排螺旋CT检查排除肺静脉狭窄是可能的。
综上所述,本研究对减少房颤RFA并发症及对手术方法的改进等方面提供了一定有价值的信息。但本研究还存在很多不足之处,样本量少,对结果可能产生一定的实验误差,还需进一步大样本前瞻性研究。
[1]林明宽,梁柳丹,刘浩.肺静脉多层螺旋CT成像在房颤射频消融术的应用[J].临床内科杂志,2013,11:789-790.
[2]Schwartzman D,Lacomis J,Wigginton WG.Characterization of left atrium and distal pulmonary vein morphology using multidimensional computed tomography[J].JAm Coll Cardiol,2003,41:1349-1357.
[3]Rostock T,Steven D,Lutomsky B,et al.Atrial fibrillation begets atrial fibrillation in the pulmonary veins on the impact of atrial fibrillation on the electrophysiological properties of the pulmonary veins in humans[J].JAm Coll Cardiol,2008,51:2153-2160.
[4]Thorning C,Hamady M,Liaw JV,et al.CT evaluation of pulmonary venous anatomy variation in patients undergoing catheter ablation for atrial fibrillation[J].Clin Imaging,2011,35:1-9.
[5]De Greef Y,Tavernier R,Raeymaeckers S,et al.Prevalence,characteristics,and predictors of pulmonary vein narrowing after isolation using the pulmonary vein ablation catheter[J].Circ Arrhythm Electrophysiol.,2012,5:52-60.
[6]陈光祥,唐光才,黄新文,等.多层螺旋CT仿真血管内窥镜对肺静脉孔的形态学评价[J].临床心血管病杂志,2009,25:693-697.
[7]Jayam VK,Dong J,Vasamreddy CR,et al.Atrial volume reduction following catheter ablation of atrial fibrillation and relation to reduction in pulmonary vein size:an evaluation using magnetic resonance angiography[J].J Interv Card Electrophysiol,2005,13:107-114.
[8]von Bary C,Weber S,Dornia C,et al.Evaluation of pulmonary vein stenosis after pulmonary vein isolation using a novel circular mapping and ablation catheter(PVAC)[J].Circ Arrhythm Electrophysiol,2011,4:630-636.
[9]Choi SI,Seo JB,Choi SH,et al.Variation of the size of pulmonary venous ostia during the cardiac cycle:optimal reconstruction window at ECG-gated multi-detector row CT[J]. Eur Radiol,2005,15:1411-1445.
Pulmonary vein morphology in atrial fibrillation patients before and after radiofrequency ablation
LIN Ming-kuan,LIANG Liu-dan,LIU Hao,TANGMei-yan,ZHAO Qiu-yan,ZHOU Xiang-qun,YANG Da-ying,DU Yong-cai.Department of Cardiology,Hainan Provincial Nongken Sanya Hospital,Sanya,Hainan Province 572000,China
LIUHao,E-mail:Liuhaomd@163.com
ObjectiveTo study the morphological changes of pulmonary vein after circumferential pulmonary vein ablation(CPVA)for atrial fibrillation(AF)by using CT three-dimensional imaging technique.Methods During the period form May 2008 to July 2011 at authors’hospital,CPVA was carried out in 24 patients with AF.64-slice spiral CT scanning of the heart was performed.The changes of pulmonary vein morphology 3-6 months after CPVA were evaluated and were compared with the preoperative morphologic findings.Results After the treatment,the maximum diameter of the left upper pulmonary vein,the minimum diameter of the right lower pulmonary vein and the cross-section area of the left upper pulmonary vein showed no statistically significant changes when compared with those determined before CPVA(P>0.05).But statistically significant differences in themaximum diameter,theminimum diameter and the crosssection area of the other pulmonary veins existed between the preoperative data and postoperative ones(P<0.05).The roundness of the pulmonary vein mouth determined after CPVA was significantly different from the preoperative one(P<0.05).The differences in pulmonary veinmouth parameters,pulmonary vein index and the roundness of pulmonary veinmouth between preoperative and postoperative data were not significant(P> 0.05).No significant difference in pulmonary vein mouth parameters existed between male and female patients(P>0.05).Of the 24 patients,three branches variation of the right pulmonary vein was up to 21%,while three branches variation of the left pulmonary vein was 4%.Conclusion In patients with AF thepulmonary vein,being the same as the left atrium,has also anatomic reconstruction,which can be reversed after CPVA.In the variations of pulmonary vein mouth the variations of right pulmonary vein mouth ismost commonly seen.(J Intervent Radiol,2014,23:288-291)
atrial fibrillation;pulmonary vein;radiofrequency ablation;imaging
R541.75
A
1008-794X(2014)-04-0288-04
2013-10-10)
(本文编辑:侯虹鲁)
广西自然科学基金资助项目(桂科青0542056);广西医疗卫生重点科研课题(桂卫重200923)
10.3969/j.issn.1008-794X.2014.04.004
572000三亚海南农垦三亚医院心内科(林明宽、梁柳丹、周祥群、杨大英、杜永才);广西医科大学第一附属医院心内科(刘浩、唐梅艳、赵秋燕)
刘浩E-mail:Liuhaomd@163.com
