姜黄素-分光光度法测定药物中的Fe2+*
2014-06-09高苏亚
高苏亚,李 华,张 韫,范 涛,王 黎,杨 筱
(1.西安医学院 药学院,陕西 西安 710021;2.西北大学 分析科学研究所,陕西 西安 710069)
复方硫酸亚铁叶酸片为卫生部颁药品标准中收载的抗贫血药[1]。该药由硫酸亚铁、叶酸、黄芪、白术、当归、干酵母及辅料组成,适应于缺铁性贫血。目前测定该药中Fe2+含量大多采用邻菲啰啉-分光光度法[2]、火焰原子吸收法[3]等,而采用姜黄素-分光光度法测定Fe2+鲜有文献报道。姜黄素与Fe2+的络合反应灵敏,形成的络合物较稳定[4-6]。另外,可药食两用的姜黄素无毒、无污染,可作为理想的显色剂和染料使用[7]。作者以姜黄素为显色剂,采用简单的分光光度法测定复方硫酸亚铁叶酸片中的Fe2+含量,方法准确可靠,灵敏度高,拓展了姜黄素与Fe2+相互作用在药物分析中的应用。
1 实验部分
1.1 试剂与仪器
复方硫酸亚铁叶酸片:批号:20091030,20091020,吉林省西点药业科技发展股份有限公司。姜黄素(CUR):上海化学试剂三厂;三羟甲基氨基甲烷(Tris):天津市福晨化学试剂厂;硫酸亚铁:天津市化学试剂三厂;盐酸:深圳市迪创化工有限公司;无水乙醇:四川西陇化工厂,上述试剂均为分析纯。实验过程中所用水为二次蒸馏水。
UV-2450紫外-可见分光光度计:日本岛津公司;PB-10型酸度计、BS210S电子天平:德国Sartorious公司。
1.2 溶液制备
姜黄素储备溶液的配制:精密称取36.80 mg姜黄素于50 mL容量瓶,加少量无水乙醇振荡至溶解,定容,摇匀,即得浓度为2.00×10-3mol/L姜黄素溶液,4 ℃储存。
标准Fe2+溶液的配制:精密称取49.70 mg硫酸亚铁晶体(FeSO4·7H2O)于50 mL容量瓶中,加0.1 mol/L 盐酸溶解,定容,摇匀,即得质量浓度为0.200mg/ mL Fe2+储备液,储存于4 ℃冰箱,使用时取一定量加0.1 mol/L 盐酸稀释至质量浓度为40 μg/mL。
供试品溶液的制备:取样品复方硫酸亚铁叶酸片10片,精密称定,去糖衣,研细,然后精密称取约0.35 g(相当于约50 mg FeSO4),置于50 mL容量瓶中,加0.1 mol/L HCl溶解并定容,摇匀,离心20 min(2 000 r/min,20 ℃),并用0.45 μm滤膜滤过,再精密量取续滤液 2.50 mL于50 mL容量瓶中,加0.1 mol/L HCl定容,摇匀即得。
阴性对照溶液的制备:除FeSO4外,其余药材按药品标准[1]处方比例精密称定,并将白术半量粉碎成细粉(备用);然后用6倍量(质量)体积分数为70%乙醇将剩余半量白术和当归采用渗漉法提取,将所得提取液回收乙醇;将黄芪加水煎煮2次,煎煮时间依次为3 h、2 h,滤过,与渗漉提取液合并,再减压浓缩至稠膏,冷却,与上述备用白术细粉、叶酸、干酵母混合均匀,干燥,研细,即得阴性样品。最后,按上述“供试品溶液的制备”方法,制得阴性对照溶液。
1.3 实验方法
在一系列10 mL容量瓶中分别加入2.5 mL姜黄素储存溶液、1.0 mL 0.1 mol/L Tris-HCl缓冲溶液(pH=6.50),精密加入一定量标准Fe2+溶液或供试品溶液,加乙醇至刻度,摇匀,静置30 min。以相应试剂作参比,1.0 cm石英比色皿,狭缝2 nm,测定其吸收光谱和432 nm波长处的吸光度[6]。
2 结果与讨论
2.1 姜黄素和Fe2+的紫外-可见吸收光谱
姜黄素和Fe2+的紫外-可见吸收光谱见图1。

λ/nm图1 姜黄素和Fe2+的紫外-可见吸收光谱
由图1可知,Fe2+基本无吸收,姜黄素在430 nm有最大吸收,加入Fe2+后,其吸收略有红移且吸光度明显减小。说明姜黄素与Fe2+发生作用(有关其配合作用在另一篇论文中论述)。
2.2 干扰实验
按“实验方法”项作阴性对照溶液的干扰实验。实验结果表明:阴性对照溶液在432 nm波长处没有明显吸收,说明其它成分对测定几乎无干扰。
2.3 工作曲线的制备
分别精密量取40 μg/mL标准Fe2+溶液0.1、0.4、0.6、0.8、1.0、1.2、1.5、1.8、2.0 mL置10 mL容量瓶中,按“实验方法”项测定,结果见图2和表1。

λ/nm图2 姜黄素-Fe2+工作曲线的吸收光谱图
图2和表1结果表明:吸光度(A)与ρ(Fe2+)(x)的回归方程为A=0.047 4x+ 0.323 7(r=0.999 5),在0.40~8.00 μg/mL线性关系良好。

表1 不同ρ(Fe2+)的吸光度
2.4 精密度、重复性和稳定性实验
分别精密量取 6份0.8 mL标准Fe2+溶液于10 mL容量瓶中,按“实验方法”测定,测得吸光度的RSD= 0.6%(见表2),表明该方法精密度良好。分别精密吸取供试品溶液(批号为20091030)1.00 mL置10 mL容量瓶中,共6份,按“实验方法”操作,平行测定3次,测得样品的平均含量为51.28 mg/片(以FeSO4计),RSD=1.2%(见表2);再将其中1份供试品溶液(批号为20091030)每隔10 min测定一次,结果发现:该样品溶液在0.5 h显色稳定,测得其FeSO4含量在0.5~3 h内的RSD为0.8%,表明该方法的重复性和稳定性也良好。
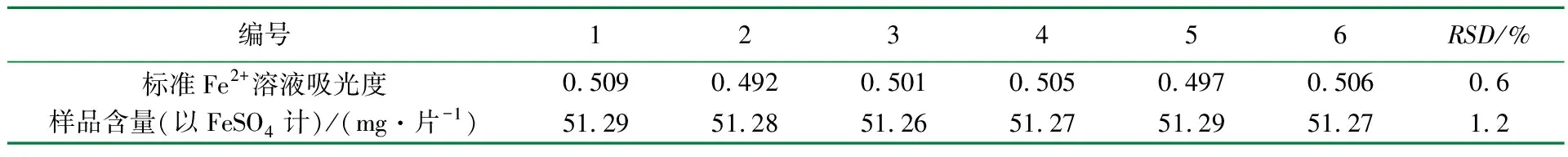
表2 精密度、重复性实验
2.5 加样回收率实验
分别精密称取5份已知含量的复方硫酸亚铁叶酸片样品(批号20091030)适量,分别精密加入标准Fe2+溶液,按“供试品溶液的制备”方法制备溶液;分别精密吸取0.5 mL于10 mL容量瓶中,按“实验方法”项测定,结果见表3。
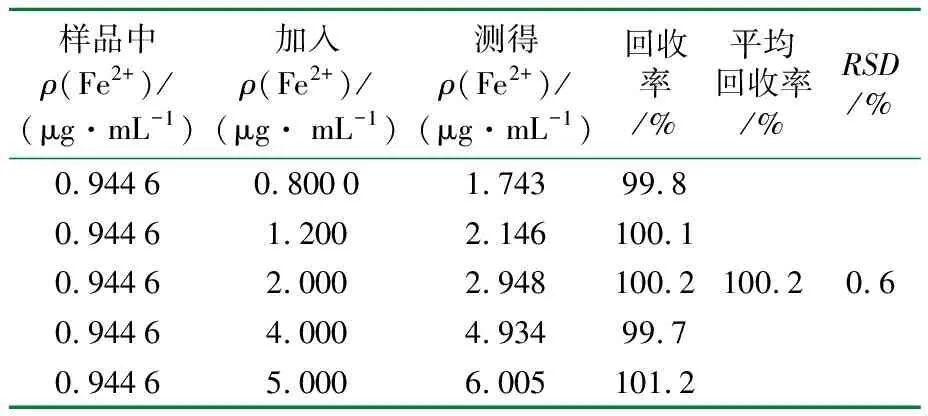
表3 回收率测定结果(n=5)
2.6 样品测定
将复方硫酸亚铁叶酸片样品(批号为20091030,20091020)按“供试品溶液的制备”方法各制备2份溶液,再分别精密吸取1.0 mL制备溶液置10 mL容量瓶中,按“实验方法”测定。测得2批样品中FeSO4平均含量分别为51.28 mg/片和48.52 mg/片,分别为标示量(FeSO450 mg/片)的102.5%和97.04%。
3 结 论
在姜黄素与Fe2+相互作用研究的基础上可知,在Tris-HCl缓冲液(pH=6.5)中,姜黄素与Fe2+反应可形成较稳定的酒红色配合物。因此作者建立了姜黄素-分光光度法测定复方硫酸亚铁叶酸片中Fe2+,其吸光度(A)与ρ(Fe2+)(x)在0.40~8.00 μg/mL线性方程为A=0.047 4x+ 0.323 7(r=0.999 5),呈良好的线性关系。该方法简单灵敏,结果可靠,且无毒环保,可为药物中Fe2+的含量测定提供参考。
[ 参 考 文 献 ]
[1] 卫生部颁药品标准(新药转正标准西药第三十册).WS1-(X-072)-2002Z,复方硫酸亚铁叶酸片[S].北京:人民卫生出版社,2008:X30-X211.
[2] 戴德银.实用新药特药手册(第4版)[M].北京:人民军医出版社,2007:928.
[3] 毕雪艳,郝宁,韩永红,等.火焰原子吸收法测定复方硫酸亚铁叶酸片中铁的含量[J].中国医院药学杂志,2007,27(3):421.
[4] Barik A,Mishra B,Kunwar A,et al.Comparative study of copper(Ⅱ) curcumin complexes as superoxide dismutase mimics and free radical scavengers[J].Eur J Med Chem,2007,42(4):431-439.
[5] Bemabe-Pineda M,Ramirez-Silva T M,Romero-Romob M M,et al.Spectrophotometric and electrochemical determination of the formation constants of the complexes curcumin-Fe(III)-water and curcumin-Fe(Ⅱ)- water[J].Spectrochimica Acta Part A,2004,60(5):1105-1113.
[6] 高苏亚,范涛,杨莉宁,等.姜黄素-Fe2+稳定常数的测定及其与鲑鱼精DNA的相互作用研究[J].分析试验室,2011,30(8):36-38.
[7] 高苏亚.药物分子与生物相关物质相互作用的方法学研究及其在药物分析中的应用[D].西北大学,2012:42-44.
