不同形貌的MOF-5纳米颗粒的制备及其氮气吸附性能研究
2014-06-07辛志峰张千峰
汪 强,辛志峰,张千峰
(安徽工业大学 分子工程与应用化学研究所,安徽 马鞍山 243002)
1 引 言
孔性配位聚合物和金属有机框架结构(MOFs)材料是由过渡金属离子与有机配体通过配位键连接构成的。这些材料具有高的比表面积、可调控的孔结构,因此在气体存储[1,2]、分离[3]、催化[4,5]、离子交换[6-8]、药物传递[9,10]等方面得到广泛应用。孔性配位聚合物微/纳米结构材料具有新奇的结构和有趣的性质[11-16,19]。分形纳米结构的MOFs材料例如:Cu-BDC和Cr-BDC[11](BDC=1,4-对苯二甲酸)已经制备出来,MOF-5[12]和HKUST-1[13]超级纳米结构材料已经被成功地合成并表现出了较高的氢气吸附焓。
Yaghi等人用对苯二甲酸和六水合硝酸锌为原料成功合成了一系列金属有机框架结构材料 (如MOF-2,MOF-3,和 MOF-5)[17-19]。在这些材料中,MOF-5具有最稳定的框架结构和最大的孔体积[20,21]。MOF-5的纳米材料在近几年也得到了报道[12,22,23],然而,用简单的方法合成不同形貌的配位聚合物纳米颗粒并研究他们的比表面积的研究还很少有报道。本文集中研究了不同形貌MOF-5纳米颗粒包括纳米聚集体(MNMOF-6)、纳米棒 (MNMOF-7)、纳米针(MNMOF-8)和纳米带(MNMOF-9)的可控合成并研究了不同形貌纳米颗粒的气体吸附性能。
2 实验部分
2.1 试剂和原料
1,4-对苯二甲酸(H2BDC)从Alfa Aesar试剂公司购买。六水合硝酸锌 [Zn(NO3)2·6H2O],三乙胺(TEA),正己烷和N,N-二甲基甲酰胺(DMF)从国药集团试剂公司购买。所有试剂购买后直接使用,没有经过任何提纯处理。
2.2 样品的制备
2.2.1 MOF-5纳米聚集体(MNMOF-6)的制备
溶液 A:1ml三乙胺(TEA)溶于 10ml正己烷;溶液 B:0.2g六水合硝酸锌和 0.036g对苯二甲酸(H2BDC)溶于 400mlN,N-二甲基甲酰胺(DMF),分别搅拌30min,把溶液A慢慢的加入溶液B,4h后收集沉淀分别用DMF和氯仿洗涤3次,离心干燥,然后把样品放入真空干燥箱,真空条件下130℃加热10h,得到0.08g样品产率大约52%。通过分子式C24H12O13Zn4计算的元素百分含量C,36.97;H,1.57;O,27.37;Zn,34.21。元素分析测得元素含量:C,37.43;H,1.60;O,27.35,ICP 测得:Zn,33.87。
2.2.2 纳米棒(MNMOF-7)的制备
样品MNMOF-7的制备方法和MNMOF-6的制备方法相似,只是在六水合硝酸锌和H2BDC在DMF溶解的过程中向溶液中加入了1ml去离子水。通过分子式C24H12O13Zn4计算的元素百分含量C,36.97;H,1.57;O,27.37;Zn,34.21。元素分析测得元素含量:C,37.04;H,1.89;O,27.98。 ICP 测得:Zn,32.34。
2.2.3 纳米针(MNMOF-8)的制备
样品MNMOF-8的制备方法和MNMOF-6的制备方法相似,只是在六水合硝酸锌和H2BDC在DMF溶解的过程中向溶液中加入了2ml去离子水。通过分子式C24H12O13Zn4计算的元素百分含量C,36.97;H,1.57;O,27.37;Zn,34.21。元素分析测得元素含量:C,36.12;H,2.05;O,28.23。 ICP 测得:Zn,31.17。
2.2.4 纳米带(MNMOF-9)的制备
样品MNMOF-9的制备方法和MNMOF-6的制备方法相似,只是在六水合硝酸锌和H2BDC在DMF溶解的过程中向溶液中加入了3ml去离子水。通过分子式C24H22O18Zn4计算的元素百分含量C,32.71;H,2.48;O,33.56;Zn,30.30。元素分析测得元素含量:C,33.54;H,2.56;O,33.48,ICP 测得 Zn,29.46。
2.3 结构表征
X射线粉末衍射(PXRD)通过岛津XRD-6000衍射仪测定。元素分析用Elementar Vario微分析仪检测。金属元素通过电感耦合等离子体发射光谱仪(岛津公司ICP)测定。红外光谱用Bruker Equinox 55傅立叶红外分析仪测试。热重分析通过STA 449C热重分析仪测定。扫描电镜图片从日立S-4800场发射扫描电镜中得到。低压氮气吸附等温线使用ASAP 2020M+C分析仪在77K温度下测定,所用样品的测试前都经过在130°C下真空脱气10h。
3 结果与讨论
3.1 MOFs微/纳米颗粒的制备
在液相扩散条件下通过控制反应体系中水的含量制备了4种不同形貌的MOFs微/纳米颗粒。有趣的是,在相同的反应物和溶剂并且在相同的反应条件下,在没有水加入的时候得到的样品是纳米颗粒的聚集体,当向DMF溶液中加入1ml水以后得到的产物是纳米棒,当向DMF溶液中加入2ml水的时候得到的产品是纳米针,当加入3ml水的时候得到纳米带。不同形貌的纳米颗粒的制备过程如示意图1所示。

图1 不同形貌MOFs纳米颗粒的合成步骤
3.2 红外光谱
样品MNMOF-6,MNMOF-7,MNMOF-8和MNMOF-9红外谱图 (如图2)在1610-1550cm-1和1420-1335cm-1处显示出配体对苯二甲酸根(BDC)的对称和不对称震动的特征吸收峰,在3500-3200cm-1处显示了水的特征吸收峰(Fig.1)[24]。然而,在这4个样品的红外谱图中在1715-1680cm-1处没有发现吸收峰,这表明在样品MNMOF-6,MNMOF-7,MNMOF-8和MNMOF-9中的对苯二甲酸完全被TEA脱质子化。[24]
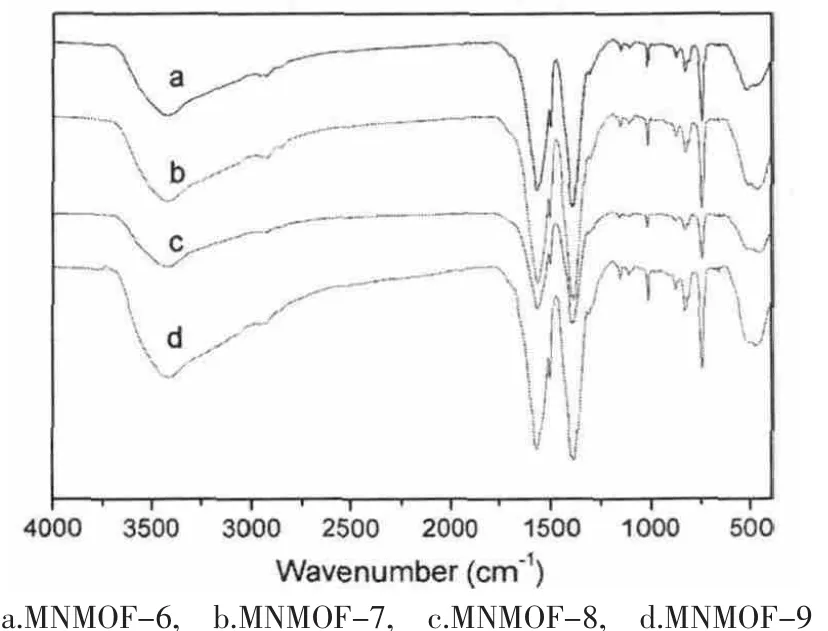
图2 红外光谱图
3.3 热分析
本文中热重分析的温度范围是从室温到900℃(图3)。第一个失重台阶发生在从室温到400℃,这表明MOF微孔中的溶剂逐渐失去。由于样品在测试之前在130℃下真空脱气10h,孔内的绝大部分溶剂已经被脱去,那么在400℃之前大约5-10%的失重表示样品在脱气完毕从真空烘箱取出到热重测试期间样品在空气吸收的水分和气体脱除。第二个明显的失重发生在400-500℃,这表示配体BDC的分解并失去,样品在这个温度区间的失重分别为MNMOF-6失重 37.1%,MNMOF-7失重 36.9%,MNMOF-8失重35.1%,NMOF-9失重33.56%。
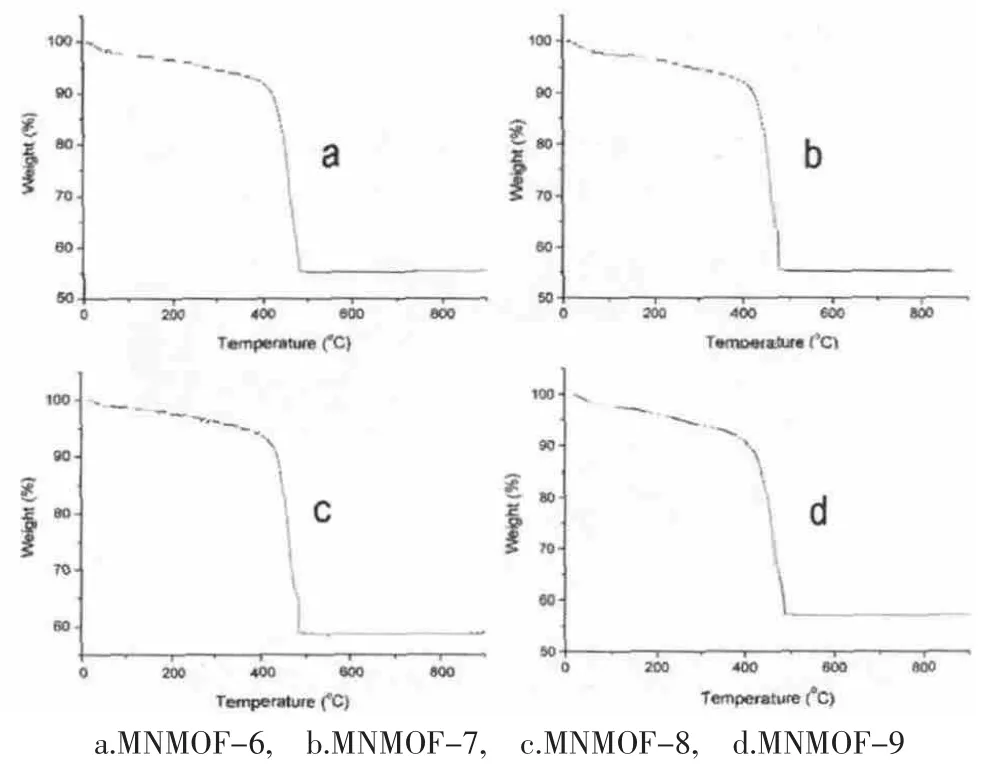
图2 样品的热重分析图
3.4 样品的结构和形貌表征
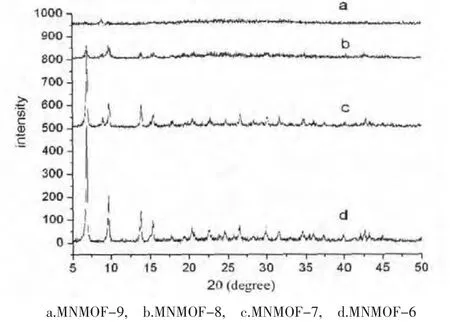
图4 样品的PXRD谱图
样品MNMOF-6的PXRD谱图与用MOF-5单晶数据模拟的粉末衍射谱图一致(图4d),这表明样品MNMOF-6具有MOF-5的结构。样品MNMOF-7和MNMOF-8的PXRD谱图在2θ=8.9处出现了一个新的衍射峰,这表明在样品中出现了第二相的成分(图4c,b)。样品MNMOF-9的PXRD谱图显示在2θ=8.9处有一个衍射峰,而其他衍射峰几乎完全消失,这表明样品MNMOF-9的结构几乎全部转化为另一种结构(图3a)。
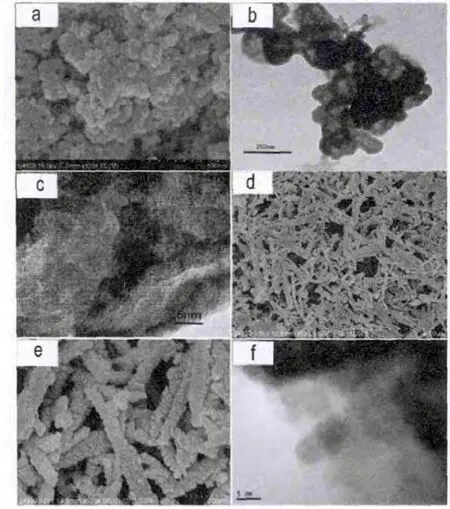
图5
从扫描电镜(SEM)图片中可以看出,样品(图5a)MNMOF-6的形貌为不规则纳米球的聚集体,每个纳米球的尺寸大约50纳米。透射电镜(TEM)图片显示(图5b)在纳米球之间有介孔存在。高分辨透射电镜(HRTEM)图片(图5c)给出了更为精细的结构。样品MNMOF-7的形貌为纳米棒(图5d,e),该纳米棒是由直径为5-10纳米的纳米球按一维方向排列而成 (图5e,f),HRTEM图片中可以看到纳米球的晶格条纹(图5f),这说明组成纳米棒的纳米球是晶态的。样品MNMOF-8表现出针状的形貌,针的直径大约100-200纳米,针的长度大约4微米(图6a,b)。样品MNMOF-9表现出了带状形貌,而且各个纳米带缠绕在一起形成簇状(图6c,d)。

图6 样品的SEM照片
3.5 比表面积和氮气吸附表征
样品的孔结构和比表面积用氮气吸附测试进行了表征。样品MNMOF-6的氮气吸附等温线 (图7a)在低压区显现出迅速的升高,这表明样品中有稳定的微孔存在。当气体压力升到相对大气压0.9P/P0的以后, 吸附等温线有一个急剧的上升,并且在出现了一个狭长的脱附滞后回环这表明样品中有介孔存在。样品MNMOF-7和MNMOF-8的N2吸附等温线(图7c)与MNMOF-6的吸附等温线相似,在低压区表现出急剧地升高,只是吸附量比MNMOF-6依次降低。
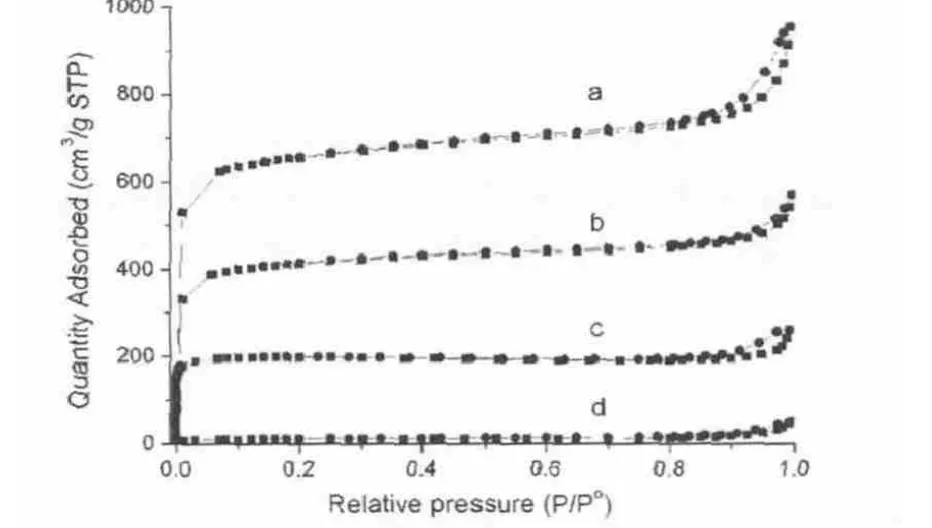
图7 在77K温度下测定的样品的N2吸附等温线
这主要是由于样品MNMOF-7和MNMOF-8中的部分结构转化成了另一种结构。样品MNMOF-9的吸附等温线(图6d)在低压区没有明显的上升,在相对压力0.95P/P0以后有轻微的上升,这表明在样品MNMOF-9中没有稳定的微孔结构。微孔孔体积从样品MNMOF-6到MNMOF-7到MNMOF-8到MNMOF-9依次减小(table1)。结合X射线粉末衍射数据可以推断出从样品MNMOF-6到MNMOF-7到MNMOF-8到MNMOF-9,样品结构逐渐地从MOF-5的结构转变为另一种无孔的结构。而且样品MNMOF-6、MNMOF-7、MNMOF-8 和 MNMOF-9的Brunauer-Emmett-Teller(BET)比表面积和孔容也表现出了依次降低的趋势 (见表1),这个结果与PXRD得到结果相符合。
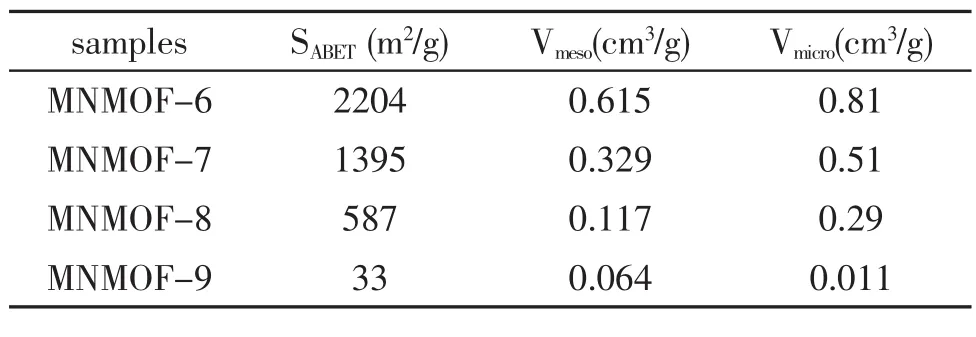
表1 样品的BET比表面积、介孔体积和微孔体积.
[1]L.Murray,M.Dincǎ,J.Long,Hydrogen storage in metal-organic frameworks[J].Chem.Soc.Rev,2009,38:1294-1314.
[2]J.David,H-C.Zhou,Hydrogen storage in metal-organic frameworks[J].J.Mater.Chem,2007,17:3154-3160.
[3]Y.Bae,K.L.Mulfort,H.Frost,P.Ryan,S.Punnathanam,L.Broadbelt,et al.Separation of CO2from CH4using mixed-ligand metal-organic frameworks[J].Langmuir,2008,24:8592-8598.
[4]J.Lee,O.K.Farha,J.Roberts,K.A.Scheidt,S.T.Nguyen,J.T.Hupp,Metal-organic framework materials as catalysts[J].Chem.Soc.Rev,2009,38:1450-1459.
[5]L.Ma,C.Abney,W.Lin,Enantioselective catalysis with homochiral metal-organic frameworks[J].Chem.Soc.Rev,2009,38:1248-1256.
[6]M.Oh,C.A.Mirkin,Ion exchange as a way of controlling the chemical compositions of nano-and microparticles made from infinite coordination polymers[J].Angew.Chem.Int.Ed,2006,45:5492-4594.
[7]J.An,N.Rosi,Tuning MOF CO2adsorption properties via cation exchange [J],J.Am.Chem.Soc,2010,132:5578-5579.
[8]O.Yaghi,H.Li,T-shaped molecular building units in the porous structure of Ag(4,4’ -bpy)·NO3[J].J.Am.Chem.Soc,1996,118:295-296.
[9]J.An,S.Geib,N.Rosi,Cation-triggered drug release from a porous zinc adeninate metal-organic framework[J].J.Am.Chem.Soc,2009,131:8376-8377.
[10]P.Horcajada,C.Serre,G.Maurin,N.Ramsahye,F.Balas,M.Vallet-Regi,et al.Flexible porous metal-organic frameworks for a controlled drug delivery[J].J.Am.Chem.Soc,2008,130:6774-6780.
[11]Z.Xin,J.Bai,Y.Shen,Y.Pan,Hierarchically microand mesoporous coordination polymer nanostructures with high adsorption performance[J].Cryst.Growth&Des,2010,10:2451-2454.
[12]Z.Xin,J.Bai,Y.Pan,M.J.Zaworotko,Synthesis and enhanced H2adsorption properties ofa mesoporous nanocrystal of MOF-5:controlling nano-/mesostructures ofMOFsto improve theirH2heatofadsorption[J].Chem.Eur.J,2010,16:13049-13052.
[13]H.Du,J.Bai,C.Zuo,Z.Xin,J.Hu,A hierarchical supra-nanostructure of HKUST-1 featuring enhanced H2adsorption enthalpy and higher mesoporosity[J].CrystEng-Comm,2011,13:3314-3316.
[14]L.Chen,J.Bai,C.Wang,Y.Pan,M.Scheer,X-Z You,One-step solid-state thermolysis of a metal-organic framework:a simple and facile route to large-scale of multiwalled carbon nanotubes[J].Chem.Commun,2008,1581-1583.
[15]Y.Shen,J.Bai,A new kind CO2/CH4separation materi-al:open ended nitrogen doped carbon nanotubes formed by direct pyrolysis of metal organic frameworks[J].Chem.Commun,2010:1308-1310.
[16]Z.Xin,X.Chen,Q.Wang,Q.Chen,Q.Zhang,Nanopolyhedrons and mesoporous supra-structures of zeolitic imidazolate framework with high adsorption performance[J].Microporous and Mesoporous Materials,2013,169:218-221.
[17]H.Li,M.Eddaoudi,M.Keeffe,OM.Yaghi,Design and synthesis of an exceptionally stable and highly porous metal-organic framework[J].Nature,1999,402:276-279.
[18]H.Li,M.Eddaoudi,T.Groy,OM.Yaghi,Establishing microporosity in open metal-organic frameworks:gas sorption isotherms for Zn(BDC)1,4-Benzenedicarboxylate[J].J.Am.Chem.Soc,1998,120:8571-8572.
[19]H.Li,C.Davis,T.Groy,D.Kelley,OM.Yaghi,Coordinatively unsaturated metal centers in the extended porous framework of Zn3(BDC)3·6CH3OH(BDC)1,4-Benzenedicarboxylate[J].J.Am.Chem.Soc,1998,120:2186-2187.
[20]S.Kaye,A.Dailly,OM.Yaghi,J.Long,Impact of preparation and handling on the hydrogen storage properties of Zn4O(1,4-benzenedicarboxylate)3(MOF-5)[J].J.Am.Chem.Soc,2007,129:14176-14177.
[21]H.Furukawa,OM.Yaghi,Storage of hydrogen,methane,and carbon dioxide in highly porous covalent organic frameworks for clean energy applications[J].J.Am.Chem.Soc,2009,131:8875-8883.
[22]S.Hermes,T.Witte,T.Hikov,D.Zacher,S.Bahnmüller,Trapping metal-organic framework nanocrystals:an in-situ time-resolved light scattering study on the crystal growth of MOF-5 in solution[J].J.Am.Chem.Soc,2007,129:5324-5325.
[23]L.Huang,H.Wang,J.Chen,et al.Synthesis,morphology control,and properties of porous metal-organic coordination polymers[J].Microporous Mesoporous Materials,2003,58(2):105-114.
[24]T.Reineke,M.Eddaoudi,M.Fehr,D.Kelly,OM.Yaghi,From condensed lanthanide coordination solids to microporous frameworks having accessible metal sites[J].J.Am.Chem.Soc,1999,121:1651-1657.
