Si对Fe-Zr-O催化CO2与甲醇合成碳酸二甲酯反应性能的影响
2014-06-07陈红萍郑小满梁英华赵新强
陈红萍,郑小满,梁英华,赵新强
(1. 河北联合大学 化学工程学院,河北 唐山 063009;2. 河北工业大学 化工学院,天津 300130)
Si对Fe-Zr-O催化CO2与甲醇合成碳酸二甲酯反应性能的影响
陈红萍1,2,郑小满1,梁英华1,赵新强2
(1. 河北联合大学 化学工程学院,河北 唐山 063009;2. 河北工业大学 化工学院,天津 300130)
采用溶胶-凝胶法制备了Si-Fe-Zr-O催化剂,利用N2吸附-脱附、SEM-EDX、TEM、XRD和NH3-TPD等方法对Si-Fe-Zr-O催化剂的织构性质、组成和酸性进行了表征,并考察了Si-Fe-Zr-O催化剂催化CO2与甲醇合成碳酸二甲酯的性能。实验结果表明,随Si加入量的增加,催化剂的比表面积增大,孔径减小且孔分布集中;当n(Fe)∶n(Zr)∶n(Si)=5∶1∶2时,存在便于传质的5~11 nm的孔且孔体积最大,催化活性最高;较大的比表面积和合适的孔径是引入Si后催化剂活性提高的主要原因。Si的加入所形成的锆硅和铁硅固溶体可与铁锆固溶体协同作用,提高Si-Fe-Zr-O催化剂的活性。
碳酸二甲酯;甲醇;二氧化碳;铁-锆-氧催化剂;二氧化硅
碳酸二甲酯(DMC)分子中具有甲基、羰基和甲氧基等多种官能团,能替代传统的羰基化试剂和甲基化试剂(如光气、碘甲烷和硫酸二甲酯等)[1-2],被称为绿色化学品。甲醇与CO2直接合成DMC的反应因具有利用温室气体为原料、反应原子利用率高、副产物只有水的特点而备受瞩目。但CO2作为碳的最终氧化物,具有非常高的化学稳定性。利用CO2与甲醇直接合成DMC的关键是高活性催化剂的研发和反应耦合剂的应用,已报道的催化剂主要有金属醇盐和有机锡[3-5]、K2CO3/CH3I[6-8]、金属氧化物(ZrO2[9],CeO2[10],CeO2-ZrO2[11],V2O5[12]等)、负载金属(Cu,Ni,Rh等)[13-14]和醋酸盐[15]。金属醇盐和有机锡、K2CO3/CH3I及醋酸盐为均相催化剂,尽管具有较好的催化活性,但催化剂的回收利用困难,尤其是金属醇盐和有机锡会与副产物水作用而失活,而CH3I作为反应消耗原料,成本较高。负载金属在固定床反应器中活性较高,但在高压反应釜中活性很低。ZrO2,CeO2,V2O5等金属氧化物因其表面具有相邻酸碱位而表现出一定的活性,但单一金属氧化物的催化活性较低。复合金属氧化物和酸处理的金属氧化物通常比单一金属氧化物的活性提高几倍甚至十倍[16-17],说明单一金属氧化物表面的酸碱活性位配比或强度并不能很好地满足该反应体系。Fe2O3作为典型的价廉易得的Lewis酸催化剂,已在尿素醇解、脱硫和费托合成等反应中得到了广泛应用[18-20]。陈红萍等[21]曾用溶胶-凝胶法制备了Fe-Zr-O复合金属氧化物,在CO2与甲醇直接合成DMC反应中表现出较好的催化活性。但由于Fe-Zr-O比表面积较小,能提供的表面活性位较少,催化活性不理想。
本工作采用溶胶-凝胶法,通过在Fe-Zr-O中添加少量Si制备了Si-Fe-Zr-O催化剂,以提高催化剂的比表面积,并考察了Si的加入对催化剂的结构、酸性、组成和活性的影响。
1 实验方法
1.1 Si-Fe-Zr-O的制备
以Fe(NO3)3·9H2O(AR,天津市光复精细化工研究所)、Zr(NO3)4·5H2O(AR,上海晶纯实业有限公司)和正硅酸乙酯(AR,天津市光复精细化工研究所)为前体,将铁盐和锆盐溶于去离子水中得到金属盐的水溶液,将正硅酸乙酯溶于无水乙醇中制得醇溶液,将金属盐的水溶液和醇溶液混合,在60 ℃磁力搅拌下制得n(Fe)∶n(Zr)∶n(Si)=5∶1∶1,5∶1∶2,5∶1∶3的胶体,将所得胶体于120 ℃下真空干燥制得干凝胶,将干凝胶研磨后于500 ℃下焙烧4 h,得到Si-Fe-Zr-O催化剂。
1.2 催化剂的活性评价
甲醇与CO2合成DMC反应在不锈钢高压平行反应釜中进行。将甲醇和催化剂放入反应釜中,用CO2置换空气后,用气体增压泵将CO2充入反应釜至约6 MPa(室温下),在磁力搅拌下加热至150 ℃计时,反应24 h,自然冷却至室温,分析所得反应液的组成。
1.3 反应液的分析
用上海天美科学仪器有限公司的GC7900型气相色谱仪对反应液进行定量分析。色谱操作条件为:0.53 mm×30 m×0.25 µm石英毛细管柱,固定液为OV-101;氮气作载气,流量17 mL/min;柱箱温度70 ℃,汽化室温度180 ℃;FID检测,检测器温度180 ℃;进样量0.25 µL,采用不分流进样,用正丁醇作内标物进行定量分析。
1.4 催化剂的表征
采用日本理学公司的D/MAX 2500PC型X射线衍射仪分析催化剂的物相,扫描范围为20°~70°,Cu Kα射线,管电压30 kV,管电流100 mA。
采用日本日立公司的S-4800型场发射扫描电子显微镜观察催化剂的形貌和颗粒尺寸,冷场发射电子源,加速电压为0.5~30 kV。通过Thermo Fisher公司的Noran7 型X射线能谱仪对催化剂进行表层元素半定量分析,工作电压20 kV,分辨率1 µm2。采用日本电子株式会社的JEM-2010型透射电子显微镜对催化剂进行形貌和颗粒尺寸的分析,加速电压为200 kV,点分辨率为0.194 nm,点阵分辨率为0.14 nm。
N2吸附-脱附表征在麦克默瑞提克(上海)仪器有限公司的Gemini V3365/2380型全自动快速比表面积分析仪上进行。试样先在573 K下脱气3 h,然后在液氮温度下吸附。采用BET法计算比表面积,BJH法计算孔体积和孔径。
NH3-TPD实验在麦克仪器公司的AUTOCHEMⅡ2920型全自动程序升温化学吸附仪上进行,热导池温度100 ℃,热丝温度175 ℃。将50 mg催化剂装入石英管中,在25 mL/min He吹扫下,以10 ℃/min的升温速率程序升温至500 ℃,保持60 min;然后降温至40 ℃,通入25 mL/min NH3,保持30 min;用50 mL/min He吹扫60 min,脱除物理吸附NH3;最后以7 ℃/min的速率程序升温至550 ℃进行NH3脱附,并用TCD检测脱出气体。
2 结果与讨论
2.1 催化剂的表征结果
2.1.1 比表面积和孔分布
较大的比表面积和适宜的孔径对提高非均相催化剂的活性十分重要。Si-Fe-Zr-O催化剂的织构性质和活性见表1,孔分布曲线见图1。

表1 Si-Fe-Zr-O催化剂的织构性质和活性Table1 Catalytic activity and textural properties of Si-Fe-Zr-O catalysts

图1 Si-Fe-Zr-O催化剂的孔分布曲线Fig.1 Pore size distribution of the Si-Fe-Zr-O catalysts.n(Fe)∶n(Zr)∶n(Si):5∶1∶1;5∶1∶2;5∶1∶3
由表1和图1可知,随Si加入量的增加,Si-Fe-Zr-O催化剂的孔径缩小,比表面积增大。当n(Fe)∶n(Zr)∶n(Si)=5∶1∶1时,孔分布范围较广,为2~20 nm,所具有的孔体积主要是4 nm以上孔的贡献;而当n(Fe)∶n(Zr)∶n(Si)=5∶1∶2时,孔分布集中在两个范围3~4 nm和5~11 nm,即大于4 nm的孔集中在5~11 nm,且孔体积最大;当n(Fe)∶n(Zr)∶n(Si)=5∶1∶3时,孔径进一步缩小,孔径主要集中在3~4 nm左右。较大孔径孔的存在有利于反应物和生成物的传质,加快反应速率。但孔径过大,比表面积减小,暴露的催化活性中心少。相反,如果孔径较小,传质阻力增加,虽具有较大的比表面积但也不利于反应的进行。结合催化剂的活性评价结果可知,当n(Fe)∶n(Zr)∶n(Si)= 5∶1∶2时,催化剂有合适的孔径和较大的比表面积,催化活性最高。
2.1.2 SEM-EDX和TEM表征结果
Si-Fe-Zr-O催化剂的TEM和SEM图片见图2。

图2 Si-Fe-Zr-O催化剂的TEM和SEM图片(右上角)Fig.2 TEM images and SEM images(on the upper right corner) of the Si-Fe-Zr-O catalysts. n(Fe)∶n(Zr)∶n(Si):a 5∶1∶1;b 5∶1∶2;c 5∶1∶3;d 5∶1∶0
从SEM图片(右上角小图)可看出,加入Si后催化剂呈层状结构,排布规整,每层由小颗粒黏结组成,且随Si加入量的增加,层间距增大,颗粒直径变大。从TEM图片可看出,随Si加入量的增加,颗粒直径变大,与SEM表征结果一致。当n(Fe)∶n(Zr)∶n(Si)=5∶1∶2时,从催化剂的大颗粒上可以看到明显的孔,孔径约为5~11 nm,而其他两个试样则看不到明显的孔。结合试样的比表面积和孔分布可以推测,加入少量Si形成的孔主要是颗粒堆积形成的颗粒间的大而不规则的孔和较少的二氧化硅的孔,故孔分布范围广且不规则;随Si加入量的增加,颗粒直径变大,颗粒中二氧化硅特有的孔的体积增大,同时颗粒间堆积的孔集中;进一步增大Si的加入量,颗粒直径进一步增大,颗粒间堆积的孔呈开放型,因此催化剂呈现出的仅仅是二氧化硅的孔。
为了解催化剂中的活性组分在催化剂中的分布,对催化剂片状表层和层断面进行分区EDX分析,分析结果见表2。由表2可见,Fe-Zr-O催化剂中Fe与Zr的配比并不等于理论加入量的配比,而是存在Fe在表层的富集。加入Si后,催化剂呈层状分布,表层和层断面的组分配比存在较大差异。片状表层的Fe与Zr的配比均小于层断面的Fe与Zr的配比,尤以n(Fe)∶n(Zr)∶n(Si)=5∶1∶2的催化剂差距大。分析其原因可能是Si的加入使Fe和Zr渗透到二氧化硅体相中[22],由于锆硅和铁硅固溶体的产生,导致催化剂层断面和表层组成的差异,使催化剂表现为各向异性。当Si加入量少时,Fe和Zr均渗入其中,使Fe与Zr的配比变化较小;随Si加入量的增加,二氧化硅体相中能渗入的Fe和Zr离子更多,但更易形成硅锆固溶体[23],因此使层断面表现为Fe与Zr的配比增大;进一步增加Si加入量,使渗入到二氧化硅体相中的表层Zr增多,表层的Fe与Zr的配比亦增大。Fe在表面的富集提供了大量的Lewis酸位,由于铁锆、锆硅和铁硅固溶体的产生,增强了Lewis酸强度[23],加速了甲醇的解离吸附。但当表层的Fe与Zr的配比增加到一定量时,催化作用仅表现出氧化铁的催化特性,而失去铁锆的协同作用。因此,加入Si对催化活性有促进作用的另一个原因可能是铁锆、锆硅和铁硅固溶体的协同催化作用。

表2 催化剂中各组分的EDX分析结果Table 2 EDS analysis of the catalysts
2.1.3 XRD表征结果
Si-Fe-Zr-O催化剂的XRD谱图见图3。从图3可知,Si的加入使ZrO2的特征峰消失,Fe2O3的特征峰变宽,峰强度减弱,说明Fe2O3和ZrO2的晶粒尺寸变小、分散均匀,或有ZrO2进入二氧化硅体相中。随Si加入量的增加,Fe2O3特征峰的强度逐渐增强,尤其当n(Fe)∶n(Zr)∶n(Si)=5∶1∶3时,Fe2O3特征峰明显增强,但仍不见ZrO2的特征峰。结合EDX和表1的活性评价结果可知,少量Si的加入可以有效分散铁锆复合氧化物,而当Si加入量较大时,Fe2O3在催化剂表面富集,使Fe2O3晶体颗粒逐渐失去ZrO2的分散作用而长大,二者的协同作用也逐渐被破坏,从而使催化活性降低。因此Si的加入量存在最佳值,即n(Fe)∶n(Zr)∶n(Si)= 5∶1∶2,此时Si可以有效分散铁锆复合氧化物,且不破坏其协同作用,因此催化剂表现出较高的活性。
2.1.4 NH3-TPD表征结果
Si-Fe-Zr-O催化剂的NH3-TPD谱图见图4。由图4可见,加入Si后,NH3脱附峰面积大幅增加,且在200~300 ℃出现明显的脱附现象,对脱附峰进行分峰拟合处理,计算所得的峰面积见表3。
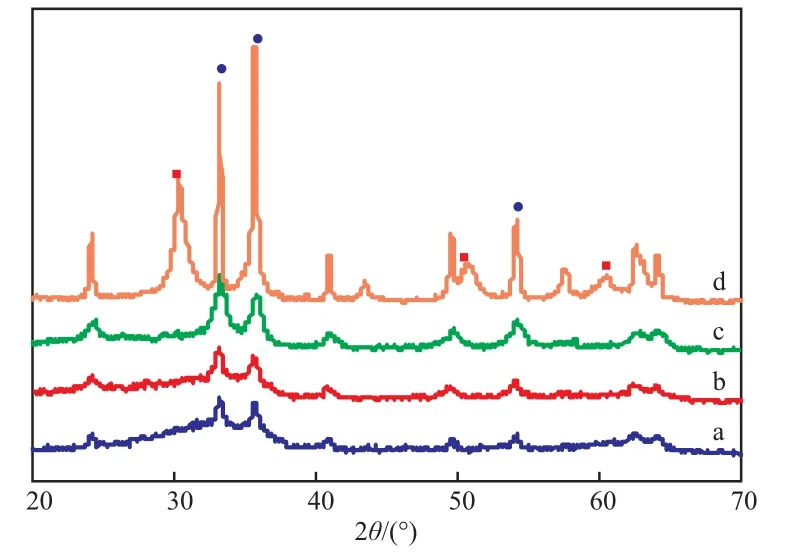
图3 Si-Fe-Zr-O催化剂的XRD谱图Fig.3 XRD patterns of the Si-Fe-Zr-O catalysts.n(Fe)∶n(Zr)∶n(Si):a 5∶1∶1;b 5∶1∶2;c 5∶1∶3;d 5∶1∶0Fe2O3;ZrO2

图4 Si-Fe-Zr-O催化剂的NH3-TPD谱图Fig.4 NH3-TPD profles of the Si-Fe-Zr-O catalysts.n(Fe)∶n(Zr)∶n(Si):a 5∶1∶0;b 5∶1∶1;c 5∶1∶2;d 5∶1∶3

表3 Si-Fe-Zr-O催化剂的NH3-TPD谱图中脱附峰的位置及面积Table 3 Positions and areas of the desorption peaks of in the NH3-TPD profles of the Si-Fe-Zr-O catalysts
由表3可见,Si的加入使催化剂表面的总酸量增加,且产生了一定量的较强酸位,与Gervasini等[23]得到的Fe-Zr-Si三组分氧化物表面的总酸量大于二组分氧化物表面总酸量的结果一致。随Si加入量的增加,表面总酸量呈先增加后降低的趋势,在n(Fe)∶n(Zr)∶n(Si)=5∶1∶2时,总酸量最多,结合表1的活性评价结果,进一步验证了酸量增加可使活性提高的结论[16-17]。
2.2 催化剂活性的评价结果
2.2.1 Si加入量对Fe-Zr-O催化剂和活性的影响
由表1可知,Si的加入使Fe-Zr-O催化剂的活性显著提高,但Si的加入量与活性并不成正比例关系,而是在n(Fe)∶n(Zr)∶n(Si)=5∶1∶2时,DMC收率出现一峰值。结合N2吸附-脱附表征结果可知,二氧化硅作为高比表面积材料,有助于铁锆复合氧化物的分散,从而使催化剂暴露更多的表面活性中心,提高活性,尤其是在n(Fe)∶n(Zr)∶n(Si)=5∶1∶2时,催化剂拥有适于传质的孔道和较大的孔体积,从而表现出最高的活性;大量Si的加入反而会稀释和掩盖活性组分,从而使活性降低。
2.2.2 反应条件对DMC收率的影响
对n(Fe)∶n(Zr)∶n(Si)=5∶1∶2的Si-Fe-Zr-O催化剂进行活性评价,考察CO2压力在6 MPa左右(室温)时反应时间和反应温度对DMC收率的影响,并与采用同样方法制备的Fe-Zr-O催化剂进行比较。
2.2.2.1 反应时间的影响
反应时间对DMC收率的影响见图5。

图5 反应时间对DMC收率的影响Fig.5 Infuences of reaction time on the yield of DMC.Reaction conditions:catalyst 1.0 g,CH3OH 20 mL,CO2pressure about 6 MPa(room temperature),150 ℃.Fe-Zr-O catalyst(n(Fe)∶n(Zr)=5∶1);Si-Fe-Zr-O catalyst(n(Fe)∶n(Zr)∶n(Si)=5∶1∶2)
由图5可知,在反应初始阶段,DMC收率随反应时间的延长增加较快,且Si-Fe-Zr-O催化剂上DMC收率的增长速度比Fe-Zr-O催化剂快;反应时间延长至24 h后,DMC生成速率的增幅趋缓。分析其原因为:在反应初始阶段,由于Si-Fe-Zr-O催化剂比Fe-Zr-O催化剂的比表面积大,提供了较多的表面活性位,有利于反应物的吸附活化和反应过程中的传质,因此DMC收率较大;随反应时间的延长,DMC浓度增大,反应接近平衡后,DMC生成速率降低。由于该反应条件下DMC的平衡收率约为5.13 mmol[6],因此两种催化剂上DMC收率仍随时间的延长而增加。
2.2.2.2 反应温度的影响
反应温度对DMC收率的影响见图6。

图6 反应温度对DMC收率的影响Fig.6 Infuences of reaction temperature on the yield of DMC.Reaction conditions:catalyst 1.0 g,CH3OH 20 mL,CO2pressure about 6 MPa(room temperature),reaction time 24 h.Fe-Zr-O catalyst;Si-Fe-Zr-O catalyst(n(Fe)∶n(Zr)∶n(Si)=5∶1∶2)
由图6可知,反应温度较低时,DMC收率非常低。随反应温度的升高,DMC收率逐渐增大,在150 ℃左右达到最大值;再升高反应温度,DMC的水解速率加快,当DMC的生成速率小于水解速率时,则表现为DMC收率降低。
与Fe-Zr-O催化剂相比,在相同反应温度下,Si-Fe-Zr-O催化剂上DMC收率均有较大提高,尤其是在150 ℃时,Si-Fe-Zr-O催化剂上DMC收率是Fe-Zr-O催化剂上DMC收率的1.75倍;当反应温度升至180 ℃时,Si-Fe-Zr-O催化剂上DMC收率下降为150 ℃时的58.8%,而Fe-Zr-O催化剂上DMC收率下降为150 ℃时的23.5%。分析其原因可能为:Si-Fe-Zr-O催化剂的比表面积大,使表面活性位增加,DMC生成速率加快。由于活性中心在高比表面积催化剂上的分散,使局部生成的DMC浓度降低,从而降低了水解速率,使Si-Fe-Zr-O催化剂在较高温度区域(150~170 ℃)内仍保持较高的DMC收率。
3 结论
1)Si的加入使Fe-Zr-O催化剂的比表面积增大,表面酸量增加,催化活性提高。当n(Fe)∶n(Zr)∶n(Si)=5∶1∶2时,存在较集中的5~11 nm的便于传质的孔道,且孔体积最大,此时催化剂的活性最高。较大的比表面积和合适的孔径是Si-Fe-Zr-O催化剂较Fe-Zr-O催化剂活性提高的主要原因。
2)少量Si的加入可有效微调催化剂表层Fe与Zr的配比,同时Si的加入所形成的锆硅和铁硅固溶体可与铁锆固溶体协同作用提高催化剂的活性。
[1] Shaikh A,Silvaram S. Organic Carbonates[J]. Chem Rev,1996,96(3):951 - 976.
[2] Ono Y. Catalysis in the Production and Reactions of Dimethyl Carbonate,an Environmentally Benign Building Block[J]. Appl Catal,A,1997,155(2):133 - 166.
[3] Laurenczy G,Picquet M,Plasseraud L. Di-n-Butyltin(Ⅳ)-Catalyzed Dimethyl Carbonate Synthesis from Carbon Dioxide and Methanol:An in Situ High Pressure119Sn{1H} NMR Spectroscopic Study[J]. J Organomet Chem,2011,696(9):1904 - 1909.
[4] Kazufumi K,Jun-Chul C,Yoshihiro O,et al. Reaction of Dibutyltin Oxide with Methanol Under CO2Pressure Relevant to Catalytic Dimethyl Carbonate Synthesis[J]. J Organomet Chem,2008,693(7):1389 - 1392.
[5] Kizlink J,Pastucha I. Preparation of Dimethyl Carbonate from Methanol and Carbon Dioxide in the Presence of Sn(Ⅳ) and Ti(Ⅳ) Alkoxides and Metal Acetates Collect[J]. Czech Chem Commum,1995,60(4):687 - 692.
[6] Cai Qinghai,Lu Bin,Guo Lingji,et al. Studies on Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide[J]. Catal Commun,2009,10(5):605 - 609.
[7] Fang S,Fujimoto K. Direct Synthesis of Dimethyl Carbonate from Carbon Dioxide and Methanol Catalyzed by Base[J]. Appl Catal,A,1996,142(1):L1 - L3.
[8] 蔡振钦,徐春明,赵锁奇,等. 同位素示踪研究K2CO3/CH3I促进的碳酸二甲酯直接合成反应[J]. 催化学报,2007,27(7):615 - 618.
[9] Tomishige K,Sakahiro T,Ikedda Y,et al. A Novel Method of Direct Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide Catalyzed by Zirconia[J]. Catal Lett,1999,58(4):225 - 229.
[10] Yoshida Y,Arai Y,Kado S,et al. Direct Synthesis of Organic Carbonates from the Reaction of CO2with Methanol and Ethanol over CeO2Catalysts[J]. Catal Today,2006,115(1/4):95 - 101.
[11] Jiang Chunjie,Guo Yihang,Wang Chungang,et al. Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide in the Presence of Polyoxometalates Under Mild Conditions[J]. Appl Catal,A,2003,256(1/2):203 - 212.
[12] Wu X L,Xiao M,Meng Y Z,et al. Direct Synthesis of Dimethyl Carbonate on H3PO4Modified V2O5[J]. J Mol Catal A:Chem,2005,238(1/2):158 - 162.
[13] Bian Jun,Xiao Min,Wang Shuanjin,et al. Highly Effective Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide Using a Novel Copper-Nickel/Graphite Bimetallic Nanocomposite Catalyst[J]. Chem Eng J,2009,147(2/3):287 - 296.
[14] Almusaiteer K. Synthesis of Dimethyl Carbonate(DMC) from Methanol and CO2over Rh-Supported Catalysts[J]. Catal Commun,2009,10(7):1127 - 1131.
[15] Zhao Tiansheng,Han Yizhuo,Sun Yuhan. Novel Reaction Route for Dimethyl Carbonate Synthesis from CO2and Methanol[J]. Fuel Process Technol,2000,62:187 - 194.
[16] Ikeda Y,Asadullah M,Fujimoto K,et al. Structure of the Active Sites on H3PO4/ZrO2Catalysts for Dimethyl Carbonate Synthesis from Methanol and Carbon Dioxide[J]. J Phys Chem B,2001,105(43):10653 - 10658.
[17] Lee H J,Park S,Jung J C,et al. Direct Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide over H3PW12O40/CexZr1-xO2Catalysts:Effect of Acidity of the Catalysts[J]. Korean J Chem Eng,2011,28(7):1518 - 1522.
[18] 肖雪,郑秀君,闫鹏. 氧化铁催化尿素醇解制备碳酸二甲酯反应工艺的研究[J]. 黑龙江工程学院学报:自然科学版,2011,25(3):41 - 44.
[19] Ren Xiurong,Chang Liping,Li Fan,et al. Study of Intrinsic Sulfdation Behavior of Fe2O3for High Temperature H2S Removal[J]. Fuel,2010,89(4):883 - 887.
[20] Sun Y,Walspurger S,Tessonnier J P,et al. Highly Dispersed Iron Oxide Nanoclusters Supported on Ordered Mesoporous SBA-15:A Very Active Catalyst for Friedel-Crafts Alkylations[J]. Appl Catal,A,2006,300(1):1 - 7.
[21] 陈红萍,梁英华,郑小满,等. 铁锆复合氧化物催化甲醇与 CO2直接合成 DMC 反应性能[J]. 分子催化,2013,27(6):556 - 565.
[22] Bogatyrev V M,Gun’ko V M,Galaburda M V,et al. Synthesis and Characterization of Fe2O3/SiO2Nanocomposites[J]. J Colloid Interface Sci,2009,338(2):376 - 388.
[23] Gervasini A,Messi C,Flahaut D,et al. Acid Properties of Iron Oxide Catalysts Dispersed on Silica-Zirconia Supports with Differrent Zr Content[J]. Appl Catal,A,2009,367(1/2):113 - 121.
(编辑 王 萍)
·技术动态·
日本凸版印刷公司开发出在再生PET上蒸镀铝的薄膜产品
石油化学新报(日),2014(4832):16
日本凸版印刷公司采用再生聚对苯二甲酸乙二醇酯(PET)(即将废弃的PET瓶子经粉碎,清洗干净后,在高温条件下进行熔融、减压及过滤后,制备出PET树脂)上蒸镀铝的薄膜产品。通过铝蒸镀处理,不仅可以阻隔氧气和水蒸气,还可以遮挡阳光和荧光灯等所发出的紫外光线,因此可以防止包装内容物的腐化。
在新产品中使用的再生PET薄膜是2012年凸版印刷公司与东洋纺公司共同开发的产品,该产品使用再生树脂的比例达到80%,目前在全球为最高水平。这次在这种再生PET薄膜的基础上又开发出蒸镀铝的PET薄膜。与以往石油原料产品相比,可减少20%的二氧化碳排放量。除此之外,它的氧气及水蒸气的阻隔性及加工性能也与石油原料制备的蒸镀铝的薄膜相同。并且,与非再生PET蒸镀铝的薄膜相比,最终产品价格相同。公司预计使用再生PET薄膜制备的产品到2016年销售额将达到25亿日元。
天华院成功研发出乙烯裂解炉用低NOx燃烧器
天华化工机械及自动化研究设计院有限公司负责研制、开发的具有自主知识产权的裂解炉用低NOx燃烧器在茂名石化乙烯裂解炉装置上应用成功,投运以来,低NOx燃烧器的运行非常平稳,NOx的排放由之前的150 mg/m3左右,下降至80 mg/m3以下。
天华院不断探索燃烧器的性能。在天津石化乙烯装置11台100 kt/a裂解炉中,其中的1台裂解炉底部燃烧器采用了该院自主研发的新型燃烧器,与引进的燃烧器相比,自主研发的新型燃烧器火焰性能更优。随后在中国石化科技部的组织和支持下,该院又改进、研发了新的燃烧器,在武汉800 kt/a乙烯裂解装置中的1104台燃烧器全部采用了该院产品,从2013年8月开车至今运行良好,火焰扁平刚直,满足热通量曲线要求,过剩空气系数低。
辽宁碳四液化气综合利用项目投产
辽宁盛星石化有限公司碳四液化气综合利用项目一期正式投产。首批产出轻芳烃1 000 t,丙烷200 t。该工程采用山东胜星(集团)化工有限公司与大连理工大学合作研发的碳四芳构化及歧化专利技术,装置达产后年可处理原料碳四液化气400 kt。
目前该公司正在积极筹备碳四液化气综合利用二期项目,将引进具有国际先进水平的丙烷脱氢、丁烷脱氢技术及甲醇制烯烃技术,计划5年内建成投产。
Effect of Si on the Catalytic Properties of Fe-Zr-O for Synthesis of Dimethyl Carbonate from CO2and Methanol
Chen Hongping1,2,Zheng Xiaoman1,Liang Yinghua1,Zhao Xinqiang2
(1. School of Chemical Engineering,Hebei United University,Tangshan Hebei 063009,China;2. School of Chemical Engineering & Technology,Hebei University of Technolgy, Tianjin 300130,China)
Si-Fe-Zr-O catalysts were prepared by sol-gel method and characterized by means of N2adsorption-desorption,SEM-EDX,TEM,XRD and NH3-TPD. The effects of the addition of Si on the structure,acidity and catalytic activity of the catalysts in the synthesis of dimethyl carbonate from methanol and carbon dioxide were investigated. The results showed that,with increasing the silicon content,the BET specific surface area increased,and the pore diameter became small and concentrated. When n(Fe)∶n(Zr)∶n(Si) was 5∶1∶2,the pore volume was the biggest and there were the pores with the pore size of 5-11 nm,which was beneficial to mass transfer. So the big specifc surface area and suitable pore size were the major reasons for the high activity of the Si-Fe-Zr-O catalysts. In addition,the synergistic effects between the solid solutions,namely zirconiumsilicon,iron-silicon and iron-zirconium,could improve the performances of the Si-Fe-Zr-O catalysts.[Keywords] dimethyl carbonate;methanol;carbon dioxide;iron-zirconium-oxygen catalyst;silica
1000 - 8144(2014)10 - 1149 - 07
TQ 426.82
A
2014 - 02 - 17;[修改稿日期] 2014 - 06 - 24。
陈红萍(1970—),女,河北省滦县人,博士生,副教授,电话 13831546421,电邮 chenhpwxy@126.com。联系人:梁英华,电话 0315 - 2592014,电邮 liangyh@heut.edu.cn
河北省教育厅项目(2010133);唐山市科技局项目(09110202A-1-1)。
