钼对雌性小鼠骨骼形态结构的影响
2014-06-07王宏伟杜祥月田二杰
王宏伟,赵 静,杜祥月,田二杰,张 才
(河南科技大学动物科技学院,河南 洛阳 471003)
钼对雌性小鼠骨骼形态结构的影响
王宏伟,赵 静,杜祥月,田二杰,张 才
(河南科技大学动物科技学院,河南 洛阳 471003)
为了研究钼对雌性小鼠骨骼形态结构的影响,选择了40只健康雌性昆明系小鼠随机分为4组,每组10只。通过在饮水中添加不同剂量的钼,建立雌性小鼠钼暴露模型:对照组、钼100组、钼200组和钼400组。在试验处理第120天时采集小鼠股骨,测量股骨长度和中点直径后制作石蜡切片,苏木素-伊红染色,用显微镜观察其形态结构的变化。试验结果显示:低剂量的钼可促进小鼠体质量的增长和骨骼的生长发育。但高剂量的钼则使股骨长度和直径显著减少(P<0.01),骨小梁数目减少、宽度变窄,骨皮质厚度增加等,并使小鼠骨骼细胞数目显著降低(P<0.01),骨骺线中分裂期细胞百分比显著下降(P<0.01)。高钼对雌性小鼠骨骼形态结构具有一定的毒性作用。
钼;雌性小鼠;骨骼;形态结构
0 引言
钼是生物体必需的微量元素之一,其生物学作用主要是依靠作为动物体内某些含钼酶类(如黄嘌呤氧化酶、亚硫酸盐氧化酶、羟乙醛氧化酶、硝酸盐还原酶等)的组成成分而实现的[1-2]。机体缺钼可导致动物的生长发育迟缓、生殖障碍和免疫功能降低等[3-5],但过量的钼也可引起腹泻、代谢障碍、体质量下降和繁殖障碍等病变[6-8]。近年来,人们对微量元素与动物硬组织关系的研究日益增多,例如,文献[9]通过观察不同剂量氟对大鼠切牙成釉细胞和骨组织形态学的改变,证明了血清氟、碱性磷酸酶(ALP)活性和骨钙素(OC)水平可作为氟致骨相损伤早期诊断的参考指标;文献[10]通过研究硒、钼、硼对氟中毒大鼠氟代谢及其成釉细胞生物学特性的影响,表明硒、钼、硼具有颉颃氟中毒引起的细胞损伤作用,即可以减轻氟斑牙的症状。目前,关于钼暴露对动物骨骼形态结构影响的研究还不充分,因此,本研究建立了雌性小鼠钼暴露模型,观察钼暴露条件下小鼠骨骼形态学的变化,为探寻钼对小鼠骨骼的影响提供理论依据。
1 材料与方法
1.1 试验动物及主要试剂
40只1周龄昆明系健康雌性小鼠,购自于郑州大学动物实验中心;苏木素、伊红购自武汉博士德生物工程有限公司;钼酸钠购自天津市化学试剂四厂。
1.2 试验方法
40只1周龄昆明系健康雌性小鼠随机分为4组,每组10只,通过在饮水中添加不同剂量的钼(以钼离子计),建立试验模型:对照组(不添加)、钼100组(100 mg/L)、钼200组(200 mg/L)和钼400组(400 mg/L)。试验处理120 d后,从每组中分别随机选取6只小鼠,处死并取出各组小鼠左右股骨。用游标卡尺测量记录小鼠股骨长度和股骨中点的直径后进行组织的固定和脱钙,常规制备骨组织石蜡切片,苏木素-伊红染色,光学显微镜下观察骨组织切片并拍照。
所得试验数据使用Excel 2003和SPSS Statistics 17.0软件进行处理。测定结果用平均值±标准差(Mean±SD)表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 钼暴露对小鼠体质量的影响
钼暴露对小鼠体质量的影响见表1。如表1所示,与对照组相比,钼100组小鼠体质量增加,且在第4周和第6周差异显著(P<0.05);钼400组小鼠体质量下降,且在第2周和第6周差异显著(P<0.05)。

表1 钼暴露对小鼠体质量的影响(平均值±标准差) g
2.2 钼暴露对股骨形态学的影响
2.2.1 钼暴露对股骨长度及宽度的影响
钼暴露对小鼠股骨长度和股骨直径的影响见表2。如表2所示,与对照组相比,钼100组股骨长度和股骨直径分别增加了0.72%和4.66%,差异不显著(P>0.05),钼400组则分别减少了7.89%和9.33%,差异极显著(P<0.01)。

表2 钼暴露对小鼠股骨长度和股骨直径的影响(平均值±标准差) mm
2.2.2 钼暴露对骨小梁形态的影响
钼暴露对骨小梁形态的影响见图1。如图1所示,对照组切片中骨小梁走向一致,粗细均匀,排列紧密;钼100组骨小梁增粗,走向一致,排列紧密;钼200组骨小梁数目减少,宽度变窄,体积变小,形状不规则;钼400组骨小梁数目减少,宽度更窄,畸形,断裂,排列紊乱,甚至部分游离在骨髓腔中。
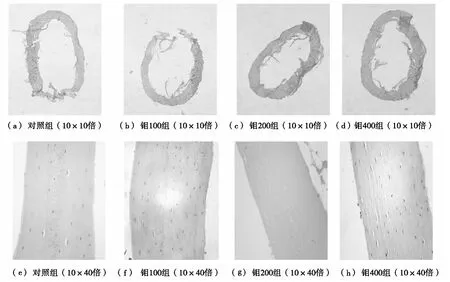
图1 钼暴露对骨小梁形态的影响
2.2.3 钼暴露对股骨中段皮质厚度的影响
钼暴露对小鼠股骨中段皮质厚度的影响见表3。如表3所示,钼100组与对照组相比股骨中段平均皮质厚度增加15.22%,差异不显著(P>0.05);钼200组与对照组相比股骨中段平均皮质厚度增加了48.90%,差异极显著(P<0.01);钼400组与对照组相比股骨中段平均皮质厚度增加了78.12%,差异极显著(P<0.01)。

表3 钼暴露对小鼠股骨中段皮质厚度的影响(平均值±标准差) μm
2.2.4 钼暴露对股骨中段细胞数目的影响
在高倍镜(40×10倍)下分别对各组切片拍照并对330μm长度单侧皮质骨组织细胞计数,结果如表4所示。钼100组与对照组相比股骨中段单位长度平均细胞个数增加了19.21%,差异显著(P<0.05);钼200组与对照组相比股骨中段细胞个数减少了14.21%,差异不显著(P>0.05);钼400组与对照组相比股骨中段单位长度细胞个数减少了20.26%,差异显著(P<0.05)。

表4 钼暴露对小鼠股骨细胞数目的影响(平均值±标准差)
2.2.5 钼暴露对骨骺线中分裂期细胞百分比的影响
显微镜下分别观察各组切片并对骨骺线中分裂期细胞进行计数,结果如表5所示。钼100组与对照组相比,骨骺线中分裂期细胞百分比增加了1.34%,差异显著(P<0.05);钼200组与对照组相比,中分裂期细胞百分比减少了1.18%,差异不显著(P>0.05);钼400组与对照组相比,中分裂期细胞百分比减少了1.63%,差异显著(P<0.05)。

表5 骨骺线中分裂期细胞百分比(平均值±标准差) %
3 分析与讨论
体质量的变化是衡量动物发育状况的重要指标之一。钼作为机体必需的微量元素,可通过提高体内含钼酶的活性,影响机体蛋白质和脂肪代谢等的过程[1,11],从而造成体质量变化。本试验中,适量的钼(100 mg/L)促进了小鼠体质量增长,但高剂量的钼抑制了小鼠体质量增长。由此可以推断,钼的添加剂量与动物的体质量增加有密切关系,高钼能够抑制小鼠体质量增长。
骨骼是机体最重要的硬组织,其生理功能主要包括运动、支持和保护身体,制造红血球和白血球,储藏矿物质等。大量研究表明:年龄、营养或疾病等因素可以造成骨骼的病变[12-14]。本研究结果显示:高钼可诱导小鼠骨骼发生形态学变化,使股骨长度和直径显著减少,骨小梁数目减少,宽度变窄等,且其损伤作用与钼浓度成正相关。有些学者认为:由于钼与磷在机体内代谢存在颉颃作用,高钼日粮通过影响磷代谢进而影响骨骼代谢[15]。但过量钼也能够干扰铜的吸收和代谢,易引起动物铜缺乏,进而影响动物骨骼代谢,导致骨代谢障碍[16]。文献[17]在高钼对雄性绵羊骨骼影响的研究中认为,高钼不仅能够抑制血清降钙素的分泌,同时还可以促进血清甲状旁腺激素分泌,从而造成全身钙磷动员及骨骼钙化不全,最终导致股骨中钙磷等矿质含量下降,使骨骼发生骨皮质变薄、骨小梁变稀疏、骨密度降低等病变。
骨组织为维持矿物质的动态平衡,不断地进行骨重建,其过程与骨原细胞、成骨细胞、骨细胞和破骨细胞等有密切关系。成骨细胞由骨原细胞分裂分化而来,被类骨质包埋后成为骨细胞,破骨细胞则可溶解并重吸收骨基质[18]。本研究中,高钼不仅导致小鼠骨骼细胞数目显著降低,也使骨骺线中分裂期细胞百分比显著下降。这可能是由于动物机体内钼含量增加,导致黄嘌呤氧化酶(XO)活力的升高而使机体生成大量NO,破坏细胞的完整功能及特异性酶功能;同时XO在机体内生成大量的超氧化物如超氧阴离子自由基(O-2),启动机体的脂质过氧化反应而损伤组织细胞或使细胞分裂受阻[19]。文献[20]发现高钼不仅可以导致小鼠肝脏脂质过氧化反应,还可通过Smac和Bax蛋白的增加诱导肝细胞的凋亡,而促凋亡基因表达的增多也可能是骨骼细胞及分裂期细胞减少的原因[21]。
骨皮质厚度可以间接反映骨骼的矿物质含量,还可对一些影响骨代谢的疾病做早期预防。本试验中,小鼠股骨中段平均皮质厚度随钼浓度增加而增厚,且切片显示试验组股骨皮质结构明显较疏松,且多有散开现象,钼浓度越高,该现象越明显。这可能是由于高钼导致骨骼的骨密度降低[17],且影响骨骼的强度和刚度[22],所以在机体可调节范围内,骨皮质发生代偿反应以增强骨骼的生物力学特性,保证机体的正常发育与活动。
综上所述,低剂量的钼可促进小鼠体质量的增长和骨骼的生长发育,而高剂量的钼则使股骨长度和直径显著减少,骨小梁数目减少、宽度变窄,骨皮质增厚等,同时导致小鼠骨骼细胞数目显著降低,骨骺线中分裂期细胞百分比显著下降,说明高钼对雌性小鼠骨骼形态结构具有一定的毒性作用。
[1] Schwarz G,Mendel R R,Ribbe M W.Molybdenum Cofactors,Enzymes and Pathways[J].Nature,2009,460(7257):839-847.
[2] Murray F J,Sullivan FM,Tiwary A K,et al.90-Day Subchronic Toxicity Study of Sodium Molybdate Dihydrate in Rats[J]. Regulatory Toxicology and Pharmacology,2013,doi:10.1016/j.yrtph.2013.09.003.
[3] Novotny JA,Turnlund JR.Molybdenum Intake Influences Molybdenum Kinetics in Men[J].Journal of Nutrition,2007,137(1):37-42.
[4] Meeker JD,Rossano M G,Protas B,et al.Cadmium,Lead,and other Metals in Relation to Semen Quality:Human Evidence for Molybdenum as a Male Reproductive Toxicant[J].Environmental Health Perspectives,2008,116(11):1473-1479.
[5] 杨自军,龙塔,冉林武,等.钼的生物学功能及其在动物生产中的作用[J].河南科技大学学报:农学版,2004,24(2):40-43.
[6] 王佳炜,程楠,王训.微量元素钼的生理作用及其对机体功能的影响研究进展[J].医学综述,2013,19(19):3460-3463.
[7] 张才,郝贵增,王亚垒,等.钼对小鼠生殖毒性研究[J].河南科技大学学报:自然科学版,2012,33(3):54-57.
[8] 张玉玲,白玉涛,刘凤军,等.钼暴露对雌性小鼠胚胎体内发育的影响[J].河南科技大学学报:自然科学版,2011,32(5):50-52.
[9] 刘璐,张颖,顾何锋,等.过量氟致骨相损伤的早期诊断指标分析[J].山东医药,2013,53(42):5-8.
[10] 汤晔,陈黎明.硒、钼、硼对氟中毒大鼠氟代谢及其成釉细胞生物学特性影响的实验研究[D].遵义:遵义医学院,2010.
[11] Mendel R R,Kruse T.Cell Biology of Molybdenum in Plants and Humans[J].Biochimica et Biophysica Acta,2012,1823(9):1568-1579.
[12] 王丹丹,伍西羽,廖二元,等.女性年龄相关的骨形成指标变化与骨密度减少的关系[J].中华内分泌代谢杂志,2013,29(4):297-301.
[13] 黄何平.营养和生活习惯对骨密度和骨强度的影响水[J].中国组织工程研究与临床康复,2008,12(50):9966-9969.
[14] Dellinger M T,Garg N,Olsen B R.Viewpoints on Vessels and Vanishing Bones in Gorham-Stout Disease[J].Bone,2014,63C:47-52.
[15] Tiffany M E,Mcdowell L R,O’Connor G A,et a1.Effects of Residual and Reapplied Biosolids on Performance and Mineral Status of Grazing Beef Steers[J].Journal of Animal Science,2002,80(1):260-269.
[16] 李树鹏,郝艳霜.畜禽钼中毒[J].饲料博览,2004,13(11):32-34.
[17] 王亚垒,杨自军,张鹏,等.高钼对雄性绵羊骨骼X线特征及骨密度变化的影响[J].河南农业科学,2013,42(4):145-148.
[18] 伍西羽,伍贤平,廖二元,等.骨细胞—治疗骨质疏松的新靶点[J].中华内分泌代谢杂志,2013,29(7):627-630.
[19] 王宏伟,周变华,张樑,等.高钼低铜对小鼠肾脏结构及其表达TNF-α蛋白的影响[J].动物医学进展,2010,31(9):5 l-54.
[20] 周变华,林霖,杨自军,等.钼对小鼠脂质过氧化损伤及肝Smac和Bax表达的影响[J].中国兽医科学,2012,42(6):617-621.
[21] W iren K M,Toombs A R,Sem irale A A,et al.Osteoblast and Osteocyte Apoptosis Associated with Androgen Action in Bone:Requirement of Increased Bax/Bcl-2 Ratio[J].Bone,2006,38(5):637-651.
[22] 于庆巍,罗民,马洪顺,等.钼中毒对骨骼力学性质影响的实验研究[J].中国地方病的防治杂志,2003,18(4):202-204.
S852
A
1672-6871(2014)06-0071-04
国家自然科学基金项目(31140003);河南省教育厅自然科学研究基金项目(2010B230002);河南科技大学博士启动基金项目(09001368);河南科技大学大学生研究训练计划(SRTP)项目(2011190,2010088)
王宏伟(1978-),男,山西朔州人,副教授,博士,主要从事畜禽营养代谢与中毒病研究.
2014-06-10
