乌司他丁对脓毒症患者器官功能的保护作用
2014-06-07王虹刘贵建刘锦丽
王虹 刘贵建 刘锦丽
近年来,人们对脓毒症和MODS进行了不断深入研究,并推出了各种防治手段,在诊断、抗生素使用、抗凝治疗、免疫治疗等方面都有了新的进展。脓毒症(Sepsis)是一种由感染而引起的机体的炎症状态,治疗脓毒症是现代医学关注的焦点和前沿问题之一,细胞因子在脓毒症的发生、发展中起到重要作用,减少促炎因子的释放,减少细胞因子水平有很重要的意义。研究表明:脓毒血症可以刺激机体生成、释放炎性细胞因子和组织因子,引起炎性损伤和凝血障碍,造成继发性损伤[1]。乌司他丁(Ulinastatin UTI)为蛋白酶抑制剂,用来抑制细胞酶的活性,且能够调控细胞因子、抑制炎症介质释放的作用,在医学领域受到关注。本研究通过观察68例脓毒症患者血浆C-反应蛋白(CRP)、肿瘤坏死因子(TNF-α)、白细胞介素-6(IL-6)水平的变化,及生化指标的变化,探讨UTI对脓毒症患者细胞因子的影响及心、肝、肾器官功能的保护作用。
1 资料与方法
1.1 一般资料 选取2012年9月-2013年11月廊坊人民医院68例脓毒症患者,年龄55~84岁,平均(74.3±17.1)岁;其中,消化道穿孔、肠坏死等术后并发感染15例,急性胰腺炎14例,肺部感染25例,血源性感染6例,泌尿系统感染8例;诊断标准根据2001年国际脓毒症定义会议制定的标准[2];排除标准:年龄<18岁,患有自身免疫系统疾病、急性脑血管疾病、急性心肌梗死、病毒性肝炎。按随机双盲,将入选患者分为常规组和UTI组,每组34例,UTI组:男19例,女15例;年龄55~84岁,平均(74.2±17.2)岁。常规组男20例,女14例;年龄55~84岁,平均(74.4±16.9)岁。两组患者的年龄、性别等方面比较差异无统计学意义(P>0.05),具有可比性。本研究符合医学伦理学标准,经医院伦理委员会批准,并获得患者或家属的知情同意。
1.2 实验材料 UTI由广东天普生化医药股份有限公司提供,IL-6、TNF-α、CRP试剂由北京利德曼生化技术有限公司提供。
1.3 治疗方法 常规治疗根据2008年国际脓毒症诊治指南采用经典治疗方案,包括早期复苏、监测乳酸指导补液、抗菌药物应用、机械通气、血液净化等。常规组给予以上常规治疗;UTI组在常规治疗基础上加用UTI 30万单位静脉滴注,2次/d,每次1 h滴完,连用7 d。
1.4 血液标本收集与测定 患者经过7 d治疗后,在第8天清晨采集患者静脉血5 mL,置于-40 ℃低温冰箱中保存。血浆TNF-α、IL-6测定采用双抗夹心酶法酶联免疫吸附法,操作按说明书进行,CRP测定采用胶乳增强免疫比浊法。血浆丙氨酸转氨酶(ALT)、天冬氨酸转氨酸转氨酶(AST)、肌酐(Cr)、尿素(BUN)、尿酸(UA)、乳酸脱氢酶(LDH)、肌酸激酶(CK)及其同工酶(CK-MB),使用BECKMAN全自动生化分析仪进行测定。
1.5 观察指标 比较两组的血浆CRP水平、TNF-α和IL-6水平及心肝肾生化指标;比较两组的APACHEⅡ评分。
1.6 统计学处理 采用SPSS 17.0统计学软件对数据进行处理,计量资料以(s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组血浆TNF-α、IL-6、CRP水平比较 治疗后,两组的TNF-α、IL-6、CRP水平较治疗前均明显下降(P<0.05),而UTI组下降更明显(P<0.05),见表1。
2.2 两组肝肾生化指标比较 治疗后,两组的ALT、AST、BUN、Cr、UA水平与治疗前比较差异均有统计学意义(P<0.05),而UTI组差异更为明显(P<0.05),见表2。
2.3 两组血浆LDH、CK、CK-MB水平比较 治疗后,两组LDH、CH、CK-MB水平较治疗前均明显下降(P<0.05),而UTI组下降更为明显(P<0.05),见表3。
2.4 两组APACHE Ⅱ评分比较 常规组治疗前APACHE Ⅱ评分为(23.91±7.23)分,治疗后为(20.09±6.51)分;UTI组分别为(24.02±5.42)分、(15.81±4.26)分;治疗后,两组的APACHE Ⅱ评分与治疗前比较差异均有统计学意义(P<0.05),而UTI组差异更为明显(P<0.05)。
表1 两组TNF-α、IL-6、CRP水平比较(s)

表1 两组TNF-α、IL-6、CRP水平比较(s)
*与本组治疗前比较,P<0.05;△与常规组治疗后比较,P<0.05
IL-6 ng/L组别 TNF-α ng/L C-反应蛋白 mg/L治疗前 治疗后 治疗前 治疗后 治疗前 治疗后UTI组(n=34)142.21±25.31 86.32±26.15*△ 76.40±7.25 25.69±8.37*△ 78.40±7.25 26.29±3.37*△常规组(n=34)141.85±28.19 119.24±24.53* 75.23±6.64 59.51±7.25* 77.23±6.64 49.51±5.25*
表2 两组肝肾生化指标变化(s)
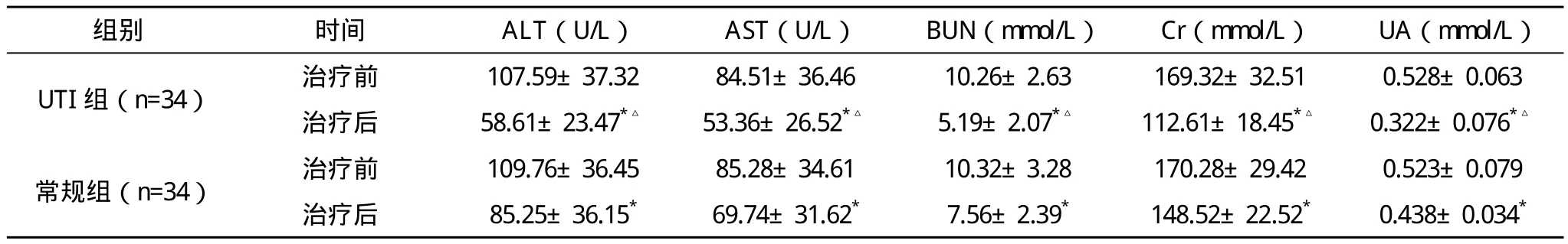
表2 两组肝肾生化指标变化(s)
*与本组治疗前比较,P<0.05;△与常规组治疗后比较,P<0.05
组别 时间 ALT(U/L)AST(U/L)BUN(mmol/L)Cr(mmol/L)UA(mmol/L)UTI组(n=34)治疗前 107.59±37.32 84.51±36.46 10.26±2.63 169.32±32.51 0.528±0.063治疗后 58.61±23.47*△ 53.36±26.52*△ 5.19±2.07*△ 112.61±18.45*△ 0.322±0.076*△常规组(n=34)治疗前 109.76±36.45 85.28±34.61 10.32±3.28 170.28±29.42 0.523±0.079治疗后 85.25±36.15* 69.74±31.62* 7.56±2.39* 148.52±22.52* 0.438±0.034*
表3 两组LDH、CK、CK-MB水平比较(s)U/L

表3 两组LDH、CK、CK-MB水平比较(s)U/L
*与本组治疗前比较,P<0.05;△与常规组治疗后比较,P<0.05
CK组别 LDH CK-MB治疗前 治疗后 治疗前 治疗后 治疗前 治疗后UTI组(n=34)256.35±62.91 128.43±52.38*△ 173.46±38.29 70.42±32.45*△ 24.03±4.18 9.62±3.05*△常规组(n=34)253.54±63.35 169.24±49.92* 178.57±41.21 112.39±29.37* 23.12±3.91 16.13±2.83*
3 讨论
随着分子生物学的迅速发展,对脓毒症发病机理的了解也日益加深,在疾病的发生发展过程中,外界刺激因子通过与机体内免疫炎症细胞受体结合,引起全身炎症反应综合征进而发展为脓毒症。脓毒症的本质为促炎介质的释放,若能控制促炎介质的释放,则可能改善脓毒症患者的炎症反应。本研究结果发现,UTI可有效降低炎症因子TNF-α、IL-6水平,能够改善患者的炎症反应,有利于改善脓毒症患者预后,对器官功能有保护作用。
脓毒症的本质是炎症因子的过度释放[3-4],若能控制炎症细胞因子的水平则能改善脓毒症的状况。炎症细胞因子是由免疫细胞分泌的、能调节细胞功能的小分子多肽,在免疫应答过程中,细胞因子对于细胞间相互作用、细胞的生长和分化有重要调节作用。炎症反应及细胞免疫是脓毒症发生发展过程中起着关键作用,炎症因子可分为促炎性细胞因子和抗炎性细胞因子两种类型,由脂肪细胞分泌的TNF-α、IL-6属于促炎因子。IL-6和TNF-α是介导急性期炎症反应最重要的细胞因子[5-6],可能是导致机体脏器受损的重要因素。可以通过检测血中TNF-α,IL-6浓度水平变化,而且IL-6、TNF-α在血中浓度可以反映脓毒症患者急性炎症的程度。CRP是机体受到各种损伤或炎症刺激后肝脏产生的一种急性期蛋白,IL-6、TNF-α是刺激肝脏细胞合成分泌CRP的主要细胞因子,CRP是全身炎症反应的敏感性标志物,CRP受IL-6、TNF-α等炎性因子的调节,在机体损伤的6~8 h内迅速升高,12~24 h内达到高峰,且几乎与炎症和组织损伤程度成正比;当炎症状态恢复时,CRP浓度也下降,在炎症反应中有重要意义。CRP可上调黏附因子的表达[7-8],调节体内多种细胞和循环中单核细胞的促进炎性因子分泌的作用,CRP可增强LDL的调理素作用并调节巨噬细胞摄取LDL,进而变为泡沫细胞,CRP可导致一氧化氮分泌减少。
UTI是由肝脏分泌的酸性糖蛋白[9],含有143个氨基酸,是一种典型的Kunitz型蛋白酶抑制剂,第10位的丝氨酸和第45位的天冬酰胺上有糖链,使其表现出稳定细胞膜和溶酶体膜的生理功能,UTI具有两个活性功能区,两个功能区不完全重叠且有多种酶的结合位点。UTI具有稳定溶酶体膜,抑制溶酶体酶的释放,清除氧自由基及抑制炎症介质释放的作用;因有很广的抑酶谱,能够同时抑制多种水解酶的活性作用,具有抗炎、减少细胞与组织损伤,改善微循环等,且抑制效率高;产物仍保留较强的抑酶活性。研究表明,UTI能够有效保护心肌细胞,维持线粒体功能,恢复细胞能量供应;对肾脏细胞的线粒体也有保护作用;并能保护肝脏,抑制转氨酶升高[10-11]。APACHE Ⅱ评分,能以量化形式反映患者当前的疾病状态,与疾病的严重程度成正相关,可以用于判定患者疾病程度[12]。本研究表明,UTI组治疗后APACHE Ⅱ评分降低,与治疗前比较差异有统计学意义(P<0.05),且与常规组治疗后比较降低更为明显(P<0.05)。UTI能够抑制水解酶、过度炎症反应、缺血和缺氧造成的组织细胞损害、中和或对抗脓毒症的各种毒素、显示确切的对器官功能保护作用。
本研究结果表明,UTI组治疗后炎症细胞因子TNF-α、IL-6及CRP水平明显下降,与治疗前及常规组治疗后比较差异均有统计学意义(P<0.05),UTI组较好降低肝功能的ALT、AST水平及肾功能的Cr、BUN、UA水平;同时UTI组的心功能的LDH、CK、CK-MB水平,与治疗前及常规组治疗后比较差异均有统计学意义(P<0.05)。UTI的上述临床作用很可能与UTI有效清除氧自由基及抑制炎症介质释放的作用有关,由此可以表明,UTI对脓毒症患者的肝、肾、心功能确有较好的保护作用。
而且,UTI能够通过抑制TNF-α、IL-6等炎症介质的过度释放[13],阻止细胞炎性因子与白细胞之间的相互作用,防止白细胞的过度激活,减轻炎症反应保护器官功能。UTI有效降低急性期反应蛋白CRP,能够有效防治全身炎症反应综合征。本研究表明,在脓毒症发展进程中,TNF-α、IL-6、CRP参与了炎症反应的进程。从这些炎性因子的变化情况,可以监测脓毒症的治疗效果及预后,在临床实践中,应用UTI能减轻脓毒症患者炎性介质的释放,抑制全身过度的炎症反应,防止脓毒症患者多器官功能衰竭的发生。
综上所述,UTI能够有效地抑制机体炎症反应,有利于改善脓毒症患者的病情及反映心肝肾各项生化指标,对脓毒症患者的器官功能发挥较好的保护作用,今后加大此方面的研究观察,进一步在临床中推广应用。
[1]Chen H,He M Y,Li Y M,et al.Treatment of patients with severe sepsis using ulinastatin and thymosin alpha1: a prospective,randomized, controlled pilot study[J].Chin Med J (Engl),2009,122(8):883-888.
[2]Levy M M,Fink M P,Marshall J C,et a1.2001 SCCM /ESICM /ACCP /ATS /SIS international sepsis definitions conference[J].Crit Core Med,2003,31(14):1250-1256.
[3]Shu Y Q,Yang Y,Wang Y G,et al.Combined therapy with methylprednisolone and ulinastatin in experimental autoimmune encephalomyelitis[J].Chin Med J (Engl),2013,126(18):3439-3445.
[4]Chen X,Wang Y,Luo H M,et al.Ulinastatin reduces urinary sepsis related inflammation by upregulating IL-10 and down regulating TNF-α levels[J].Mol Med Rep,2013,8(1):29-34.
[5]Wu T J,Zhang L N,Kang C C,et al.The effect of ulinastatin on disbalance of inflammation and immune status in patients with severe sepsis[J].Chinese Critical Care Mdicine,2013,25(4):219-223.
[6]景炳文.乌司他丁在急危重症临床应用的进展[J].中国危重病急救医学,2010,22(4):25-75.
[7]Ken I I,Hirohisa T.Urinary trypsin inhibitor as a therapeutic option for endotoxin related inflammatory disorders[J].Expert Opin Investig Drugs,2010,19(4):513-520.
[8]Tu Y,Diao Y F,Yang X P,et al.Effect of ulinastatin in traumatic brain injury with multiple injuries[J].Chinese Critical Care Medicine,2012,24(11):677-679.
[9]Cao Y Z,Tu Y Y,Chen X,et al.Protective effect of ulinastatin against murine models of sepsis: inhibition of TNF-α and IL-6 and augmentation of IL-10 and IL-13[J].Exp Toxicol Pathol,2012,64(6):543-547.
[10]Masuda T,Sato K,Noda C,et al.Protective effect of urinary trypsin inhibitor on myocardial mitochondria during hemorrhagic shock and reperfusion[J].Crit Care Med,2009,31(7):1987-1992.
[11]王志,林娜.乌司他丁治疗慢性心力衰竭的疗效及对细胞因子与心功能的影响[J].中国医药导报,2012,9(1):76-78.
[12]Park K H.The anti-inflammatory effects of ulinastatin in trauma patients with hemorrhagic shock[J].Journal of Koreal Medical Science,2010,25(1):128-134.
[13]陈宁波,曾杰,李艳,等.应用乌司他丁治疗严重多发伤血清IL-6、IL-8、IL-10、TNF-α的表达及临床意义[J].四川医学,2013,34(1):1-4.
