隔药灸对克罗恩病肠纤维化大鼠结肠成纤维细胞 CTGF、FN、Smad表达的影响
2014-06-05安彩萍黄燕马晓芃吴焕淦施征杨玲窦传字洪珏
安彩萍,黄燕,马晓芃,吴焕淦,施征,杨玲,窦传字,洪珏
(1.复旦大学附属妇产科医院,上海 200011;2.上海中医药大学,上海 201203;3.上海市针灸经络研究所,上海200030)
·“973计划”专栏·
隔药灸对克罗恩病肠纤维化大鼠结肠成纤维细胞 CTGF、FN、Smad表达的影响
安彩萍1,黄燕2,马晓芃3,吴焕淦3,施征3,杨玲3,窦传字3,洪珏3
(1.复旦大学附属妇产科医院,上海 200011;2.上海中医药大学,上海 201203;3.上海市针灸经络研究所,上海200030)
目的 观察隔药灸对克罗恩病肠纤维化大鼠结肠成纤维细胞(conlonic fibroblast,CFB)CTGF、FN蛋白和Smad3、Smad7 mRNA表达的影响,探讨隔药灸治疗克罗恩病肠纤维化的作用机制。方法 SD大鼠随机分为正常组、模型组、隔药灸组和西药组。在成功制备克罗恩病肠纤维化大鼠模型的基础上,隔药灸组取天枢穴(双)、气海穴进行治疗,西药组以美沙拉嗪灌胃治疗。各组治疗干预结束后,留取结肠组织,分离并体外培养大鼠CFB。采用免疫细胞化学法观察各组大鼠CFB的CTGF、FN蛋白表达,应用实时荧光定量PCR技术检测各组大鼠CFB的Smad3、Smad7 mRNA表达。结果 与正常组比较,模型组大鼠CFB的CTGF、FN蛋白表达升高(均P<0.01);与模型组比较,隔药灸组CFB的CTGF、FN蛋白表达降低(均P<0.01)。各组大鼠比较,CFB的Smad3和Smad7 mRNA表达变化均不显著(均P>0.05)。结论 隔药灸能下调克罗恩病肠纤维化大鼠肠成纤维细胞CTGF、FN的蛋白表达。
隔药灸;克罗恩病;肠纤维化;成纤维细胞;CTGF;FN
克罗恩病(Crohn's disease,CD)是一种病因未明的从口腔至肛门的消化道任何一段均可受累的消化管壁全层性炎症,但以末端回肠与邻近结肠多见。肠纤维化是其常见的并发症,可发生于CD病程中任一时段[1]。在CD中,肠纤维化被看作是一种对损伤过度的愈合反应,旨在修复黏膜,但是重度肠纤维化可能导致管腔的临界狭窄或狭窄,甚至由狭窄而发展为肠闭塞[2-4]。目前,尚无特效的抗纤维化药物,60%以上的患者最终需要手术或机械治疗[5-6]。
肠纤维化是一种慢性和渐进性的过程,其特征在于由细胞外基质(extracellular matrix,ECM)如胶原蛋白、纤维连接蛋白(fibronectin,FN)等的过度沉积而导致的硬化和/或所涉及的组织的瘢痕形成[3,6]。ECM的产生与纤维化细胞的活性和各种生长因子有关[7],其中CFB是ECM的主要细胞来源,其异常增殖和过量产生的ECM是导致肠纤维化的直接原因。转化生长因子(transforming growth factor-beta1,TGF-β)被认为是多种炎症性疾病及纤维化疾病进程的主要驱动力,其下游因子——结缔组织生长因子(connective tissue growth factor,CTGF)与纤维化疾病密切相关[8],常介导TGF-β的促纤维化作用[9]。研究表明CTGF可刺激CFB的增殖和ECM的沉积,CFB可能通过CTGF的过度表达而诱发CD的肠狭窄,CTGF在狭窄性克罗恩病的CFB中表达增强[10]。TGF-β诱导CTGF表达可通过Smad通路调控[11-12];TGF-β通过CTGF启动子上的一种Smad3功能性结合位点来诱导CTGF的表达[13],该位点突变可消除TGF-β诱导的CTGF表达或减少基础CTGF表达,而此作用可被Smad7明显抑制。本研究拟观察隔药灸对克罗恩病肠纤维化大鼠结肠成纤维细胞CTGF、FN蛋白表达及Smad3、Smad7 mRNA表达的影响,探讨艾灸治疗克罗恩病肠纤维化的作用机制,以期为针灸防治肠纤维化提供实验依据。
1 材料与方法
1.1 实验动物
清洁级,雄性 SD(Sprague-Dawley)大鼠,体重(150±20)g,由上海中医药大学实验动物中心提供[实验动物质量合格证为SCXK(沪)2003-0003]。
1.2 主要试剂及仪器
5%(W/V)TNBS(2,4,6-三硝基苯磺酸)(Sigma公司);美沙拉嗪肠溶片(佳木斯鹿灵制药有限责任公司); DMEM/F-12培养液(Hyclone公司);胎牛血清(Gibco公司);新生牛血清(杭州四季青生物材料有限公司); 0.25%胰蛋白酶(含EDTA)(Gibco公司);一抗(Santa cruz公司);FQ-PCR试剂盒(广州达安生物技术有限公司);Trizoltm(联合生物集团公司);CO2培养箱(NAPCO公司,法国);超净工作台(Heraeus公司,德国);光学显微镜(Olympus公司,日本);倒置相差显微镜(Nikon公司,日本);MOTIC图像分析系统(麦克奥迪实业集团有限公司);低温高速离心机(德国);移液器(吉尔森公司);TYPEB2生物安全柜(BAKER公司,美国);荧光定量PCR仪(ABI公司,美国)。
1.3 模型制备
应 用 2,4,6-三 硝 基 苯 磺 酸 (2,4,6-trinitrobenzene sulfonic acid,TNBS)制备克罗恩病肠纤维化大鼠模型[14-15]。各组大鼠灌肠前24 h禁食、不禁水。将无水乙醇加双蒸水,配成50%乙醇,然后将5%(W/V)的TNBS与50%的乙醇按2:1比例混合成TNBS灌肠液。造模大鼠以TNBS灌肠液3 mL/kg(含TNBS 100 mg/kg)灌肠。用改良型灌胃针连接注射器,抽取适量灌肠液,大鼠体位为头下尾上,灌肠时灌胃针缓慢插入肛门6~8 cm,注入灌肠液,拔出灌胃针后再将大鼠倒立1 min左右,以防药液溢出。正常组大鼠用相同体积0.9%氯化钠注射液灌肠。每隔7 d重复灌肠1次,共4次。
1.4 分组与治疗
大鼠模型制备成功后,按体重根据随机数字表随机分为模型组、隔药灸组和西药组,并与正常大鼠作对照。
隔药灸组采用隔附子饼灸,取双侧天枢穴、气海穴。药饼配方包括附子(广西)、肉桂(四川)等药,研成细粉,灸前用黄酒调和药粉拌成糊状,制成直径0.5 cm、厚0.3 cm大小药饼。艾炷选精制艾绒约90 mg,制成小椎体状。每日隔药饼灸1次,每次每穴灸2壮,共治疗10 d。
西药组采用美沙拉嗪稀释液灌胃,每日投药量按成人(70 kg体重,4 g/d)与大鼠(200 g体重)56:1比例[16],每日2次,共治疗10 d。
正常组与模型组不进行任何治疗,只作与隔药灸组相同的抓取与固定。
1.5 结肠成纤维细胞分离与体外培养
治疗结束后,断颈法处死大鼠,参照文献[17]用消化法进行大鼠CFB原、传代的培养。剪取3 cm结肠,用无菌双蒸水反复冲洗,将组织剪成为 1 mm×1 mm×1 mm的块状,加入适量 0.25%胰酶-0.01%EDTA消化液,室温搅拌消化20 min,弃上清,重新加入适量0.25%胰酶-0.01%EDTA消化液,5%CO2培养箱 37℃消化 20 min,收集上清液,加入含10%胎牛血清的DMEM/F-12培养液终止消化,4℃750 rpm离心8 min,弃上清液,加入4 mL含 10%胎牛血清的DMEM/F-12培养液,重悬细胞计数,并调整细胞浓度,按1×105个/mL接种于25 cm×25 cm培养瓶中,加入含 10%FBS的DMEM/F-12培养液,湿度95%、5%CO2培养箱中37℃培养,培养2 h后,换液1次,纯化肠成纤维细胞。每2~3 d换液1次,待细胞生长融合至90%,消化传代,收集CFB后进行指标检测。
1.6 指标检测
1.6.1 大鼠结肠成纤维细胞的鉴定
采用免疫细胞化学染色检测大鼠结肠成纤维细胞波形蛋白和结蛋白的表达。
1.6.2 大鼠结肠成纤维细胞CTGF、FN的表达
采用EnVision二步法检测。细胞爬片,95%乙醇固定,3%过氧化氢室温孵育5 min,PBS洗片,5%正常羊血清室温孵育30 min,滴加适量抗CTGF抗体、FN抗体(4℃孵育18 h,PBS洗3次,滴加适量二抗,37℃孵育30 min,PBS洗3次,苏木素复染1 min,温水返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片并镜检。采用MMOTICAM6.0图像分析系统,进行图像分析。
1.6.3 大鼠结肠成纤维细胞Smad3、Smad7 mRNA表达的检测
采用实时荧光定量聚合酶链反应检测。按照TRIzol说明书抽提细胞总RNA。取出 RT-PCR试剂盒解冻,将RNA逆转录cDNA。转录cDNA逆转录体系,为5 ×逆转录buffer,上游引物F,上游引物R,dNTPs,逆转录酶 MMLV,DEPC水,总体积 20 µL,反应条件为 37℃1 h,95℃5 min,灭活MMLV。实时荧光定量PCR(FQ-PCR)体系,试剂分别是Taq酶、dNTPs、上下游引物、ddH2O、10×buffer、荧光标记探针。扩增条件:①93℃ 2 min,②93℃15 s、55℃1 min40个循环。引物序列见表1。反应完数据保存。
应用 ABI7300型荧光定量 PCR仪数据软件(ABI Prism 7300 SDS Software)分析。Smad3、Smad7 mRNA的相对表达量以 2-ΔCt×100%表示(ΔCt=目的基因Ct值-内参基因Ct值)。

表1 各基因引物和探针序列
1.7 统计学方法
采用SPSS15.0统计分析软件,对各组数据进行正态分布和方差齐性检验,若正态分布、方差齐性,采用单因素方差分析(one-way ANOVA)进行统计,组间两两比较则采用LSD检验。若方差不齐,采用Games-Howell检验分析。统计结果以P<0.05表示差异具有统计学意义。
2 结果
2.1 大鼠结肠成纤维细胞的鉴定
应用免疫细胞化学染色法鉴定大鼠结肠成纤维细胞。结果发现从大鼠结肠分离培养的细胞,波形蛋白(vimentin,V)免疫细胞化学染色显示细胞胞质染成深棕色,为阳性(+);结蛋白(desmin,D)免疫细胞化学染色显示细胞胞质未染色,为阴性(-);提示本研究从大鼠结肠分离出的细胞具有成纤维细胞的免疫学特征。
2.2 大鼠肠成纤维细胞FN蛋白表达结果
免疫细胞化学染色结果显示,大鼠 CFB核内及胞质均有FN阳性表达,颜色呈棕黄色。从表2及图1可见,与正常组比较,模型组CFB的FN蛋白表达明显增强(P<0.01);隔药灸组及西药组CFB的FN蛋白表达明显减少(P<0.01),西药组与隔药灸组相比,差异无统计学意义(P>0.05)。
表2 各组大鼠肠成纤维细胞FN表达变化 (±s)

表2 各组大鼠肠成纤维细胞FN表达变化 (±s)
注:与正常组比较1)P<0.01;与模型组比较2)P<0.01
组别 n 阳性积分光密度(IOD)正常组 3 961.709±193.915模型组 3 7307.125±1743.622隔药灸组1)3 2121.942±329.706西药组1)2) 3 2257.024±478.7721)2)

图1 各组大鼠肠成纤维细胞FN免疫细胞化学染色结果[FN染色(×100)]
2.3 各组大鼠肠成纤维细胞CTGF表达结果
大鼠CFB核内及胞质均有CTGF阳性表达,呈棕黄色。从表3及图2可见,模型组CTGF强表达,与正常组比较明显增强(P<0.01);与模型组比较,隔药灸组和西药组CFB的CTGF蛋白表达减少(P<0.01);西药组与隔药灸组比较差异无统计学意义(P>0.05)。
表3 各组大鼠肠成纤维细胞CTGF表达变化 (±s)

表3 各组大鼠肠成纤维细胞CTGF表达变化 (±s)
注:与正常组比较1)P<0.01;与模型组比较2)P<0.01
组别 n 阳性积分光密度(IOD)正常组 3 1040.599±258.125模型组 3 6446.396±3037.893隔药灸组1)3 1891.315±165.584西药组2)3 2125.134±149.0992)
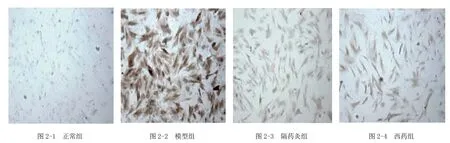
图2 各组大鼠肠成纤维细胞CTGF免疫细胞化学染色结果[CTGF染色(×100)]
2.4 各组大鼠肠成纤维细胞Smad3、Smad7 mRNA表达结果
Smad3 mRNA检测结果显示,正常组为 10.53%± 7.44%,模型组为24.55%±27.08%,隔药灸组为17.00% ±13.53%,西药组为16.62%±17.50%。与正常组比较,模型组大鼠CFB的Smad3 mRNA表达虽有增加但差异无统计学意义(P>0.05);隔药灸组和西药组大鼠CFB的Smad3 mRNA表达虽有降低,但差异无统计学意义(P>0.05)。
Smad7 mRNA检测结果显示,正常组为 2.23%± 0.92%,模型组为4.07%±1.32%,隔药灸组为12.78%± 5.39%,西药组为 7.27%±5.54%。与正常组比较,模型组大鼠CFB的Smad7 mRNA表达虽有增加但差异无统计学意义(P>0.05);隔药灸组和西药组大鼠 CFB的Smad7 mRNA表达虽有升高,但差异无统计学意义(P>0.05)。
3 讨论
克罗恩病发病率在世界范围内呈逐年升高趋势[18],而肠纤维化是CD进展的主要并发症之一,被认为是慢性炎症和伤口愈合失调的结果[19]。在CD肠壁正常修复和纤维化进程中,CFB发挥着重要作用。CD炎症初期,激活的单核细胞或巨噬细胞等炎性细胞,分泌大量如IL-1β、bFGF、PDGF、TGF-β1和IGF-1等促纤维介质,促使CFB大量出现,是损伤愈合的象征;但反复的炎症损伤和组织修复不断刺激肠壁,则使CFB过度增殖并被激活,其产生和分泌ECM的能力增强,导致胶原大量堆积,是肠壁纤维化发生、发展的原因。ECM产生细胞的活化是纤维化形成的关键步骤和核心环节,而CFB正是合成和分泌以胶原蛋白为主要成分的ECM的主要来源[20],故CFB被认为是肠壁各层纤维化和狭窄形成的主要细胞类型。CTGF是一种多效细胞因子,有促CFB有丝分裂和趋化的作用,不仅可以直接刺激CFB增殖,还可通过CFB诱导Ⅰ型胶原α1、FN和整合素α5的表达,介导以FN为代表的ECM的沉积,促进间质细胞与Ⅰ型胶原黏着,在结缔组织细胞增殖和ECM沉积中扮演着重要作用。CTGF集中在CD肠黏膜下层的CFB内及淋巴结周围和接近肠腔表面的一些严重损伤区域内[21]。CTGF可作用于CFB介导损伤性肠黏膜的修复,而且过度表达的CTGF可刺激CFB增殖和ECM沉积,进而诱发肠纤维化和狭窄的形成。在正常CFB中CTGF通常不表达或极低表达[22],而用TGF-β刺激正常和狭窄性CD的CFB,发现狭窄性CD的肠成纤维细胞CTGF蛋白和mRNA的表达均比正常组高[23],且与肠壁纤维化程度呈正相关,故CFB内CTGF的持续过高表达成为CD肠壁纤维化的基础。
CTGF是TGF-β特异性下游效应分子,TGF-β的促肠纤维化作用可通过多种信号途径诱导CTGF的表达来完成[24]。TGF-β刺激CFB增殖和ECM合成,且在正常的成熟CFB中,TGF-β诱导CTGF的表达,在急性纤维化模型中与CTGF协同刺激细胞增殖和ECM沉积。关于CTGF的信号通路,主要与Smad、丝裂原活化蛋白激酶(mitogen-activated proteinkinase,MAPK)及蛋白激酶C(the protein kinaseC,PKC)的活化有关。在Smad信号通路中,TGF-β诱导CTGF的表达主要依赖Smad3和Smad4,而非Smad2[25];在CTGF启动子上基因序列为5'-GAGGAATG-3'的Smad结合元件(SBE)是TGF-β诱导CFB分泌CTGF所必需的[22],并为Smad3提供了黏着位点,Smad3可直接与SBE及相关的DNA序列结合,从而促进CTGF的表达。Smad7被认为是TGF-β/Smad信号传导通路中最重要的负性调节因子之一,可通过抑制Smad3磷酸化来阻滞Smad3/4复合物的形成,进而抑制TGF-β信号通路,Smad7表达下调在纤维化发病机制中起重要作用。
本课题组在体实验的研究已发现艾灸能够改善大鼠CD肠纤维化[26],下调CD肠纤维化大鼠结肠TGF-β、Smad4蛋白及mRNA的异常表达[27]。本研究应用细胞培养、免疫细胞化学等技术,在分离培养CFB的基础上,观察隔药灸对克罗恩病肠纤维化大鼠CFB的CTGF、FN蛋白和Smad3、Smad7 mRNA表达的影响,探讨隔药灸治疗克罗恩病肠纤维化的分子机制。研究结果显示,CD肠纤维化模型大鼠CFB内FN、CTGF蛋白表达显著增高,隔药灸治疗后,CD肠纤维化大鼠的CFB内FN、CTGF蛋白表达显著降低,提示下调CFB内FN、CTGF蛋白表达可能是艾灸治疗克罗恩病肠纤维化的重要分子机制。对Smad3、Smad7mRNA的检测结果发现,各组大鼠CFB的Smad3、Smad7mRNA组间比较差异均无统计学意义,分析原因,可能因检测标本非原代细胞,培养传代后细胞的原有特性有所改变,无法呈现CFB的在体特征,因而无法检测出Smad3和Smad7 mRNA表达的变化;抑或是隔药灸对克罗恩病肠纤维化大鼠 CFB的 Smad3、Smad7 mRNA表达无影响,而是通过其他途径影响FN和CTGF蛋白的表达,尚需今后进一步深入探讨和验证。
[1] Rieder F, L awrance I C, L eite A, et.al. P redictors of f ibrostenotic Crohn’s disease[J].Inflamm Bowel Dis,2011,17(9):2000-2007.
[2] Principi M, Giorgio F,Losurdo G, et.al. Fibrogenesis and fibrosis in inflammatory bowel diseases: Good and bad side of same coin?[J]. World J Gastrointest Pathophysiol, 2013,4(4):100-107.
[3] Speca S, Giusti I, Rieder F, et al. Cellular and molecular mechanisms of intestinal fibrosis[J]. World J Gastroenterol, 2012,18(28):3635-3661.
[4]Chen YW,Ge WS,Xu LM, et al. miR-200b is involved in intestinal fibrosis of Crohn’s disease [J].Int J Mol Med, 2012,29(4):601-606. [5]Govani S M,Stidham R W,Higgins P D. How e arly t o t ake a rms against a sea of troubles? The case for aggressive early therapy in Crohn’s disease to prevent fibrotic intestinal strictures[J].J C rohns Colitis, 2013,7(11):923-927.
[6]Rieder F , Zimmermann EM ,Remzi FH , et.al. C rohn’s disease c ompli- cated by strictures: a systematic r eview[J].Gut, 2013,62(7):1072- 1084.
[7]Abe Y,Murano M,Murano N, et al. Simvastatin attenuates intestinal fibrosis independent o f th e a nti-inflammatory e ffect by pr omoting fibroblast/myofibroblast apoptosis in the regeneration/healing process from TNBS-induced colitis[J].Dig Dis Sci, 2012,57(2):335-344.
[8] Verrecchia F, Mauviel A. Transforming growth factor-beta and fibrosis[J]. World J Gastroenterol, 2007,13(22):3056-3062.
[9]Zuehlke J,Ebenau A,Krueger B, et al. Vectorial secretion of CTGF as a c ell-type specific r esponse to LPA a nd TGF-β in hu man tu bular epithelial cells[J]. Cell Commun Signal, 2012,10(1):25.
[10]Beddy D,Mulsow J,Watson RW, et al. Expression and r egulation of connective tissue growth factor by transforming growth factor beta and tumour necrosis factor alpha in fibroblasts isolated from strictures in patients with Crohn’s disease[J].Br J Surg, 2006,93(10):1290-1296.
[11] Razzaque M S, Foster C S, Ah med AR. Role of c onnective tissue growth factor in the pathogenesis of conjunctival scarring in ocular cicatricial pe mphigoid[J].Invest Ophthalmol Vis Sci, 2003,44(5): 1998-2003.
[12]Li S,Ge S,Yang P. Immunohistochemical localization of connective tissue growth f actor, transforming growth f actor-beta1 and phosphorylated-smad2/3 in the developing periodontium of rats[J].J Periodontal Res, 2013 Nov 13.DOI:10.1111/jre.12143.
[13] Theiss AL, Fruchtman S, Lund PK. Growth factors in inflammatory bowel disease: the actions and interactions of growth hormone and insulin-like gr owth f actor-1[J]. Inflamm B owel Di s, 2004,10 (6):871-880.
[14] Morris GP, B eck P L, He rridge MS, et al. Hapten-induced m odel of chronic in flammation and u lceration in th e r at colon[J]. Gastroenterology, 1989,96(3):795-803.
[15] 马晓芃,安彩萍,吴焕淦,等.隔药灸与电针对克罗恩病大鼠结肠转化生长因子β1和结缔组织生长因子及Ⅰ型胶原和纤维连接蛋白表达的影响[J].中国组织工程研究与临床康复,2008,12(20):3853-3858.
[16] 徐淑云,卞如濂,陈修.药理学实验方法学[M].第2版,北京:人民卫生出版社,1991:1011-1013.
[17] Steenfos HH. Growth factors and wound healing[J]. Scand J Reconstr Surg Hand Surg, 1994,28(2):95-105.
[18]Stasi C,Falchini M,Milani S. Imaging modalities for the noninvasive assessment of fibrosis in Crohn’s disease[J].Scientific World Journal, 2012:450151.
[19]Flier S N, Tanjore H, Kokkotou, et al. Identification o f epithelial to mesenchymal transition as a novel source of fibroblasts in intestinal fibrosis[J].J Biol Chem, 2010,285(26):20202-20212.
[20]Burke JP,Mulsow JJ,O’ Keane C, et al. Fibrogenesis i n C rohn’s disease[J].Am J Gastroenterol,2007,102(2):439-448.
[21]Di Mola FF,Di Sebastiano P,Gardini A, et al. Differential expression of connective tissue growth factor in inflammatory bowel disease[J]. Digestion, 2004,69(4):245-253.
[22] Leask A, Holm es A, B lack C M, et al. Connective ti ssue gr owth factor ge ne r egulation. R equirements f or it s ind uction b y transforming gr owth f actor-beta 2 in fibroblasts[J]. J B iol C hem, 2003,278(15): 13008-13015.
[23] Beddy D, Mulsow J, Watson RW, et al. Expression and r egulation of connective tissue growth factor by transforming growth factor beta and tumour necrosis factor alpha in fibroblasts isolated from strictures in patients with Crohn’s disease[J]. Br J S urg, 2006,93(10):1290-1296.
[24] 安彩萍,马晓芃,吴焕淦,等.TGF-β/CTGF在肠纤维化机制中的作用[J].世界华人消化杂志,2008,16(19):2137-2143.
[25]Arnott J A,Zhang X,Sanjay A, et al. Molecular r equirements f or induction of CTGF expression by TGF-beta1 in primary osteoblasts[J]. Bone, 2008,42(5):871-885.
[26] 马晓芃,安彩萍,吴焕淦,等.隔药灸和电针对克罗恩病大鼠结肠IGF-I、IGF-IR、IGFBP-5表达的影响[J].上海针灸杂志,2008,27 (5):37-40.
[27]WuHG, Zhao C, Wu LY, et al. Effect of moxibustion on expressions of TGF-β and Smad4 in colonic mucosa of rats with intestinal fibrosis in Crohn disease[J]. J Acupunct Tuina Sci, 2012,10(6):331-335.
Effect of Medicinal Cake Moxibustion on the Expressions of Colonic Fibroblast CTGF, FN and Smad in Crohn Disease Rats with Intestinal Fibrosis
AN Cai-ping1, HUANG Yan2, MA Xiao-peng3, WU Huan-gan3, SHI Zheng3, YANG Ling3, DOU Chuan-zi3.
1.Fudan U niversity O bstetrics & G ynecology H ospital,Shanghai 200001,China; 2.Shanghai U niversity of Traditional C hinese Medicine,Shanghai 201203,China; 3.Shanghai Research Institute of Acupuncture and Meridian,Shanghai 200030,China
ObjectiveTo investigate the effect of medicinal cake moxibustion on the expressions of colonic fibroblast (CFB) CTGF, fibronectin (FN), and Smad3 and Smad7 mRNA in Crohn disease rats with intestinal fibrosis and explore the mechanism of medicinal cake moxibustion treatment for intestinal fibrosis in Crohn disease.MethodSD rats were randomly allocated to normal, model, medicinal cake moxibustion and Western drug groups. After a rat model of Crohn’s disease-associated intestinal fibrosis was made successfully, the medicinal cake moxibustion group was treated by selecting points Tianshu (ST25,bilateral) and Qihai (CV6) and the Western drug group, by oral gavage of mesalazine. After treatment was finished in every group, colonic tissues were taken and rat CBF was separated and cultivated outside the body. The expressions of CTGF and FN in CFB were examined by immunocytochemistry and the expressions of Smad3 and Smad7 mRNA in CFB, by fluorescence-based quantitative real-time PCR in e very g roup of r ats.ResultThe e xpressions of C TGF a nd F N i n C FB i ncreased i n t he model g roup c ompared with t he normal group (both P<0.01) and decreased in the medicinal cake moxibustion group compared with the model group (both P<0.01). There were no statistically significant differences in the expressions of Smad3 and Smad7 mRNA in CFB between various groups of rats (all P>0.05).ConclusionMedicinal cake moxibustion can down-regulate the expressions of colonic fibroblast CTGF and FN in Crohn disease rats with intestinal fibrosis.
Medicinal cake moxibustion; Crohn disease; Fibroblast; CTGF; FN
R2-03
A
10.13460/j.issn.1005-0957.2014.06.0487
1005-0957(2014)06-0487-05
2014-02-20
国家自然科学基金项目(81273843,81072879);国家重点基础研究发展计划(2009CB522900);上海高校选拔培养优秀青年教师科研专项基金(SZY10071)
安彩萍(1981 - ),女,住院医师,硕士
马晓芃(1973 - ),女,研究员,博士生导师
