绵羊Txl-2基因CDS区克隆及其生物信息学分析
2014-06-05张晓东张国林郭丽娜张春香任有蛇岳文斌
秦 雪,张晓东,张国林,郭丽娜,张春香,任有蛇,岳文斌
(山西农业大学 动物科技学院,山西 太谷 030801)
绵羊Txl-2基因CDS区克隆及其生物信息学分析
秦 雪,张晓东,张国林,郭丽娜,张春香,任有蛇,岳文斌*
(山西农业大学 动物科技学院,山西 太谷 030801)
本研究以绵羊睾丸组织为材料,利用RT-PCR技术获得绵羊硫氧还蛋白类蛋白2(Thioredoxin like protein 2,Txl-2)基因的CDS区序列,并对其进行生物信息学分析。结果表明,克隆得到的绵羊Txl-2基因CDS区为795 bp,编码264个氨基酸。生物信息学分析结果表明,Txl-2编码的蛋白无跨膜区、信号肽和N-糖基化位点,存在多个磷酸化位点;预测出了Txl-2蛋白的二级结构和三级结构;Clustel W方法对比绵羊Txl-2与绵羊、山羊预测序列同源性最高。
Txl-2;绵羊;CDS区克隆;生物信息学分析
硫氧还蛋白(Thioredoxin,Trx)是生物体中普遍存在的一种小分子蛋白,是生物体调节体内氧化还原系统的一种重要蛋白质,广泛存在于低等生物到人的组织中。硫氧还蛋白系统由三部分组成:Trx、NADPH和TrxR,即硫氧还蛋白、还原型烟酰胺腺嘌呤二核苷酸和硫氧还蛋白还原酶。硫氧还蛋白在大肠杆菌中首次被发现,在随后的研究中人们发现其存在于绝大多数的真核及原核生物中[1]。硫氧还蛋白在进化上相当保守,存在一个二硫化物活性中心Cys-Gly-Pro-Cys(CGPC),组成了具有氧化还原活性功能的结构基序[2],发挥其氧化还原作用。硫氧还蛋白最主要的功能就是二硫化物还原酶活性,除此之外,还是细胞凋亡、细胞生长和分化的调控因子;也可作为DNA转录调节因子[3]。Txl-2(Thioredoxin like protein 2)是硫氧还蛋白家族的新成员,是介于在组织中广泛表达和睾丸/精子特异性表达的Trx蛋白[4]。Sadek等[5]研究了 Txl-2 在人上的定位和表达情况,结果表明,Txl-2的开放阅读框由330个氨基酸组成的,N端是典型的硫氧还蛋白结构域,C端则属于核酸蛋白激酶(NDP)的结构域。研究中还发现了外显子5缺失的△5Txl-2。Txl-2在睾丸和肺中有高表达外,在其它组织中也有低水平的表达。Txl-2主要定位于肺泡上皮的纤毛组织和由微管组成的精子尾部轴丝,可能与维持微管的结构稳定性有关,但其确切的生物学功能有待进一步研究。但是在其它哺乳动物中Txl-2研究较少。由于Txl-2在精子发生成熟以及受精过程中可能发挥重要作用,因而是发展新型男用免疫避孕抑制剂的一种潜在的靶分子。
1 材料与方法
1.1 材料
1.1.1 试验动物
本试验选用杂种公羔(杜泊×小尾寒羊)的睾丸组织采自山西农业大学动物科技学院牧站羊场。
1.1.2 主要试剂
pMD-18T载体、Ecoil JM109、RNAiso Plus、Taq 酶、dNTP、Prime ScriptTM RT Master均 购 自 TaKaRa公 司;DEPC、AMP+、X-Gal、酵母提取物均购自Sigma公司;感受态细胞、DNA琼脂糖胶回收试剂盒均购自北京康为试剂有限公司;其他常规试剂均为国产分析纯。
1.2 方法
1.2.1 引物设计与合成
以GeneBank中已公布的绵羊预测序列(登录号:XM_004003307)为模版,利用Primer Premier 5.0软件设计,引物序列为:Txl-2 F:GCCATGGGCAGCAAGAAAAAGG AAG;Txl-2 R:CTTCAGCTTGTGGCCTCAC CCTGG。
1.2.2 睾丸总RNA提取
绵羊睾丸组织经液氮冷冻后研磨成粉,移入EP管中,在样品中加入1 ml RNAiso Plus试剂,漩涡混匀,按操作说明提取总RNA,核酸蛋白分析仪测定其浓度与纯度。
1.2.3 RT-PCR扩增
反转录体系:5×Prime ScriptTM RT Master Mix 2 μl,总 RNA 4.5 μl,无 RNA 酶H2O 3.5 μl。反 应 条 件:37 ℃ 15 min;85℃5s;4℃延伸;PCR扩增体系:10×PCR 缓冲液 1.5 μl,NTP 模板 2 μl,Taq 酶0.5 μl,cDNA 模 版 1 μl,上 下 游 引 物 各0.6 μl,双 蒸 水 8.8 μl。PCR 扩 增 程 序:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸8 min。
1.2.4 克隆测序
采用TaKaRa公司PCR产物纯化试剂盒将PCR琼脂糖凝胶检测的目的片段回收纯化,在DNA连接酶的作用下,与载体过夜连接,将连接产物转化到感受态细胞中,并在含氨苄青霉素的LB平板上培养,经蓝白斑筛选,挑取白色的单菌落在含AMP+的LB液体培养基振荡培养,将所得菌液进行扩增,分装送至公司测序。
1.2.5 生物信息学分析
生物信息学分析方法如下:蛋白质基本性质分析 http://web.expasy.org/protparam/;蛋白质跨膜区分析 http://www.cbs.dtu.dk/services/TMHMM/;蛋白质信号肽预测http://www.cbs.dtu.dk/services/SignalP/;蛋白质N-糖基化位点预测http://www.cbs.dtu.dk/services/NetNGlyc/;蛋白质磷酸化位点预测 http://www.cbs.dtu.dk/services/NetPhos/;蛋白质二级结构预测DNAStar软件;蛋白质三级结构预测http://www.rcsb.org/pdb/;序列比对及同源性分析采用DNA MAN、DNA Star软件中EditSeq程序。
2 结果与分析
2.1 RT-PCR扩增
以绵羊睾丸总RNA为模版,通过RTPCR,产物用2%的琼脂糖凝胶电泳检测,得到约800 bp的片段,与预期结果相符(图1)。
2.2 Txl-2序列分析
绵羊Txl-2基因CDS区为795 bp,共编码264个氨基酸。
2.3 Txl-2的生物信息学分析
2.3.1 Txl-2蛋白基本性质分析
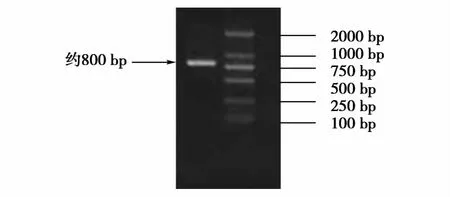
图1 RT-PCR产物琼脂糖凝胶电泳

图2 绵羊Txl-2编码区核苷酸序列及氨基酸序列
根据在线网站的ProtParam程序的分析结果,目的蛋白分子质量约为29KD,pI为4.70,不稳定系数为44.50,大于40,为不稳定蛋白。编码264个氨基酸,其中带负电荷的氨基酸(Asp+Glu)为56个,带正电荷的氨基酸(Arg+Lys)为31个。总平均疏水指数为-0.610。
2.3.2 Txl-2蛋白跨膜区、信号肽、磷酸化位点等理化功能预测
通过TMHMM、SignalP服务器预测绵羊Txl-2氨基酸无跨膜结构,也没有信号肽位点(图3A、B);NetOGlyo服务器预测Txl-2氨基酸序列无 N糖基化位点(图3C);NetPhos预测Txl-2氨基酸包括12个磷酸化位点,其中包括7个丝氨酸位点和5个苏氨酸位点(图3D)。
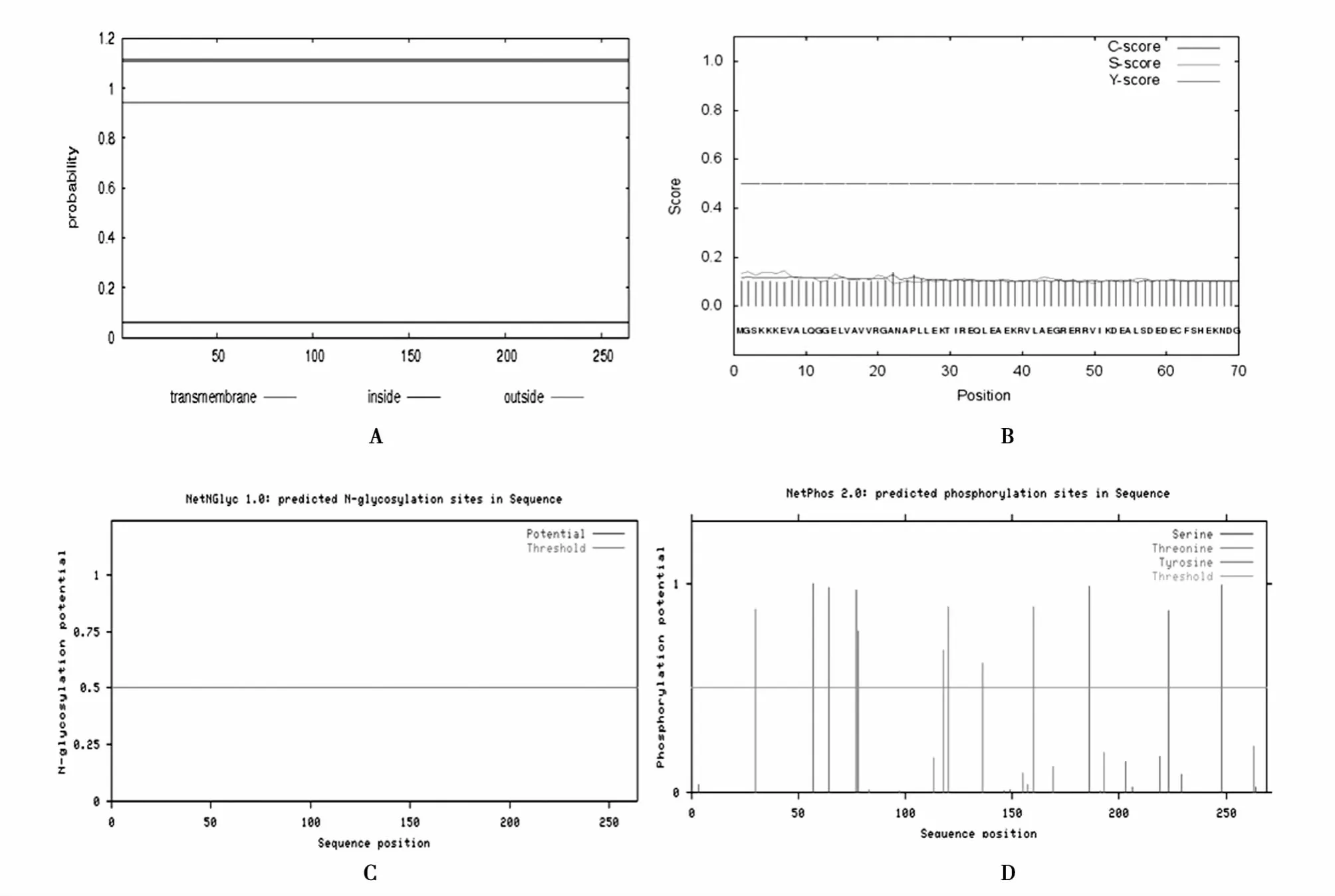
图3 绵羊Txl-2跨膜结构(A)、信号肽位点(B)、N糖基化位点(C)和磷酸化位点(D)
2.3.3 Txl-2蛋白二级、三级结构预测
应用DNA Star中的Protean程序分析Txl-2蛋白质的二级结构。应用 Carnier-Robson方法预测目的蛋白的α-螺旋、β-折叠、Turn-转角和Coil卷曲(见图4),所占比例依次为78.8%、2.16%、9.71%和9.33%。采用Swiss Model服务器预测绵羊Txl-2蛋白质的三级结构,结构模型见图5。

图4 绵羊Txl-2蛋白二级结构分析图

图5 绵羊Txl-2蛋白三级结构预测
2.3.4 氨基酸同源比对
绵羊Txl-2氨基酸序列与人、小鼠序列及大鼠、牛、山羊、绵羊、猪、马、大猩猩预测序列进行Clustal W多重比对结果见图6。由图6可知,绵羊Txl-2与山羊、绵羊(预测序列)同源性最高,亲缘关系最近,首先聚在一起;与猪、马(预测序列)关系较近,与其他物种遗传距离逐渐增大。

图6 绵羊Txl-2氨基酸序列多重比对及分子系统进化树
3 讨论
所有的生物体都有至少一种硫氧还蛋白体系,随着真核生物的进化复杂性的增加,相应地硫氧还蛋白体系的数量也有所增加。哺乳动物细胞有至少两种硫氧还蛋白体系,分别定位在细胞质中和线粒体中[6]。在多种氧化还原酶类中,硫氧还蛋白及相关蛋白是许多生理反应和病理反应的最重要的酶类之一[7]。本研究从绵羊睾丸组织中克隆得到的Txl-2基因CDS区由264个氨基酸组成,分子量约为29KD,蛋白结构分析其具有典型的硫氧还蛋白家族的结构基序。通过绵羊Txl-2核酸序列与其他动物比对,绵羊与山羊、猪、马亲缘关系最近,这表明哺乳类的家畜都具有相似的进化速度。
预测绵羊Txl-2氨基酸序列化学修饰位点,Txl-2蛋白没有跨膜结构,没有N-糖基化位点,表明Txl-2是一个核蛋白,参与调节细胞的生长、分化或转录调控。大量研究表明,硫氧还蛋白系统在细胞增殖和生存过程中起着重要的调节作用。Muller等[8]报道,当谷胱甘肽还原酶缺失时,氧化的谷胱甘肽增加,在这种情况下细胞需要Trx才能正常生长。Matsui等[9]报道,Trx不仅在正常发育过程中对细胞的分化起调节作用,并且可以作为生长因子刺激T淋巴细胞的增殖。Nakamura等[10]研究表明,血浆中 Trx含量是代表机体氧化应激水平的重要指标,同时发挥保护细胞以及抗炎症因子的作用。对Txl-2蛋白质二级和三级结构的预测有助于判断Txl-2活性中心位置和功能区域,也是预测Txl-2更高级蛋白质结构的基础。Txl-2蛋白的二级结构以α-螺旋为主,较易形成复合物发挥作用,并能牢固地维持蛋白质的高级结构。
通过生物信息学分析可以认识代谢、发育、分化、进化等规律。本研究成功从绵羊睾丸组织中克隆出Txl-2的完整 CDS区,并首次运用生物信息学方法对绵羊Txl-2编码的蛋白进行功能预测,为进一步研究Txl-2的表达和功能奠定基础,对深入了解Txl-2基因结构与功能之间的相关性具有重要意义。
[1]Garth Powis,William R Montfort.Properties and biological activities of thioredoxins[J].Annual Review of Pharmacology and Toxicology.2001,41:261-295.
[2]Klas Pekkari,Arne Holmgren.Truncated thioredoxin:physiological Functions and mechanism [J].Antioxid Redox Signal,2004,6(1):53 -61.
[3]梁鹏,张一娜,腾宗艳,等.硫氧还蛋白生物活性及其与人类疾病的关系[J].中国老年学杂志,2004,24(5):478-481.
[4]Nakamura H.Thioredoxin and its related molecules update[J].Antixid Redox Signal,2005,7(5 - 6):823-828.
[5]施惠娟,王健.睾丸/精子细胞特异表达的硫氧还蛋白研究进展[J].生殖和避孕,2006(4):227-232.
[6]Sadek C M,Jimenez A,Damdimopoulos A E,et al.A novel microtubule-binding thioredoxin expressed predominantly in the cilia of lung air way epithelium and spermatid manchette and axoneme[J].The Journal of Biology and Chemisty,2003,278(15):13133 -13142.
[7]Miranda Vizuete A,Damdimopoulos A E,Spyrou G.The Mitochondrial Thioredoxin System [J].Antioxidants and Redox Signal,2000,2(4):801 -810.
[8]Stepham Gromer,Sabine Urig,Katja Becker.The thioredoxin system from science to clinic[J].Medicinal Research Review,2004(24):40-89.
[9]Muller E G.Thioredox in deficiency in yeast prolongs S phase and shortens the G1 interval of the cell cycle[J].The Journal of Biology and Chemisty,1991,266(14):9194-9202.
[10]Matsui M,Oshima M,Oshima H,et al.Early embryonic lethality caused by targeted disruption of the mouse thioredoxin gene [J].Developmental Biology,1996,178:179-185.
Clonging and Bioinformatics Prediction of Thioredoxin like protein 2 Coding Sequence in Sheep
QIN Xue,ZHANG Xiao-dong,ZHANG Gao-lin,GUO Li-na,ZHANG Chun-xiang,REN You-she,YUE Wen-bin
(College of Animal Science and Technology Shanxi Agricultral University,TaiGu 030801)
RT-PCR was used to clone full length of Thioredoxin like protein 2 CDS from sheep testis and bioinformatics analysis was performed.The results showed that Txl-2 CDS was 795 bp and encoded a protein of 264 amino acids.It had no transmembrane region,signal peptide and N -glycosylation sites of Txl-2 protein,while there were several phosphpryiation sites in the sequence.The Secondary structure and tertiary structure of Txl-2 protein were also predicted.The Clustel W alignment results showed that Txl-2 had a close relationship with sheep and goat predicated sequence.
Thioredoxin like protein 2;sheep;CDS cloning;bioinformatics analysis
S826;Q81
A
1005-2739(2014)02-0003-05
2014-01-07
现代农业产业技术体系建设专项资金(NYCYTX-39)资助。
秦雪(1988-),女,山西长治人,在读硕士研究生,研究方向动物繁殖技术调控。
岳文斌(1952-),男,教授,博士生导师,主要从事动物繁殖调控方面研究。
