芦根乙醇提取物对糖尿病小鼠肝糖原含量及糖原合成酶的影响
2014-06-05宋佰慧程云龙辛禧瑞姜京植张默函
宋佰慧 程云龙 辛禧瑞 姜京植 张默函△
芦根乙醇提取物对糖尿病小鼠肝糖原含量及糖原合成酶的影响
宋佰慧1程云龙2辛禧瑞3姜京植3张默函3△
目的 探讨芦根乙醇提取物对链脲佐菌素(STZ)诱导的糖尿病小鼠肝糖原含量及糖原合成酶(GS)的影响。方法正常对照组小鼠10只,糖尿病小鼠随机分为模型对照组、高剂量组和低剂量组,每组10只。应用组织化学糖原(PAS)染色法检测各组小鼠肝糖原含量,应用逆转录聚合酶链反应(RT-PCR)和蛋白质免疫印迹法(Western-blot)法检测各组实验小鼠肝脏GS mRNA和蛋白的表达。结果PAS染色后模型对照组肝糖原含量明显减少,低剂量组、高剂量组较模型对照组明显增多(P<0.01),其中高剂量组最为明显;模型对照组GS mRNA和GS蛋白均低于其他3组,低剂量组低于高剂量组(P<0.05)。结论芦根乙醇提取物对糖尿病小鼠肝糖原含量具有正向促进作用,其机制可能是通过提高肝糖原合成酶的表达而起作用。
芦根;乙醇;植物提取物;糖尿病;糖原;糖原合成酶;小鼠,近交系;肝糖原
糖尿病是一种由于胰岛功能减退、胰岛素抵抗等引发的以糖代谢紊乱为主的疾病。肝糖原作为体内糖的储存形式之一,参与机体血糖水平的调节。芦根是一种常用中药,具有免疫促进、调节代谢、清除体内毒物等作用,常作为组成成分出现在糖尿病治疗的复方制剂中。本研究旨在观察芦根乙醇提取物对糖尿病小鼠肝糖原含量及糖原合成酶(GS)表达的影响,为芦根治疗糖尿病提供实验依据。
1 材料与方法
1.1 材料 采用清洁级成年雄性昆明小鼠40只,体质量23~25 g,由延边大学实验动物中心提供。芦根(北京同仁堂);链尿佐菌素(STZ,Sigma);小量柱离心式组织总RNA提取纯化试剂盒(Promega);一步法RT-PCR试剂盒(Promega);总糖原合成酶与β-actin抗体(Cell Signaling);辣根过氧化物标记IgG抗体(SantaCruz)。GeneAmp 2004型PCR仪(美国);Gel Doc XR凝胶成像分析系统(美国);Western-blot转膜仪(美国);T-型200病理显微分析系统(OLYMPUS)Amberlite XAD-7大孔吸附树脂(上海)。
1.2 方法
1.2.1 芦根乙醇提取物的制备 干燥芦根切碎(长1 cm左右),8倍药物体积的95%乙醇浸泡(≥12 h),然后分别用6倍、5倍95%乙醇回流提取,各次时间为2 h、1.5 h、1 h。合并过滤提取液,浓缩至浸膏,保存备用。
1.2.2 糖尿病小鼠模型制备 小鼠适应性喂养1周,禁食24 h,自由饮水。腹腔注射柠檬酸缓冲液配制的新鲜STZ溶液0.12 mg/g。饲养条件不变,喂养60 h后,禁食不禁水12 h,尾静脉取血,检测空腹血糖值(FBG),FBG≥11.1 mmol/L表明糖尿病小鼠模型制备成功[1-2]。
1.2.3 动物分组及处理 正常对照组小鼠10只,糖尿病小鼠随机分为模型对照组、高剂量组和低剂量组,每组10只。高剂量组和低剂量组分别按5.0 g/kg、1.25 g/kg灌胃芦根乙醇提取物,正常对照组、模型对照组分别灌胃相同体积无菌蒸馏水,实验期间各组小鼠均给予普通饲料喂养,自由进食饮水,实验周期为5周。将小鼠脱颈处死后,迅速剖腹取肝脏,部分洗净、拭干,备用,部分投入4℃Carnoy氏液中固定。
1.2.4 免疫组织化学观察 将在4℃Carnoy氏液中的肝组织固定6~8 h后,上行乙醇脱水、二甲苯透明、石蜡包埋,切片(5 μm)。然后脱蜡,进行碘酸雪夫氏(PAS)染色,显示肝糖原[3]。以唾液消化肝糖原后的PAS染色作为对照实验。染色后用病理显微分析系统进行定量分析(每组随机抽取3张×3个视野,在×200镜下测定每个视野糖原颗粒面积所占百分比)。
1.2.5 RT-PCR检测GS mRNA的表达 Trizol提取肝脏组织总RNA10 μg,按照RT-PCR试剂盒要求进行实验。引物序列:GS上游5′-AAGAGTAACGTCACTGTGC-3′,下游5′-TGATGGAAATACCCCAAGG-3′,453 bp,60℃;β-actin上游5′-CACCCGCGAGTACAACCATC-3′,下游5′-TCTAGAA AGTGTGGTGCCAA-3′,338 bp,62℃。反应条件:48℃反转录45 min,94℃灭活禽成髓细胞白血病病毒反转录酶活性及引物变性2 min,然后94℃30 s,各退火温度1 min,68℃2 min,循环40次,68℃7 min,4℃冷却。图像分析系统成像,以β-actin为参考,计算GS mRNA的相对含量。
1.2.6 Westen-blot法检测GS蛋白的表达 按照小量组织蛋白提取试剂盒要求提取总蛋白,全波长分光光度计测定蛋白样品浓度。取待测蛋白煮沸2 min,加样40 μg/孔。10%SDSPAGE电泳分离后,利用半干转移法将分离胶内的蛋白转移到PVDF膜。用5%脱脂奶粉TBS-T缓冲液(25 mmol/L Tris, 150 mmol/L NaCl,1%Tween 20,pH7.5),封闭PVDF膜上的非特异性位点后洗膜。兔抗小鼠GS多克隆第一抗体(1∶500),4℃过夜,洗涤后加入辣根酶标记山羊抗兔IgG(1∶1 000),与膜室温下孵育1 h,洗膜。图像分析系统曝光成像并分析图像,以β-actin为参考,计算GS蛋白的相对含量。
1.3 统计学方法 应用SPSS 11.5统计软件,计量资料采用±s表示,各组间进行单因素方差分析,组间多重比较用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 芦根乙醇提取物对糖尿病小鼠肝糖原含量的影响 PAS染色后肝糖原在光镜下呈紫红色颗粒。正常对照组肝糖原含量丰富,染色深。模型对照组肝糖原含量明显减少,染色浅。芦根乙醇提取物低剂量组、高剂量组肝糖原含量明显增多,染色较深,其中高剂量组最为明显,接近正常对照组,见图1、表1。
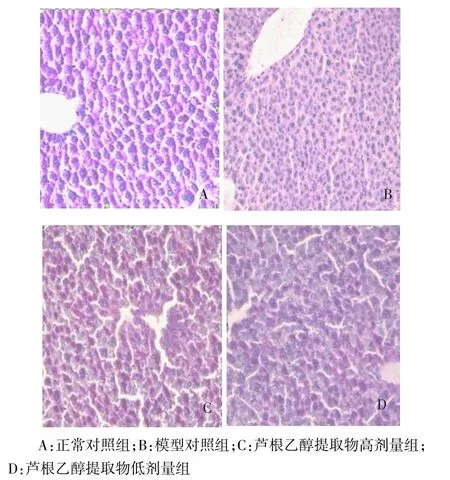
Figure 1 The PAS results of the different groups of liver glycogen(×200)图1 不同实验组肝糖原PAS结果(×200)
Table 1 Comparison of hepatic glycogen content,GS mRNA and GS protein between four groups of mice表14组间小鼠肝糖原含量、GS mRNA和GS蛋白的比较结果 (n=10±s)
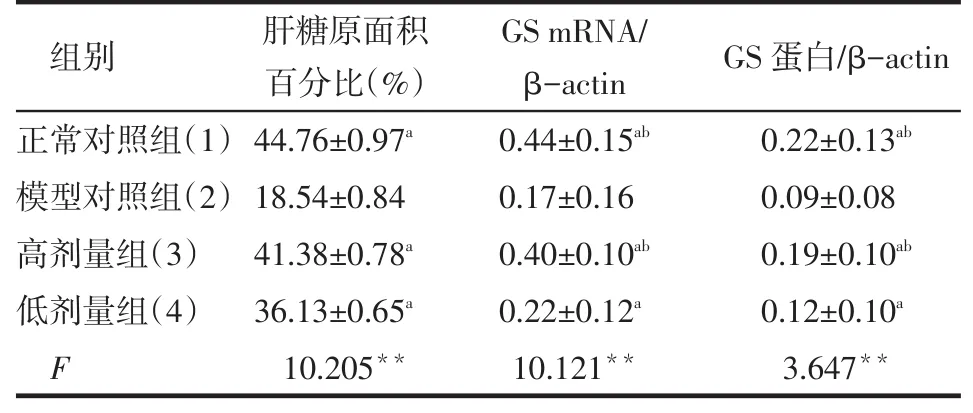
Table 1 Comparison of hepatic glycogen content,GS mRNA and GS protein between four groups of mice表14组间小鼠肝糖原含量、GS mRNA和GS蛋白的比较结果 (n=10±s)
**P<0.01;a与(2)组比较,b与(4)组比较,P<0.05
组别 肝糖原面积百分比(%)GS mRNA/ β-actin GS蛋白/β-actin正常对照组(1)模型对照组(2)高剂量组(3)低剂量组(4)F 44.76±0.97a18.54±0.84 41.38±0.78a36.13±0.65a10.205**0.44±0.15ab0.17±0.16 0.40±0.10ab0.22±0.12a10.121**0.22±0.13ab0.09±0.08 0.19±0.10ab0.12±0.10a3.647**
2.2 芦根乙醇提取物对糖尿病小鼠肝脏GS mRNA表达的影响 模型对照组GS mRNA低于其他3组,低剂量组低于高剂量组,差异有统计学意义,见表1、图2。
2.3 芦根乙醇提取物对糖尿病小鼠肝脏GS蛋白表达的影响 模型对照组GS蛋白表达低于其他3组,低剂量组低于高剂量组,差异有统计学意义,见表1、图3。
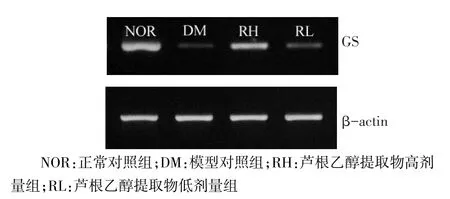
Figure 2 Effects of ethanol extract of rhizoma phragmitis on GS mRNA expression图2 芦根乙醇提取物对GS mRNA表达的影响
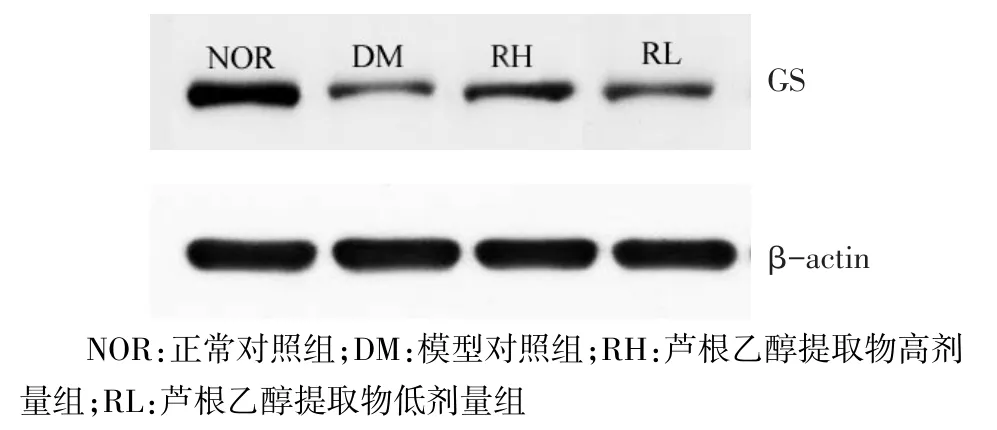
Figure 3 Effects of ethanol extract of rhizoma phragmitis on GS protein expression图3 芦根乙醇提取物对GS蛋白表达的影响
3 讨论
肝糖原可以调节和影响机体血糖的变化,其合成和分解受胰岛素控制,当此控制失调,可导致肝糖原分解增多,使血糖增高。胰岛素可以抑制糖原分解,促进糖原合成,这可能与糖原合成酶有关[4-5]。糖原合成酶是糖原合成过程中催化不可逆反应的关键酶和限速酶,同时也是胰岛素作用的主要靶酶。胰岛素通过和受体结合后,启动一系列信号传导途径使糖原合成酶去磷酸化,从而提高糖原合成酶的活性[6]。本研究发现,芦根乙醇提取物对糖尿病小鼠肝糖原的合成具有正向的促进作用,且具有一定的量效关系。为探讨高糖状态下芦根乙醇提取物的促糖原合成作用的具体机制,本研究对肝糖原合成过程中的关键酶-糖原合成酶进行了相关研究,结果显示,芦根乙醇提取物可使糖尿病小鼠肝糖原合成酶mRNA表达增高,且高剂量组的作用效果明显强于低剂量组,接近于正常对照组,说明芦根乙醇提取物在基因层面可以促进高糖状态下的肝糖原合成酶的表达。本研究的肝糖原合成酶蛋白表达结果与其基因表达情况吻合,说明芦根乙醇提取物在蛋白层面也可以促进高糖状态下的肝糖原合成酶的表达。综上,笔者认为芦根乙醇提取物对糖尿病小鼠肝糖原合成酶具有明显的促表达作用,且量效关系明显。
可能机制为,芦根乙醇提取物增加了糖原合成酶表达,同时也可能减少了糖原合成酶被磷酸化失活的可能性,其结果是增加了有活性的糖原合成酶相对含量,使得肝糖原合成增多,血糖相对下降。另一种可能机制为:糖尿病状态下,机体细胞内原有的抗氧化系统功能下降,活性氧(ROS)含量增多[7-8],从而改变多种基因及蛋白的表达。STZ诱导糖尿病小鼠肝糖原合成酶表达趋势必受到ROS的影响,结果使糖尿病小鼠肝糖原含量下降,血糖升高。现代药理分析,芦根含大量的具有抗氧化效用的成分[9],笔者利用乙醇提取了其中的部分该成分。其作用于机体后,减少了糖尿病小鼠肝细胞内ROS,从而使得糖原合成酶去除束缚,进而表达相对增加,间接地增加了活性糖原合成酶的量,使得肝糖原合成增加。
[1]Cai YL,Xu DY,Li XL,et al.C-type natriuretic-peptide-potentiated relaxation response of gastric smooth muscle in streptozotocininduced diabetic rats[J].World J Gastroenterol,2009,15(17):2125-2131.
[2] Xu DY,Liu L,Cai YL,et al.Natriuretic peptide dependent cGMP signal pathway potentiated relaxation of gastric smooth muscle in streptozotocin-induced diabetic rat[J].Digestive Diseases and Sciences,2010,55(3):589-595.
[3] 赵荧,唐军民.形态学实验技术[M].北京:北京大学医学出版社, 2008:157-162.
[4] Maggs D,MacDonald I,Nauck MA.Glucose homeostasis and the gastrointestinal tract:insights into the treatment of diabetes[J].Diabetes Obes Metab,2008,10(1):18-33.
[5] Hara D,Paul J,Morrison PJ,et al.Effect of carbohydrate-protein supplementation postexercise on rat muscle glycogen synthesis and phosphorylation of proteins controlling glucose storage[J].Metabolism,2011,60(10):1406-1415.
[6]桑敏,李威,胡敏,等.糖原合成酶激酶-3与糖代谢异常的关系[J].中国糖尿病杂志,2011,3(2):174-177.
[7]Aybek H,Aybek Z,Rota S,et al.The effects of diabetes mellitus, age,and vitamin E on testicular oxidative stress[J].Fertil Steril, 2008,90(3):755.
[8] Calle MC,Fernandez ML.Inflammation and type 2 diabetes[J].Diabetes Metab,2012,38(3):183-191.
[9] 邵荣,郭海滨,许伟,等.芦苇中活性物质研究进展[J].中国生化药物杂志,2011,32(2):167-169.
(2012-12-18收稿 2013-04-15修回)
(本文编辑 魏杰)
Effects of Ehanol Extract of Rhizoma Phragmitis on Liver Glycogen Content and Glycogen Synthetase in Diabetic Mice
SONG Baihui1,CHENG Yunlong2,XIN Xirui3,JIANG Jingzhi3,ZHANG Mohan3
1 Department of Basic Medicine,Changchun Medical College,Changchun 131000,China;2 The Fourth People’s Hospital; 3 Department of Histology&Embryology,College of Medicine,Yanbian University
ObjectiveTo study the effects of ethanol extract of rhizoma phragmitis on liver glycogen content and glycogen synthetase(GS)in streptozotocin(STZ)induced diabetic mice.MethodsThe diabetic model mice were divided into model control group,high-dose group and low-dose group,10 mice for each group.Another 10 normal mice were used as control group.The liver glycogen content was detected by histochemical staining of glycogen(PAS)method.The expression of GS mRNA was detected by reverse transcription polymerase chain reaction(RT-PCR)and Western blot assays.ResultsAfter PAS staining the hepatic glycogen content decreased significantly in model control group,and which was significantly increased in low-dose group and high-dose group compared with that of model control group(P<0.01).The hepatic glycogen content was the highest in high-dose group compared with that of other three groups.The levels of GS mRNA and GS protein were significantly lower in model control group than those of other three groups,which were significantly lower in low-dose group than those of high-dose group(P<0.05).ConclusionThere is a dose-dependent effect of ethanol extract of rhizoma phragmitis on liver glycogen in STZ induced diabetic mice,which may be related with the increased expression of liver glycogen synthetase.
RHIZOMA PHRAGMITIS;ethanol;plant extracts;diabetes mellitus;glycogen;glycogen synthase;mice, inbred strains;liver glycogen
R587.1,R-332
A【DOI】10.3969/j.issn.0253-9896.2014.01.020
1长春医学高等专科学校基础医学部(邮编131001);2吉林省四平市第四人民医院;3延边大学医学院组织学与胚胎学教研室
△通讯作者 E-mail:mhzhang@ybu.edu.cn
