下调HER2磷酸化水平对骨肉瘤细胞U2-OS体外增殖转移的抑制作用研究*
2014-06-05张志宏龙新华刘志礼汪逃芳朱粮博
张志宏 龙新华 刘志礼 王 恒 汪逃芳 朱粮博
临床研究
下调HER2磷酸化水平对骨肉瘤细胞U2-OS体外增殖转移的抑制作用研究*
张志宏 龙新华 刘志礼△王 恒 汪逃芳 朱粮博
目的 探讨下调人类表皮生长因子受体2(HER2)磷酸化水平对骨肉瘤细胞U2-OS体外增殖、侵袭转移能力的影响。方法采用不同浓度(5、10、20、30、40 μmol/L)的HER2磷酸化抑制剂二甲苯磺酸拉帕替尼作用骨肉瘤细胞U2-OS。四甲基偶氮唑盐(MTT)检测作用不同时间(24、48、72 h)细胞的增殖能力,并计算出24 h药物的半数抑制浓度(IC50)。10 μmol/L二甲苯磺酸拉帕替尼作用U2-OS细胞,Western blot检测磷酸化HER2(p-HER2)蛋白表达水平;Wound healing和Transwell invasion实验检测细胞迁徙、侵袭能力。结果二甲苯磺酸拉帕替尼显著抑制U2-OS细胞的增殖,并且呈时间、剂量依赖性;二甲苯磺酸拉帕替尼作用24 h后,细胞中p-HER2蛋白表达水平显著低于阴性对照组(0.093±0.033 vs 0.306±0.033);细胞迁徙率低于阴性对照组(%:32.70±3.00 vs 94.52±4.76),穿膜细胞数低于阴性对照组(个/视野:37±5 vs 85±10)。结论体外下调U2-OS细胞中HER2磷酸化水平能显著抑制U2-OS细胞的增殖、迁徙和侵袭,HER2有望成为抗骨肉瘤侵袭转移的分子靶点。
受体,表皮生长因子;氧化磷酸化;骨肉瘤;细胞增殖;肿瘤侵润;二甲苯磺酸拉帕替尼;U2-OS
人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)已经被证实在乳腺癌中过度表达并促进癌细胞转移,且其对化疗药物具有拮抗作用[1-3]。但HER2是否在骨肉瘤细胞中过度表达及其作用目前存在较大分歧[4-6]。最近又有研究认为HER2可能与骨肉瘤的浸润及转移有关[7]。本研究采用体外实验研究抑制HER2磷酸化对骨肉瘤细胞U2-OS增殖及转移的影响,为进一步探讨HER2在骨肉瘤细胞中的作用提供依据。
1 材料与方法
1.1 材料 人骨肉瘤细胞系购于美国Invitrogen公司,二甲苯磺酸拉帕替尼(GW-572016)购自美国Selleck公司,HAM’S/F-12培养基购自美国Hyclone公司,兔抗人磷酸化HER2(p-HER2)IgG、鼠抗人β-actin IgG购于SANTA CRUZ公司,Matrigel基质胶购自美国BD公司。
1.2 方法
1.2.1 细胞培养 将人骨肉瘤细胞U2-OS置于HAM’S/F-12培养基中(内含10%胎牛血清及青霉素、链霉素各100 kU/L),在37℃、5%CO2饱和湿度孵育箱中贴壁培养。
1.2.2 四甲基偶氮唑盐(MTT)检测细胞增殖能力 取对数生长期细胞进行实验,常规消化贴壁细胞,调整细胞浓度为1×104/mL接种于无菌96孔培养板,每孔100 μL,常规培养12 h。待细胞贴壁良好,分别加入不同浓度的二甲苯磺酸拉帕替尼泊(5、10、20、30、40 μmol/L)作用24、48、72 h后,每孔加入5 g/L的MTT 20 μL。孵育4 h后,吸弃各孔培养液,每孔加入二甲基亚砜(DMSO)150 μL。微振荡10 min,用酶标仪检测波长490 nm处吸光度(OD)值,计算各组细胞生长抑制率=(对照组OD值-处理组OD值)/对照组OD值,计算24 h药物的半数抑制浓度(IC50)。实验重复3次。
1.2.3 Western blot检测p-HER2表达水平 用终浓度10 μmol/L的二甲苯磺酸拉帕替尼(p-HER2抑制剂)作用人骨肉瘤细胞U2-OS 24 h后(PBS替代二甲苯磺酸拉帕替尼作为阴性对照)收集细胞,RIPA裂解,提取总蛋白,BCA法蛋白定量,10%SDS-PAGE凝胶电泳分离蛋白,转膜,5%脱脂奶粉封闭1 h,一抗(兔抗人p-HER2,1∶200,鼠抗人β-actin,1∶2 500)室温孵育2 h,TBST洗膜3次,二抗(山羊抗兔和山羊抗鼠,1∶5 000)室温孵育1 h,TBST洗膜3次,Pro-light HRP化学发光检测试剂(TIANGEN,PA112)化学发光、压片、拍照,用Image J软件对条带灰度值进行分析。重复实验3次。
1.2.4 Wound healing检测细胞迁徙能力 取对数生长期细胞进行实验,常规消化细胞,调整细胞数5×105/mL,接种于6孔细胞培养板,待细胞成功形成单层贴壁细胞,用10 μmol/L的二甲苯磺酸拉帕替尼作用细胞(PBS替代二甲苯磺酸拉帕替尼为阴性对照组)24 h后,用10 μL枪头在单层细胞表面划一直线。用PBS漂洗2次去除划落的细胞;加入含10 g/L BSA的无血清HAM’S/F-12培养液继续培养24 h,倒置显微镜下观察划痕中细胞迁移情况并拍照。Image J软件测量迁徙距离,计算各组细胞迁徙率。不同时间重复实验3次。
1.2.5 Transwell invasion检测细胞侵袭能力 应用Transwell小室进行细胞迁移实验。将用10 μmol/L的二甲苯磺酸拉帕替尼处理24 h后的细胞用含10 g/L的BSA无血清培养基重悬,调整细胞浓度为1×105个/mL,取150 μL细胞悬液接种小室,然后将小室放入加有600 μL/孔含10%胎牛血清的HAM’S/F-12培养基的24孔板中,常规培养24 h。取出小室,吸弃上室液体,用PBS漂洗2次,95%乙醇固定10 min,用棉签擦净小室膜上侧未迁移的细胞,4 g/L结晶紫染色20 min,PBS漂洗2次。倒置显微镜下随机读取10个视野观察细胞穿膜情况并拍照,Image J分析软件计数(未经抑制剂处理细胞为阴性对照组)。不同时间重复实验3次。
1.3 统计学方法 用SPSS 19.0进行统计学分析,数据以±s表示,采用独立样本t检验分析组间细胞迁徙与侵袭差异情况,P<0.05为差异有统计学意义。
2 结果
2.1 二甲苯磺酸拉帕替尼对U2-OS细胞增殖能力的影响 二甲苯磺酸拉帕替尼能有效抑制U2-OS细胞体外增殖,并呈时间、剂量依赖性,见图1。根据本实验结果计算24 h药物IC50为22.15 μmol/L。
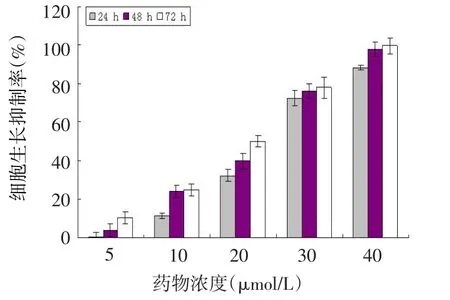
Figure 1 Inhibitory rates of different concentrations and durations of lapatinib ditosylate in U2-OS cell growth图1 不同浓度二甲苯磺酸拉帕替尼作用不同时间对U2-OS细胞生长的抑制率
2.2 10 μmol/L二甲苯磺酸拉帕替尼对U2-OS细胞中p-HER2水平的影响 10 μmol/L二甲苯磺酸拉帕替尼处理U2-OS细胞24 h后,二甲苯磺酸拉帕替尼作用组细胞中p-HER2表达水平(0.093±0.033)显著低于对照组(0.306±0.033),差异有统计学意义(t= 7.860,P<0.05),见图2。
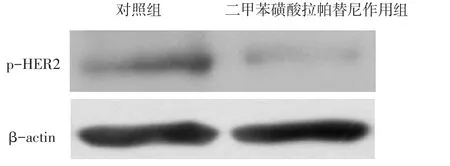
Figure 2 Comparison of the p-HER2 expression level in U2-OS cells between two groups图2 2组U2-OS细胞中p-HER2表达水平比较
2.3 下调HER2磷酸化水平对U2-OS细胞迁移、侵袭能力的影响 二甲苯磺酸拉帕替尼作用组细胞24 h体外迁徙率为(32.70±3.00)%,低于阴性对照组的(94.52±4.76)%,差异有统计学意义(t=19.051,P<0.05);二甲苯磺酸拉帕替尼作用组的穿膜细胞数为(37±5)个,低于阴性对照组的(85±10)个,差异有统计学意义(t=7.755,P<0.05),见图3。
3 讨论
骨肉瘤是青少年最常见的原发性恶性骨肿瘤,恶性度高,远处转移出现早。虽然从20世纪70年代开始由于新辅助化疗药物的出现骨肉瘤患者的5年生存率提高到70%左右,但是,近30年来未见上升趋势,并且合并肺部转移患者5年生存率还是非常的不理想。因此通过研究原癌基因和抑癌基因来阐明骨肉瘤的发生、发展及转移机制,进而寻找骨肉瘤治疗的新的分子靶点,成为骨肉瘤防治研究的热点。

Figure 3 The cell migration and invasion abilities detected by Wound healing(A)and Transwell invasion(B)assays图3 Wound healing实验(A)和Transwell invasion实验(B)检测2组U2-OS细胞迁徙、侵袭能力
原癌基因HER2属于I型受体酪氨酸激酶(RTK)家族中的erbB亚家族。在正常情况下该基因处于非激活状态,参与细胞分化的调节。当受到某些体内外因素刺激后,与erbB亚家族其他成员形成处于激活状态的异二聚体,能使细胞内蛋白质的酪氨酸基磷酸化,产生细胞分裂信号,具有肿瘤转化活性。研究表明,HER2在多条信号转导通路中起作用,参与肿瘤的生长与分化[8]。HER2扩增或过表达可能通过其酪氨酸激酶活性使p34cdc2磷酸化,或(和)增强DNA修复酶的活性,能高效地进行DNA修复,阻止肿瘤细胞凋亡,并促进其生长[9-10]。
虽然有大量的研究证实HER2的过度表达与肿瘤的增殖、侵袭转移有关[11-13],但是对于HER2基因在骨肉瘤组织中是否有扩增情况及其作用如何,目前存在不同观点[4-6]。最近研究表明骨肉瘤细胞存在EGFR、HER2/neu及Her-4固有磷酸化[14]。因此,根据HER2的生物学特性,笔者推测抑制HER2的磷酸化很有可能抑制骨肉瘤细胞的恶性表型。本研究结果显示,体外下调骨肉瘤细胞U2-OS中HER2的磷酸化水平能有效的抑制细胞增殖、侵袭转移,HER2及其相关信号通路有望成为抗骨肉瘤治疗的分子靶点。但是,本研究仅采用一种细胞系进行体外研究,并且肿瘤细胞的增殖、侵袭转移与体内微环境的关系非常密切,所以还需要进一步的体内外实验来探讨HER2在骨肉瘤细胞增殖、侵袭转移中的作用。
[1] Gradishar WJ.Emerging approaches for treating HER2-positive metastatic breast cancer beyond trastuzumab[J].Ann Oncol,2013, 24(10):2492-2500.
[2]Arsenault D,Hurley J,Takita C,et al.Predictors of Locoregional Outcome in HER2-Overexpressing Breast Cancer Treated With Neoadjuvant Chemotherapy[J].Am J Clin Oncol,2013 Jun 24.[Epub ahead of print]
[3]Zhu X,Wu L,Qiao H,et al.Autophagy stimulates apoptosis in HER2-overexpressing breast cancers treated by lapatinib[J].J Cell Biochem,2013 Jun 21.[Epub ahead of print]
[4]Anninga JK,van de Vijver MJ,Cleton-Jansen AM,et al.Overexpression of the HER-2 oncogene does not play a role in high-grade osteosarcomas[J].Eur J Cancer,2004,40(7):963-970.
[5]Ebb D,Meyers P,Grier H,et al.Phase trial of trastⅡuzumab in combination with cytotoxic chemotherapy for treatment of metastatic osteosarcoma with human epidermal growth factor receptor 2 overexpression:a report from the children's oncology group[J].J Clin Oncol,2012,30(20):2545-2451.
[6] Shan LQ,Ma S,Qiu XC,et al.A novel recombinant immuno-tBid with a furin site effectively suppresses the growth of HER2-positive osteosarcoma cells in vitro[J].Oncol Rep,2011,25(2):325-331.
[7]Ma Q,Zhou Y,Ma B,et al.The clinical value of CXCR4,HER2 and CD44 in human osteosarcoma:A pilot study[J].Oncol Lett,2012,3 (4):797-801.
[8] Zhou BP,Liao Y,Xia W,et al.HER-2/neu induces p53 ubiquitination via Akt-mediated MDM2 phosphorylation[J].Nat Cell Biol, 2001,3(11):973-982.
[9]Schiffer IB,Gebhard S,Heimerdinger CK,et al.Switching off HER-2/neu in a tetracycline-controlled mouse tumor model leads to apoptosis and tumor-size-dependent remission[J].Cancer Res,2003,63 (21):7221-7231.
[10]Way TD,Kao MC,Lin JK.Apigenin induces apoptosis through proteasomal degradation of HER2/neu in HER2/neu-overexpressing breast cancer cells via the phosphatidylinositol 3-kinase/Akt-dependent pathway[J].J Biol Chem,2004,279(6):4479-4489.
[11]Firwana B,Atassi B,Hasan R,et al.Trastuzumab for Her2/neu-positive metastatic salivary gland carcinoma:Case report and review of the literature[J].Avicenna J Med,2012,2(3):71-73.
[12]Artac M,Koral L,Toy H,et al.Complete response and long-term remission to anti-HER2 combined therapy in a patient with breast cancer presented with bone marrow metastases[J].J Oncol Pharm Pract,2013 May 14.[Epub ahead of print]
[13]Hohensee I,Lamszus K,Riethdorf S,et al.Frequent genetic alterations in EGFR-and HER2-driven pathways in breast cancer brainmetastases[J].Am J Pathol,2013,183(1):83-95.
[14]Hughes DP,Thomas DG,Giordano TJ,et al.Essential erbB family phosphorylation in osteosarcoma as a target for CI-1033 inhibition [J].Pediatr Blood Cancer,2006,46(5):614-623.
(2013-07-16收稿 2013-09-04修回)
(本文编辑 闫娟)
The Inhibitory Effect of Down-Regulating Phosphorylated HER2 on Proliferation and Metastasis in U2-OS Osteosarcoma Cells
ZHANG Zhihong,LONG Xinhua,LIU Zhili,WANG Heng,WANG Taofang,ZHU Liangbo The First Affiliated Hospital of Nanchang University,Nanchang 330006,China
ObjectiveTo investigate the effects of down-regulating phosphorylated human epidermal growth factor receptor 2(HER2)on the proliferation and metastasis in human osteosarcoma cells(U2-OS)in vitro.MethodsVarious concentrations of HER2 phosphorylation inhibitor lapatinib ditosylate(5,10,20,30 and 40 μmol/L)were adopted to deal with U2-OS.MTT assay was performed to evaluate the cell proliferation during various times(24,48 and 72 h),and the IC50value in 24 h was calculated.The value of 10 μmol/L(IC50=22.15 μmol/L)was chosen to deal with U2-OS cells.The expression level of phosphorylated HER2(p-HER2)was measured by Western blot assay.The cell migration and invasion abilities were detected by Wound healing and Transwell invasion assays.ResultsThe cell proliferation of U2-OS was significantly inhibited by HER2 phosphorylation inhibitor lapatinib ditosylate in a concentration-and time-dependent manner.During 24 hours,the p-HER2 level was significantly lower in lapatinib ditosylate group than that of negative control group(0.093± 0.033 vs 0.306±0.033),the cell migration rate was significantly lower in lapatinib ditosylate group than that of negative control group(32.70%±3.00%and 94.52%±4.76%),and the trans-membrane cells were significantly lower than those of negative control group(37/HP±5/HP and 85/HP±10/HP),respectively.ConclusionThe down-regulating p-HER2 in U2-OS could efficiently inhibit the cell proliferation,migration and invasion in vitro.HER2 has the potential to become a molecular target for anti-osteosarcoma metastasis.
receptor,epidermal growth factor;oxidative phosphorylation;osteosarcoma;cell proliferation;neoplasm invasiveness;lapatinib ditosylate;U2-OS
R738.1
A【DOI】10.3969/j.issn.0253-9896.2014.01.001
*国家自然科学基金资助(项目编号:81260400);江西省自然科学基金资助(项目编号:20114BAB205093)
南昌大学第一附属医院骨科(邮编330006)
△通讯作者 E-mail:zgm7977@163.com
