某区甲型H1N1流感病毒分离鉴定及同源性的分析
2014-06-05胡淮洁
曹 晓 巩 飚* 胡淮洁 许 娇 冉 冉
(开封市疾病预防控制中心检验科,河南 开封 475000)
某区甲型H1N1流感病毒分离鉴定及同源性的分析
曹 晓 巩 飚* 胡淮洁 许 娇 冉 冉
(开封市疾病预防控制中心检验科,河南 开封 475000)
目的检测并分离甲型H1N1流感病毒,对开封地区首次分离到的病毒株进行全基因组序列测定及同源性分析,为研究流感病毒的流行及变异规律提供科学依据。方法采用Real-time RT-PCR方法检测,筛选确定出甲型H1N1流感病毒阳性标本;利用狗肾传代细胞分离得到甲型H1N1流感病毒株A/Kaifeng/01/2009(H1N1);测定并分析其全基因组序列;利用序列比对进行了同源性分析。结果从1828份流感样病例中检出甲型H1N1流感病毒阳性标本286份,阳性率15.6%。在开封地区首次获得甲型H1N1流感病毒株及全基因组序列。基因组序列分析表明:该毒株与2009年大流行株高度同源,为同一进化分支。与以往流行的猪流感病毒株对比发现,HA基因有12个碱基发生了点突变。结论MDCK细胞对甲型H1N1 流感病毒具有较高敏感性;开封地区首例甲型H1N1流感病例分离病毒株与北美流行株高度同源;相对于以往古典型猪流感代表株出现了HA蛋白抗原性漂移;为今后进一步开展甲型H1N1 流感病毒分子生物学研究奠定基础。
甲型H1N1流感;病毒分离;序列分析;同源性
2009年肆虐全球的甲型HINI流感由一种新型流感病毒引起,该病毒基因组由禽流感、猪流感和人流感病毒基因混合而成[1,2]。此次流感传播速度快、范围广,动物实验研究已经证实导致此次流感的新型甲型H1N1流感病毒较季节性流感具有更强的感染力[3,4]。本研究通过了解开封地区甲型H1N1流感病毒株的全基因组序列,在掌握北美地区和欧洲猪流感病毒流行情况的基础上,运用生物信息学技术,通过序列同源性比较和基因进化树分析,得到了一些初步结论,同时也对我国流感病毒的研究工作进行了部分总结。这对开封地区甲型H1N1流感病毒的基因起源和遗传进化的探究,对研究我国流感病毒的分子进化机制,及时发现可能出现的新病毒,具有极其重要的价值。
1 材料与方法
1.1 材料
①标本来源:鼻咽拭子标本286份,来自流感监测哨点医院(开封市第一人民医院)采集的甲型H1N1流感确诊病例标本。②试剂:甲型H1N1流感病毒荧光RT-PCR法检测试剂盒(北京金豪);病毒RNA提取试剂盒(德国QIAGEN);逆转录试剂盒购于公司(美国Promega);PCR 反应试剂和Rnase inhibitior(大连TAKARA公司);琼脂糖凝胶(大连TAKARA公司);狗肾传代细胞(MDCK)由国家流感中心提供、本实验室保存。③引物:流感病毒逆转录通用引物为universal primer 12 : 5’-A GCAAAA GCA GG-3’,全基因组PCR扩增引物序列见参考文献[5]。④实验条件:以下操作均在在BSL-2实验室进行。
1.2 方法
①甲型H1N1流感病毒检测:采用Real-time RT-PCR方法,确定甲型H1N1流感病毒阳性标本。②病毒分离:采用第26~28代MDCK细胞进行病毒分离,具体方法见参考文献[6]。③病毒RNA提取:按病毒RNA提取试剂盒(QIAGEN)中说明书提取,将提取到的病毒RNA 保存于-70 ℃备用。④cDNA的制备:按逆转录试剂盒操作说明进行。产物置于-20 ℃保存备用。⑤全基因组PCR 扩增与测序:配制50 μL反应体系如下:10×PCR buffer 5 μL,dNTP Mixture(2.5 mmol/L each)4 μL,上下游引物(10 μmol/L)各2 μL,ExTaqase (5 Unit/μL)1 μL,RNase Free Water 30 μL,逆转录产物6 μL。PCR反应条件为:95 ℃15 min,94 ℃ 30 s变性,50 ℃ 30 s退火,72 ℃ 1 min延伸,35个循环,72 ℃ 10 min,4 ℃保温。取4 μL PCR反应产物作琼脂糖凝胶电泳观察目的条带。产物达50 ng/μL后,送大连TAKARA公司进行测序。⑥同源性及基因变异分析:将病毒各节段的核酸序列与GENBANK上公布的 A/California/04/2009(H1N1)序列进行同源性比较,分析此次病毒分离株HA基因重要位点变异情况。
2 结 果2.1 病毒检测:从1828份流感样病例标本中检出286例甲型H1N1流感病毒阳性标本。
2.2 病毒分离:将甲型H1N1流感病毒阳性标本接种MDCK细胞,逐日观察细胞病变(CPE) 情况。接种第一代24 h左右,即可镜检观察到轻微CPE ,接种72~96 h CPE可达+++~++++。接种第二代40 h左右,CPE可达+++~++++,CPE变化的进程为肿胀→圆缩→脱落→溶解,见图1。分离的53株病毒,经Real-time PCR鉴定全部为甲型H1N1病毒。开封地区首例甲型H1N1流感病例分离株命名为:A/ Kaifeng/01/2009(H1N1)。
2.3 同源性分析:将各扩增片段的核苷酸序列用软件拼接,获得病毒株8个节段的完整核苷酸序列。开封地区首例甲型H1N1流感患者的病毒株与北美地区流行的甲型H1N1流感病毒高度同源,为同一进化分支。
2.4 HA基因变异分析:与以往流行的猪流感病毒对比发现,决定流感病毒变异的关键基因HA基因(1699bp)中有12个碱基发生了点突变,分别涉及第412位(A→C),第414位(A→U),第436位(C→A),第437位(G→A),第464位(A→G),第465位(G→C),第598位(A→C),第599位(G→U),第826位(G→A),第828位(C→U),第833位(A→C),第834位(G→U)。
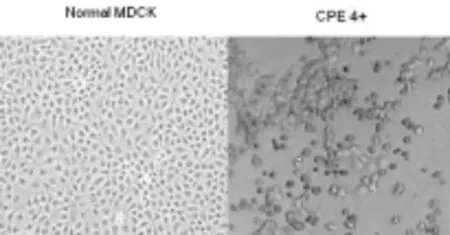
图1 正常的MDCK细胞和接种流感病毒株4 d之后CPE的细胞状态图
3 讨 论
自2009年4月中旬全球报告第一例新甲型H1Nl流感确诊病例,由于人群普遍的缺乏免疫力,该病毒通过人际传播迅速波及全球五大洲120余个国家和地区,成为巨大的公共卫生威胁。开封地区自2009年7月26日出现首例输入性甲型 H1N1流感确诊病例以来,患病人数急剧增加。到目前为止,全市共采集流感样病例标本1828例,甲型H1N1流感确诊病例达286例,占总样品数15.6%。
我们采用MDCK细胞从286例甲型H1N1流感确诊病例咽拭子或鼻咽拭子标本中分离甲型H1N1流感病毒,将分离出的首株甲型H1N1流感病毒株,命名为A/Kaifeng/01/2009(H1N1)。我们在研究中发现,在相同操作流程和培养条件下MDC K细胞似乎对甲型H1 N1流感病毒比散发季节性流感病毒更加敏感:前者第一代多在24 h左右即可观察到CPE,72~96 h CPE可达+++~++++而后者则多在48h后才能观察到CPE,96 h左右甚至更长时间CPE才达到+++~++++。
流感病毒通过不断的基因重排改变其抗原性来逃避宿主特异性免疫的识别,从而不断引起流行,尤其以HA基因重排引起的HA蛋白抗原决定簇位点的变异最为重要[7]。HA抗原具有免疫原性,能使人体产生保护性抗体[8];但其容易变异。是流感流行的主要原因之一。导致甲型流感病毒抗原高度易变的主要原因是高发的点突变率和基因重排[9]。在此次研究中我们将A/Kaifeng/01/2009(H1N1)毒株与以往流行的猪流感病毒株对比发现,决定流感病毒变异的关键基因HA基因(1699bp)中有12个碱基发生了点突变,突变涉及的基因编码的氨基酸序列均是HA蛋白重要的抗原位点,又由于HA基因编码蛋白具有重要的免疫原性,能使人体产生保护性抗体,因此,HA基因的变异直接导致HA蛋白抗原决定簇的氨基酸发生了变化,在人群普遍易感的情况下,造成了流感大流行。这同时也提示了开封地区首例病毒分离株A/Kaifeng/01/2009(H1N1)出现了HA蛋白的抗原漂移现象。
此次对开封地区甲型H1N1流感病毒进行分离鉴定及同源性分析,不但为在河南地区开展甲型H1N1流感的预防控制工作奠定了研究基础,且在全面防治甲型H1N1流感病毒的传播方面也有着极其重要的意义。
[1] Stein RA.Lessons from outbreaks of HI N1 influenza[J].Ann Intern Med,2009,150(1):26.
[2] Garten RJ,Davis CT.Antigenic and genetic characteristics of swine—origin 2009 A(H1 N1) influenza viruses circulating in humans [J].Science,2009,325(5937):197-201.
[3] Munster VJ,de Wit E.Pathogenesis and transmission of swineorigin 2009 A(H1N1)influenza virus in ferrets[J].Science,2009,3 25(5939):481-483
[4] Maines TR,Jayaraman A,Belser JA,et al.Transmission and pathogenesis of swine-origin 2009 A(H1N1)influenza viruses in ferrets and mice[J].Science,2009,325(5939):484-487.
[5] WHO.Sequencing primers and protocol [EB/OL]. http://www.who.Int/csr/resources/publications/swineflu/ GenomePrimers_20090512.pdf.
[6] 郭元吉,程小雯.流行性感冒病毒及其实验技术[M].北京:中国三峡出版社,1997:185-188.
[7] Drescher J,Aron R.Influence of the amino acid differences between the hemagglutinin HAl domains of influenza virus H1N1 strains on their reaction with antibody[J].J Med Virol,1999,57(4):397-404
[8] 谢佳新,殷建华.2009年新型甲型H1N1流感病毒血凝素基因进化分析[J].第二军医大学学报,2009,30(6):613-617
[9] Bizebard T,Gigant B.Structure of influenza virus haemagglutinin complexed with a neutralizing antibody[J].Nature,1995,376(6535):92-94.
Isolation, Identification and Homology Analysis of the First Influenza A (H1N1) Virus in A District
CAO Xiao, GONG Biao*, HU Huai-jie, XU Jiao, RAN Ran
(Department of Laboratory, Kaifeng Center for Disease Control and Prevention, Kaifeng 475000, China)
ObjectiveDetection and separation of H1N1 influenza virus, the first area of Kaifeng virus strains were isolated from whole genome sequencing and homology analysis, to provide a scientific basis for the study of influenza virus epidemic and the variation law.MethodsReal-time RT-PCR method for detection, screening to determine the influenza A H1N1 virus positive specimens; using MDCK cells isolated H1N1 influenza virus strain A/Kaifeng/01/2009 (H1N1); measured and analyzed their whole genome sequence; conducted using sequence alignment homology analysis.ResultsH1N1 influenza virus were detected in samples from 1828 were positive for influenza-like illness in 286 copies, the positive rate of 15.6%. The first time the whole strain of H1N1 influenza virus genome sequence and in Kaifeng area. Genome sequence analysis showed that: the strain and 2009 pandemic strain is highly homologous to the same evolutionary branch. Previous epidemic of swine influenza virus strains found in contrast, HA gene 12 bp point mutation occurred.ConclusionMDCK cells (H1N1) virus has a high sensitivity; Kaifeng area first case of H1N1 flu virus strains isolated in North America epidemic strains highly homologous; compared with the previous representative strains of classical swine influenza HA protein antigen appeared drift; lay the foundation for further research in molecular biology (H1N1) virus in the future.
Influenza A (H1N1) virus; Virus isolation; Sequence analysis; Homology
R373.1
B
1671-8194(2014)28-0002-02
开封市科技攻关项目(100369)
*通讯作者
