渤海大型底栖动物种类组成与群落结构研究
2014-06-01刘晓收范颖史书杰华尔张志南
刘晓收,范颖,史书杰,华尔,张志南*
(1.中国海洋大学海洋生命学院,山东青岛 266003)
渤海大型底栖动物种类组成与群落结构研究
刘晓收1,范颖1,史书杰1,华尔1,张志南1*
(1.中国海洋大学海洋生命学院,山东青岛 266003)
本文利用2008年8月在渤海23个站位采集的样品对大型底栖动物的丰度、生物量、群落结构及其与环境因子的关系进行了研究。共鉴定出大型底栖动物300种,主要类群包括环节动物多毛类、节肢动物甲壳类、软体动物、棘皮动物等。研究海域大型底栖动物的平均丰度为1 094.7 ind/m2,平均生物量为11.78 g/m2,其中丰度最高区位于辽东湾,最低区位于渤海湾;生物量最高区位于渤海中部,最低区出现在渤海海峡湾口处。依据丰度和生物量进行了CLUSTER聚类和MDS标序图分析,结果可将研究站位划分为6个站组,均与沉积物底质类型密切相关。所研究海域底质类型包括黏土质粉砂、砂、砂质粉砂、粉砂质砂、砂-粉砂-黏土5种。通过BIOENV分析,发现影响大型底栖动物群落结构和分布的主要环境因子有水深、黏土粉砂含量、脱镁叶绿酸含量、叶绿素含量等。与20世纪90年代历史数据的对比发现,本次研究大型底栖动物的物种数目明显减少,平均丰度也减少,特别是优势物种表现出了小型化趋势,传统的大型种类,如心形海胆、双壳类等,被小个体的多毛类和甲壳类所取代。本研究表明渤海近年来受人类活动影响,出现了不同程度的污染,导致大型底栖动物群落结构发生了变化。
大型底栖动物;丰度;生物量;群落结构;渤海
1 引言
渤海是北太平洋温带海域的一个典型的陆架浅海,位于37°7′~41°00′N和117°35′~121°10′E之间,海区面积约7.7×104km2,平均水深18 m,最大深度达70 m。它三面被大陆包围,是一个半封闭型的暖温带陆缘内海,也是我国主要的海洋渔场之一,其主要特点就是水体的交换能力及海水的自净能力弱。而随着环渤海地区经济的发展,人类活动对渤海水域的影响增加,造成渤海特别是近岸海域生态环境恶化,对此海域的生物产生极大的胁迫作用,造成整个生物资源结构和数量的变动[1]。新中国成立以来已在渤海进行了多次包括大型底栖动物调查在内的综合性生物生态调查[2—6]。陆源排污、重大海上溢油灾害及海洋赤潮和绿潮灾害的影响是导致我国近岸局部海域污染严重的主要原因[7]。研究表明,近年来渤海生态监控区的赤潮发生次数和灾害面积都在显著增加,处于不同程度的富营养化状态。由于其重要的经济价值和重污染的环境特征,渤海的生态环境一直备受关注[8—10]。
底栖动物生活在海洋环境的“底栖区”,生境的高度多样化使其具有高的生物多样性。底栖动物的种数(预计超过100万种)远远超过水层中的大型浮游动物、鱼类和海洋哺乳类的总和。同时,底栖动物的丰富度也远高于水层区,而且具有一些特有的生物门类[11—14]。大型底栖动物是海洋生态系统中的一个重要生态类群,大多生活在有氧和有机质丰富的沉积物表层,通过作用于底层水体环境,参与水体营养物循环,以及影响污染物的迁移转化与沉积物的稳定性,在海洋生态系的能流和物流中占有十分重要的地位[15—18]。本文通过研究渤海23个站位的大型底栖动物丰度、生物量和群落结构,并探讨其与环境因子的相互关系,以期了解渤海生态环境现状,为保护生态资源实现可持续利用及生态系统健康评价提供科学依据。
2 材料与方法
2.1 研究海域和站位分布
2008年8月搭载“向阳红09”科学调查船,在渤海23个站位进行了底栖定量采泥,站位分布在辽东湾、渤海湾、莱州湾、渤海中部和渤海海峡(图1)。

图1 渤海2008年8月大型底栖动物取样站位Fig.1 Map of the Bohai Sea,showing the macrofauna sampling stations in August,2008
2.2 样品的采集与处理
使用0.1 m2箱式采泥器,采集未受扰动的沉积物样品,每站取3个样品,现场用0.5 mm孔径网筛分选大型底栖动物,将生物标本及残渣全部转移至样品瓶,并用5%福尔马林固定。同时在采样点取一定量的表层沉积物,用于沉积物粒度、有机质、叶绿素等环境因子的分析,放入-20℃冰柜,冷冻保存。底栖动物进行挑拣时在体视显微镜下尽量鉴定到种并计数,每站每种的样品使用0.001 g感量的电子天平进行称重,以湿重作为重量,称重前使用滤纸将生物体吸干。样品的处理、保存、计数和称量等均按《海洋调查规范》[19]和《海洋底栖生物研究方法》[18]进行。软体动物带壳称重,寄居蟹去壳称重,管栖多毛类去管称重,群体标本不计算个数。
2.3 环境因子的测定
本航次中现场通过船载CTD测得的环境因子有:水深、表温、表盐、底温、底盐。沉积物有机质含量按《海洋监测规范》[20]中有机质的测定方法进行,即重铬酸钾氧化法。沉积物粒度采用英国Malvern公司生产的Mastersizer 2000型激光粒度仪测定,叶绿素a测定按照《海洋调查规范》[19]中的荧光分光光度计法,计算沉积物中叶绿素a和脱镁叶绿酸的含量。
2.4 数据处理和分析
2.4.1 优势种的确定
采用相对重要性指数IRI[21]计算,该指数的计算是将大型底栖动物种群的个体大小、数量和分布情况考虑其中,从而能定量地反映出它们在渤海的地位和数量分布的变化情况。计算公式为:

式中,W为某一种群的生物量占大型底栖动物总生物量的百分比;N为该种群的丰度占大型底栖动物总丰度的百分比;F为该种群出现的频率。
2.4.2 群落结构分析
采用生物统计分析软件PRIMER 6.0进行群落结构分析,原始的丰度数据经平方根转化后,以Bray-Curtis相似性系数为基础构建相似性矩阵,然后使用等级聚类分析CLUSTER将样品逐级连接成组,通过树枝图来表示群落结构[22—23]。用SIMPER(similarity percentage program)分析来计算不同物种对样本组内相似性和组间差异性的平均贡献率。群落结构与环境变量的关系采用BIOENV分析(采用Weighted Spearman相关系数),找出与群落结构形成最佳匹配(最大相关)的环境变量组合。
3 结果与分析
3.1 环境因子
3.1.1 水层环境因子
各站位水层环境因子见表1。本次调查的23个站位水深变化范围为13.7~37.9 m,其中B01站位取样水深最浅,离岸相对较近,水深只有13.7 m,B08站位取样水深达37.9 m,离岸较远;表温为22.66~25.83℃,各站位表温差距明显;底温为18.79~25.78℃,相对表温变化较大。表盐30.02~31.53,B22站位表盐最低,B15站位最高;底盐30.03~31.65,B19站位最低,B05站位最高,相同站位,表盐与底盐的变化趋势相近,一般情况下,底盐高于表盐。

表1 渤海研究站位水层环境因子Tab.1 Pelagic environmental factors at the sampling stations in the Bohai Sea

续表1
3.1.2 渤海沉积物的粒度特征和沉积物类型
研究站位沉积物的粉砂黏土百分比含量和中值粒径(Mdφ)的等值线图见图2、图3。渤海各站位沉积物组成表明,各站位粉砂黏土含量和中值粒径变化趋势相近。粉砂黏土百分比含量变化范围为28.93%~98.87%,其中位于渤海海峡的B18站位粉砂黏土百分含量最低,位于渤海湾的B10站位粉砂黏土百分含量最高;中值粒径变化范围为2.91~6.95,B18站位中值粒径最低,B10站位中值粒径最高。底质类型的确定是由沉积物中百分含量超过20%的粒级命名的,且含量多的在后,少的在前。研究海域底质类型包括黏土质粉砂、砂、砂质粉砂、粉砂质砂、砂-粉砂-黏土5种。

图2 渤海沉积物粉砂黏土百分比含量(%)等值线图Fig.2 Contour map of the percentage content(%)of silt and clay in the Bohai Sea
3.1.3 渤海沉积物中有机质含量
渤海各站位沉积物有机质含量变化范围为0.48%~2.99%,各站位差距明显,其中位于辽东湾的B04站位有机质百分含量最高,位于渤海海峡的B21站位有机质百分含量最低(见图4)。有机质含量与中值粒径等值线图对比分析表明,有机质含量与中值粒径变化趋势相近。随着沉积物中黏土含量的降低,有机质和水分含量的降低也十分明显,其原因可能是由于底质越细,其透气性就越差,易形成缺氧状态,不利于有机质的氧化,但却有利于有机质和部分重金属的保存。
3.1.4 渤海沉积物叶绿素a及脱镁叶绿酸含量
沉积物中叶绿素的含量关系到底栖动物的食物来源和底质环境的质量,脱镁叶绿酸的含量预示着底质中死亡植物的量。渤海各站位沉积物中叶绿素a含量变化范围为0.12~2.66μg/g(见图5),脱镁叶绿酸含量变化范围为0.78~7.24μg/g(见图6),各站位之间差异较显著。叶绿素a含量整体偏低,脱镁叶绿酸含量相对叶绿素a含量略高,二者变化趋势基本相同。叶绿素a和脱镁叶绿酸含量的高值区位于辽东湾东南部,低值区位于渤海湾。
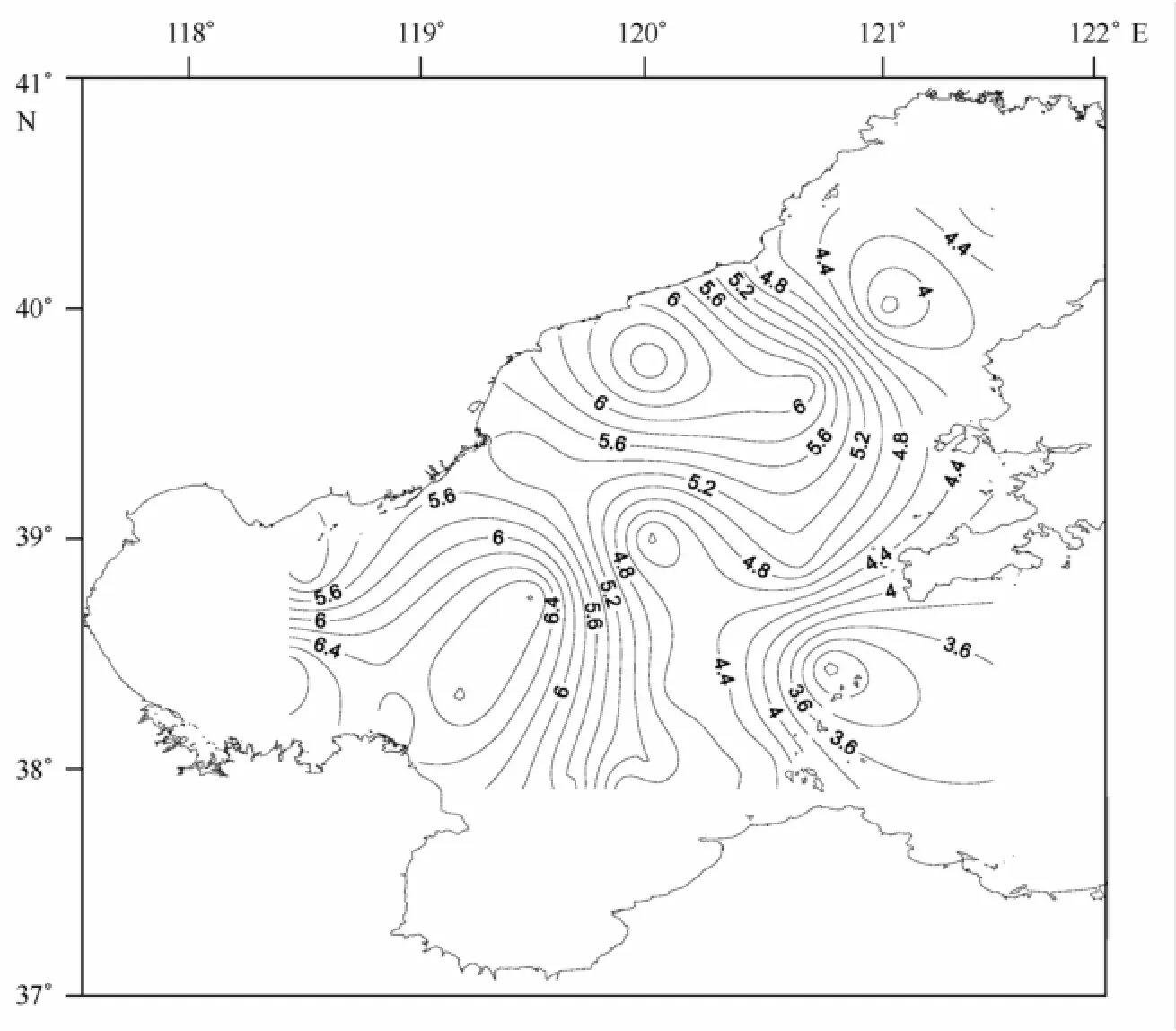
图3 渤海沉积物中值粒径(Mdφ)等值线分布图Fig.3 Contour map of the sediment median size(Mdφ)in the Bohai Sea
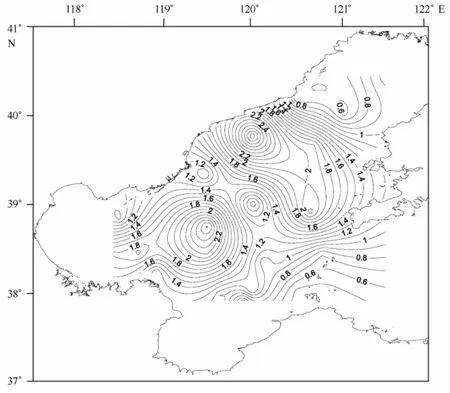
图4 渤海沉积物有机质等值线(%)分布图Fig.4 Contour map of the organic matter(%)in the Bohai Sea

图5 渤海沉积物叶绿素a含量(μg/g)等值线分布图Fig.5 Contour map of the chlorophyllacontent(μg/g)in sediment in the Bohai Sea
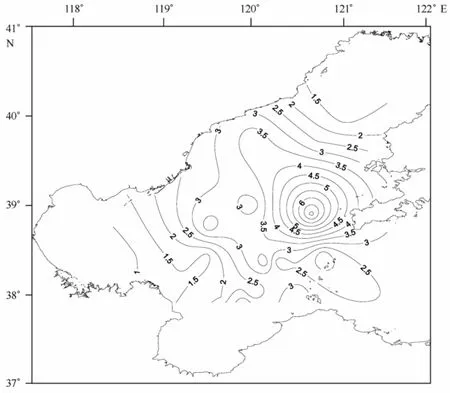
图6 渤海沉积物脱镁叶绿酸含量(μg/g)等值线分布图Fig.6 Contour map of the sediment phaeophorbide content(μg/g)in the Bohai Sea

图7 渤海大型底栖动物各类群丰度、生物量及种类比例图Fig.7 Composition of species number,abundance and biomass of each macrofauna taxon in the Bohai Sea
3.2 大型底栖动物的丰度和生物量
3.2.1 类群组成和优势种
本研究共采集到大型底栖动物300种,包括环节动物多毛类、节肢动物甲壳类、软体动物、棘皮动物、星虫动物、螠虫动物、腔肠动物、腕足动物、扁形动物、纽形动物和鱼类,各类群丰度、生物量及其所占比例见图7。从丰度来看,大型底栖动物各站位总平均丰度为1 094.7 ind/m2,多毛类的平均丰度为405.9 ind/m2,占总平均丰度的37%;甲壳类的平均丰度为389.6 ind/m2,占总平均丰度的36%;软体动物的平均丰度为230.14 ind/m2,占总平均丰度的21%;棘皮动物平均丰度为53.99 ind/m2,占总平均丰度的5%;其他种类的总平均丰度为15.07 ind/m2,共占总平均丰度的1%。可见多毛类、甲壳类、软体动物、棘皮动物在丰度上占据优势。从生物量看,各站位大型底栖动物总平均生物量为11.78 g/m2,虽然占优势的仍是多毛类(3.64 g/m2,占31%)及甲壳类(3.00 g/m2,占25%)、软体动物(1.73 g/m2,占15%),但鱼类(1.04 g/m2,占9%)、棘皮动物(0.70 g/m2,占6%)和腔肠动物(0.63 g/m2,占5%)的比重明显增加,主要由于鱼类、棘皮动物和腔肠动物个体比较大。从物种数来看,甲壳类(100种,占34%)、多毛类(99种,占33%)和软体动物(81种,占27%)种数较多。
优势种分析(表2)表明,研究海域的优势种主要包括甲壳类塞切尔泥钩虾、麦秆虫、日本鼓虾,多毛类不倒翁虫、长须沙蚕、中蚓虫、寡鳃齿吻沙蚕、拟特须虫,以及软体动物江户明樱蛤。

表2 渤海2008年8月大型底栖动物相对重要性指数Tab.2 Results of IRI of macrofauna in the Bohai Sea in August 2008
3.2.2 丰度和生物量的平面分布
渤海23个站位的大型底栖动物丰度水平分布见图8。位于辽东湾的B25站位的丰度值最大,为4 040 ind/m2,且明显高于其他站位,同样位于辽东湾的B01站位(2 973.33 ind/m2)次之,位于渤海湾的B10站位(303.33 ind/m2)最少。优势种方面,以丰度较大的4个站位为例,B01站位的优势种为日本长尾虫、长尾亮钩虾;B05站位的优势种为日本镜蛤、微小海螂;B08站位的优势种为纤细长涟虫、寡鳃齿吻沙蚕;B25站位优势种为河蜾蠃蜚、日本倍棘蛇尾。

图8 渤海大型底栖动物丰度(ind/m2)等值线分布图Fig.8 Contour map of macrofauna abundance(ind/m2)in the Bohai Sea
渤海大型底栖动物生物量水平分布见图9,与丰度相比出现了明显的变化,位于渤海中部的B07站位的生物量最大,为33.28 g/m2,其中贡献最大的为泥虾(50%),其次为海鼠鳞沙蚕(20%)。另外差别较大的是位于莱州湾的B16站位,其丰度只有723.33 ind/m2,而其生物量却为20.47 g/m2,仅次于B07站位,这主要是由于其中某些样品体型较大的原因,如鰕虎鱼科一种(67%)、毛蚶(23%)等。此外,位于莱州湾的B12站位中对生物量贡献较大的是日本鼓虾(33.6%)、绒毛近方蟹(30.5%);B06站位中主要是由于海葵一种(78.5%);B22站位中长吻沙蚕(30.9%)和塞切尔泥钩虾(27.6%)对其生物量影响较大。
3.3 群落结构分析
对各站位的大型底栖动物种类丰度进行平方根转化,做出Bray-Curtis相似性矩阵,以此进行CLUSTER聚类和MDS标序,结果见图10。调查海域的大型底栖动物群落,在33%的相似性水平上大致可划分出6个大型底栖动物群落站组,同时使用SIMPER分析了各站组的优势物种。

图10 渤海大型底栖动物丰度CLUSTER聚类和MDS标序图Fig.10 CLUSTER and MDS plots based on macrofauna abundance in the Bohai Sea
站组1:B01和B25站位,位于辽东湾,相似性指数约38%。这两个站位的丰度值较大,优势种为河蜾蠃蜚、长尾亮钩虾、日本长尾虫、背尾水虱等甲壳类,日本倍棘蛇尾、钩倍棘蛇尾等棘皮动物。此群落生活水域离岸较近,水深13.72~20.99 m,底温23.58~24.90℃,底盐30.05~31.42,底质类型为砂质粉砂和粉砂质砂。
站组2:B03、B10、B22和B23站位,分别位于辽东湾、渤海湾东部、渤海中部和莱州湾,相似性约35%。这几个站位的丰度较低,为303.33~830.00 ind/m2,优势种为拟特须虫、角海蛹等多毛类,塞切尔泥钩虾、弯指伊氏钩虾、麦秆虫等甲壳类,银白壳蛞蝓、紫壳阿文蛤、秀丽波纹蛤、江户明樱蛤等软体动物。此群落生境的水深一般较深,为17.30~29.96 m,底温18.94~25.40℃,底盐为30.15~31.61,底质类型为粉砂质砂、黏土质粉砂。
站组3:B05和B08站位,位于辽东湾,相似性约35%。这两个站位的丰度较高,优势种为不倒翁虫、寡鳃齿吻沙蚕等多毛类,日本镜蛤、微小海螂、细纹河口螺等软体动物和纤细长涟虫等。该群落生活在30.26~37.91 m的较深海域,底温为18.784~12.818℃,底盐为31.12~31.65,底质类型为砂-粉砂-黏土和砂质粉砂。
站组4:B09和B18站位,位于渤海湾东部和渤海海峡,其相似性约50%。这两个站位的丰度近似,分别为1 025 ind/m2和1 090 ind/m2,优势种为拟特须虫、寡鳃齿吻沙蚕等多毛类,日本倍棘蛇尾、微小海螂和背尾水虱等。该群落生活在26.5~33.7 m的较深海域,底温为24.53~20.72℃,底盐为31.10~31.52,底质类型为粉砂质砂。
站组5:B11、B14、B15、B16、B19、B20、B21和B26站位,位于渤海湾东部、渤海中部、莱州湾,其群落相似性为40%。这8个站位的丰度都较低,平均丰度为785 ind/m2,优势种为塞切尔泥钩虾。该群落生活在16.91~23.88 m的浅水海域,底温为20.19~25.78℃,底盐为30.03~31.56,底质类型为粉砂、砂质粉砂和黏土质粉砂。
站组6:B04、B06、B07、B12和B27站位,位于辽东湾和渤海中部,该群落的相似性为35%,丰度很小,其平均丰度为574.67 ind/m2,优势种为中蚓虫、不倒翁虫、长须沙蚕等多毛类,江户明樱蛤、龙氏拟美蛤等软体动物,塞切尔泥钩虾、中华蜾蠃蜚等甲壳类。该群落生活在17.3~28.2 m的浅水海域,底温为21.95~23.20℃,底盐为31.21~31.46,底质类型为粉砂质砂、砂质粉砂和黏土质粉砂。
3.4 环境因子与群落结构的关系
BIOENV分析结果表明(见表3),与渤海大型底栖动物群落结构最匹配的环境因子是沉积物粉砂黏土含量和脱镁叶绿酸含量,其相关系数最大,为0.284。此外,大型底栖动物的群落结构还受水深、叶绿素含量等的综合影响。丰度最高的B25站位是粉砂质砂,丰度较高的B01、B08、B21站位都是砂质粉砂,其粉砂黏土含量在50%~80%之间,即随着沉积物粉砂粘土含量的降低和砂含量的增加,大型底栖动物的丰度会显著或极显著地增加,这也说明渤海含砂量相对高的生境有利于动物丰度的增加。除了B08站位,丰度较高的B01、B05、B21、B25站位的水深和脱镁叶绿酸含量都处于较低水平。

表3 大型底栖动物群落结构与环境因子的相关分析结果Tab.3 Results of BIOENV between macrofaunal community structure(based on abundance)and environmental factors
4 讨论
按自然分区,渤海由辽东湾、渤海湾、莱州湾和渤海中部组成。本次调查将渤海水域作为一个整体进行比较,在各海区分别选取一定站位,探讨大型底栖动物在渤海不同海区的分布格局。为了解渤海海域的大型底栖动物群落结构状况,本文把本次研究所得渤海海区大型底栖动物丰度和生物量与历史资料进行了对比(见表4)。
通过与周红等[24]邻近莱州湾的渤海中部海域的研究比较,本次调查的平均丰度与邻近莱州湾的渤海中部海域的调查结果相近,而与其他5次调查的结果相差较大;本次调查的平均生物量只有11.78 g/m2,与历史资料对比最低。通过与韩洁等[25]渤海中南部大部分海区大型底栖生物丰度和生物量的研究资料比较可知,渤海大部分海区的大型底栖动物丰度在近10年来有明显下降,生物量也明显降低:渤海中南部在20世纪90年代的总丰度和总生物量的平均值为分别为2 576 ind/m2和44.47 g/m2;而该研究对渤海大部分海区的调查的总丰度和总生物量分别为1 094.7 ind/m2和11.78 g/m2,而且研究海域大型底栖动物以多毛类和甲壳类占丰度优势,这说明近年来频繁的人类活动对该海域生物类群有所影响,致使某些物种在该海域消失。Huston的非平衡假说能较好地解释这种现象,即人为扰动导致的富营养化降低了底栖动物的多样性[26-27]。与孙道元和刘银城[3]的调查比较,本次调查的渤海大部分海区的平均丰度值有较大幅度的增加,平均生物量虽然也比以前的调查的结果高,但增加幅度相对较小;与张志南等[4-5]的报道比较,也发现类似结果。本研究中的渤海大部分海区的平均丰度远高于黄河口及其邻近海域,但其中的生物量却相对较低,不同的生境条件和人类活动影响程度可能是造成上述差异的主要原因。

表4 渤海大型底栖动物丰度和生物量历史数据与本研究数据对比Tab.4 Comparison of abundance and biomass in the Bohai Sea with historical data
通过与刘录三等[29]的调查比较,渤海大部分海区总丰度平均值高于辽东湾北部海域大型底栖动物,而生物量略低,但是整体情况与之前的调查比较基本相同:本次调查总丰度平均值最高区也出现在辽东湾,且明显高于其他站位,同样位于辽东湾的B01站位(辽河口附近)次之,而该站位的优势种与之前的调查区内总生物量的最主要贡献者棘皮动物情况类似。
刘瑞玉等[31]基于20世纪50-70年代的调查资料,将渤海大体划分为4种底栖动物群落类型,优势种都是个体较大的棘皮动物、甲壳类、双壳类等。韩洁等[1]在1997—1999年对渤海大型底栖动物群落结构的研究与孙道远和刘银城[3]在1982年对渤海底栖动物种类组成研究时的描述基本是一致的,即渤海的动、植物区系贫乏、单调,多样性很低,占优势的种主要是低盐、广温性暖水种,最南端和最北端有不少种同时出现,区系成分没有明显的差异,仅在湾口深水区沉积物颗粒组成显著不同的底质区才表现出种组成方面的某些区别,但渤海大型底栖动物的种类组成和群落结构1990年代和1980年代已有显著不同[32]。在1980年代莱州湾穴居型的双壳类和棘皮动物在数量上和生物量上均占明显优势[5]。形成一个以凸壳肌蛤Musculista senhousia-心形海胆Echinocardium cordatum为优势种的群落[2-3]。到了1990年代,原来莱州湾丰度和生物量很高的心形海胆和凸壳肌蛤被较小的紫壳阿文蛤Alvenius ojianus和银白齿缘蛞蝓Yokoyamaia argentata取代[1]。而20世纪以后,又进一步被更小的种类小亮樱蛤代替[24]。莱州湾自1990年代以来大型底栖动物群落结构已发生变化,总体来呈现小型化变化趋势,如类群的替代(小型多毛类动物和甲壳类动物取代大个体的棘皮动物和软体动物)和类群内种类小型化的趋势。在胶州湾也观察到了类似的变化。毕洪生等[33]在对胶州湾的底栖生物群落进行的为期5年的连续监测中发现,1990年代与1980年代相比,丰度一直呈稳步上升趋势,尤其是小型底泥食性种类。在胶州湾西北部海域大型底栖动物的研究中[34]发现胶州湾的原有优势种棘皮动物棘刺锚参Protankyra bidentata和细雕刻肋海胆Temnopleurus toreumaticus数量明显增加,群落结构发生变化。
造成群落结构的长期变化的原因可能主要有:地方性污染、富营养化、过度捕捞及大型底拖网等[35—36],底栖动物捕食者的改变和自然界的长期变化等[37—40]。地方性污染尚未对渤海群落结构造明显影响,而自然界长期变化则不可能在十年间就显露出来,看来快速的富营养化进程、过度捕捞、大型底拖网的捕捞方式以及底栖动物捕食者的改变,可能是造成渤海大型底栖动物群落结构变化的主要原因。对1959—1962年、1982-1983年和1992-1993年渔业资源的研究表明[37—38],从全国解放以后,特别是1962年秋捕捞对虾以来,渤海区的捕捞量不断增加,直到1988年拖网渔业才退出渤海,这种较长时间的定向、大力的捕捞造成了渤海鱼类种群结构的变化。“过捕”的直接后果是作为渤海传统捕捞对象的底层经济鱼类资源不断衰退,经济鱼种低龄化,小型化和劣质化,许多以大型底栖动物为食的鱼类结构也相应发生了变化,这种食物链的改变,必然会造成大型底栖动物群落结构的改变,即大型底栖动物的幼龄化、小型化,以及某些大型代表动物(特别是棘皮动物和软体动物)的缺失或消失[24]。这种趋势在世界其他海域也有所发现[36,41]。
对于底栖生物来说,水层环境和沉积环境条件的变化情况都可能对生物群落结构的空间和时间分布格局有影响。在本研究的渤海大部分海域中,对于形成大型底栖动物群落结构空间格局影响较大的是沉积环境。
从沉积物特征和大型底栖生物的相关分析来看,本次研究发现总丰度平均最高值出现在辽东湾B04站位,B02站位次之。底质主要是粉砂质砂,而丰度平均最低值出现在B10站位,粉砂黏土含量最高,即随着沉积物粉砂黏土含量的降低和砂含量的增加,大型底栖动物的丰度会显著或极显著地增加,这也说明渤海含砂量相对高的生境有利于动物丰度的增加。
本次研究中各站位的叶绿素a和脱镁叶绿酸含量在渤海湾中部达到最高值,此海域的B07站位所在群落的生物量达到最高值。说明生物量与叶绿素含量和脱镁叶绿酸含量都呈正相关关系,研究表明沉积物中叶绿素含量是水体和底栖初级生产较为可靠的指示因子[27],生物量与沉积物叶绿素含量和脱镁叶绿酸含量的这种正相关关系也说明了水层初级生产量是大型底栖动物食物的重要来源。这与韩洁等[25]描述的随沉积环境特征变化趋势基本一致。
现有的研究资料在各个海区进行的大型底栖动物研究较为零散,且出于研究目的不同,研究者在野外调查中的站位设置疏密不一,采样范围各不相同,以及海上取样和室内分选方法的差异等,造成了数据间的可比性较差。而本次调查海域较广、可比资料较少,使得大型底栖动物丰度和生物量与历史资料的比较异常困难,所以渤海大型底栖动物群落演替的具体特点和趋势尚需通过长期的、连续的调查数据进一步得到证实。
目前渤海海区由于人类活动等原因已受到不同程度的污染,渤海海岸生境退化与改变已成为渤海又一个重要的问题。为此,增加渤海及周边海域底栖动物的生态学调查,深入了解渤海底栖动物的生物组成群落结构,正确判断人为活动导致的海域生态系统退化范围与程度,对合理开发海洋生物资源具有重要意义。
5 结论
(1)本研究2008年8月渤海调查共鉴定出大型底栖动物300种,平均丰度为1 094.7 ind/m2,平均生物量为11.78 g/m2,其中丰度最高区位于辽东湾,最低区位于渤海湾;生物量最高值区位于渤海中部,最低值区出现在渤海海峡湾口处。影响大型底栖动物群落的决定因素包括沉积物粉砂黏土含量、脱镁叶绿酸含量、水深和叶绿素含量等环境因子。
(2)分析表明,大型底栖动物平均丰度较20世纪90年代减小,物种数目也明显减少,优势物种出现小型化趋势。同时通过对渤海大部分海域的环境因子分析表明,渤海大部分海域的底栖生物群落受到人类活动、化学因素、生物因素和物理因素的共同影响,变化特点和环境因素的改变情况基本符合。
[1] 韩洁,张志南,于子山.渤海中、南部大型底栖动物物种多样性的研究[J].生物多样性,2003,11(1):20-27.
[2] 孙道元,唐质灿.黄河口及邻近水域底栖动物生态特点[J].海洋科学集刊,1989,30:261-275.
[3] 孙道元,刘银城.渤海底栖动物种类组成和数量分布[J].黄渤海海洋,1991,9(1):42-49.
[4] 张志南,图立红,于子山.黄河口及其邻近海域大型底栖动物的初步研究(一)生物量[J].青岛海洋大学学报,1990,20(1):37-45.
[5] 张志南,图立红,于子山.黄河口及其邻近海域大型底栖动物的初步研究(二)生物与沉积环境的关系[J].青岛海洋大学学报,1990,20(2):45-52.
[6] 房恩军,李军,马维林,等.渤海湾近岸海域大型底栖动物(Macrofauna)初步研究[J].现代渔业信息,2006,21(10):11-15.
[7] 国家海洋局.《2010年中国海洋环境状况公报》.
[8] 刘学海,袁业立.渤海近岸水域近年生态退化状况分析[J].海洋环境科学,2008,27(5):531-536.
[9] 吴迪,王菊英,马德毅,等.基于PSR框架的典型海湾富营养化综合评价方法研究[J].海洋湖沼通报,2011(1):131-136.
[10] 冯士筰,张经,魏皓,等.渤海环境动力学导论[M].北京:科学出版社,2007.
[11] Brey T.Estimating productivity of macrobenthic invertebrates from biomass and mean individual weight[J].Meeresforsch,1990,32:329-343.
[12] Brey T,Cerdes D.Is Antarctic benthic biomass really higher than elsewhere?[J].Antarctic Sci,1997,9:266-267.
[13] Brey T,Gerdes D.High Antarctic macrobenthic community production[J].J Exper Mar Biol Ecol,1998,231(2):191-200.
[14] Buchanan J B,Warwick R M.An estimate of benthic macrofaunal production in the off shore mud of the Northumberland coast[J].J Mar Biol Asso UK,1974,54(1):197-222.
[15] Crips D J.Energy Flow Measurements in Methods for the Study of Marine Benthos[M].Oxford:Blackwell Scientific Publications,1984:284-366.
[16] Edgar G J.The use of the size structure of benthic macrofaunal communities to estimate faunal biomass and secondary production[J].J Exp Mar Biol Ecol,1990,137(3):195-214.
[17] 于子山,张志南,韩洁.渤海大型底栖动物次级生产力的初步研究[J].青岛海洋大学学报,2001,31(6):867-871.
[18] Eleftheriou A,McIntyre A.Methods for the Study of Marine Benthos[M].Oxford:Blackwell Scientific Publications,2005:1-418.
[19] 国家质量监督局和国家标准化委员会.海洋调查规范第6部分:海洋生物调查.中华人民共和国国家标准GB/T12763.6-2007[S].北京:中国标准出版社,2008.
[20] 国家质量监督局和国家标准化委员会.海洋监测规范.第5部分:沉积物分析.中华人民共和国国家标准GB/T17378.5-2007[S].北京:中国标准出版社,2008.
[21] Pinkas L,Oliphant M S,Iverson I L K.Food habits of albacore,blue fin tuna,and bonito in California waters[J].California Department of Fish and Game Fish Bulletin,1971,152:1-105.
[22] Clarke K R,Warwick R M.Change in Marine Communities:an Approach to Statistical Analysis and Interpretation[M].Plymouth,UK:Plymouth Marine Laboratory,1994.
[23] 周红,张志南.大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用[J].青岛海洋大学学报,2003,33(1):58-64.
[24] 周红,华尔,张志南.秋季莱州湾及邻近海域大型底栖动物群落结构的研究[J].中国海洋大学学报,2010,40(8):80-87.
[25] 韩洁,张志南,于子山.渤海大型底栖动物丰度和生物量的研究[J].青岛海洋大学学报,2001,31(6):889-896.
[26] Huston M.A general hypothesis of species diversity[J].The American Naturalist,1979,113(1):81-101.
[27] Moodley L,Heip C H R,Middelburg JJ.Benthic activity in sediments of the Northwestern Adriatic Sea:sediment oxygen consumption,macroand meiofauna dynamics[J].J Sea Res,1998,40(3/4):263-280.
[28] 王瑜,刘录三,刘存歧,等.渤海湾近岸海域春季大型底栖动物群落特征[J].环境科学研究,2010,23(4):430-436.
[29] 刘录三,孟伟,郑丙辉,等.辽东湾北部海域大型底栖动物研究:Ⅰ.种类组成与数量分布[J].环境科学研究,2008,21(6):118-123.
[30] 刘录三,孟伟,李新正,等.辽东湾北部海域大型底栖动物研究:Ⅱ.生物多样性与群落结构[J].环境科学研究,2009,22(2):155-161.
[31] Liu R Y,Cui Y H,Xu F S,et al.Ecology of Macrobenthos of the East China Sea and Adjacent Waters,Proceedings of International Symposium on Sedimentation on the Continental Shelf,with Special Reference to the East China Sea[M].Beijing:China Ocean Press,1983:879-903.
[32] Zhou H,Zhang Z N,Liu X S,et al.Changes in the shelf macrobenthic community over large temporal and spatial scales in the Bohai Sea,China[J]. Journal of Marine Systems,2007,67(3/4):312-321.
[33] 毕洪生,孙松,孙道远.胶州湾大型底栖生物群落结构的变化[J].海洋与湖沼,2001,32(2):132-138.
[34] 袁伟,张志南,于子山,等.胶州湾西北部海域大型底栖动物群落研究[J].中国海洋大学学报,2006,36(Z1):91-97.
[35] Gao X L,Zhou F X,Chen C T A.Pollution status of the Bohai Sea:An overview of the environmental quality assessment related trace metals[J]. Environment International,2014,62:12-30.
[36] Handley SJ,Willis T J,Cole R G,et al.The importance of benchmarking habitat structureand composition for understanding theextent of fishing impacts in soft sediment ecosystems[J].Journal of Sea Research,2014,86:58-68.
[37] 邓景耀.渤海渔业资源增殖与管理的生态学基础[J].海洋水产研究,1988(9):1-10.
[38] 邓景耀,孟田湘,任胜民,等.渤海鱼类种类组成及数量分布[J].海洋水产研究,1988(9):11-89.
[39] 邓景耀,姜卫民,杨纪明,等.渤海主要生物种间关系及食物网的研究[J].中国水产科学,1997,4(4):1-7.
[40] 李新正,于海燕,王永强,等.胶州湾大型底栖动物的物种多样性现状[J].生物多样性,2001,9(1):80-84.
[41] Rijinsdorp A D,van Leeuwen P I,Daan N,et al.Changes in abundance of demersal fish species in the North Sea between 1906-1909 and 1990-1995[J].ICESJournal of Marine Science 1996,53(6):1054-1062.
Studies on the species composition and community structure of macrofauna in the Bohai Sea,China
Liu Xiaoshou1,Fan Ying1,Shi Shujie1,Hua Er1,Zhang Zhinan1
(1.College of Marine Life Sciences,Ocean University of China,Qingdao266003,China)
In this paper,the abundance,biomass,community structure of macrofauna and its relationship with environmental factors in the Bohai Sea were studied using the samples collected from 23 stations in August 2008.A total of 300 species were identified,among which the major taxa were polychaetes,crustaceans,mollusks and echinoderms.The average abundance of macrofauna was 1 094.7 ind/m2,and the average biomass was 11.78 g/m2.The highest abundance was located in Liaodong Bay,while the lowest was in Bohai Bay.The highest biomass was located in the middle of the Bohai Sea,while the lowest appeared in Bohai Strait.CLUSTER and MDS analysis based on the abundance data showed that six communities groups could be divided,which were closely related to the types of sediment.The sediment types in this area included clayey silt,sand,sandy silt,silt sand and sand-silt-clay.BIOENV analysis showed that the major environmental factors affecting the community macrofaunal structure and distribution were water depth,sediment silt-clay percentage,phaeophorbide and chlorophyll contents.The number of species and average abundance of macrofauna in the area have obviously declined compared with the historical data in 1990s.It is noted that the dominant species showed a miniaturization trend.The traditionally dominant largesized species,such as heart urchin and bivalves,were replaced by small-sized polychaetes and crustaceans.The present study showed that the Bohai Sea was affected by human activities and suffered various degrees of pollution in recent years,resulting in the changes of macrofauna community structure.
macrofauna;abundance;biomass;community structure;Bohai Sea
Q958.1
A
0253-4193(2014)12-0053-14
刘晓收,范颖,史书杰,等.渤海大型底栖动物种类组成与群落结构研究[J].海洋学报,2014,36(12):53—66,
10.3969/j.issn. 0253-4193.2014.12.005
Liu Xiaoshou,Fan Ying,Shi Shujie,et al.Studies on the species composition and community structure of macrofauna in the Bohai Sea,China[J].Acta Oceanologica Sinica(in Chinese),2014,36(12):53—66,doi:10.3969/j.issn.0253-4193.2014.12.005
2014-02-16;
2014-03-06。
国家自然科学基金项目(40730847,41006081);中国海洋大学中央高校基本科研业务费专项项目(201462008)。
刘晓收(1979—),男,山东省博兴县人,博士,副教授,主要从事生物海洋学与海洋生物生态学研究。E-mail:liuxs@ouc.edu.cn
*通信作者:张志南(1937—),男,山东省青岛市人,教授,博导,主要从事生物海洋学研究。E-mail:znzhang@ouc.edu.cn
