不同适温海洋富油微藻在富碳培养条件下的油脂积累特性研究
2014-06-01王帅郑立韩笑天李林杨佰娟刘晨光
王帅,郑立,韩笑天,李林,杨佰娟,刘晨光
(1.中国海洋大学海洋生命学院,山东青岛 266003;2.国家海洋局第一海洋研究所海洋生态研究中心,山东青岛 266061;3.中国科学院海洋所海洋生态与环境科学重点实验室,山东青岛 266071;4.青岛科技大学化学与分子工程学院,山东青岛 266042)
不同适温海洋富油微藻在富碳培养条件下的油脂积累特性研究
王帅1,2,郑立2*,韩笑天3,李林4,杨佰娟2,刘晨光1
(1.中国海洋大学海洋生命学院,山东青岛 266003;2.国家海洋局第一海洋研究所海洋生态研究中心,山东青岛 266061;3.中国科学院海洋所海洋生态与环境科学重点实验室,山东青岛 266071;4.青岛科技大学化学与分子工程学院,山东青岛 266042)
本实验分别针对3株低温藻株:微拟球藻Nannochloropsissp.ZL-12、四爿藻Tetraselmis chuiZL-33和小球藻Chlorellasp.ZL-45,3株中温藻株:球等鞭金藻Isochrysis galbanaCCMM5001、等鞭金藻Isochrysissp.CCMM5002和微拟球藻Nannochloropsissp.CCMM7001,3株高温藻株:微拟球藻Nannochloropsissp.JN1、绿色巴夫藻Pavlova viridisJN2和海洋小球藻Chlorellasp.JN3,研究了在通入0.03%(空气)、5%、10%3个CO2浓度梯度条件下的生长特性,同时考察了其总酯及中性脂的累积情况。结果显示,富碳培养有利于不同温度条件下9株藻株的生长,除微拟球藻Nannochloropsissp.CCMM7001最适生长的CO2浓度为5%外,其余8株藻株最适生长的CO2浓度均为10%。在低温和高温条件下,6株海洋富油微藻在通入10%CO2时具有最大生物量产率,在中温条件下球等鞭金藻和等鞭金藻在通入10%CO2时获得最大生物量产率,而微拟球藻在通入5%时获得最大生物量产率,随着CO2浓度的增加,9株藻株的总脂含量和中性脂含量有明显提高。低温和中温藻株的总脂含量高于高温藻株的总脂含量,从中性脂的累积规律来看,9株藻株均在平台期的累积达到最大值,GC -MS分析结果表明,9株微藻适合制备生物柴油的C14~C18系脂肪酸相对含量在不同CO2条件下基本保持不变,维持在90%左右。实验结果显示,所研究的藻株作为富油高固碳优良藻株,具备用于海洋生物质能耦合CO2减排开发的潜力。
海洋富油微藻;富碳培养;中性脂;油脂积累
1 引言
化石能源的应用极大地推动了社会的文明和发展,但随着其大量的消耗和使用,储量日益减少,近几十年来,大气CO2浓度(体积百分数)不断升高,造成严重的环境污染和气候变化问题,引起广泛重视。据CO2信息分析中心(Carbon Dioxide Information Analysis Center)最新监测数据显示[1],截至2009年全球石化燃料的碳排放量为8.738×109t,2012年大气CO2全球平均浓度体积分数已经达到392.6×10-6,并以每年增加1.2×10-6的速度上升。各国已意识到问题的严重性,1997年缔约了“京都协议书”,使得CO2在全球范围内受到排放限制,如何减排CO2并对其进行资源化利用也成为研究热点。因此,大力推进碳捕捉与封存技术的开发,发展可再生能源已成为世界各国重点关注的科学问题。
目前,减少CO2排放的方法,按其原理可分为物理、化学和生物技术。采用物理方法简单但成本极高,如深海注射、陆地埋葬等;化学方法主要是通过酶促反应、电化学方法及碳化作用,将碳源转化为可永久储存的化学能源,但这一技术开发和应用成本也很高,并且在处理过程中能源的消耗及排放的CO2又会增加环境新的负担。生物固碳(生物质能)技术主要利用植物的光合作用固定CO2,其中利用大规模培养微藻固定CO2是一项新兴的生物技术。微藻生长速度快、固碳效率高、自身合成油脂能力强且易培养;某些微藻还能耐受如低温、高温、高CO2等极端条件,最终将无机碳转化成生物质能,因此开发微藻油脂是解决能源危机及环境污染的最佳选择之一。此外,微藻还可以做工农业原料生产食品添加剂、药物和保健品等。综上所述,微藻这一可持续性海洋资源,在生物固碳领域具有广阔的应用前景。
利用微藻进行CO2捕捉与封存方面的研究已经取得了一些进展,特别是对微藻的CO2耐受性做了广泛研究,但研究对象多为淡水藻中的绿藻和蓝藻,其CO2耐受浓度在5%~40%不等[2]。目前,对海洋微藻的固碳研究不多,主要是针对中温藻中的微拟球藻Nannochloropsissp.、海水小球藻Chlorellasp.、盐生杜氏藻Dunaliella salina、海链藻Thalassiosira weissflogiiH1和三角褐指藻Phaeodactylum tricornutum等[3]进行了研究,而对于不同适温条件下固碳方面的研究还未见报道,特别是中性脂积累特性也少有研究。研究发现海洋微藻当CO2浓度超过5%时,其生长率,生物量积累都会受到一定的抑制[4],而现有数据表明,电厂的CO2排放浓度在10%左右[5],所以要利用海洋微藻进行碳减排,必须耐受10%的CO2。此外,适合藻类培养的温度一般在20~25℃范围内,冬季和夏季温度过低或过高时均不利于藻类培养,若要进行室外全年培养,则要增加能耗调节温度,这样不仅增加成本,而且很有可能由此产生的CO2比固定封存的CO2还要多。因此从海洋微藻的藻种筛选上着手,获得适应不同温度条件下的藻种可以很好的解决这一问题。
大型工业厂区(如发电厂)是排放含高浓度CO2的主要场所,其废气中含有10%左右高浓度的CO2,高等植物在这种条件下不能存活,因此能够耐受高浓度CO2的微藻具有较大的应用价值。本实验考察了9株可耐受不同温度条件的海洋富油微藻的CO2耐受性。通过对其耐受不同浓度CO2气体的实验研究,考察了9株海洋富油微藻的生长、油脂积累及其脂肪酸组成和含量的变化,为从海洋富油微藻中筛选生物质能耦合CO2减排开发的潜在优良藻种提供生物材料,可延长全年可进行微藻培养的时间。
2 材料与方法
2.1 材料
本研究选用前期筛选的9株海洋富油微藻(粗油脂含量均大于30%)进行实验。3株低温海洋富油微藻:微拟球藻Nannochloropsissp.ZL-12、四爿藻Tetraselmis chuiZL-33和小球藻Chlorellasp.ZL-45由中国科学院海洋研究所提供。3株中温海洋富油微藻:球等鞭金藻Isochrysis galbanaCCMM5001、等鞭金藻Isochrysissp.CCMM5002、微拟球藻Nannochloropsissp.CCMM7001由中国科学院海洋研究所提供。3株高温海洋富油微藻:微拟球藻Nannochloropsissp.JN1、绿色巴夫藻Pavlova viridisJN2和海洋小球藻Chlorellasp.JN3由暨南大学提供。
2.2 实验
2.2.1 海洋微藻培养
海洋微藻培养采用f/2培养基[6]配方,培养条件为:温度分别设定为15℃、25℃、30℃,光照强度100 μmol/(m2·s),光暗周期比12 h∶12 h,通入不同CO2浓度气体(占空气的体积比为:0.03%、5%、10%)进行培养。用玻璃转子流量计控制通气速率,通气量为0.1 vvm(volume gas per volume media permin),12 h光周期不间断通气(其中CO2为每天6 h不间断通气)。每个梯度设置3个平行组。每24 h定时取藻液进行细胞密度和中性脂测定。培养至平台期收集生物量,测定每种海洋微藻的总脂及脂肪酸组成。
2.2.2 细胞密度的计算和中性脂的测定
2.2.2.1 细胞密度和生物量的测定
每天定时取藻液样品,利用血球计数板进行细胞密度的测定。6 000 r/min离心5 min,收集藻细胞,冷冻干燥后将藻粉称重即获得生物量干质量,计算平台期生物量平均生长率。
生物量产率计算根据公式:
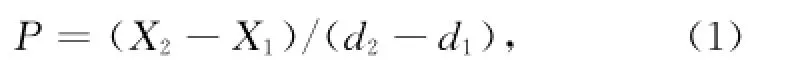
平均油脂产率计算则根据:

式中,P为生长率,X为时间d时的生物量干质量,d为时间,L为平均油脂产率,C为总脂含量[7—8]。
2.2.2.2 中性脂的测定
本实验中性脂的测定采用高通量尼罗红(J&K Scientific公司)染色法[9—10]。用多功能酶标仪(Tecan Infinite M200)测定单位体积藻液的荧光值(激发波长为480 nm,发射波长为580 nm),通过单个藻细胞的荧光强度的变化来表征中性脂积累的变化。
单个藻细胞荧光值的计算公式:
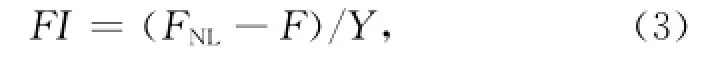
式中,FI为单个藻细胞中性脂荧光强度,FNL为尼罗红染色的荧光总强度,F为不加尼罗红藻液的荧光强度,Y为细胞密度[11]。
2.2.3 微藻总脂提取和脂肪酸分析
将微藻培养至平台期,用离心机(CR22GII,日本HITACHI公司)收集藻体(4℃,12 000 r/min),藻体进行冷冻干燥,用改进的三氯甲烷-甲醇提取法测定总脂含量[12]。总脂经皂化和甲酯化处理后,用气质联用技术GC-MS(5975 CMSD和7890 GC,安捷伦公司)对脂肪酸组成进行分析。色谱柱型号为HP-5MS(30 m×0.25 mm×0.25μm)。气相色谱条件:载气为氦气,流速为1 m L/min,进样口温度280℃,传输线温度为280℃;升温程序为:初温50℃,保持2 min,以6℃/min升到300℃,保持15 min;不分流进样,进样量1μL。质谱条件:离子源为EI,倍增器电压1 200 V,离子源温度为230℃,四级杆温度150℃,Scan方式检测。
2.3 统计分析
利用SPSS11.5软件对实验结果进行统计分析。
3 结果
3.1 不同温度和CO2浓度对9株海洋微藻生长曲线与中性脂动态累积
图1~3给出了不同温度和CO2浓度条件对9株海洋富油微藻的生长和中性脂积累的影响。当温度过低(15℃)或过高(30℃)时,均会影响微藻生长,开始进入指数生长期的时间会延长,中温富油微藻则在第三天即可进入指数生长期,而高温富油微藻在第四天进入指数生长期,低温富油微藻则在第五天才进入指数生长期,并且与中温(7~11 d)和高温富油微藻(10 d)相比,低温富油微藻的生长周期更长(13 d)。在不同温度条件下,属于同一个属的3株微拟球藻的生长情况具有显著差异(p<0.05),在25℃条件下细胞密度达到最大值(1.90×108个/m L),明显高于低温和高温处理组。
如图1所示,当海洋微藻进入对数期后,细胞密度随着CO2浓度的提高而变化显著(p<0.05)。3株海洋富油低温微藻在指数生长期细胞密度由高到低为Y10%、Y5%和Y空气,小球藻ZL-45在10%CO2条件下最大细胞密度为6.53×107个/mL,并且细胞密度为3株微藻的最大值,明显高于通入空气和5%CO2的4.06×107个/mL和4.16×107个/mL。微拟球藻ZL-12和四爿藻ZL-33也有类似的生长情况,在CO2浓度为10%时,细胞密度显著增加(p<0.05),细胞密度最高可分别达到5.68×107个/m L和3.53×107个/m L,明显高于通入空气和5%CO2的细胞密度。如图2所示,球等鞭金藻CCMM5001和等鞭金藻CCMM5002在指数生长期细胞密度由高到低为Y10%,Y5%和Y空气,而微拟球藻生长进入指数生长期,生长由快到慢为Y5%,Y空气和Y10%,球等鞭金藻CCMM5001在CO2浓度为10%条件下最大细胞密度为5.04×107个/mL,明显高于通入空气和5%CO2的3.60×107个/mL和4.60×107个/m L,等鞭金藻CCMM5002在CO2浓度为10%条件下,细胞密度显著增加(p<0.05),最高细胞密度可达4.86×107个/m L,明显高于通入空气和5%CO2的3.24×107个/mL和3.60×107个/mL。微拟球藻CCMM7001在CO2浓度为5%条件下生长最快,到达平台期时,细胞密度最高可达1.90×108个/m L。10%的CO2浓度对微拟球藻CCMM7001有一定的毒害作用,微拟球藻的生长受到了抑制,收获密度仅有7.66×107个/m L,甚至低于通入空气的1.76×108个/mL。如图3所示,3株海洋富油高温微藻在指数生长期细胞密度由高到低为Y10%,Y5%和Y空气,微拟球藻JN1在10% CO2条件下最大细胞密度为8.11×107个/m L,并且细胞密度为3株微藻的最大值,明显高于通入空气和5%CO2的6.20×107个/m L和6.62×107个/m L。绿色巴夫藻JN2和海洋小球藻JN3在10%CO2和5%CO2条件下,细胞密度没有显著差异(p<0.05),在通入10%CO2条件下,细胞密度达到最大值(6.26 ×107个/m L和6.75×107个/m L),明显高于通入空气和5%CO2的细胞密度。
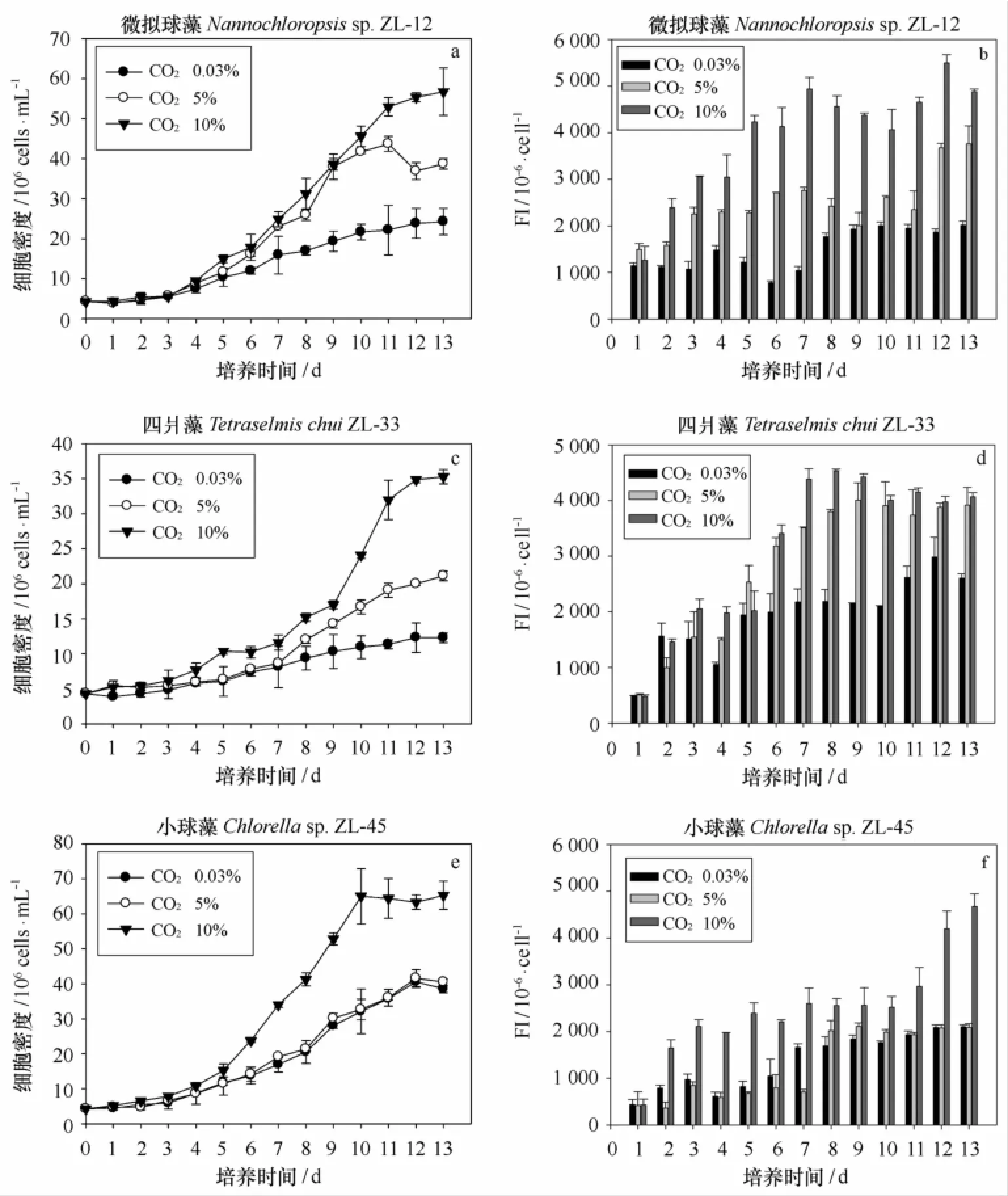
图1 不同CO2浓度条件下3株低温海洋富油微藻的生长曲线(a、c和e)和中性脂积累(b、d和f)的影响(平均值±标准偏差)Fig.1 The growth curve(a,c and e)and neutral lipid accumulation(b,d and f)of 3 strains of cold resisting marine microalgae under different CO2concentrations(Mean±SD)
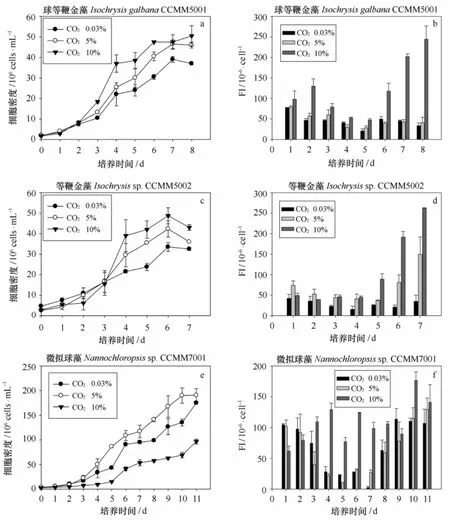
图2 不同CO2浓度条件下3株中温海洋富油微藻的生长曲线(a、c和e)和中性脂积累(b、d和f)的影响(平均值±标准偏差)Fig.2 The growth curve(a,c and e)and neutral lipid accumulation(b,d and f)of 3 strains of mesophilic marine microalgae under different CO2concentrations(Mean±SD)
实验采用尼罗红染色法对海洋微藻细胞内中性脂含量进行测定。如图1所示,CO2浓度对9株海洋富油微藻的中性脂动态积累过程具有显著影响,单因子方差分析表明,与通入空气和5%CO2的处理组相比,10%浓度CO2对9株海洋富油微藻的单个藻细胞中性脂荧光强度具有极显著作用(p<0.01),单个藻细胞中性脂荧光强度随着CO2浓度增加呈现梯度增加趋势:FI10%、FI5%和FI空气。微藻中性脂含量主要在指数生长期后期以及稳定期进行积累,中性脂含量随着温度的降低明显升高,在低温条件下(15℃),中性脂含量迅速积累,而在中温和高温条件下,总体呈现先降低后升高的趋势。在不同温度条件下,属于同一个属的3株微拟球藻的中性脂动态积累情况具有显著差异(p<0.05),在15℃条件下单个藻细胞中性脂荧光强度达到最大值,明显高于中温和高温处理组。
3.2 不同温度和CO2浓度对微藻生长率及平均油脂产率的影响
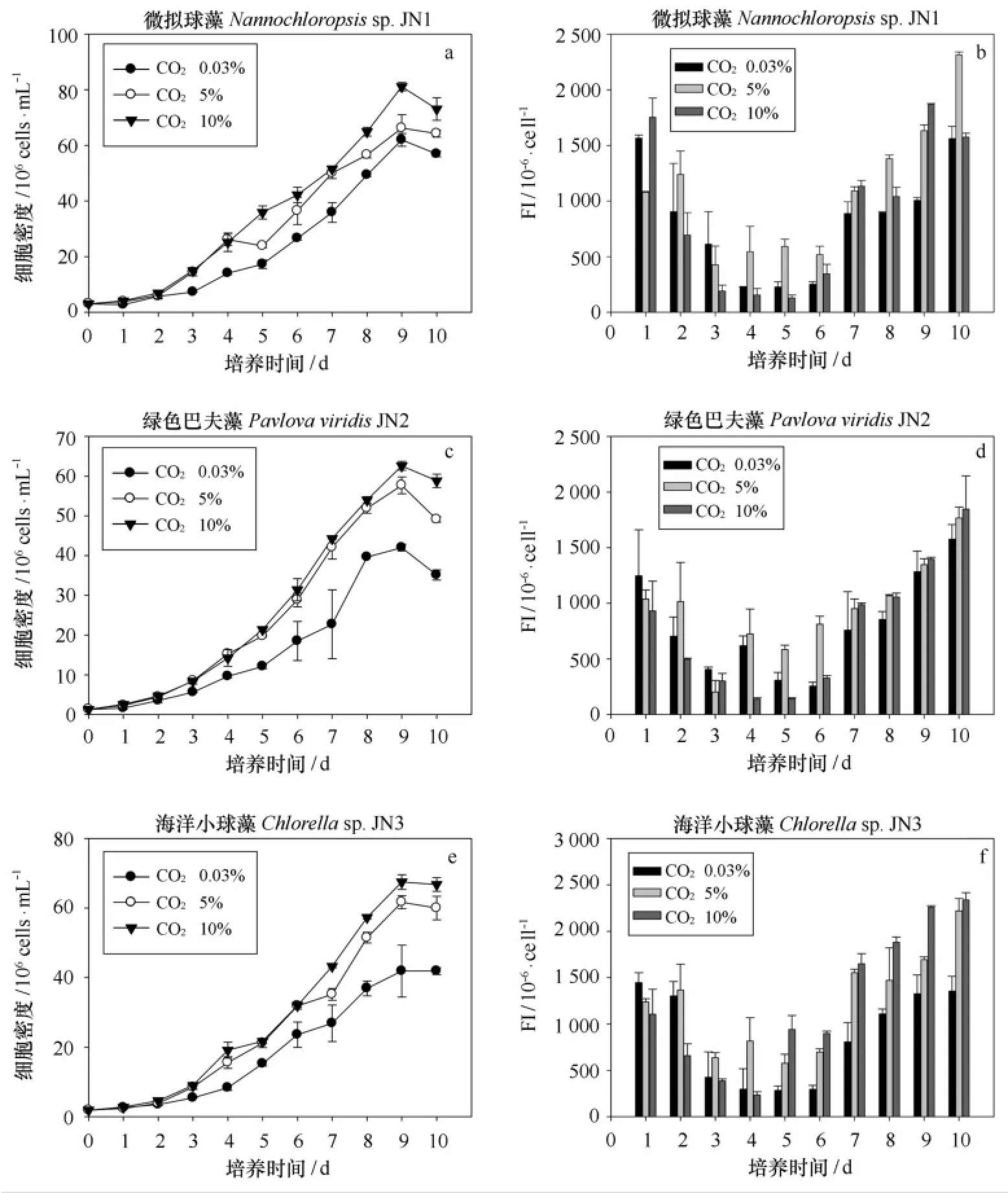
图3 不同CO2浓度条件下3株高温海洋富油微藻的生长曲线(a、c和e)和中性脂积累(b、d和f)的影响(平均值±标准偏差)Fig.3 The growth curve(a,c and e)and neutral lipid accumulation(b,d and f)of 3 strains of heat resisting marine microalgae under different CO2concentrations(Mean±SD)
9株海洋富油微藻的最大生物量产率、总脂含量及平均油脂产率均随CO2浓度提高而显著提高(p<0.05)(见表1),在中温条件下,富油微藻的最大生物量产率、总脂含量及平均油脂产率达到最大值。3株海洋富油低温微藻和3株海洋富油高温微藻的最大生物量产率、总脂含量及平均油脂产率均在10% CO2条件下达到最大值,3株海洋富油中温微藻中,球等鞭金藻CCMM5001和等鞭金藻CCMM5002的最大生物量产率、总脂含量及平均油脂产率均在10%CO2条件下达到最大值,而微拟球藻CCMM7001的最大生物量产率在5%CO2条件下达到最大值(122.25±1.17)mg/(L·d),平均油脂产率也达到最大值(43.41±3.00)%,此时总脂含量为(36.00±2.12)%。在CO2通气浓度为10%条件下,由于抑制了微拟球藻藻本身的生长,最大生物量产率仅有(85.43±8.61)mg/(L·d),但是油脂含量较高,达到(41.20±1.69)%。
3.3 不同温度和CO2浓度对微藻的脂肪酸组成及相对含量的影响
表2给出了不同温度和CO2浓度条件对9株海洋富油微藻的脂肪酸组成和相对含量的影响。如表2所示,C14、C16、C18和C20是3株海洋富油低温微藻(微拟球藻ZL-12、四爿藻ZL-33和小球藻ZL-45)和3株海洋富油高温微藻(微拟球藻JN1、绿色巴夫藻JN2和海洋小球藻JN3)主要的脂肪酸组成部分,而C14、C16、C18是3株海洋富油中温微藻(球等鞭金藻CCMM5001、等鞭金藻CCMM5002和微拟球藻CCMM7001)主要的脂肪酸组成部分,9株海洋富油微藻在不同CO2浓度条件下,C14~C18占脂肪酸组成80%以上,其中C16含量较高。
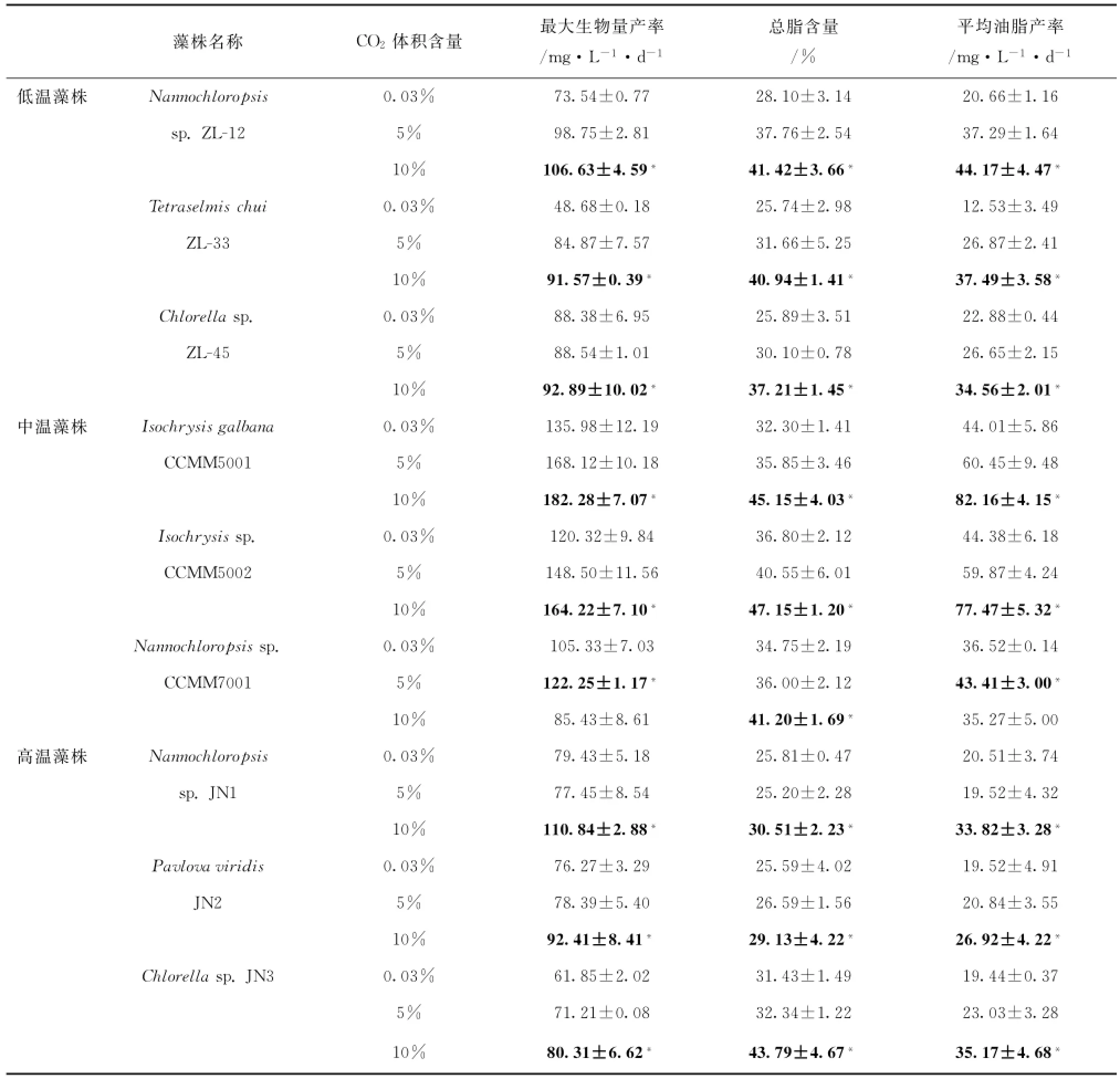
表1 9株海洋微藻不同CO2浓度条件下的最大生物量产率,总脂含量及平均油脂产率(平均值±标准偏差)Tab.1 The maxium biomass yield,total lipid concentration and average lipid productivity of 9 strains of marine microalgae under different CO2concentrations(Mean±SD)
就不同的脂肪酸组成而言,3株海洋富油低温微藻的C18含量随CO2浓度的增加而增加,微拟球藻、四爿藻和小球藻的C18含量分别由10.93%增加至18.49%,6.98%增加至16.00%,10.74%增加至15.99%。此外,3株海洋富油低温微藻均具有一定含量的二十二碳六烯酸(Docosahexaenoic Acid,DHA)(C22∶6),含量范围在1.08%~2.86%之间,二十碳五烯酸(Eicosapntemacnioc Acid,EPA)(C20∶5)含量均未检测到。3株海洋富油中温微藻中,微拟球藻CCMM7001的C14含量非常少,仅为3%左右,而其他两株金藻在20%以上,而微拟球藻C16含量较高,保持在78%以上,而其他两株金藻则在30%以下。球等鞭金藻和等鞭金藻DHA(C22∶6)含量较高,在5%~10%之间,EPA(C20∶5)含量则较低;而微拟球藻的DHA(C22∶6)没有检测到,但EPA(C20∶5)含量较高。3株海洋富油高温微藻中,海洋小球藻JN3的C18含量较高,保持在13%以上,最高达到17.7%,而其他两株则保持在7%~10%之间。此外,3株海洋富油高温微藻中EPA(C20∶5)含量较高,微拟球藻含量达到最大值5.43%;但DHA(C22∶6)较低,仅在海洋小球藻检测到含有DHA,含量范围在0.34%~0.59%。

从整体来看,9株海洋富油微藻脂肪酸组分的含量随CO2浓度的变化而改变,但适合于制备生物柴油的脂肪酸成分C14~C18总量一直维持在较高水平,均保持在80.45%~95.14%之间。3株海洋富油低温微藻的多不饱和脂肪酸(PUFAs)含量随CO2浓度的增加而明显降低,微拟球藻ZL-12、四爿藻ZL-33和小球藻ZL-45的PUFAs含量分别由61.44%降低至50.06%,66.66%降低至59.51%,57.64%降低至48.41%。3株海洋富油中温微藻中,球等鞭金藻CCMM5001的PUFAs随CO2浓度的增加,其总量由37.01%增加到了53.78%,最主要的原因是C18∶1从7%增加到了42%,而其他两株PUFAs的变化不明显,保持在45.5%~50%之间。3株海洋富油高温微藻的PUFAs随CO2浓度的增加而增加,其总量均在CO2浓度为5%时达到最大值。
3 讨论
CO2是植物光合作用的底物,又是光合作用的主要限制因子之一。微藻进行光合作用,首先由1,5-二磷酸核酮糖羧化酶氧合酶(Rubisco)固定CO2,再通过卡尔文循环转化为有机物[13]。因此,微藻生长环境中CO2浓度升高可在两方面影响其光合作用,一方面增加了CO2对Rubisco酶结合位点的竞争,从而提高羧化速率;另一方面通过抑制光呼吸提高净光合效率[14]。影响微藻固定CO2的因素很多,主要为CO2浓度和温度。不同藻种和藻株最适生长所耐受的CO2浓度各异,大多数海洋微藻最适CO2浓度不超过5%,例如微拟球藻Nannochloropsissp.[15]、三角褐指藻Phaeodactylum tricornulum[16]和紫球藻Porphyridiumsp.[17]等的最佳生长浓度为5%。Yue和Chen[18]从淡水中分离出一株能耐高浓度CO2的小球藻ChlorellaZY-1,CO2浓度为10%的时候出现最大生长速率。Yoon等[19]研究了多变鱼腥藻Anabaenavariabilis在不同进气CO2浓度下的生长情况,CO2浓度为4%~13%时,没有观察到停滞期,在CO2浓度为18%时,则出现了停滞期,藻细胞的生长受到抑制,可能是过高的CO2浓度使培养基p H降低引起的。欧阳峥嵘等[20]的研究表明,温度过高会影响海洋微藻的放氧速率,微藻固碳率也会降低。徐宁等[21]通过对锥状斯氏藻Scrippsiella trochoidea的研究也表明,温度过高,微藻固碳能力变弱。高春燕等[22]分别在15~35℃温度范围内考察了小球藻对CO2的脱除效果,在通气流量为600 mL/min,光强为3 500 lux,CO2入口浓度控制在1%左右条件下,进气中CO2的去除率随着温度的升高逐渐增大,在30℃达到最大值。
本实验采用尼罗红染色法测定了9株海洋富油微藻的中性脂含量,尼罗红染色后的细胞荧光强度与细胞内油脂含量具有显著相关性[10,23—24]。与传统方法(质量法)和色谱法测定植物中的脂类含量[25—26]相比,尼罗红染色法具有需要样品量小,处理时间短,可不经抽提,直接测定藻类细胞的总脂含量等优点。本研究结果表明,随着CO2浓度的提高,微藻的中性脂含量明显增加,且平台期为中性脂的积累期,这与王金娜[11]等的研究结果一致。原因可能是由于藻细胞进入平台期后,生长所需蛋白质合成量降低,呼吸作用和热耗散的能量也比指数生长期时有所下降,光合作用所同化的碳主要合成碳水化合物和脂类物质,表现出能量积累的趋势[27—28],而提高CO2浓度,能为碳水化合物和脂肪的积累提供丰富的碳源。在整个生长过程中,3株海洋富油中温微藻和3株海洋富油高温微藻的中性脂含量呈现先降低后增加的趋势,而3株海洋富油低温微藻中性脂含量呈现逐渐积累的趋势。原因可能是由于种子液为处于对数期后期的微藻,藻细胞内的中性脂含量处于较高水平。在温度较高条件下,微藻的代谢速度快,同时在藻体培养前期及指数生长过程中,需要消耗大量的ATP,这部分能量主要由脂类提供[29]。本实验中3株海洋富油中温微藻和3株海洋富油高温微藻的中性脂在指数生长期消耗增加而使含量降低,因此中性脂含量在指数生长期不增加,这与魏东等[30]研究结果相似,而3株海洋富油低温微藻可在指数生长期缓慢积累中性脂,这可能与其适应低温环境生长,通过适当降低生长速度而增加细胞内油脂含量的储存,从而达到保护自身的作用,目前中性脂的代谢机制与细胞生长周期的关系尚不明确。
从微藻的脂肪酸组成来看,3株海洋富油低温微藻的高不饱和脂肪酸(PUFAs)相对含量随着CO2浓度的增加而有所降低,可能的原因是,CO2浓度的增加更促进藻类对于中性脂的积累。2株海洋富油中温微藻(等鞭金藻CCMM5001和微拟球藻CCMM7001)和3株海洋富油高温微藻的PUFAs相对含量随着CO2浓度的增加而增加,等鞭金藻CCMM5002的PUFAs相对含量随着CO2浓度的增加变化不大。Tang[8]研究结果表明,提高CO2浓度有利于斜生栅藻Scenedesmus obliquus和蛋白核小球藻Chlorella pyrenoidosaPUFAs的积累。可能的原因是,增加CO2浓度也就是等于相对降低了通气中氧气的浓度,这会影响去饱和酶的活性[31],也就使得PUFAs增加。但Tsuzuki等[32]研究也发现有些蓝绿藻像眼虫属Euglena和紫球藻属Porphyridium微藻的PUFAs量也不随CO2变化而改变,但是具体原因并不确定,对于利用微藻油脂制备生物柴油而言,不饱和脂肪酸的增加会影响生物柴油的燃烧性能,因此就不饱和脂肪酸含量而言,3株海洋富油低温微藻采用浓度为10%的CO2进行减排并制备微藻生物柴油综合效果更好。
[1] Boden T A,Marland G,Andres R J.Global,Regional,and National Fossil-Fuel CO2Emissions[R].Carbon Dioxide Information Analysis Center,Oak Ridge National Laboratory,U.S.Department of Energy,Oak Ridge,Tenn.2012,U.S.A.doi 10.3334/CDIAC/00001_V2013
[2] 杨忠华,杨改,李方芳,等.利用微藻固定CO2实现碳减排的研究进展[J].生物加工过程,2011,9(1):66-76.
[3] Salih F M.Microalgae tolerance to high concentrrations of carbon dioxide:a review[J].Journal of Environmental Protection,2011,2(5):648-654.
[4] Lee Y K,Tay H S.High CO2partial pressure depresses productivity and bioenergetic growth yield of Chlorella pyrenoidosa culture[J].Journal of Applied Phycology,1991,3(2):95-101.
[5] 白冰,李小春,刘延锋,等.中国CO2集中排放源调查及其分布特征[J].岩石力学与工程学报,2006,25(1):2918-2924.
[6] Guillard R R L,Ryther J H.Studies of marine planktonic diatoms:I.Cyclotella nana Hustedt,and Detonula confervacea(cleve)Gran[J].Canadian Journal of Microbiology,1962,8(2):229-239.
[7] Huerlimann R,de Nys R,Heimann K.Growth,lipid content,productivity,and fatty acid composition of tropical microalgae for scale-up production[J].Biotechnology and Bioengineering,2010,107(2):245-257.
[8] Tang D H,Han W,Li P L,et al.CO2biofixation and fatty acid composition ofScenedesmus obliquusandChlorella pyrenoidosain response to different CO2levels[J].Bioresource Technology,2011,102(3):3071-3077.
[9] Chen W,Sommerfeld M,Hu Q.Microwave-assisted nile red method for in vivo quantification of neutral lipids in microalgae[J].Bioresource Technology,2011,102(1):135-141.
[10] Chen W,Zhang C W,Song L R,et al.A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae[J].Journal of Microbiological Methods,2009,77(1):41-47.
[11] 王金娜,严小军,周成旭,等.产油微藻的筛选及中性脂动态积累过程的检测[J].生物物理学报,2010,26(6):472-480.
[12] Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[13] Sánchez Pérez J A,Rodríguez Porcel E M,Casas López J L,et al.Shear rate in stirred tank and bubble column bioreactors[J].Chemical Engineering Journal,2006,124(1/3):1-5.
[14] Kirk J T O.Light and Photosynthesis in Aquatic Ecosystems[M].Cambridge:Cambridge University Press,1983:101-105.
[15] Hu H H,Gao K S.Optimization of growth and fatty acid composition of a unicellular marine picoplankton,Nannochloropsissp.,with enriched carbon sources[J].Biotechnology Letters,2003,25(5):421-425.
[16] Chrismadha T,Borowitzka M A.Effect of cell density and irradiance on growth,proximate composition and eicosapentaenoic acid production ofphaeodactylum tricornutum grown in a tubular photobioreactor[J].Journal of Applied Phycology,1994,6(1):67-74.
[17] Li S Y,Shabtai Y,Arad S.Production and composition of the sulphated cell wall polysaccharide ofPorphyridium(Rhodophyta)as affected by CO2concentration[J].Phycologia,2000,39(4):332-336.
[18] Yue L H,Chen W G.Isolation and determination of cultural characteristics of a new highly CO2tolerant fresh water microalgae[J].Energy Conversion and Management,2005,46(11/12):1868-1876.
[19] Yoon J H,Sim SJ,Kim M S,et al.High cell density culture ofAnabaena variabilisusing repeated injections of carbon dioxide for the production of hydrogen[J].Inter Hydrogen Energy,2002,27(11/12):1265-1270.
[20] 欧阳峥嵘,温小斌,耿亚红,等.光照强度、温度、p H、盐度对小球藻(Chlorella)光合作用的影响[J].武汉植物学研究,2010,28(1):49-55.
[21] 徐宁,吕颂辉,陈菊芳,等.温度和盐度对锥状斯氏藻生长的影响[J].海洋环境科学,2004,23(3):36-39.
[22] 高春燕,程丽华,张林,等.小球藻光生物反应器脱除空气中二氧化碳的研究[J].膜科学与技术,2005,25(4):8-12.
[23] Kimura K,Yamaoka M,Kamisaka Y.Rapid estimation of lipids in oleaginous fungi and yeasts using Nile red fluorescence[J].J Microbiol Meth,2004,56(3):331-338.
[24] Elsey D,Jameson D,Raleigh B,et al.Fluorescent measurement of microalgal neutral lipids[J].J Microbiol Meth,2007,68(3):639-642.
[25] Ben-Amotz A,Tomdene T C,Thoms W H.Chemical profile of selected species of Microalgae with emphasis on lipids[J].JPhycol,1985,21(1):72-81.
[26] Liang Y,Mai K S,Sun S C.Total lipid and fatty acid composition of seven Chaetoceros strains[J].Trans Oceanol Limnol,2000(3):29-33.
[27] 石娟,潘克厚.不同培养条件对微藻总脂含量和脂肪酸组成的影响[J].海洋水产研究,2004,25(6):79-86.
[28] 徐进,徐旭东,方仙桃,等.高产油小球藻的筛选及其油脂分析[J].水生生物学报,2012,36(3):426-433.
[29] 朱顺妮,王忠铭,尚常花,等.微藻脂肪合成与代谢调控[J].化学进展,2011,23(10):2169-2177.
[30] 魏东,张学成,邹立红,等.细胞生长时期对两种海洋微藻总脂含量和脂肪酸组成的影响[J].青岛海洋大学学报(自然科学版),2000,30(3):503-509.
[31] Vargas M A,Rodríguez H,Moreno J,et al.Biochemical composition and fatty acid content of filamentous nitrogen-fixing cyanobacteria[J].Journal of Phycology,1998,34(5):812-817.
[32] Tsuzuki M,Ohnuma E,Sato N,et al.Effects of CO2concentration during growth on fatty acid composition in microalgae[J].Plant Physiology,1990,93(3):851-857.
Effect on lipid accumulation of marine oil-rich microalgae under different temperature and CO2enrichment cultivation
Wang Shuai1,2,Zheng Li2,Han Xiaotian3,Li Lin4,Yang Baijuan2,Liu Chenguang1
(1.College of Marine Life Science,Ocean University of China,Qingdao 266003,China;2.Marine Ecology Research Center,First Institute of Oceanography of State Oceanic Administration,Qingdao 266061,China;3.Key Laboratory of Marine Ecology and Environmental Science,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China;4.Qingdao Technology University of Shandong,College of Chemistry and Molecular Engineering,Qingdao 266042,China)
Nine marine microalgae were cultured under different CO2concentrations of ambient air(0.03%),5% and 10%,respectively.Nine marine microalgae include 3 strains of cold resisting marine microalgae(Nannochloropsissp.ZL-12,Tetraselmis chuiZL-33,Chlorellasp.ZL-45),3 strains of mesophilic marine microalgae(Isochrysis galbanaCCMM5001,Isochrysissp.CCMM5002 andNannochloropsissp.CCMM7001)and 3 strains of heat resisting marine microalgae(Nannochloropsissp.JN1,Pavlova viridisJN2 andChlorellasp.JN3).The growth characterization,accumulation of total and neutral lipid of these microalgae were investigated.The results showed that CO2enrichment cultivation could increase the growth of all nine microalgae,but the optimum CO2concentrations were different.The optimum CO2concentration ofNannochloropsissp.CCMM7001 was 5%,The optimum CO2concentration of 8 strains of marine microalgae was 10%.3 strains of cold resisting marine microalgae and 3 strains of heat resisting marine microalgae reached the maximum biomass yield when culturing with 10%CO2.2 strains of mesophilic marine microalgae(Isochrysis galbanaCCMM5001 andIsochrysissp.CCMM5002)run up to the maximum biomass yield when culturing with 10%CO2.However,the maximum biomass yield ofNannochloropsissp.CCMM7001 was(122.25±1.17)mg/(L·d)when culturing with 5%CO2.With the increased CO2concentration,the total lipid and neutral lipid of three microalgae improved significantly.The total lipid content of 3 strains of cold resisting marine microalgae and 3 strains of mesophilic marine microalgae was higher than 3 heat resisting marine microalgae.The maximum neutral lipid content of 9 strains of microalgae could be accumulated in stationary phase.The fatty acid analysis of 9 strains of microalgae showed the relative content of C14-C18 fattyacid which suitable for biodiesel preparation maintained at 90%when culturing with different CO2concentration. The results indicate our marine oleaginous microalgae with high carbon dioxide fixation ability are the potential excellent strains for marine bioenergy development coupled with CO2emission reduction.
marine oil-rich microalgae;CO2enrichment cultivation;neutral lipid;lipid accumulation
Q946.4
A
0253-4193(2014)12-0041-12
王帅,郑立,韩笑天,等.不同适温海洋富油微藻在富碳培养条件下的油脂积累特性研究[J].海洋学报,2014,36(12):41—52,
10.3969/j.issn.0253-4193.2014.12.004
Wang Shuai,Zheng Li,Han Xiaotian,et al.Effect on lipid accumulation of marine oil-rich microalgae under different temperature and CO2enrichment cultivation[J].Acta Oceanologica Sinica(in Chinese),2014,36(12):41—52,doi:10.3969/j.issn.0253-4193.2014.12.004
2013-12-13;
2014-02-26。
中央级公益性科研院所基本科研业务费专项资金(2012G32,2014 T05);国家海洋局青年海洋科学基金(2012131);海洋可再生能源专项资金项目“海洋微藻制备生物柴油耦合CO2减排技术研究与示范”(GHME2001SW02);山东省科技发展计划“富油微藻的筛选、改造及耦合CO2减排的高密度培养技术”(2011GHY11533);国家科技支撑计划项目“水环境微生物测量溯源技术及计量标准研究”(2013BAK12B00);中国科学院实验海洋生物学重点实验室资助(KF2012No3)。
王帅(1983—),女,山东省济南市人,博士生,助理研究员,主要从事微藻生理生化研究。E-mail:wangshuai@fio.org.cn
*通信作者:郑立,博士,副研究员。E-mail:zhengli@fio.org.cn
