卵巢卵泡膜瘤-纤维瘤的影像学表现及病理对照研究
2014-05-31肖飞鹰叶伙华陈传明
肖飞鹰 叶伙华 陈传明
卵巢卵泡膜瘤-纤维瘤源于卵巢性索-间质细胞,临床不十分常见[1]。卵巢卵泡膜细胞瘤老化时增多其纤维组织,肿瘤中含有纤维细胞及卵泡膜细胞两种成份[2]。近几年,随着微创及介入手术等医疗技术的迅速发展,卵巢各种肿瘤的术前影像学检查及诊断十分关键[3]。本研究对卵巢卵泡膜瘤-纤维瘤进行影像学检查,探析该病的影像学临床特征表现,并进行病理对照,取得了满意效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2011年6月~2013年8月南方医科大学附属中山博爱医院收治的卵巢卵泡膜瘤-纤维瘤患者26例,年龄43~71 岁,平均(57.9±1.3)岁,按影像学检查方式的不同均分为2 组(n=13)。临床表现:无症状者,体检时发现CA 125升高3 例,腹部肿块2 例;阴道无规则出血15 例;腹部自觉腹痛3 例,腹胀、隆起1 例,下腹部轻微不适2 例。2 组患者的平均年龄、性别、病理类型等一般资料比较,差异无统计学意义,具有可比性。
1.2 方法 观察组进行MRI 检查,膀胱适当充盈,检查前空腹。进行矢状面、冠状面、常规轴面平扫;扫描参数:矩阵256×160、T1WI 取TE 11-15 ms、TR 500-15000 ms,NEXT=3,间隔0~2 mm,层厚7.0 mm,FOV34-38;FSE T2WI序列,FOV 34-38,矩阵256×160,间隔0~2 mm,层厚6~8 mm,NEXT=3~4。将对比剂Gd-DTPA 0.1 mmol/kg 应用高压注射器静脉注入,注射速度为1.5 mL/s。进行轴面扫描增强,局部病灶同时进行矢状面扫描。动态增强,FOV34-38,间隔1 mm,层厚5 mm,NEXT=1。注药后20、50、140 s 自肿块上缘至耻骨联合进行动脉期、实质期、延时扫描;对照组进行CT 扫描,肠道准备:常规适量服用等渗水溶液,膀胱充盈过度,纱布填塞阴道。仰卧位,扫描顺序自耻骨联合下缘向上扫描至病灶上缘。耻骨联合至病灶上缘增强扫描。螺距1.0,层距、层厚为5 mm,电流300 mAs,管电压120 kV。应用高压注射器注射1.5 mL/kg 的非离子型对比剂碘海醇,流速为3 mL/s。对比剂注入后30、60 s进行动脉期、实质期扫描,局部病灶120 s 延迟扫描。2 组患者均进行常规石蜡包埋切片、HE 染色,手术切除病灶,显微镜下观察组织学形态检查。
1.3 仪器和试剂 Signa Ovation 0.35 T 核磁共振成像系统(GE 公司,美国);SIEMENS 128 排螺旋CT(SIEMENS 公司,德国)。
1.4 统计学方法 所有数据采用SPSS 14.0 统计学软件进行处理,正态计量资料采用“±s”表示;计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 手术病理及影像学特征 病变位于左侧11 例,右侧者15 例,肿瘤最大径平均值(12.6±4.8)cm,体积3.5cm×2.9cm×3.3cm~18cm×14cm×17cm;肿瘤呈分叶状12 例,椭圆形14例,边界较清晰,周围可见假包膜或包膜。
MRI 信号特征:T1WI 呈混杂信号4 例,低信号5 例,等信号4 例;T2WI 呈混杂信号12 例,低信号1 例;内部呈多囊者2 例,长T2囊变区11 例;内部可见短T2低信号9 例,内可见短T1、长T2低信号者2 例,内部可见长T1、短T2出血信号者2 例;增强扫描后呈9 例呈不均匀强化,4 例呈均匀强化,动脉期强化相对显著者2 例,其他11 例动脉期不显著,延迟期及静脉期强化程度逐渐增强,肿瘤内部出现强化分隔者6 例。见图1。
MRI 其他征象:膀胱及子宫受压6 例,其中伴大网膜及肠系膜增厚1 例,腹腔内积液3 例,伴肠管移位2 例;内膜显著增厚7例。
CT 影像检查特征:肿瘤密度不均匀者9 例,密度均匀者4例,其中5 例显示低密度囊变区;进行扫描增强均为不均匀强化,动脉期肿瘤强化均不显著,延迟期及静脉期强化程度逐渐增强,肿瘤周边及内部可见强化小血管影5 例。见图2。
MRI 术前准确诊断5 例,4 例诊断为囊腺瘤,其他4 例为卵巢恶性肿瘤;CT 术前准确诊断3 例,诊断囊腺瘤2 例,诊断卵巢恶性肿瘤7 例,1 例诊断为间质瘤。
病理学诊断:诊断为典型的卵泡膜细胞瘤12 例,由类似于卵泡膜内层细胞的瘤细胞构成,细胞质丰富,卵圆形细胞核,细胞周围包绕网状纤维;6 例确诊为黄素化卵泡膜细胞瘤,卵泡膜细胞内可见黄素细胞;5 例确诊为伴少量性索成份的间质肿瘤,可见5%~10%粒层细胞;2 例确诊为细胞性纤维瘤,肿瘤内部可见纤维成份较多;1 例内部可见纤维肉瘤成份,肿瘤主体为卵泡膜细胞瘤。见图3。
2.2 影像学特征与病理对照 典型的卵泡膜细胞瘤12 例,黄素化的卵泡膜细胞瘤6 例,细胞性纤维瘤2 例。肿瘤实质部分T2WI 信号偏低,主要因肿瘤内部纤维成份不等;肿瘤密度或信号不均匀,呈高低混杂信号或密度,对照病理学检查,由于肿瘤内部骨化、钙化、粘液变性、出血、内部囊变导致。短T1、长T2低信号亚急性出血者2 例,长T1、短T2出血信号者2 例,其中1 例合并形成液平面;内部可见条索状短T2低信号9 例,对照病理学检查,主要为骨化或钙化导致,增强扫描动脉强化不显著,延迟期及静脉期逐渐增强,强化程度均不及子宫显著。
5 例确诊为伴少量性索成份的间质肿瘤,其中2 例为囊实性,呈混杂信号,部分T2WI 呈稍高信号,内可见低信号区,同时内部形成多发囊变;3 例为实性,T2WI 呈稍高信号;增强扫描动脉期强化较显著,延迟期及静脉期逐渐强化。
1 例内部可见纤维肉瘤成份,肿瘤主体为卵泡膜细胞瘤。影像学表现为囊实性肿物,实性的壁结节呈稍低信号。

图1 卵巢卵泡膜瘤-纤维瘤MRI 信号特征

图2 卵巢卵泡膜瘤-纤维瘤CT 影像特征
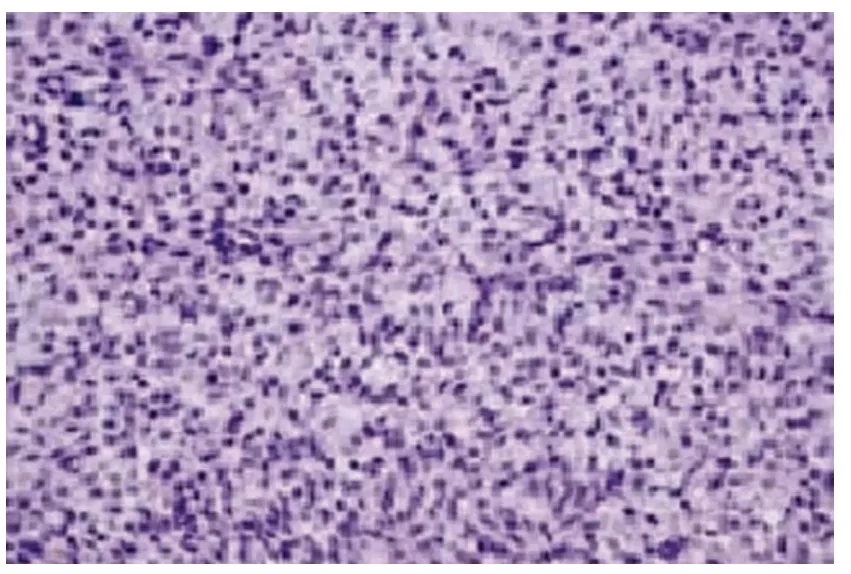
图3 卵巢卵泡膜瘤-纤维瘤病理学检查
3 讨论
卵巢卵泡膜瘤-纤维瘤主要有恶性的纤维肉瘤、交界性的伴少量性索成份的卵泡膜细胞瘤、硬化性间质瘤、纤维瘤、伴黄素化的卵泡膜细胞瘤、良性卵泡膜细胞瘤等类型[4]。本研究典型的卵泡膜细胞瘤12 例,黄素化的卵泡膜细胞瘤6 例,纤维卵泡膜细胞瘤2 例,5 例确诊为伴少量性索成份的卵泡膜细胞瘤,1 例为恶性纤维肉瘤。该肿瘤可出现于任何年龄段,高发年龄为绝经后患者,有研究报道,10%卵巢卵泡膜纤维瘤患者低于30 岁,临床无显著症状,多体检中偶然出现。
卵泡膜细胞瘤的主要组成成份为纤维母细胞及卵泡膜细胞,其中卵泡膜细胞富含脂质,其组织学构成可在一定程度于MRI中显示[5]。有研究报道称瘤内含有的脂质成份可应用化学位移双回波序列显示[6]。该肿瘤的另一成份为纤维细胞及纤维母细胞,可引起实性部分T2WI 信号偏低,可与其他卵巢肿瘤相鉴别。该肿瘤易继发骨化、钙化、出现、粘液样变性、水肿囊变等,引起肿瘤密度及信号不均匀[7]。多囊性改变需要鉴别粘液性囊腺瘤,后者的影像特征为多房多囊性病变,扫描增强其分隔及囊壁可见强化,强化度较显著。增强扫描该肿瘤的强化程度与卵泡膜细胞含量密切相关[8]。以下特征可能提示为卵泡膜瘤-纤维瘤:肿瘤边界较清晰,大部分出现骨化、钙化、出血、粘液样变、囊变、包膜,边界较清晰,引起肿瘤密度或信号不均匀;以渐进式强化增强扫描为主,动脉期强化不显著,含性索成份的交界性肿瘤强化较为显著,部分肿瘤伴子宫内膜增厚。
[1]康林英,刘佳,张国福,等.卵巢卵泡膜纤维瘤的MRI 诊断[J].中国医学计算机成像杂志,2012,18(5):34-35.
[2]夏皓,周金柱,王灿云.7 例卵泡膜细胞瘤的CT 回顾分析[J].中国现代医生,2012,50(27):211-214.
[3]林云,赵树伟.右卵巢卵泡膜纤维瘤超声表现一例[J].中华医学超声杂志,2009,6(4):17-20.
[4]丁晶,赵前群.卵巢卵泡膜纤维瘤扭转破裂超声误诊1 例分析[J].中国误诊学杂志,2010,10(27):115-117.
[5]蒋兴德,李伟大.卵巢卵泡膜瘤-纤维瘤的MRI 诊断[J].放射学实践,2013,8(4):433-435.
[6]郭久柏,程玉芬.卵巢纤维瘤及纤维卵泡膜细胞瘤24 例临床分析[J].中国妇幼保健,2011,26(31):156-157.
[7]宋华.高频超声对乳腺纤维瘤的诊断价值[J].当代医学,2014, 20(22):36.
[8]蒋兴德,李伟大.卵巢卵泡膜瘤-纤维瘤的MRI 诊断[J].放射学实践,2013,28(4):433-435.
