DEV囊膜糖蛋白gI基因缺失病毒生物学特性研究
2014-05-30华炯钢叶伟成
陈 柳,余 斌,倪 征,华炯钢,叶伟成,云 涛,张 存
(浙江省农业科学院畜牧兽医研究所,浙江杭州310021)
鸭瘟病毒(DEV)基因组共含78 个ORFs,推测12 个编码病毒囊膜糖蛋白,正式命名11 个,包括gK、gN、gC、gB、gH、gM、gL、gG、gD、gI、gE[1,2]。单纯疱疹病毒(HSV)中囊膜糖蛋白大部分具有重要功能,参与了病毒吸附穿入过程、病毒诱导的细胞融合过程及病毒从核膜出芽、释放过程等。因此包膜糖蛋白是病毒感染发病的关键所在,在诱导机体的免疫应答作为保护性免疫诱导剂方面的作用十分重要,是研制病毒亚单位疫苗的主要免疫原[3]。
疱疹病毒gI 是一多功能蛋白,其核苷酸和氨基酸序列在不同亚科以及种属间都存在较大差异。gI作为囊膜糖蛋白是病毒颗粒表面的抗原决定簇,具有一定的免疫性,Ghiasi 等表达了HSV-1 的7 种糖蛋白(gB、gC、gD、gE、gG、gH、gI),并比较了7 种蛋白在小鼠咽部感染中的免疫保护作用,发现接种重组gI 蛋白的小鼠在体内产生高滴度中和抗体,具有明显的免疫保护作用[4]。在α-疱疹病毒中,gI 常与gE 以功能性非共价复合物的形式存在并发挥功能,在单纯疱疹病毒I 型(HSV-1)、水痘带状疱疹病毒(VZV)、伪狂犬病毒(PRV)感染的细胞和宿主中,gE/gI 复合物促进病毒粒子胞间转染、介导病毒在细胞之间扩散。没有gI/gE 复合体,病毒体外培养时只能产生很少的CPE,在体内组织的扩散也很有限[4-6]。Schumacher D.等(2001)[7]研究表明,gI、gE 单基因缺失和gI/gE 双基因缺失的MDV 病毒只能在单个细胞中检测到,而不能形成病毒蚀斑,Devlin JM.等(2006)[8]在ILTV 上观察到了同样现象。此外,gI 蛋白还与病毒免疫逃避机制相关,HSV-1、VZV 和PRV gE/gI 异源二聚体与通过与IgG的Fc 片段相结合,改变或阻断Fc 功能,参与免疫逃避[9]。HSV-1 中gI 的128-145 位氨基酸是结合IgG Fc 段的关键区,gI 缺失病毒也丧失了IgG 结合能力[10]。但牛疱疹病毒I 型(BHV-1)gE/gI 不能与Fc 结合[11],其它疱疹病毒gE/gI 是否具有该特征尚待研究。
为了阐明DEV gI 的生物学功能,本研究在构建鸭瘟病毒疫苗株全长感染性克隆的基础上,采用“Red E/T”介导的两步重组技术删除gI 基因,构建了DEV gI 基因缺失突变体克隆,并拯救获得了重组病毒,对重组病毒生物学特性进行了初步研究。
1 材料和方法
1.1 质粒载体、菌株和病毒株 DEV 标准强毒株CHv(CVCC AV1221)购自中国兽医药品监察所(北京);pEPkanS 质粒和pCAGGS-NLS/Cre 质粒由德国柏林自由大学Osterrieder N 博士惠赠;E.coli DH5α、DH10B 和GS1783 菌株由本实验室保存。DEV 疫苗株全长感染性克隆pDEV-vac 及相应病毒rDEV-BAC 由本实验室构建、保存。
1.2 工具酶和试剂 各种DNA 限制性内切酶、T4 DNA 连接酶购自Takara(大连)公司;Primestar DNA聚合酶、Taq DNA 聚合酶购自Takara(大连)公司;DMEM 培养基购自吉诺生物医药技术有限公司;磷酸钙转染试剂购自Promega 公司;甲基纤维素购自Sigma 公司;胎牛血清购自Gibco 公司;胰酶购自Difico 公司。胶回收和病毒DNA/RNA 提取试剂盒购于Takara 公司。
1.3 引物设计 参考DEV 疫苗株序列(GenBank EU082088.2),设计引物对DEV-ΔgI-for/ rev 和ΔgIJD-F/R 分别用于“Red E/T 介导的两步重组”删除gI 基因及鉴定基因删除是否成功,序列如表1所示,由上海某生工合成。
1.4 试验用SPF 鸡胚 9-11日龄SPF 鸡胚购自浙江某生物技术公司。
1.5 DEV gI 基因缺失突变体的构建 采用两步Red E/T 重组法构建DEV 疫苗株gI 基因缺失株。首先将pDEV-vac 质粒转化E.coli GS1783 株,提取质粒以BamH I 酶切筛选,阳性克隆命名为pDEVvac/GS1783。将 pDEV-vac/GS1783 接 种 于 含 有CAM 的LB 培养基,32℃220 r/min 培养至A600 为0.5 ~0.7 时,42℃水浴摇床保温30min 以诱导Red重组酶表达,常规方法制备感受态细胞。第一步Red 重组以Kan 抗性基因替代gI 基因序列。具体方法为:以引物DEV-ΔgI-for 和DEV-ΔgI-rev (序列见表1)扩增pEPKanS 质粒模板上含有Ⅰ-SceⅠ酶切位点和卡那霉素抗性基因的DNA 片段(Ⅰ-SceⅠ-Kan),产物经胶回收试剂盒回收,以纯水洗脱;取100 ng 电转化pDEV-vac/GS1783 感受态细胞,32℃振荡培养1 h 后涂布含34 μg/mL CAM 和50 μg/mL Kan 的LB 平板,32℃培养24 ~48 h。挑取阳性克隆提取质粒,BamH I 和Xho I 酶切筛选正确重组的克隆(pDEV-ΔgI-Kan)进行第二次重组。第二步Red 重组将pDEV-ΔgI-Kan 质粒中的Kan 抗性基因删除。具体方法为:接种pDEV-ΔgI-Kan 菌落于液体培养基,于32℃220 r/min 培养过夜,次日转接于2 mL CAM-LB 中,振荡培养2 ~4 h,加入等量2% L-阿拉伯糖,继续培养1 h 诱导表达Ⅰ-SceⅠ核酸内切酶,然后再转入42℃水浴摇床培养30 min进行Red 重组,最后32℃培养1 h。将细菌悬液作10-3~10-5稀释后涂布于CAM 平板,32℃孵育24~48 h,挑取菌落同时点种于CAM 和Kan 平板。BamH I 和Xho I 酶切分析Cam 阳性和Kan 阴性的菌落,以筛选正确重组的克隆(pDEV-ΔgI)。以pDEV-ΔgI 为模板,用引物对ΔgI-JD-F 和ΔgI-JD-R(序列见表1)进行PCR 扩增,胶回收PCR 片段之后送至Invitrogen 公司测序。

表1 用于缺失DEV gI(US7) 的引物
1.6 重组病毒拯救 取4 μg pDEV-ΔgI 以磷酸钙法转染至CEFs,转染细胞放于37℃CO2培养箱培养3 ~6 d,直至荧光出现,收获病毒,命名为rDEV-ΔgI。为 去除rDEV-BAC 病 毒基因 组 上的mini-F 序列,将4 μg pDEV-ΔgI 和1 μg Cre 重组酶表达质粒pCAGGS-NLS/Cre 以磷酸钙法转染至CEFs 细胞,第2 d 铺上含有1.5%甲基纤维素的DMEM 培养基,置37℃CO2培养箱继续培养,直至出现病毒蚀斑,挑取非荧光蚀斑进行稀释和传代,经过几轮重复,直至获得纯化的非荧光蚀斑病毒。抽提病毒DNA,采用18F/15R 引物对,序列分别为5'-AAAGCTTCGACGA GAGTATCAGCACTCATC-3'和5'-AGAATTCAAGCTT ATCGACGAACAACTAAGAGTTTGC-3'进 行PCR 扩增鉴定mini-F 序列是否去除。鉴定正确的病毒命名为rDEV-ΔgI-Cre。
第三,定期对全区资产专管员进行纸质业务和电脑业务培训,并制定出资产管理信息系统的业务流程,培训方式有集中培训、电话指导、网络信息等。
1.7 重组病毒的生物学特性分析
1.7.1 重组病毒蚀斑大小测定 将rDEV-BAC 和rDEV-ΔgI 病毒冻存液用不同稀释度进行稀释,接种于12 孔板中的单层CEFs 上,2 h 后,换上含1.5%甲基纤维素的DMEM 培养基,置37℃CO2培养箱培养48 h。在荧光显微镜下各拍摄100 个荧光蚀斑,采用Image J 软件测量蚀斑面积并取平均值。用SPSS 11.5 软件的One-way ANOVA 程序进行统计学分析。
1.7.2 重组病毒多步生长曲线测定 以常规病毒学方法测定rDEV-BAC、rDEV-ΔgI、rDEV-ΔgI-Cre 和DEV-vac 的体外增殖特性。CEFs 细胞单层接种0.02 MOI 病毒后,依次吸附90 min,PBS(pH 7.2)洗涤2 次,以冰浴的CBS 缓冲液(40 mmol/L 柠檬酸钠、10 mmol/L 氯化钾、135 mmol/L 氯化钠,pH 3.0)处理3 min,PBS(pH 7.2)洗涤2 次,加入1 mL 维持液继续培养。接种后0、12、24、36、48、60、72 h 分别收集细胞培养上清和细胞,细胞用PBS(pH 7.2)洗涤2 次。收集的上清和细胞冻存于-80℃直至进行滴度测定。分别取100 μL 细胞培养上清和细胞裂解液按照常规方法测定TCID50,每个稀释度重复接种3 孔。计算上述各时间点收获的病毒毒价,绘制病毒在体外的多步生长曲线。
1.7.3 重组病毒对鸭瘟强毒攻击的免疫保护试验
将15 羽20日龄无鸭瘟抗体的鸭子随机分为3 组(n=5),饲养于不同栏舍。两组分别肌内接种0.5 mL 含有1 ×105TCID50 病毒的rDEV-BAC 和rDEVΔgI 病毒液,第3 组作为对照组,接种同体积DMEM培养基。接种2 周后,皆肌内注射100 × DLD50(50%致死剂量)的DEV 强毒株CHv,于2 周内观察供试鸭的患病及死亡情况。
2 结果与分析
2.1 pDEV-ΔgI 突变体克隆的构建 详见图1、图2。
质粒pDEV-ΔgI-Kan(第 一 步Red 重 组)和pDEV-ΔgI(第二步Red 重组)经BamH I 和Xho I 酶切后电泳图谱详见图1-b,电泳图显示了gI 基因酶切片段的迁移率变化,与预测图谱(图1-a)基本一致。以pDEV-ΔgI-Kan 和pDEV-ΔgI 克隆为模版,以引物ΔgI-JD-F 和ΔgI-JD-R 扩增gI 上下游部分序列(图2),并进行测序,结果显示gI 基因成功缺失。综合酶切图谱和PCR 产物测序结果表明,pDEV-ΔgI突变体构建成功。

图1 pDEV-ΔgI 突变体克隆的BamH I和Xho I 酶切鉴定图谱
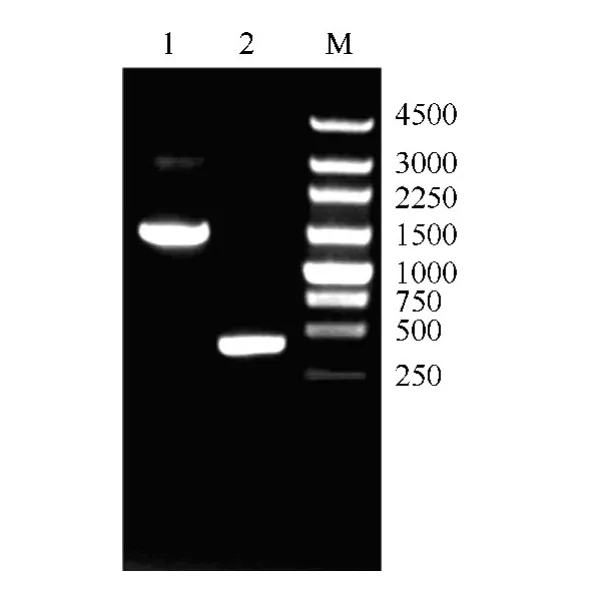
图2 pDEV-ΔgI 突变体克隆的PCR 鉴定图
2.2 gI 基因缺失突变体病毒的拯救 详见图3。

图3 rDEV-ΔgI 病毒感染CEFs 形成荧光蚀斑(a) 及rDEV-ΔgI-Cre 感染CEFs 形成病毒蚀斑(b) (24 h,100 ×)
以pDEV-ΔgI 质粒转染CEFs 细胞后24 h,在荧光显微镜下可以见到绿色的荧光蚀斑,表明成功拯救了rDEV-ΔgI 病毒(图3- a)。rDEV-ΔgI 可以在CEFs 细胞上繁殖和形成空斑,因此gI 基因不是DEV 在细胞上繁殖的必需基因。将pDEV-ΔgI 和pCAGGS-NLS/Cre 共转染至CEFs 细胞,经过几轮非荧光蚀斑挑选和PCR 鉴定,获得了去除载体序列的病毒rDEV-ΔgI-Cre(图3-b)。
2.3 重组病毒生长曲线 详见图4。
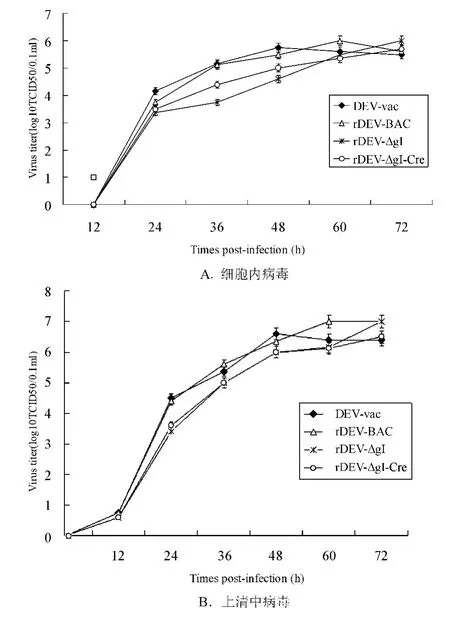
图4 rDEV-BAC、rDEV-ΔgI、rDEV-ΔgI-Cre和DEV-vac 在CEFs 上的体外生长曲线
测定重组病毒rDEV-BAC、rDEV-ΔgI 和rDEVΔgI-Cre 的生长曲线,并与亲本毒株DEV-vac 进行了比较,图4所示,不论是细胞内还是细胞外病毒,其滴度从12 h 到60 h 稳步增加,在此期间gI 基因缺失毒株病毒滴度较亲本毒株稍有降低,但病毒滴度于72 h 接近并超过对照毒株。
2.4 重组病毒蚀斑大小测定 详见图5。
rDEV-BAC 和rDEV-ΔgI 感染细胞3 d 后,各拍摄病毒蚀斑照片100 例,并用Image J 软件测定蚀斑面积并计算平均值。发现rDEV-ΔgI 蚀斑面积较rDEV-BAC 增加约60%。数据具有统计学意义(P=0.004)。
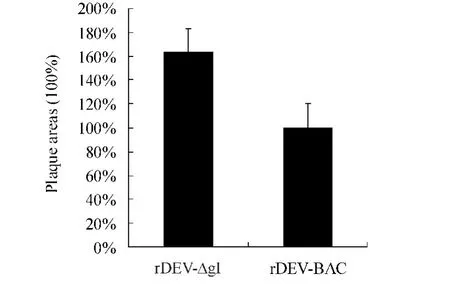
图5 rDEV-BAC 和rDEV-ΔgI 在CEFs 上的蚀斑面积测定及比较
2.5 重组病毒对鸭瘟强毒攻击的免疫保护试验详见图6。

图6 重组病毒对鸭瘟强毒攻击的免疫保护试验
为研究重组病毒是否具有保护鸭体免于鸭瘟病毒强毒株攻击能力,对2 组20日龄无DEV 抗体的鸭群分别通过肌内注射1 ×105TCID50的rDEV-ΔgI、rDEV-BAC,1 组注射等体积培养基作为对照,2 周后采用DEV 强毒株攻毒,第3 d,对照组5 羽鸭子陆续出现鸭瘟症状或死亡,5 d 内,对照组鸭全部死亡。rDEV-ΔgI 组第4 d 有1 羽鸭子死亡,至第5 d 有2羽鸭子死亡,之后再无鸭子死亡,而rDEV-BAC 注射组无鸭子死亡。图6对各组鸭子的存活率进行了统计,rDEV-ΔgI 注射组存活率较对照组下降40%。
经对照组和rDEV-ΔgI 试验组死亡鸭进行病理学观察,发现死亡鸭出现了典型的鸭瘟症状,包括血管损伤、组织出血,尤其是肝、肾、泄殖腔,消化道粘膜表面出现了典型的出血环和形成假膜或溃疡。
3 小结与讨论
疱疹病毒由于自身基因组较大的原因,感染性克隆的构建一度受到了限制。但从20 世纪90年代新型DNA 载体系统——细菌人工染色体(BAC)技术的问世改变了该局面。研究者通过同源重组或者Cre-LoxP 特异位点重组等DNA 重组技术,将BAC载体插入到病毒基因组复制非必需位点成功构建了许多疱疹病毒的感染性克隆。迄今为止,HSV-1、VZV、人细胞巨化病毒(HCMV)、EB 病毒、卡波氏肉瘤病毒(HHV-8,KSHV)、PRV、犬疱疹病毒(CHV)、BHV-1、MDV、EHV-1 等许多疱疹病毒都利用该技术克隆到E.coli 并稳定保持为感染性克隆。
在病毒BAC 系统的基础上,利用随机转座子或定点RecA-或Rec E/T 介导的克隆,可在短时间内快速构建病毒突变体。Rec E/T 介导的克隆是基于λ 噬菌体Red 操纵子(Redα/Redβ/Redγ)和Rac 噬菌体RecE/RecT 同源重组酶进行的,即“Red E/T重组”。与RecA 介导的克隆需要较长的同源臂(约1 kb)不同,“Red E/T 重组”仅需35 ~50 bp 碱基序列作为同源臂,使PCR 产物或寡核苷酸可以直接作为供体分子对目标DNA 进行打靶修饰。因此,不仅简化了同源重组的操作过程,而且提高了重组效率,同时,由于同源臂不受碱基序列组成的限制,可以人为随意选择,所以运用该技术可轻松地对各种DNA分子尤其是基因组或染色体大分子进行修饰。所以,该技术不仅操作简单、快捷,而且可精准地在全长感染性克隆的基础上进行序列修饰[13]。
本文在前期构建的DEV 疫苗株感染性克隆的基础上,利用两步Red E/T 介导的克隆技术简单、快捷地构建了gI 基因缺失的BAC 突变体,所构建的突变体与预期完全一致,未发现任何碱基意外的插入、缺失或突变。该BAC 突变体转染CEFs 细胞后获得重组病毒,显示gI 是DEV 复制非必需基因。gI 缺失病毒较亲本毒在细胞上的蚀斑面积增大,说明gI 蛋白在DEV 病毒细胞间扩散中所起的作用与同属马立克氏病病毒属的MDV 具有显著差异。gI基因缺失毒株对DEV 强毒攻击的免疫保护能力下降,可能与病毒早期在鸭体内增殖滴度稍有降低有关,具体原因有待进一步研究解析。
[1]Li Y,Huang B,Ma X,Wu J,Li F,Ai W,Song M,Yang H.Molecular characterization of the genome of duck enteritis virus[J].Virology,2009,391:151-161.
[2]Wang J,Höper D,Beer M,Osterrieder N.Complete genome sequence of virulent duck enteritis virus(DEV)strain 2085 and comparison with genome sequences of virulent and attenuated DEV strains [J].Virus Res,2011,160:316-325.
[3]Ramos-Kuri J M.Envelope and membrane glycoproteins of Herpes simplex virus[J].Rev Latinoam Microbiol,1992,34(1):23-31.
[4]Johnson D C,Webb M,Wisner T W,Brunetti C.Herpes simplex virus gE/gI sorts nascent virions to epithelial cell junctions,promoting virus spread[J].J Virol,2001,75(2):821-833.
[5]McGraw H M,Awasthi S,Wojcechowskyj J A,Friedman H M.Anterograde spread of herpes simplex virus type 1 requires glycoprotein E and glycoprotein I but not Us9[J].J Virol,2009,83(17):8315-8326.
[6]Berarducci B,Rajamani J,Reichelt M,Sommer M,Zerboni L,Arvin A M.Deletion of the first cysteine-rich region of the varicella-zoster virus glycoprotein E ectodomain abolishes the gE and gI interaction and differentially affects cell-cell spread and viral entry[J].J Virol,2009,83(1):228-240.
[7]Schumacher D,Tischer B K,Reddy S M,Osterrieder N.Glycoproteins E and I of Marek's disease virus serotype 1 are essential for virus growth in cultured cells [J].J Virol,2001,75(23):11307-11318.
[8]Devlin J M,Browning G F,Gilkerson J R.A glycoprotein I- and glycoprotein E-deficient mutant of infectious laryngotracheitis virus exhibits impaired cell-to-cell spread in cultured cells[J].Arch Virol,2006,151(7):1281-1289.
[9]李丽娟,程安春,汪铭书.疱疹病毒gI 基因及其编码蛋白的研究进展[J].病毒学报,2010,26(4):340-344.
[10]Basu S, Dubin G, Nagashunmugam T, Basu M,Goldstein LT,Wang L,Weeks B,Friedman H M.Mapping regions of herpes simplex virus type 1 glycoprotein I required for formation of the viral Fc receptor for monomeric IgG[J].J Immunol,1997,158(1):209-215.
[11]Whitbeck J C,Knapp A C,Enquist L W,Lawrence W C,Bello L J.Synthesis,processing,and oligomerization of bovine herpesvirus 1 gE and gI membrane proteins[J].J Virol,1996,70(11):7878-7884.
[12]Tsujimura K,Yamanaka T,Kondo T,Fukushi H,Matsumura T.Pathogenicity and immunogenicity of equine herpesvirus type 1 mutants defective in either gI or gE gene in murine and hamster models[J].J Vet Med Sci,2006,68(10):1029-1038.
[13]王军平,张友明,粟永萍.Red E/T 同源重组介导细菌人工染色体的快速修饰[J].生物化学与生物物理进展,2005,32(5):468-473.
